このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
移植片対宿主病の誘導および
要約
マウス骨髄移植は、ヒトにおいて、移植片対宿主病を支配する免疫のメカニズムを研究するために広く使われているテクニックです。 T細胞の人身売買パターンを監視する機能移植片対宿主病の間にT細胞応答の開発や永続化の詳細な分析が可能になります。
要約
移植片対宿主病(GVHD)は、血液学的欠陥の様々な根治療法として骨髄移植の広範な使用に制限する障壁となっている。 GVHDはレシピエントに注入された骨髄移植に存在する成熟したアロ反応性T細胞によって引き起こされるとホストの臓器に損傷を与えるされています。しかし、マウスでは、T細胞がGVHDを引き起こすために骨髄接種に追加する必要があります。大規模な作業は、T細胞応答の移植後を特徴づけるために行われているが、生物発光イメージング技術は、生体内で T細胞の人身売買パターンを監視する非侵襲的方法である。
致死照射後、レシピエントマウスをドナーマウスから骨髄細胞と脾細胞を移植されています。 L2G85.B6(恒常的にルシフェラーゼを発現するトランスジェニックマウス)由来のT細胞サブセットは、移植に含まれています。のみ特定のT細胞サブセットを移植することによって、人は、 生体内で特異的なT細胞サブセットを追跡することができますとその場所に基づいて、様々な時点でGVHDの促進に特異的なT細胞サブセットの役割に関する仮説を開発しています。所定の間隔の移植後に、レシピエントマウスXenogen IVIS CCDカメラを用いて結像される。光強度は光子強度(赤=高強度、紫=低強度)に基づいて擬似カラー画像を生成するためにリビングImageソフトウェアを用いて定量化することができる。
4-7日後、移植の間、レシピエントマウスはGVHDの臨床徴候を示し始める。クックら 1は、レシピエントマウスの毛皮の質感、皮膚の完全性、活動、体重減少、及び姿勢に基づいて、病気の進行を定量するためのスコアリングシステムを開発しました。マウスは毎日の得点、そして、彼らは瀕死状態になったときに安楽死させる。レシピエントマウスは、一般的に20〜30日、移植後瀕死になる。
マウスモデルでは、GVHDの免疫学を研究するための貴重なツールです。選択的に移植特定のT細胞サブセットら各サブセットが果たす役割を慎重に識別のための安値。非侵襲的に生体内で T細胞応答を追跡すると、マウスGVHDモデルに付加価値の別の層を追加します。
プロトコル
1。致死的照射
- 使用する照射器と互換性microisolatorケージに10レシピエントマウスまで置きます。
- 総線量を合計2つの等しい用量(BALB.B受取人のための総投与量= 9 CGY)で照射します。 2回目の照射は、最初の3時間後でなければなりません。注射は、最終照射後4〜6時間の間に発生しなければ。セシウム137のソースまたはRS2、000、照射器のいずれかで照射したマウス。
- 移植の時まで酸性化した水でmicroisolatorケージ内の第二放射線量、ストアマウスを次に示します。
2。脾細胞の調製
- 制度上のガイドラインに従って1ドナーマウスを安楽死させる。 125x10 6脾-各ドナーは、一般的に75x10 6が得られます。 12×10 6 CD8 T細胞- CD8精製キットを使用して、各マウスは、一般的に6×6が得られます。
- 最初の角を右に直接正中線の縦2cmの切開2cmを行うことで、脾臓を取り除く胸郭下。毛皮、皮膚、内臓膜を介してカットします。
- 脾臓を削除し、5%FBSを含むRPMI 1640でシャーレ内40μlのメッシュスクリーンで脾臓を配置することによって単一の細胞懸濁液を作成します。全体脾臓はメッシュスクリーンを通過するまで、脾臓を分解するために、シリンジプランジャを使用しています。
- 各WTとL2G85.B6ドナーに対して、この手順を繰り返します。 1〜50ミリリットルコニカルチューブ内のすべてのWTは単一の細胞懸濁液を回収し、別の50 mlコニカルチューブにすべてL2G85.B6単一の細胞懸濁液を収集します。
- 4℃で10分、1,200 rpmで遠心し5%FBSおよびカウント細胞と1640 RPMIに再懸濁したペレット。
3。骨髄準備
- ドナーマウスの1後肢から皮膚を取り除きます。
- 慎重に大腿骨と脛骨/腓骨からできるだけ多くの筋肉組織として切り取った。
- 股関節で大腿骨を切り欠いて後肢を取り外します。ちょうど脛骨/腓骨交差点下後部足を切り取る。すべての骨のカットは頑丈なはさみを使用してなされるべきである。
- 慎重に残っている筋肉組織を削除します。腓骨、比較的少ない骨髄が腓骨で発見し、努力する価値はありませんがカットオフ。
- 寒い1640 RPMI 5%FBSで行わ後肢および第後肢同じ処理を繰り返します。 40x10 6骨髄細胞-各マウスに20×10 6の間に生成する必要があります。
4。骨髄除去
- メディアと冷たいメディアの少量(〜1ml)を持つ大規模なシャーレ内の場所から1後肢を取り外します。
- 膝関節を切り取る。脛骨にシリンジ(容量> 5ミリリットル)、インサート皮下注射針を使用して、すべての赤の材料は、脛骨の内側から削除されるまで注射器を押し下げる。大腿骨を使用してプロセスを繰り返します。骨髄を欠いた残りの骨を捨てる。第二後肢同じ処理を繰り返します。
- 大型シャーレに骨髄を含むメディアをピペッティングすることによって単一の細胞懸濁液を作成し、シリンジのプランジャーとμlの40を使用画面をメッシュにする。 50mlコニカルチューブにピペット単一細胞懸濁液を行い、氷上で保存する。
5。 CD3枯渇
骨髄からCD3 +細胞を枯渇させる様々な方法があります。私たちの研究室では、ミルテニーバイオテク社( - 130-093-021 CD3-ビオチン)製のキットを使用しています。製造業者のプロトコルに従って骨髄からCD3 +細胞を枯渇させる。ミルテニーキット用バッファは今後のMACSバッファー(2mMのEDTA、PBS、pH7.2中0.5%BSA)で呼び出されます。
- 4℃とカウント細胞で10分間、1200rpmで脾細胞と骨髄細胞を遠心分離することによって細胞を洗浄します。
- すべての上清を取り除きます。 MACS Buffer内千万骨髄細胞当たり100μlで骨髄細胞を再懸濁します。
- "製造·プロトコルを使用して、CD3枯渇に進みます。
- CD3枯渇した骨髄細胞を滅菌PBSで3回洗浄する。 CD3枯渇した骨髄細胞をカウントし、10 7個の細胞を注入するための適切な音量で再懸濁します。
6。 L2G85.B6 CD8 + T細胞の精製
L2G85.B6マウス由来のCD8 T細胞を精製するためのさまざまな方法があります。また、WTの脾細胞ドナーからのCD8 + T細胞を枯渇させるいくつかの方法があります。私たちの研究室では、ミルテニーバイオテク社( - 130-049-401、CD8浄化 - 130-095-236 CD8枯渇)からのキットを使用しています。
- 10 7個の細胞あたり90μlのMACSバッファーのWTペレットを再懸濁します。 '製造プロトコル( - 130-049-401 CD8枯渇)によるCD8 T細胞の枯渇を続行します。
- 10 7個の細胞あたり40μlのMACS BufferにL2G85.B6ペレットを再懸濁します。 '製造プロトコル( - 130-095-236 CD8精製)によるCD8 T細胞の浄化を続けてください。
- 各細胞集団をカウントし、滅菌PBSで各集団を3回洗う。 18x10 6 WT(CD8枯渇)脾細胞とCD8 T細胞を精製した2×10 6 L2G85.B6を注入する適切なボリュームで、各集団を再懸濁します。
7。注射の準備
- マイクロ遠心チューブにCD8 T細胞を精製し10 7 CD3枯渇骨髄細胞、18x10 6 WT(CD8枯渇)脾細胞、および2×10 6 L2G85.B6を兼ね備えています。 300μlの滅菌PBSに再懸濁しで洗ってください。
- レシピエントマウスの尾静脈に細胞調製物を注入します。注射は28ゲージの針を使用して行われる必要があります。
- 酸性水とmicroisolatorケージにマウスを保管してください。スコアマウスは毎日クックらによって開発された1得点移植片対宿主病(GVHD)のスコアリングシステムを使用しています。
8。生物発光イメージング
- 六日後に移植、4mgのD-ルシフェリンとレシピエントマウスを注入します。ルシフェリンのための5分がルシフェラーゼと反応することができます。
- 小さなビニングで5分間生物発光イメージャと画像受信者のイソフルラン室でマウスを麻酔。できるだけ多くのイベントとして収集しながら、これは、高解像度の画像を作成します。
- リビングを使用してデータを分析映像ソフト。擬似カラー画像のスケールは、最良の結果を得るために変更することができます。しかし、それは同じスケールが実験を越えて使用することが不可欠です。
- 関心領域は、関心のある各領域から放出されるフラックス(光子/秒)を計算することにより定量化することができるリビングImageソフトウェアと光のエミッタンスを使用して作成できます。
9。代表的な結果
約7-10日、移植後、マウスはGVHDの臨床徴候を示し始めます。マウスは、グルーミングの不足のためにだらしが表示されます。受信者は、7〜10日後の移植の間重量を失うために開始されます。レシピエントマウスの活動や姿勢は、約12から14日後の移植まで、比較的正常なままになります。移植片対宿主病(GVHD)の累積スコアは着実に最初の2-3週間後に移植( 図1A)を介して増加します。疾患の経過はマウスの間かなり可変ですが、受信者は一様に30から40 dでGVHDに屈するべきであるAYS移植後( 図1B)。
図2は、6日後に移植を画像化したレシピエントマウスを示しています。擬似着色されたスケールは脾臓と腸内で放出されている最高の光強度で体全体に光放射率を変化させることを示しています。腸内でCD8 T細胞の蓄積がこれまでの知見と一致している6。レシピエントマウスを後の時点で撮像または ex vivoイメージングのために安楽死させるためにmicroisolatorケージに戻すことができます。
| 基準 | グレード0 | グレード1 | グレード2 |
| 減量(wkly.) | <10% | > 10% - <25% | > 25% |
| 姿勢 | ノーマル | 安静時だけハンチング | いくつかのハンチング;損なうmovemeNT |
| 活動 | ノーマル | 活性の低下が軽度から中等度 | 静止刺激しない限り、 |
| 毛皮の質感 | ノーマル | 波打ち、軽度から中等度 | 重度の波打ち/貧しいグルーミング |
| 肌のきめ | ノーマル | 足/尾のスケーリング | 裸にされた皮膚の明白な分野 |
表1。クックらは、1996年1でこのスコアリングシステムを開発しました。マウスは、左の基準のそれぞれで、毎日獲得する必要があります。各マウスは、各基準について0から2のスコアを与えられ、総得点は、すべての個別スコアの合計である。

図1致死量の放射線を照射BALB.Bが10 7骨を移植した骨髄細胞を単独で、または18x10 6 CD8 T細胞枯渇WT脾細胞および2×10 6精製L2G85.B6 CD8 T細胞を持つ。 )骨髄のレシピエントの臨床スコアデータ単独またはCD8 T細胞とWTの脾細胞を枯渇しL2G85.B6 CD8 T細胞を精製した。 B)の骨髄のレシピエントの生存データ単独またはCD8 T細胞枯渇WTの脾細胞および精製L2G85.B6 CD8 T細胞とは大きく姿を見るにはここをクリック 。
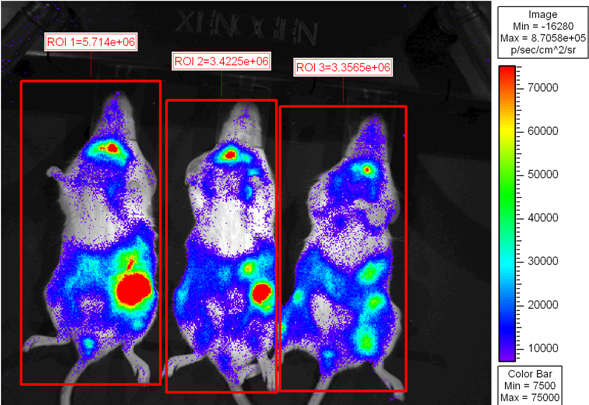
図2:致死量の放射線を照射BALB.Bマウスは10 7骨髄細胞単独またはL2G85.B6 CD8 T細胞を精製18x10 6 CD8 T細胞枯渇WT脾細胞と2×6を移植した。受信者は、腹腔内注射によって4 mgのD-ルシフェリンを注入したと小さなビニングで5分間のXenogen IVISを用いて撮像した。 psの紫は低強度を表し、赤は関心の高強度領域を表しeudo色の画像が表示されます全体のマウスと全光束(光子数/秒)を定量したの周りに描かれた。
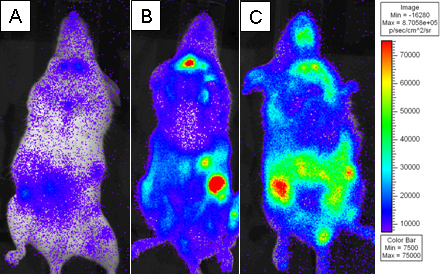
図3:致死量の放射線を照射BALB.Bマウスは10 7の骨髄細胞を単独で、またはL2G85.B6 CD8 T細胞を精製18x10 6 CD8 T細胞枯渇WT脾細胞と2×6を移植した。受信者は、腹腔内注射によって4 mgのD-ルシフェリンを注入したと小さなビニングで5分間のXenogen IVISを用いて撮像した。紫は低強度を表し、赤は高輝度を表し、擬似カラー画像が表示されます。受信者は)4日目、B)は6日目、C)は8日目のポスト転送で撮像した。
ディスカッション
ここに提示されたマウスでGVHDを誘導するためのプロトコルがマウスGVHDの臨床的に関連のあるモデルを表します。もともとBerger らによって確立された1994年に、C57BL / 6はBALB.Bひずみ組み合わせに、MHC-照合され、依存CD4、最も一般的な臨床シナリオ3と非常に類似してCD8 + Tエフェクタ2によって媒介移植片対宿主病(GVHD)で死亡。それは単独でCD8 + T細胞を移植する?...
開示事項
特別な利害関係は宣言されません。
謝辞
我々は、その優れた技術サポート、知的入力、および精神的支援先にこれらの研究を動かすことに尽力していたアリスゴーハンとジャオ·チン王の世話になっています。これらの研究は、GAHにNIHの助成金AI036532によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| RPMI 1640 | インビトロジェン | 12633-012 | |
| ウシ胎仔血清 | インビトロジェン | 10439016 | |
| 40μMのセルストレーナー | BD Biosciences社 | 352340 | |
| CD3e-ビオチン | ミルテニーバイオテク | 130-093-021 | |
| Anti-Biotin MicroBeadsは | ミルテニーバイオテク | 130-091-147 | |
| CD8aマイクロビーズ | ミルテニーバイオテク | 130-049-401 | 脾臓からCD8 T細胞を枯渇させるために使用します。 |
| CD8a精製抗体カクテル | ミルテニーバイオテク | 130-095-236 | 精製するために使用脾臓からCD8 T細胞。 |
| D-ルシフェリン | キャリパーライフサイエンス | 122796 |
参考文献
- Cooke, K. R. An experimental model of idiopathic pneumonia syndrome after bone marrow transplantation: The roles of minor H antigens and endotoxin. Blood. 88, 3230-3239 (1996).
- Berger, M. T cell subsets involved in lethal graft-versus-host disease directed to immunodominant minor histocompatibility antigens. Transplantation. 57, 1095-1102 (1994).
- Nimer, S. D. Selective depletion of CD8+ cells for prevention of graft-versus-host disease after bone marrowtransplantation. A randomized controlled trial. Transplantation. 57, 82-87 (1994).
- Korngold, R., Sprent, J. Surface markers of T cells causing lethal graft-vs-host disease to class I vs class II H-2 differences. Journal of Immunology. 135, 3004-3010 (1985).
- Cao, Y. A. Molecular imaging using labeled donor tissues reveals patterns of engraftment, rejection, and survival in transplantation. Transplantation. 80, 134-139 (2005).
- Asady, R. E. l. TGF-{beta}-dependent CD103 expression by CD8(+) T cells promotes selective destruction of the host intestinal epithelium during graft-versus-host disease. J. Exp. Med. 201, 1647-1657 (2005).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol Rev. 114, 181-217 (1990).
- Karecla, P. I. Recognition of E-cadherin on epithelial cells by the mucosal T cell integrin alpha M290 beta 7 (alpha E beta 7). Eur. J. Immunol. 25, 852-856 (1995).
- Cepek, K. L. Adhesion between epithelial cells and T lymphocytes mediated by E-cadherin and the alpha E beta 7 integrin. Nature. 372, 190-193 (1994).
- Malarkannan, S. The molecular and functional characterization of a dominant minor H antigen, H60. J. Immunol. 161, 3501-3509 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved