Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Induktion der Graft-versus-Host-Krankheit und
In diesem Artikel
Zusammenfassung
Murine Knochenmark-Transplantation ist eine weit verbreitete Technik, um immunologische Mechanismen für Graft-versus-Host-Krankheit beim Menschen zu studieren. Die Fähigkeit zur T-Zell-Trafficking-Muster zu überwachen In vivo Ermöglicht eine detaillierte Analyse der Entwicklung und Aufrechterhaltung der T-Zell-Reaktionen während der Graft-versus-Host-Krankheit.
Zusammenfassung
Graft-versus-host disease (GVHD) der limitierende Barriere für den breiten Einsatz von Knochenmarktransplantation als kurative Therapie für eine Vielzahl von hämatologischen Mängel. GVHD wird durch reife alloreaktiven T-Zellen im Knochenmark Transplantat, das in den Empfänger infundiert werden verursacht und verursachen Schäden an Host Organe. Jedoch in Mäusen, muß T-Zellen des Knochenmarks Inoculum zugegeben werden, um GVHD bewirken. Obwohl umfangreiche Arbeit getan ist, um T-Zell-Reaktionen nach der Transplantation charakterisieren, ist biolumineszierenden Bildgebungstechnologie eine nicht-invasive Methode zur T-Zell-Trafficking Mustern in vivo zu überwachen.
Nach tödlichen Bestrahlung werden Empfängermäuse mit Knochenmarkzellen und Splenozyten von Spender-Mäusen transplantiert. T-Zell-Teilmengen aus L2G85.B6 (transgene Mäuse konstitutiv exprimieren Luciferase) in dem Transplantat enthalten. Mit nur Transplantation bestimmte T-Zell-Untergruppen, ist man in der Lage, spezifische T-Zell-Untergruppen in vivo zu verfolgen,und basierend auf ihren Standort, entwickeln Hypothesen über die Rolle von spezifischen T-Zell-Untergruppen bei der Förderung GVHD zu verschiedenen Zeitpunkten. In vorgegebenen Intervallen nach der Transplantation sind Empfängermäuse abgebildet mit einem Xenogen IVIS CCD-Kamera. Lichtintensität kann quantifiziert unter Verwendung Lebend Image Software, um eine Pseudo-Farbbildes auf Photonenintensität (rot = hoher Intensität, violett = geringer Intensität) basierend zu generieren.
Zwischen 4-7 Tage nach der Transplantation beginnen Empfängermäuse klinischen Anzeichen von GVHD zu zeigen. Cooke et al. 1 entwickelt ein Scoring-System bis zur Krankheitsprogression auf der Empfängermäuse Fell Textur, die Integrität der Haut, Aktivität, Gewichtsverlust, und die Haltung der Basis zu quantifizieren. Mäuse werden täglich bewertet und eingeschläfert, wenn sie moribund werden. Empfängermäuse Regel geworden moribund 20-30 Tage nach der Transplantation.
Murine Modelle sind wertvolle Werkzeuge für das Studium der Immunologie der GVHD. Selektiv Transplantation insbesondere T-Zell-Untergruppen alTiefs für sorgfältige Identifikation der Rollen jede Teilmenge spielt. Nicht-invasiv Tracking T-Zell-Antworten in vivo fügt eine weitere Schicht von Wert murine GVHD Modelle.
Protokoll
Ein. Lethal Bestrahlung
- Platzieren bis 10 Empfängermäuse in einen Käfig Mikroisolator kompatibel mit dem Bestrahler verwendet werden.
- Strahlen in 2 gleich große Dosen Summierung Gesamtdosis (Gesamtdosis = 9 cGy für BALB.B Empfänger). Zweiten Bestrahlung sollte 3 h nach der ersten. Die Injektion sollte zwischen 4-6 Stunden nach der letzten Bestrahlung auftreten. Bestrahlen Mäuse in beiden Cs 137 Quelle oder RS2, 000, Strahler.
- Im Anschluss an die zweite Strahlungsdosis, speichern Mäuse in Mikroisolator Käfig mit angesäuertem Wasser bis zum Zeitpunkt der Transplantation.
2. Splenozyten Vorbereitung
- Einschläfern einem Spender Maus nach den Richtlinien des Instituts. Jeder Spender in der Regel ergibt 75x10 6 - 125x10 6 Splenozyten. Mit CD8 Aufreinigungskits, jede Maus in der Regel ergibt 6x10 6 - 12x10 6 CD8 T-Zellen.
- Entfernen der Milz, indem man zuerst eine vertikale 2 cm lange Inzision 2 cm rechts von der Mittellinie direktunter dem Brustkorb. Schnitt durch das Fell, Haut und viszeralen Membran.
- Entfernen der Milz und erstellen Einzelzellsuspension indem Milz in 40 ul Sieb in eine Petrischale mit 1640 RPMI mit 5% FBS. Verwenden Sie einen Spritzenkolben auseinander zu brechen, die Milz, bis die gesamte Milz durch Sieb verabschiedet worden.
- Wiederholen Sie diesen Vorgang für jeden WT und L2G85.B6 Spender. Sammeln Sie alle WT einzelnen Zellsuspensionen in 1-50 ml konischen Röhrchen, und sammeln Sie alle L2G85.B6 einzelnen Zellsuspensionen in einem separaten 50 ml konischen Röhrchen.
- Zentrifuge Zellen bei 1.200 Upm für 10 min bei 4 ° C. Resuspendieren Pellets in 1640 RPMI mit 5% FBS und Graf Zellen.
3. Bone Marrow Vorbereitung
- Entfernen Sie die Haut von einem Hinterbein eines Spenders Maus.
- Vorsichtig weggeschnitten so viel Muskelgewebe wie möglich von Femur und Tibia / Fibula.
- Entfernen Hinterbein indem Femur derzeit Hüftgelenk. Schneiden Sie Hinterpfote knapp unter Tibia / Fibula Kreuzung. Alle Knochenschnitte sollte durch robuste Schere werden.
- Entfernen Sie vorsichtig restlichen Muskelgewebe. Abgeschnitten Wadenbein-relativ wenig Knochenmark in Fibula gefunden und die Mühe nicht wert.
- Zeigen Hinterbein in kaltem 1640 RPMI 5% FBS und wiederholen Sie den Vorgang mit dem zweiten Hinterbein. 40x10 6 Knochenmarkszellen - Jede Maus sollte zwischen 20x10 6 ergeben.
4. Bone Marrow Removal
- Entfernen ein Hinterbein von Medien und in großen Petrischale mit einer kleinen Menge kaltem Medium (~ 1 ml).
- Schneiden Sie das Kniegelenk. Verwendung einer Spritze (Volumen> 5 ml), Insert subkutanen Nadel in Tibia und niederdrücken Spritze bis das gesamte Material von roten Inneren Tibia entfernt wird. Wiederholen Sie den Vorgang mit Femur. Verbleibende Knochen frei von Knochenmark. Wiederholen Sie den Vorgang mit dem zweiten Hinterbein.
- Erstellen einzigen Zellsuspension durch Pipettieren Medien mit Knochenmark in großen Petrischale und Nutzung Spritzenkolben und 40 ulMaschensieb. Pipette einzigen Zellsuspension in 50 ml konischen Röhrchen und auf Eis.
5. CD3 Depletion
Es gibt eine Vielzahl von Möglichkeiten, CD3 +-Zellen aus dem Knochenmark abzureichern. Unser Labor verwendet ein Set von Miltenyi Biotec (CD3-Biotin - 130-093-021) hergestellt. Abzureichern CD3 +-Zellen aus dem Knochenmark nach Herstellers bestimmt. Der Puffer für Miltenyi Kits wird fortan als MACS-Puffer (2 mM EDTA, 0,5% BSA in PBS, pH 7,2) werden.
- Waschen der Zellen durch Zentrifugation Splenozyten und Knochenmarkszellen bei 1200 UpM für 10 min bei 4 ° C und Zählung Zellen.
- Entfernen Sie alle Überstand. Resuspendieren Knochenmarkzellen in 100 ul pro 10 Millionen Knochenmarkszellen in MACS-Puffer.
- Fahren Sie mit CD3 Depletion mit fertigt 'Protokoll.
- Waschen CD3 verarmte Knochenmarkzellen 3 mal in sterilem PBS. Graf CD3 abgereichert Knochenmarkzellen und resuspendieren in einem geeigneten Volumen auf 10 7 Zellen zu injizieren.
6. L2G85.B6 CD8 + T-Zell-Reinigung
Es gibt eine Vielzahl von Möglichkeiten, um CD8 + T-Zellen von Mäusen L2G85.B6 reinigen. Auch gibt es mehrere Möglichkeiten, um CD8 + T-Zellen aus Splenocyten WT Spendern führen. Unser Labor verwendet Kits von Miltenyi Biotec (CD8 Depletion - 130-049-401, CD8 Reinigung - 130-095-236).
- Resuspendieren des WT Pellet in 90 ul MACS Puffer pro 10 7 Zellen. Fahren Sie mit CD8 T-Zell-Depletion nach Hersteller 'Protokoll (CD8 Depletion - 130-049-401).
- Resuspendieren L2G85.B6 Pellet in 40 ul MACS Puffer pro 10 7 Zellen. Fahren Sie mit CD8 T-Zell-Reinigung nach Hersteller 'Protokoll (CD8 Reinigung - 130-095-236).
- Zählen Sie jeden Zellpopulation und waschen jeder Population 3 mal mit sterilem PBS. Resuspendieren jeder Population in ausreichender Menge, um 18x10 6 WT (CD8 abgereichertes) Splenozyten und 2x10 6 L2G85.B6 gereinigt CD8 T Zellen zu injizieren.
7. Injection Vorbereitung
- Kombinieren Sie 10 7 CD3 erschöpft Knochenmarkszellen, 18x10 6 WT (CD8 abgereichertes) Splenozyten und 2x10 6 L2G85.B6 gereinigt CD8 T-Zellen in einem Mikrozentrifugenröhrchen. Waschen mit sterilem PBS und resuspendieren in 300 ul.
- Inject Zellpräparation in die Schwanzvene von Empfängermäuse. Injektionen sollte mit 28 Gauge-Nadeln werden.
- Shop Mäuse in Mikroisolator Käfig mit angesäuerten Wasser. Ergebnis Mäuse täglich mit Scoring GVHD Scoring-System von Cooke et al 1 entwickelt.
8. Bioluminescent Imaging
- Sechs Tage nach der Transplantation, injizieren Empfängermäuse mit 4 mg D-Luciferin. Lassen Sie 5 min zur Luciferin mit Luciferase reagieren.
- Anesthetize Maus in Isofluran Kammer des Biolumineszenz-Imager und Bild Empfänger für 5 min mit kleinen Binning. Dadurch wird eine hohe Auflösung beim Sammeln so viele Veranstaltungen wie möglich.
- Analysieren von Daten mit WohnzimmerImage-Software. Der Maßstab der Pseudo-Farbbildes verändert werden, um die besten Ergebnisse zu ergeben. Allerdings ist es unabdingbar, dass die gleiche Größenordnung in Experimenten verwendet werden.
- Interessierenden Regionen können mit Lebend Image Software und Licht Emittanz kann durch Berechnen des Flusses (Photonen / sec) von jedem interessierenden Bereich emittiert quantifiziert werden kann.
9. Repräsentative Ergebnisse
Etwa 7-10 Tage nach der Transplantation beginnen Mäusen klinischen Anzeichen von GVHD. Mäuse erscheinen scruffy wegen des Mangels an Pflege. Die Empfänger werden auch damit beginnen, Gewicht zwischen 7-10 Tage nach der Transplantation zu verlieren. Aktivität und Haltung Empfängermäuse bleibt relativ normal, bis ca. Tag 12-14 nach der Transplantation. Kumulierte GVHD Partituren wird stetig durch den ersten 2-3 Wochen nach der Transplantation (Abbildung 1A) erhöhen. Krankheitsverlauf ist sehr variabel zwischen Mäusen, aber Empfänger sollten gleichmäßig erliegen um 30-40 d GVHDays nach der Transplantation (Abbildung 1B).
Abbildung 2 zeigt Empfängermäuse, die 6 Tage nach der Transplantation abgebildet wurden. Pseudo-farbigen Skala zeigt variierende Licht Emittanz während des Körpers mit der höchsten Lichtstärke in der Milz und dem Darm emittiert. CD8 T-Zell-Anreicherung im Darm ist konsistent mit früheren Feststellungen 6. Empfängermäuse kann wieder in Mikroisolator Käfig platziert werden, um zu einem späteren Zeitpunkt abgebildet werden euthanasiert oder zur ex vivo Bildgebung.
| Kriterien | Grade 0 | Grade 1 | Grade 2 |
| Gewichtsverlust (wkly.) | <10% | > 10% - <25% | > 25% |
| Haltung | Normal | Gebeugt nur in Ruhe | Mehrere gebeugt; beeinträchtigt movement |
| Aktivität | Normal | Leichte bis Abnahme der Aktivität moderieren | Stationäre es sei denn, stimuliert |
| Fur texture | Normal | Leichte bis mäßige zerzauste | Schwere Kräuseln / schlechte Pflege |
| Hautstruktur | Normal | Skalierung der Pfoten / tail | Offensichtliche Bereichen entblößt Haut |
Tabelle 1. Cooke et al entwickelte diese Scoring-System in 1996 1. Mäuse sollten täglich auf jedes der Kriterien auf der linken gewertet. Jede Maus wird eine Punktzahl von 0-2 für jedes Kriterium gegeben und die Gesamtpunktzahl ist die Summe aller einzelnen Noten.

Abbildung 1. Letal bestrahlten BALB.B wurden mit 10 7 Knochen transplantiertKnochenmarkzellen allein oder mit 18x10 6 CD8 T-Zell-Depletion WT Splenozyten und 2x10 6 gereinigt L2G85.B6 CD8 T-Zellen. A) Clinical Score-Daten von Empfängern von Knochenmark allein oder mit CD8 T-Zell-Depletion WT Splenozyten und gereinigt L2G85.B6 CD8 T-Zellen. B) Survival Daten von Empfängern von Knochenmark allein oder mit CD8 T-Zell-Depletion WT Splenozyten und gereinigt L2G85.B6 CD8 T-Zellen. Klicken Sie hier für eine größere Abbildung zu sehen .
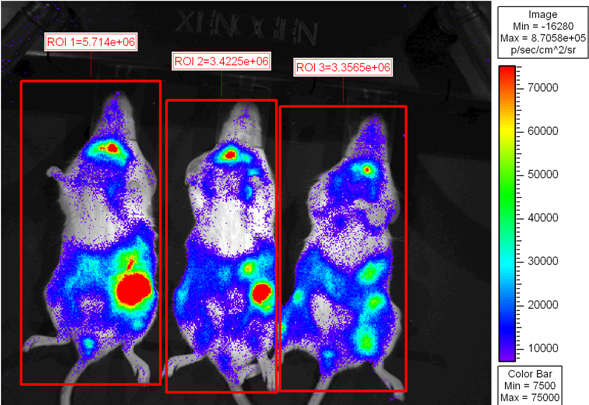
Abbildung 2. Letal bestrahlten BALB.B Mäuse wurden mit 10 7 Knochenmarkzellen allein oder mit 18x10 6 CD8 T-Zell-Depletion WT Splenozyten und 2x10 6 gereinigt L2G85.B6 CD8 T-Zellen transplantiert. Empfänger wurden mit 4 mg D-Luciferin über intraperitoneale Injektion injiziert und wurden unter Verwendung Xenogen IVIS 5 min bei kleinen Binning. PsEudo-farbigen Bilder werden gezeigt, wo Purpur stellt geringer Intensität und Rot steht für hohe Intensität Regionen von Interesse rund um die gesamte Maus und Gesamtfluss (Photonen / sec) gezogen wurden quantifiziert.
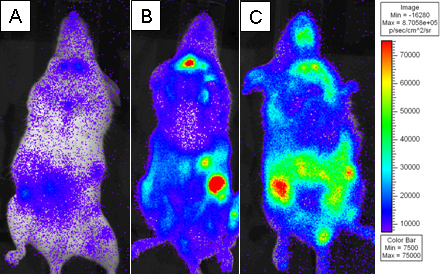
Abbildung 3. Letal bestrahlten BALB.B Mäuse wurden mit 10 7 Knochenmarkzellen allein oder mit 18x10 6 CD8 T-Zell-Depletion WT Splenozyten und 2x10 6 gereinigt L2G85.B6 CD8 T-Zellen transplantiert. Empfänger wurden mit 4 mg D-Luciferin über intraperitoneale Injektion injiziert und wurden unter Verwendung Xenogen IVIS 5 min bei kleinen Binning. Pseudo-farbigen Bilder werden gezeigt, wo Purpur stellt geringer Intensität und Rot steht für hohe Intensität. Die Empfänger wurden auf A) Tag 4, B) Tag 6 und C) Tag 8 nach der Übertragung abgebildet.
Diskussion
Das Protokoll zur Induktion bei Mäusen hier vorgestellten GVHD stellt eine klinisch relevante Modell der murinen GvHD. Zitat von Berger et al. Im Jahr 1994, ist die C57Bl / 6 in BALB.B Stammkombination MHC abgestimmt, mit GVHD Sterblichkeit durch CD4 abhängig, CD8 T-Effektoren 2, sehr ähnlich zu den häufigsten klinischen Szenario 3 vermittelt. Es ist bekannt, dass die Transplantation CD8 T-Zellen allein verursacht keine GVHD in diesem Modell, jedoch ist Krankheitsprogression deutlich s...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Alice Gaughan und Jiao-Jing Wang, dessen hervorragende technische Unterstützung, geistigen Input und moralische Unterstützung waren maßgeblich an der Bewegung dieser Studien vor. Diese Studien wurden von der NIH AI036532 zur GAH unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | Kommentare |
| RPMI 1640 | Invitrogen | 12633-012 | |
| Fetal Calf Serum | Invitrogen | 10439016 | |
| 40 uM Zellsieb | BD Biosciences | 352340 | |
| CD3e-Biotin | Miltenyi Biotech | 130-093-021 | |
| Anti-Biotin Microbeads | Miltenyi Biotech | 130-091-147 | |
| CD8a Microbeads | Miltenyi Biotech | 130-049-401 | Verwendet werden, um CD8 T-Zellen aus der Milz führen. |
| CD8a Reinigung Antikörper Cocktail | Miltenyi Biotech | 130-095-236 | Gebrauchte zu reinigenCD8 T-Zellen aus der Milz. |
| D-Luciferin | Caliper Life Sciences | 122796 |
Referenzen
- Cooke, K. R. An experimental model of idiopathic pneumonia syndrome after bone marrow transplantation: The roles of minor H antigens and endotoxin. Blood. 88, 3230-3239 (1996).
- Berger, M. T cell subsets involved in lethal graft-versus-host disease directed to immunodominant minor histocompatibility antigens. Transplantation. 57, 1095-1102 (1994).
- Nimer, S. D. Selective depletion of CD8+ cells for prevention of graft-versus-host disease after bone marrowtransplantation. A randomized controlled trial. Transplantation. 57, 82-87 (1994).
- Korngold, R., Sprent, J. Surface markers of T cells causing lethal graft-vs-host disease to class I vs class II H-2 differences. Journal of Immunology. 135, 3004-3010 (1985).
- Cao, Y. A. Molecular imaging using labeled donor tissues reveals patterns of engraftment, rejection, and survival in transplantation. Transplantation. 80, 134-139 (2005).
- Asady, R. E. l. TGF-{beta}-dependent CD103 expression by CD8(+) T cells promotes selective destruction of the host intestinal epithelium during graft-versus-host disease. J. Exp. Med. 201, 1647-1657 (2005).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol Rev. 114, 181-217 (1990).
- Karecla, P. I. Recognition of E-cadherin on epithelial cells by the mucosal T cell integrin alpha M290 beta 7 (alpha E beta 7). Eur. J. Immunol. 25, 852-856 (1995).
- Cepek, K. L. Adhesion between epithelial cells and T lymphocytes mediated by E-cadherin and the alpha E beta 7 integrin. Nature. 372, 190-193 (1994).
- Malarkannan, S. The molecular and functional characterization of a dominant minor H antigen, H60. J. Immunol. 161, 3501-3509 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten