Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo murino de asma inducida por alergenos
En este artículo
Resumen
Los modelos experimentales de ratón de asma alérgica ofrecen nuevas posibilidades para el estudio de patogénesis de la enfermedad y el desarrollo de nuevas terapias. Estos modelos se adaptan bien a los factores de medición que regulan la respuesta inmune alérgica, inflamación de las vías, y la fisiopatología pulmonar.
Resumen
El asma es una causa importante de morbilidad y mortalidad, que afecta a unos 300 millones de personas en todo el mundo. 1 Más de un 8% de la población de EE.UU. tiene asma, con la creciente prevalencia. 2 Al igual que con otras enfermedades, los modelos animales de enfermedad de las vías respiratorias alérgicas facilitan en gran medida comprensión de la fisiopatología subyacente, ayudan a identificar posibles dianas terapéuticas, y permitir que las pruebas preclínicas de posibles nuevas terapias. Los modelos de la enfermedad de las vías respiratorias alérgicas se han desarrollado en varias especies animales, pero los modelos murinos son particularmente atractivas debido al bajo costo, disponibilidad, y bien caracterizados sistema inmunológico de estos animales. 3 Disponibilidad de una gran variedad de cepas transgénicas aumenta aún más el atractivo de estos modelos. 4 A continuación se describen dos modelos murinos de enfermedad de las vías respiratorias alérgicas, tanto en el empleo de la ovoalbúmina como antígeno. Después de sensibilización inicial por inyección intraperitoneal, un modelo Delivres la exposición al antígeno por nebulización, el otro por la entrega intratraqueal. Estos dos modelos ofrecen ventajas complementarias, con cada imitando las características principales de asma humano. 5
Las principales características de asma aguda incluyen una respuesta exagerada a los estímulos vía aérea, tales como la metacolina (hiperreactividad de las vías respiratorias; AHR) y eosinófilos rica inflamación de las vías. Estos son también efectos importantes de la exposición al alérgeno en los modelos murinos, 5,6, y se describen las técnicas para su medición y por lo tanto la evaluación de los efectos de la manipulación experimental. En concreto, se describen ambos invasivos y no invasivos 7-8 técnicas para la medición de la hiperreactividad de las vías respiratorias, así como los métodos para evaluar la infiltración de células inflamatorias en las vías respiratorias y el pulmón. Las vías respiratorias células inflamatorias son recogidos por lavado broncoalveolar, mientras que la histopatología de pulmón se utiliza para evaluar los marcadores de inflamación en todo el órgano. Estostécnicas proporcionan herramientas poderosas para el estudio del asma en formas que no serían posibles en los seres humanos.
Protocolo
I. La sensibilización alérgica y el desafío (ver Figura 1)
A. Para Challenge intratraqueal
- Por sensibilización inicial, inyectar macho o hembra C57BL / 6 o ratones BALB / c (6-8 semanas de edad) por vía intraperitoneal el día 0 y de nuevo el día 7 con 20 mg de ovoalbúmina (OVA; Sigma-Aldrich, St. Louis, MO) emulsionado en 0,2 ml de fosfato de solución salina estéril tamponada (PBS) que contenía 2 mg de hidróxido de aluminio (Sigma-Aldrich) o con 2 mg de hidróxido de aluminio en 0,2 ml de PBS estéril como control.
- Desafío con el antígeno como apropiado (por ejemplo, en los días 14, 16, 18 y 20). Desafío procedimiento siguiente.
- Anestesie ratón con una inyección intraperitoneal (ip) de inyección de una mezcla de ketamina (90 mg / kg) y xilazina (10 mg / kg). Asegúrese de que el ratón está totalmente anestesiado durante al menos 10 minutos.
- La superficie de operación de ángulo a 45 grados o más. Coloque el cursor sobre esta superficie de mantenimiento de la parte ventral hacia arriba y la cabeza en la parte superior.
- Hook tHRead en los incisivos delanteros para mantener la cabeza hacia atrás. Nivel de las patas entre sí para garantizar la tráquea es recta y use cinta de etiquetas para mantener las piernas. Remoje sitio quirúrgico con EtOH 70% y el hisopo.
- Aplicar bupivicaína (0,1 a 0,2 ml de solución al 0,25%) por vía tópica en el sitio de la incisión.
- Nip piel de la garganta con unas pinzas y tirar suavemente hacia afuera. Hacer una pequeña incisión vertical con unas tijeras quirúrgicas. Reducir al mínimo el tamaño de la incisión.
- Preparar una jeringa de 1 ml con 50 l de PBS o el 0,1% OVA en PBS y se inserta en una pipeta repetitiva (Tridak paso a paso, Torrington, CT). Tomar la pipeta en una mano y usar la otra para mantener el tejido de vuelta con las pinzas y exponer la tráquea.
- Sosteniendo la jeringa como paralela a la tráquea como sea posible, insertar la aguja a través de la tráquea pared e inyectar la solución.
- Mantener el ratón en una inyección de la orientación vertical de las siguientes para dar tiempo a la solución para resolver en los pulmones.
- La herida suavemente y cerca estéril área conpinzas y sello con sutura.
- Coloque el ratón el esternón hacia abajo en un cojín de calefacción y permitir su recuperación hasta que esté completamente ambulatoria. Después de la recuperación, devolver el ratón para la instalación de cuidado de los animales y monitorear diariamente para detectar signos de seroma, inflamación o infección, y la dehiscencia de la herida hasta que la herida haya cicatrizado completamente.
B. Para Challenge por nebulización
- Sensibilizar ratones en el día 0 por inyección intraperitoneal de 20 mg de OVA (Sigma-Aldrich) emulsionado en 0,2 ml de PBS estéril que contiene 2 mg de hidróxido de aluminio (Sigma-Aldrich) o con 2 mg de hidróxido de aluminio en 0,2 ml de PBS estéril como control .
- En el día 14, aumentar la sensibilización por inyección ip como se describió anteriormente.
- El día 21, 22 ª, 23 ª, 24 ª y 25 ª después de la sensibilización inicial, los ratones desafío por la exposición durante 30 minutos a la OVA nebulizada al 1% o PBS solo entrega a través de un nebulizador ultrasónico (Buxco de Investigación de Sistemas, Wilmington, Carolina del Norte).
- Los ratones lugar en la cámara principal de WBP; aclimatarlos dentro de la cámara pletismografía por lo menos durante 10 minutos.
- Colocar 1 ml de 0,1% OVA en PBS estéril o PBS estéril solo, como se describe en los pasos 4-6 abajo, a través de un nebulizador. Nebulizar durante 30 min.
- Retire del nebulizador y descartar cualquier solución restante.
- Nebulización puede realizarse en todos los ratones simultáneamente mediante el uso de una cámara de nebulización.
II. Determinación de la hiperreactividad bronquial a la metacolina
A. no invasiva de medición de la hiperreactividad de la vía aérea mediante pletismografía corporal (WBP; Buxco de Investigación de Sistemas, de Wilmington, Carolina del Norte)
- Dejar que la botella metacolina en polvo a calentar a temperatura ambiente antes de la apertura (metacolina es muy higroscópico y formar montones inútiles si se permite que absorben agua). Preparar una 200 mg / ml de solución madre en PBS estéril, a continuación, hacer serie 2-diluciones (por ejemplo, 100, 50, 25, 12,5 y 60,25 mg / ml). Mantenga las soluciones de frío.
- Instale el equipo de la siguiente manera: conectar la entrada principal de WBP de nebulizador, el sesgo de flujo de entrada a la bomba de aire, y la salida a la trampa de gas WBP utilizando ajustada tubo de goma. Coloque el transductor de presión para reducir las salidas de las principales cámaras y referencia de la WBP. Conecte el transductor de presión para el preamplificador con los cables suministrados, y conectar a la PC usando preamplificador específico de adquisición de datos de la tarjeta.
- Calibrar el preamplificador utilizando el software de acuerdo a las recomendaciones del fabricante.
- Los ratones lugar en la cámara principal de WBP; aclimatarlos dentro de la cámara pletismografía por lo menos durante 10 minutos, a continuación, registrar lecturas de referencia (Penhbase) durante 3 min.
- Colocar 1 ml de PBS estéril en el vaso del nebulizador. Nebulizar durante 2 minutos y luego monitorear las variables respiratorias durante 6 minutos durante la fase de secado. Retire del nebulizador y descartar cualquier resto de PBS.
- Colocar 1 ml de 6,25 mg / ml de metacolina en la taza del nebulizador y rEPEAT nebulización durante 2 minutos más un ciclo de seguimiento de 6 min.
- Repita la medición con 12,5, 25, 50 y 100 mg / ml de metacolina, con el mismo período de 2 minutos de la nebulización y la 6-min ciclo de supervisión.
- Retire los ratones de las cámaras y devolverlos a sus jaulas.
- Vuelva a llenar la taza del nebulizador con 1 ml de PBS estéril y ejecutar otra secuencia para limpiar la tubería.
- Apague los flujos de aire, desmontar, y limpie todas las cámaras antes de ejecutar un segundo grupo de animales.
B. invasiva de medición de la capacidad de respuesta por la vía aérea controlada por ordenador Ventilador (flexiVent; SCIREQ Inc., Montreal, Canadá)
- Pesar el ratón y anestesiar por vía intraperitoneal (ip) la inyección de 60 mg por kg de peso corporal de sodio pentobarbital.
- Después de la anestesia adecuada posición, los ratones ventro-dorsal de la traqueostomía.
- Desinfecte la piel del cuello con un 70% de etanol. Aplicar bupivicaína (0,1 a 0,2 ml de solución al 0,25%) por vía tópica en el incision sitio. Una incisión y abrir la piel del cuello. Separe los músculos del cuello y exponer la tráquea.
- Haga un 1 - a 2 mm de incisión en la tráquea con tijeras finas (estar seguro de no cortar la tráquea) e introduzca el tubo traqueal con cautela. Atar una sutura alrededor de la tráquea para evitar una fuga de aire.
- Coloque el ratón en la cámara de pletismógrafo corporal y conectar el tubo que se inserta la tráquea al respirador.
- Iniciar la ventilación mecánica. Establezca la frecuencia respiratoria adecuada y el volumen corriente / carrera (150 golpes por minuto y 200 l, respectivamente, para un ratón de 20 g). Asegúrese de que el tórax se mueve en sincronía con el ventilador. Si el ratón está "luchando" con el respirador (auto-respiración), inyectar más anestesia y esperar a la sincronización.
- Después de las mediciones de referencia, mantener los ratones en la ventilación de referencia para otros 3 minutos, y luego tomar un 2 º conjunto de las mediciones de impedancia. Este 2 º conjunto de mediciones de referencia se utiliza para calcmular los valores basales medias.
- Entregar PBS o metacolina (MM) retos (6,25, 12,5, 25, 50 y 100 mg / ml) por canalizar el flujo inspiratorio del respirador a través de un nebulizador ultrasónico.
- Después de cada reto con MM (6,25, 12,5, 25, 50 y 100 mg / ml), se devolverá el pistón a la entrega de un Vt de 10 ml / kg a 120 respiraciones por minuto y tomar las mediciones de impedancia.
III. La medición de la infiltración celular en el espacio aéreo
A. Realice el lavado broncoalveolar (LBA)
- Después de la medición de la AHR, la eutanasia a los ratones con el CO 2, y la posición de cada ratón en su parte posterior en la plataforma quirúrgica.
- Remoje el área con 70% de EtOH.
- Comenzando en la parte inferior del abdomen, corte la cavidad abdominal y remover la piel / superior de los músculos, moviéndose hacia arriba, hacia las costillas.
- Una vez que las costillas son visibles, con unas tijeras cuidadosamente perforar el diafragma. Los pulmones deben colapsar lejos del diafragma. Tenga especial careful de no dañar los pulmones o el corazón.
- Corte la caja torácica para exponer completamente los pulmones o del corazón (evitar cortar cualquier principales vasos sanguíneos para que la sangre se llene el lugar).
- Con una jeringa de 1 ml con una aguja de calibre 27 (BD jeringas, Franklin Lakes, NJ), la punción de los ventrículos del corazón y poco a poco y con cuidado tire hacia atrás de la jeringa para recoger la sangre. Tenga cuidado para evitar el colapso del corazón.
- Recoger el suero de la sangre utilizando este protocolo estándar. Almacenar a -70 ° C hasta su uso.
- Corte y retire la piel y el tejido de la garganta hasta la tráquea se revela. Borrar el tejido suficiente para trabajar con facilidad en el campo (de nuevo, evitar cortar cualquier principales vasos sanguíneos).
- Con unas tijeras curvas, cortados en la tráquea para despejar el camino.
- Pase el punto de un fórceps curvados bajo la tráquea y sujete el extremo de un trozo de hilo de sutura. Tire del hilo de sutura en la tráquea.
- Haga un medio nudo suelto sobre la tráquea, la baja en la garganta.
- CAREFUlly cortar una muesca, un tamaño suficiente para que la cánula, por encima del hilo de sutura.
- Cuidadosamente insertar la cánula en el agujero y abajo de la tráquea más allá del punto del hilo de sutura. Presione suavemente hacia adelante hasta que la cánula sale justo a la entrada a los pulmones (demasiado lejos: pulmones punzantes, demasiado cortos: la tráquea colapso cuando se trata de recuperar BAL).
- Apretar hilo de sutura y el nudo completo para sellar alrededor de la tráquea cánula.
- Bloqueo de la jeringa (que contiene 1 ml de PBS) en la cánula, y presione suavemente el líquido en el pulmón. Lóbulos pulmonares de forma individual debe inflar lentamente. No llene excesivamente. Para un total de ratón cultivadas 0,9-1,0 ml es el máximo absoluto. 0,8 ml puede ser más seguro. Bloqueo de la jeringa a la cánula sin apretar, de lo contrario es probable que cause daños al tratar de desactivar.
- Retirar el líquido de los pulmones. Si se encuentra resistencia (tejido aspirado dentro de la cánula), presione lentamente la cánula más allá en el pulmón y volver a remover. También pruebe a girar la cánula en su lugar. Si todos los ELSe no, retirar la cánula parte del camino, la tráquea es mucho más probable que se hunda en este caso.
- Retire la jeringa de la cánula, el líquido depositado en el contenedor BAL, y repetir 2 veces con solución de PBS fresca.
- Mantenga la solución BAL en hielo hasta centrifugarse.
- Usar el líquido de BAL y el suero para medir la OVA de IgE específica mediante disponible en el mercado del ratón IgE kits de ELISA (Bioproductos MD, St. Paul, MN).
B. Contar las células y determinar Diferenciales
- Centrifugar el líquido de BAL 5 minutos a ~ 600 × g, 4 ° C.
- Resuspender el sedimento celular suavemente en PBS y mantener en hielo.
- Cargar un estándar hemacitómetro Neubauer con la suspensión celular diluida y contar las células.
- Retire las alícuotas de 2 × 10 4 células en 10 a 40 l de volumen de cytospins. Diluir las células, si es necesario.
- Para cytospins, mezcle 2 × 10 4 células, 130 l de PBS y el FBS al 10 l. Agregue la mezcla de célula entera de doubLe citospina embudo y centrifugar 10 min a 700 rpm, utilizando cytoslides dobles para las muestras duplicadas.
- Permitir que los portaobjetos se seque a temperatura ambiente durante 1 h antes de la tinción.
- Mancha de las diapositivas mediante el uso de Diff-Quick mancha (Siemens, Newark, DE).
IV. Los resultados representativos
Constricción de las vías respiratorias después de estímulos provocadores excesiva es una característica prominente de asma clínica. Se describen dos métodos para la medición de la hiperreactividad bronquial a la metacolina como en ratones OVA-sensibilizado y desafiado: Pletismografía del cuerpo entero (Figura 2) y oscilación forzada utilizando el sistema de flexiVent (Figura 3). Ambos métodos demuestran que la OVA de sensibilización y desafío produce hiperreactividad bronquial en los ratones.
Rica en eosinófilos inflamación de las vías es otra característica destacada de tanto clínico del asma y la enfermedad de las vías respiratorias alérgicas en ratones. Como se muestra en la Figura 4 , OVA de sensibilización y el desafío aumenta considerablemente el número total de células que pueden ser recuperados de las vías respiratorias por el BAL. El número de eosinófilos y, en menor medida, los neutrófilos son especialmente aumentado.
La evidencia indica que los resultados de las vías respiratorias alérgicas enfermedades de la sobreproducción de anticuerpos IgE frente a antígenos de sensibilización. La sensibilización y el desafío con OVA utilizando los protocolos que describen aumenta los niveles de IgE en suero y líquido de BAL de ratones tratados (Figura 5).
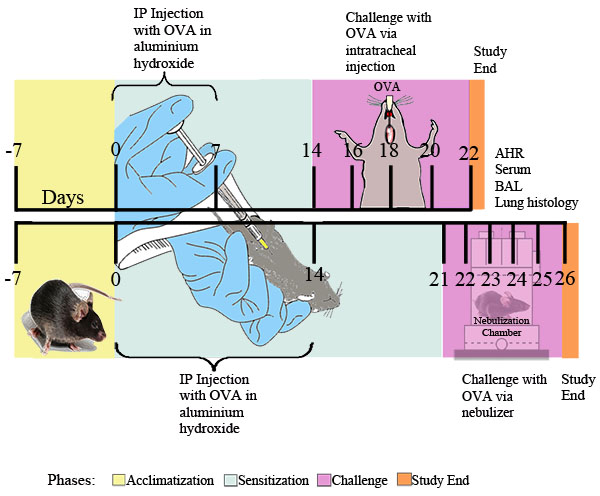
Figura 1. Esquema experimentales para OVA inducida por el asma alérgica. Ratones se sensibilizaron dos veces ip con 20 mg de OVA emulsionado en 2 mg de hidróxido de aluminio en 0,2 ml de PBS estéril, o 2 mg de hidróxido de aluminio en 0,2 ml de estéril solo PBS, seguido en el los puntos indicados por el tiempo que desafían con un 0,1% OVA o solución estéril de PBS o por el ex diario POSICION durante 30 minutos a la OVA nebulizado 1% en PBS o PBS solo entrega a través de un nebulizador ultrasónico (Buxco). Veinticuatro horas después de la exposición OVA final, se determinó la capacidad de respuesta las vías respiratorias. Posteriormente, el líquido de BAL, muestras de sangre, células de pulmón, y los tejidos se recogieron para su posterior análisis.
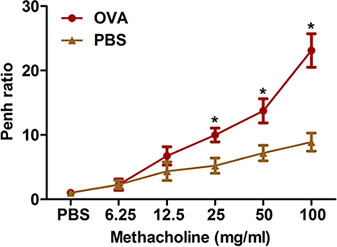
Figura 2. Los ratones de evaluación de la inducida por alergenos hiperreactividad bronquial por un método no invasivo. (N = 4/group) fueron sensibilizados y desafiados con OVA. Veinticuatro horas después del último desafío, la hiperreactividad bronquial a la metacolina inhalada se determinó a través de todo el cuerpo pletismografía como se describe en el protocolo. Penh se determinó y expresó como Penh relación (promedio Penh durante el intervalo de tiempo 8-min con metacolina dividido por el promedio Penh durante el intervalo de 8-min con PBS). *, P <0,05 vs PBS.
iles/ftp_upload/3771/3771fig3.jpg "/>
Figura 3. Los ratones de evaluación de la inducida por alergenos hiperreactividad bronquial por un método no invasivo (oscilación forzada). (N = 4/group) fueron sensibilizados y desafiados con OVA. Veinticuatro horas después del desafío último, hiperreactividad bronquial a concentraciones crecientes de metacolina inhalada se determinó por la oscilación forzada (flexiVent) método descrito en el protocolo. A, B) la vía aérea de resistencia; C) elastancia del pulmón. *, P <0,05 vs PBS.
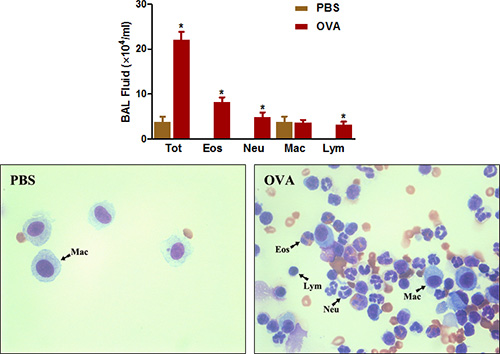
Figura 4. Recuento de células BAL fluido. Los ratones (n = 4/group) fueron sensibilizados y desafiados con OVA. Veinticuatro horas después del último reto, (Arriba) BAL células se recogieron y se contaron las células totales, como se describe en el protocolo. (Abajo) Cytospin diapositivas fueron pREPARADO y se tiñeron con Diff-Quick. Total = total de células; Eos = eosinófilos; Neu = neutrófilos, macrófagos, Mac = LYM = linfocitos. *, P <0,05 vs PBS.
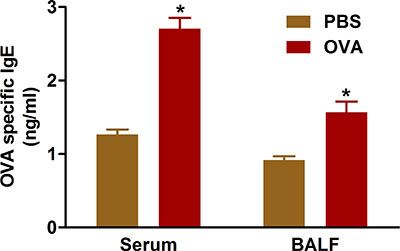
Figura 5. OVA-IgE específica. Los ratones (n = 4/group) fueron sensibilizados y desafiados con OVA. Veinticuatro horas después del desafío último, la IgE se midió en el líquido de BAL y en el suero de la sangre recogida por punción cardiaca como se describe en el protocolo. *, P <0,05 vs PBS.
Discusión
Los modelos animales de enfermedad de las vías respiratorias alérgicas constituyen instrumentos importantes para los estudios pertinentes para el asma clínica. Una serie de modelos diferentes, que emplean diferentes especies y antígenos, se han desarrollado. El ratón, una especie de laboratorio atractivas y de uso frecuente, también ofrece una serie de ventajas para los modelos de la enfermedad de las vías respiratorias alérgicas. 9,10 Aunque estos modelos no asemejar al asma en todos los aspectos,
Divulgaciones
Los experimentos en animales se realizaron de conformidad con las directrices y regulaciones establecidas por el Comité Atlanta VAMC IACUC bajo el protocolo # V010-10.
Agradecimientos
Este trabajo fue apoyado por el NIH Grant HL093196 (RCR) y el Centro de Atlanta y la Fundación de Educación (AREF).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del Material | Empresa | Número de catálogo | Comentarios |
| Ovoalbúmina | Sigma-Aldrich St. Louis, MO | A5503 | |
| Hidróxido de aluminio | Sigma-Aldrich | 239186 | |
| Acetil-β-methylcholine cloruro de | Sigma-Aldrich | A2251 | |
| Sal de sodio pentobarbital | Sigma-Aldrich | P3761 | |
| Pletismografía de cuerpo entero (WBP) del sistema | Buxco de Investigación de Sistemas Wilmington, Carolina del Norte | http://www.buxco.com | |
| FlexiVent | SCIREQ, Inc. Montreal, Canadá | http://www.scireq.com | |
| Microscopio de luz | Leica Microsystems, Inc. Buffalo Grove, IL | ||
| Cytospin 4 | Thermo Scientific Asheville, Carolina del Norte | ||
| Diff-Quick mancha | Siemens Newark, DE | B4132-1A | |
| Pipeta repetitiva | Tridak Torrington, CT | STP4001-0025 |
Referencias
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados