A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דגם Murine של אסטמה אלרגן מושרה
In This Article
Summary
מודלים העכבר ניסיוני של אסטמה אלרגית להציע אפשרויות חדשות ללימוד בהיווצרות המחלה ופיתוח ותרופות חדשות. דגמים אלה מתאימים גם לגורמים השולטים מדידה תגובה חיסונית אלרגית, דלקת בדרכי הנשימה, ו פתופיזיולוגיה ריאתי.
Abstract
אסטמה היא הגורם העיקרי לתחלואה ותמותה, המשפיעים על כ -300 מיליון בני אדם ברחבי העולם. 1 יותר מ 8% מאוכלוסיית ארה"ב יש אסטמה, עם שכיחות הולכת וגוברת. 2 כמו עם מחלות אחרות, מודלים בבעלי חיים למחלות דרכי הנשימה אלרגית מאוד להקל ההבנה של הפתופיזיולוגיה הבסיסית, לסייע בזיהוי מטרות טיפוליות אפשריות, ולאפשר בדיקה קליני של טיפולים חדשים אפשריים. מודלים של מחלות דרכי הנשימה אלרגית פותחו זנים של בעלי חיים שונים, אבל הם מודלים Murine אטרקטיבי במיוחד בשל עלות נמוכה, זמינות מוכן, מערכת חיסונית היטב מאופיין של חיות אלה. 3 זמינות של מגוון רחב של זנים מהונדס עוד יותר מגביר את האטרקטיביות של מודלים אלה. 4 כאן אנו מתארים שני מודלים של מחלות דרכי הנשימה Murine אלרגית, הן ovalbumin העסקת כמו אנטיגן. בעקבות רגישות ראשוני בזריקה intraperitoneal, מודל אחד delivERS אתגר אנטיגן על ידי ערפול, זאת על ידי משלוח intratracheal. אלו שני מודלים להציע יתרונות משלימים, עם כל מחקה את התכונות העיקריות של אסטמה האדם. 5
המאפיינים העיקריים של אסתמה חריפה כוללים תגובה מוגזמת לגירוי דרכי הנשימה כגון methacholine (hyperresponsiveness דרכי הנשימה; AHR) ו eosinophil עשיר דלקת דרכי הנשימה. אלה גם תופעות בולטות של אתגר האלרגן במודלים Murine שלנו 5,6, ואנחנו מתארים טכניקות למדידת אותם ובכך להעריך את ההשפעות של מניפולציה ניסויית. באופן ספציפי, אנו מתארים את שני 7 פולשניים ולא פולשניים 8 טכניקות למדידת hyperresponsiveness דרכי הנשימה, כמו גם שיטות להערכת חדירת תאים דלקתיים לתוך דרכי הנשימה ואת הריאות. תאים דלקתיים בדרכי האוויר נאספים על ידי שטיפה ברונכואלוואולרית תוך הריאות אנליזה פתולוגית בכליה שנועדה לבחון סמנים של דלקת לאורך האיבר. אלהטכניקות לספק כלים רבי עוצמה ללימוד אסטמה בדרכים שלא יהיה אפשרי בבני אדם.
Protocol
י רגישות אלרגן אתגר (ראה איור 1)
א לאתגר Intratracheal
- על רגישות הראשוני, להזריק C57BL זכר או נקבה / 6 או BALB / C עכברים (6-8 שבועות) intraperitoneally ביום 0 ושוב ביום 7 עם 20 מיקרוגרם של ovalbumin (OVA: Sigma-Aldrich, סנט לואיס, מיזורי) לתחליב ב 0.2 מ"ל של פוספט סטרילית בופר סליין (PBS) המכיל 2 מ"ג של הידרוקסיד אלומיניום (Sigma-Aldrich) או הידרוקסיד 2 מ"ג אלומיניום של 0.2 מ"ל סטרילי PBS כמו שליטה.
- האתגר עם אנטיגן על פי הצורך (למשל, על 14 ימים, 16, 18, 20). הליך האתגר הבא.
- להרדים העכבר עם זריקה (IP) intraperitoneal מתערובת של קטמין (90 מ"ג / ק"ג) ו xylazine (10 מ"ג / ק"ג). ודא העכבר הוא מורדם לחלוטין דקות לפחות 10.
- המבצע פני זווית של 45 מעלות או יותר. במקום העכבר על פני השטח זה לצד שמירה על הגחון כלפי מעלה וראש בראש.
- הוק לאלחם תחת החותכות הקדמיות כדי להחזיק את הראש בחזרה. רמה את הכפות אחד עם השני על מנת להבטיח קנה הנשימה ישר ולהשתמש הקלטת התווית כדי להחזיק את הרגליים. משרים באתר כירורגית עם 70% ו EtOH ספוגית.
- החל bupivicaine (0.1-0.2 מ"ל של תמיסת 0.25%) מקומי במקום החתך.
- ניפ העור על הצוואר עם מלקחיים ומושכים החוצה בעדינות. לעשות חתך אנכי קטן עם מספריים כירורגיות. מזעור גודל החתך.
- להכין מזרק 1 מ"ל עם 50 μl של PBS או OVA 0.1% ב PBS ו להכניס אותו לתוך טפטפת חוזרות (Tridak צעד, Torrington, CT). קח פיפטה ביד אחת ולהשתמש השני להחזיק את הרקמה חזרה עם פינצטה את ולחשוף את קנה הנשימה.
- מחזיק את המזרק כמו קנה הנשימה מקביל ככל האפשר, הכנס המחט דרך קנה הנשימה קיר להזריק את הפתרון.
- לשמור על העכבר הזרקת אוריינטציה אנכית הבאה כדי לאפשר זמן לפתרון להתיישב הריאות.
- אזור הפצע בעדינות קרוב sterilely עםפינצטה וחותמת עם תפר.
- העכבר במקום עצם החזה כלפי מטה על משטח חימום ולאפשר לו להתאושש עד אמבולטורי באופן מלא. לאחר ההחלמה, להחזיר את העכבר למתקן טיפול בבעלי חיים לפקח בו מדי יום בחיפוש אחר סימנים seroma, דלקת או זיהום, וכן פצע בקיעה עד הפצע נרפא לגמרי.
ב לאתגר על ידי ערפול
- רגישות עכברים ביום 0 בזריקה intraperitoneal של 20 מיקרוגרם של OVA (Sigma-Aldrich) לתחליב ב 0.2 מ"ל של PBS סטרילי המכיל 2 מ"ג של הידרוקסיד אלומיניום (Sigma-Aldrich) או הידרוקסיד אלומיניום 2 מ"ג 0.2 מ"ל של PBS סטרילית כמו שליטה .
- ביום 14, להגביר את רגישות בהזרקה ה-IP כפי שתואר לעיל.
- ביום ה -21, -22, ה -23, 24 וה 25 אחרי ה רגישות הראשוני, עכברים אתגר ידי חשיפה למשך 30 דקות כדי OVA 1% nebulized או PBS לבד מועברת באמצעות nebulizer קולי (Buxco מחקר מערכות, Wilmington, צפון קרוליינה).
- מקום עכברים בתא המרכזי של WBP; להתאקלם אותם בתוך החדר plethysmography דקות לפחות 10.
- מקום 1 מ"ל של 0.1% ב OVA סטרילית PBS או סטרילית PBS בלבד, כמתואר בצעדים 4-6 להלן, באמצעות כוס nebulizer. Nebulize למשך 30 דקות.
- הסר כוס nebulizer וזורקים כל פתרון הנותרים.
- ערפול יכול להתבצע על כל העכברים בו זמנית באמצעות חדר ערפול.
השנייה. קביעת Hyperresponsiveness Airway כדי Methacholine
א מדידה לא פולשנית של Hyperresponsiveness Airway ידי Plethysmography-Whole הגוף (WBP; Buxco מחקר מערכות, Wilmington, צפון קרוליינה)
- אפשר בקבוק methacholine אבקת לחמם לטמפרטורת החדר לפני הפתיחה (methacholine הוא hygroscopic מאוד יהוו גושים חסר תועלת אם מותר לספוג מים). להכין 200 מ"ג / מ"ל המניות פתרון ב PBS סטרילית, ואז לעשות סדרתיים 2-לקפל דילולים (למשל, 100, 50, 25, 12.5 ו - 60.25 מ"ג / מ"ל). שמור על פתרונות קר.
- הגדרת ציוד כדלקמן: להתחבר כניסת העיקרי של WBP כדי nebulizer, משוא פנים זרימת כניסת משאבת אוויר, שקע WBP למלכודת הגז באמצעות צמודה צינור גומי. צרף מתמר לחץ לגשר על חנויות של חדרי העיקריים והפניה של WBP. חבר מתמר לחץ עם מגבר קדם את הכבלים המסופקים, ולחבר מגבר קדם למחשב באמצעות כרטיס ספציפי נתונים הרכישה.
- כיול מגבר קדם באמצעות התוכנה על פי המלצות היצרן.
- מקום עכברים בתא המרכזי של WBP; להתאקלם אותם בתוך החדר plethysmography לפחות 10 דקות, ולאחר מכן קריאות הבסיס שיא (Penhbase) 3 דקות.
- מקום 1 מ"ל של PBS סטרילית בכוס nebulizer. Nebulize 2 דקות ולאחר מכן לעקוב אחר משתנים הנשימה דקות 6 נוספת בשלב הייבוש. הסר כוס nebulizer וזורקים כל PBS הנותרים.
- מקום 1 מ"ל של methacholine מ"ג / מ"ל 6.25 בגביע nebulizer ו-REPEAT ערפול 2 דקות בתוספת מחזור של 6 דקות ניטור.
- חזור על המדידה עם 12.5, 25, 50 ו 100 מ"ג / מ"ל methacholine, תוך שימוש באותה תקופה של 2 דק 'ערפול ו 6 דקות מחזור ניטור.
- הסר את העכברים מן החדרים ולהחזיר אותם בכלובים.
- מילוי nebulizer כוס עם 1 מ"ל סטרילי PBS ולרוץ אחר רצף לשטוף בצינור.
- כבה את זרימת האוויר, לפרק, לנקות ולנגב את כל החדרים לפני הפעלת סט שני של בעלי חיים.
ב מדידה פולשנית של היענות Airway ידי מאוורר מבוקרת מחשב (flexiVent; SCIREQ בע"מ, מונטריאול, קנדה)
- לשקול את העכבר להרדים בזריקה (IP) intraperitoneal של 60 מ"ג לכל ק"ג משקל גוף נתרן pentobarbital.
- בעקבות עמדת נאותה הרדמה, עכברים ventro-dorsally עבור ההנשמה.
- לחטא את העור בצוואר עם אתנול 70%. החל bupivicaine (0.1-0.2 מ"ל של תמיסת 0.25%) מקומי ב incision באתר. לחתוך ולפתוח את העור בצוואר. הפרד את שרירי הצוואר ולחשוף את קנה הנשימה.
- לעשות 1 - כדי חתך 2-מ"מ קנה הנשימה עם מספריים עדינים (להיות בטוח שלא לנתק את קנה הנשימה) והכנס צינור קנה הנשימה בזהירות. לקשור תפר סביב קנה הנשימה כדי למנוע דליפת אוויר.
- הנח את העכבר בתא plethysmograph הגוף וחבר את צינור קנה הנשימה מוכנס למכונת הנשמה.
- התחל להנשמה מלאכותית. הגדר קצב הנשימה המתאימים נפח גאות / שבץ מוחי (שבץ 150 / ד 'ו 200 μl, בהתאמה לעכבר 20-G). ודא החזה נע בתיאום עם מכונת ההנשמה. אם העכבר הוא "נלחם" עם מכונת ההנשמה (עצמי הנשימה), מזריקים חומר הרדמה יותר ולחכות הסנכרון.
- בעקבות מדידות בנקודת ההתחלה, לשמור על עכברים תחת אוורור בסיסית עבור 3 דקות אחר ולאחר מכן לקחת כמה -2 קבוצה של מדידות עכבה. 2 nd זה קבוצה של מדידות הבסיס משמש Calculate את ערכי הבסיס ממוצע.
- לספק PBS או methacholine (MCH) אתגרים (6.25, 12.5, 25, 50 ו 100 מ"ג / מ"ל) של זרימת תקשור inspiratory ממכונת ההנשמה דרך nebulizer קולי.
- בעקבות אתגר זה עם MCH (6.25, 12.5, 25, 50 ו 100 מ"ג / מ"ל), להחזיר את הבוכנה לספק Vt של 10 מ"ל / ק"ג על 120 נשימות / דקה ולקחת מדידות עכבה.
ג. מדידה של הסתננות נייד למרחב האווירי
א Perform ברונכואלוואולרית שטיפה (BAL)
- לאחר מדידת AHR, להרדים עכברים עם CO 2, למקם את כל העכבר על גבו על כרית כירורגית.
- משרים את האזור עם EtOH 70%.
- החל ב הבטן התחתונה, חתך לפתוח את חלל הבטן ולהסיר עור / שריר העליון, נע כלפי מעלה לכיוון הצלעות.
- פעם אחת הצלעות גלויים, השתמש במספריים לנקב בזהירות הסרעפת. הריאות צריכות להתמוטט מן הסרעפת. להיות CA במיוחדreful לא ניק הריאות או הלב.
- חתך את בית החזה כדי לחשוף באופן מלא את הריאות / לב (לא לחתוך את כל כלי הדם הגדולים כדי לשמור על הדם ממלא את האתר).
- באמצעות מזרק 1 מ"ל עם מחט 27 מד (BD מזרקים, פרנקלין לייקס, ניו ג'רזי), לנקב את החדרים לב לאט ובזהירות למשוך בחזרה את המזרק על מנת לאסוף את הדם. תשמרי על עצמך, כדי למנוע התמוטטות לב.
- איסוף סרום מהדם הזה באמצעות הפרוטוקול הסטנדרטי. חנות ב -70 ° C עד השימוש.
- חתך את העור ורקמות מגרונו עד קנה הנשימה מתגלה. לסלק רקמות מספיק כדי לעבוד בקלות בתחום (שוב, לא לחתוך את כל כלי הדם הגדולים).
- באמצעות מספריים מעוגלות, חתוכים תחת קנה הנשימה כדי לפנות דרך.
- להעביר את נקודת מלקחיים מעוגלים תחת קנה הנשימה ולהבין סוף פיסת תפר. צייר את החוט תפר מתחת קנה הנשימה.
- לקשור קשר רופף למחצה על קנה הנשימה, נמוך בגרון.
- Carefully לחתוך חריץ, מספיק גודל הצינורית, מעל חוט תפר.
- בזהירות להכניס צינורית לתוך החור ומטה קנה הנשימה מעבר לנקודה של חוט תפירה. לחץ בעדינות קדימה עד צינורית עולה רק בכניסה אל הריאות (יותר מדי: ריאות לנקב, קצרים מדי: קריסת קנה הנשימה כאשר מנסים לשחזר BAL).
- החוט הדק תפר ואת הקשר המלא לאטום סביב צינורית לקנה הנשימה.
- מזרק Lock (המכילה 1 מ"ל PBS) על צינורית ולחץ בעדינות את הנוזל לתוך הריאות. אונות ריאה צריך לנפח בנפרד לאט. אל על מילוי. עבור מ"ל העכבר מלא גדל הוא 0.9-1.0 לכל היותר. 0.8 מ"ל עשוי להיות בטוח יותר. נעל מזרק באופן רופף צינורית, אחרת זה עלול לגרום לנזק כאשר מנסים להתנתק.
- משיכה נוזלים מהריאות. אם הוא נתקל בהתנגדות (רקמת נשאב לתוך צינורית), לחץ על צינורית יותר לאט לתוך הריאות ולחדש את הסרת. כמו כן נסה לסובב את צינורית במקום. אם כל אלסדואר נכשל, לסגת באופן חלק צינורית, קנה הנשימה הרבה יותר סביר לקרוס במקרה זה.
- ניתוק המזרק מן הצינורית, נוזל ההפקדה BAL במיכל, ולחזור על פי 2 עם פתרון PBS טרי.
- שמור את הפתרון BAL על הקרח עד הסתובב מטה.
- שימוש בנוזל BAL ו בסרום למדוד IgE ספציפי OVA שימוש זמינה באופן מסחרי העכבר IgE ערכות ELISA (Bioproducts MD, סנט פול, MN).
ב 'ספירת תאים ו קביעת הפרשי
- בצנטריפוגה נוזל BAL 5 דק 'ב ~ × 600 גרם, 4 ° C.
- Resuspend תא גלולה בעדינות PBS ולשמור על הקרח.
- טען hemacytometer תקן Neubauer עם ההשעיה התא בדילול מלא ולספור את התאים.
- הסר aliquots של 2 × 10 4 תאים בנפח 10-40 μl על cytospins. לדלל תאים במקרה הצורך.
- עבור cytospins, לערבב 2 × 10 4 תאים, 130 ו PBS μl 10 FBS μl. להוסיף תערובת התא כולו התכשירLe cytospin משפך ו סרכזת 10 דק 'ב 700 סל"ד, באמצעות cytoslides כפולים עבור דגימות כפולות.
- אפשר השקופיות לייבוש בטמפרטורת החדר למשך שעה 1 לפני צביעה.
- כתם על השקופיות באמצעות גרסאות, מהירה כתם (סימנס, ניוארק, DE).
IV. נציג תוצאות
היצרות דרכי האוויר יתר בעקבות גירויים פרובוקטיביים הוא מאפיין בולט של אסתמה קלינית. נתאר שתי שיטות למדידת hyperresponsiveness דרכי הנשימה כזה methacholine בעכברים OVA רגיש וקרא תיגר על כל הגוף: plethysmography (איור 2), נאלץ תנודה באמצעות מערכת flexiVent (איור 3). שתי השיטות להראות סנסיטיזציה אתגר OVA ומייצרת hyperresponsiveness דרכי הנשימה אצל עכברים.
Eosinophil עשיר דלקת דרכי הנשימה היא עוד מאפיין בולט של אסטמה הן קלינית ומחלות דרכי הנשימה אלרגיות אצל עכברים. כפי שניתן לראות בתרשים 4 , רגישות אתגר OVA ומגבירה באופן משמעותי את מספרם הכולל של תאים שניתן שהתגלו דרכי הנשימה על ידי BAL. המספרים של אאוזינופילים, ובמידה פחותה יותר, נויטרופילים מוגדלים במיוחד.
הראיות מצביע על מחלה אלרגית דרכי הנשימה תוצאות מ ייצור יתר של נוגדני IgE על אנטיגנים רגישות. רגישות ואתגר עם OVA באמצעות פרוטוקולים אנו מתארים מעלה את רמות ה-IgE בסרום הן נוזל BAL של עכברים שטופלו (איור 5).
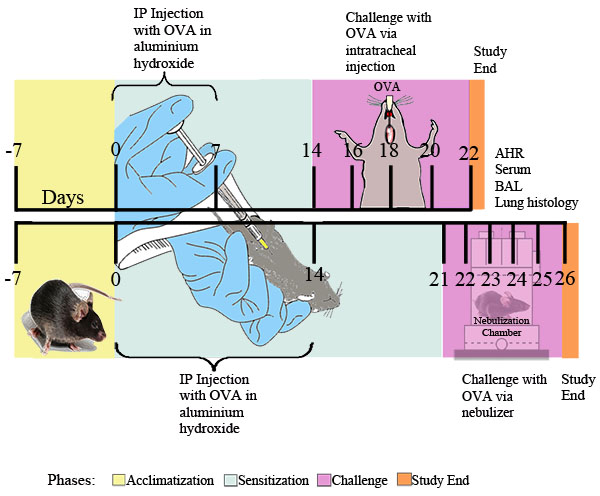
באיור 1. סכימה ניסיונית עבור אסטמה אלרגית הנגרמת OVA. העכברים היו רגישים IP פעמיים עם 20 מיקרוגרם של OVA לתחליב של 2 מ"ג של אלומיניום הידרוקסיד 0.2 מ"ל של סטרילית PBS, או 2 מ"ג של אלומיניום הידרוקסיד 0.2 מ"ל של סטרילית PBS לבד, לאחר מכן ב נקודות הזמן המצוין על ידי זה האתגר עם 0.1% OVA או סטרילית פתרון PBS או לשעבר יומי posure במשך 30 דקות עד OVA 1% nebulized ב PBS או PBS לבד מועברת באמצעות nebulizer קולי (Buxco). עשרים וארבע שעות לאחר החשיפה OVA הסופי, היענות דרכי הנשימה נקבע. כתוצאה מכך, נוזל BAL, דגימות דם, לתאי ריאה, ורקמות נאספו לניתוח נוסף.
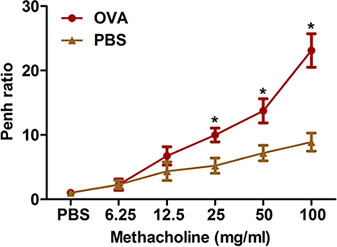
איור 2. עכברים הערכה של hyperresponsiveness-האלרגן דרכי הנשימה הנגרמת על ידי שיטה לא פולשנית. (N = 4/group) היו רגישים ו תיגר עם OVA. עשרים וארבע שעות לאחר האתגר האחרון, hyperresponsiveness דרכי הנשימה כדי methacholine בשאיפה נקבע באמצעות הגוף כולו plethysmography כמפורט בפרוטוקול. פן היה נחוש כפי שבאה לידי ביטוי פן יחס (ממוצע פן על מרווח של 8 דקות זמן עם methacholine חלקי פן בממוצע על רווח של 8 דקות עם PBS). * P <0.05 לעומת PBS.
iles/ftp_upload/3771/3771fig3.jpg "/>
איור 3. עכברים הערכה של hyperresponsiveness-האלרגן דרכי הנשימה הנגרמת על ידי שיטה פולשנית (תנודה נאלץ). (N = 4/group) היו רגישים ו תיגר עם OVA. עשרים וארבע שעות לאחר האתגר האחרון, hyperresponsiveness דרכי הנשימה כדי להגדיל ריכוזים של methacholine בשאיפה נקבע על ידי תנודה נאלץ (flexiVent) שיטה כמתואר בפרוטוקול. א, ב) התנגדות Airway: C) elastance ריאות. * P <0.05 לעומת PBS.
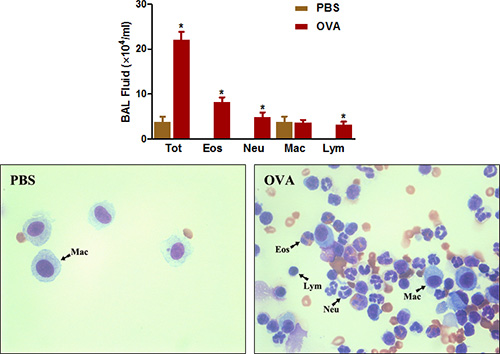
באיור 4. נוזל BAL ספירת כדוריות. עכברים (n = 4/group) היו רגישים ו תיגר עם OVA. עשרים וארבע שעות לאחר האתגר האחרון (למעלה) תאים של באל נאספו תאים בסך הכל נספרו כמפורט בפרוטוקול. (למטה) שקופיות Cytospin היו עמ 'repared ומוכתמת עם גרסאות, מהירה. טוט = תאים בסך הכל, Eos = אאוזינופילים, Neu = נויטרופילים, מקרופאגים, מק = Lym = לימפוציטים. * P <0.05 לעומת PBS.
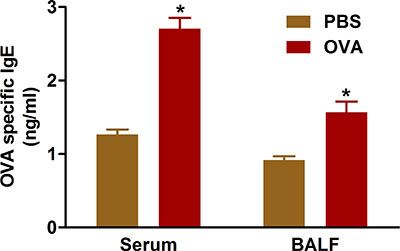
איור 5. OVA-IgE ספציפי. עכברים (n = 4/group) היו רגישים ו תיגר עם OVA. עשרים וארבע שעות לאחר האתגר האחרון, IgE נמדדה בנוזל BAL ו ב סרום מהדם שנאסף על ידי לנקב לב כמתואר בפרוטוקול. * P <0.05 לעומת PBS.
Discussion
במודלים של בעלי חיים של מחלות דרכי הנשימה אלרגית לספק כלים חשובים מחקרים רלוונטיים אסטמה קליני. מספר דגמים שונים, המעסיקים מינים שונים ו אנטיגנים, פותחו. העכבר, זן מעבדה אטרקטיביים ומשמש לעתים קרובות, גם מציע מספר יתרונות על מודלים של מחלות דרכי הנשימה אלרגית. 9,10
Disclosures
ניסויים בבעלי חיים בוצעו בהתאם להנחיות והתקנות שנקבעו על ידי VAMC אטלנטה IACUC לפי פרוטוקול ועדת # V010-10.
Acknowledgements
עבודה זו נתמכה על ידי NIH גרנט HL093196 (RCR) לבין מחקר אטלנטה קרן החינוך (עארף).
Materials
| Name | Company | Catalog Number | Comments |
| שם החומר | חברה | מספר קטלוגי | תגובות |
| Ovalbumin | Sigma-Aldrich סנט לואיס, מיזורי | A5503 | |
| אלומיניום הידרוקסיד | Sigma-Aldrich | 239186 | |
| Acetyl-β-methylcholine כלוריד | Sigma-Aldrich | A2251 | |
| נתרן Pentobarbital מלח | Sigma-Aldrich | P3761 | |
| כל הגוף plethysmography (WBP) מערכת | Buxco לחקר מערכות בווילמינגטון, צפון קרוליינה | http://www.buxco.com | |
| FlexiVent | SCIREQ, Inc מונטריאול, קנדה | http://www.scireq.com | |
| מיקרוסקופ אור | Leica Microsystems, Inc באפלו גרוב, אילינוי | ||
| Cytospin 4 | Thermo Scientific אשוויל, צפון קרוליינה | ||
| הבדל מהירה כתם | סימנס ניוארק, DE | B4132-1A | |
| חוזר פיפטה | Tridak Torrington, CT | STP4001-0025 |
References
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved