É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo murino de asma induzida alergénio
Neste Artigo
Resumo
Modelos de ratos experimentais de asma alérgica oferecer novas possibilidades para o estudo da patogênese da doença eo desenvolvimento de novas terapêuticas. Estes modelos são bem adequados para factores de medição que regulam a resposta imune alérgica, inflamação das vias aéreas, e fisiopatologia pulmonar.
Resumo
A asma é uma das principais causas de morbidade e mortalidade, afetando cerca de 300 milhões de pessoas em todo o mundo. 1 Mais de 8% da população dos EUA tem asma, com o aumento da prevalência. 2 Tal como acontece com outras doenças, modelos animais da doença alérgica das vias aéreas facilitar grandemente compreensão da fisiopatologia subjacente, ajudar a identificar potenciais alvos terapêuticos, permitindo testes pré-clínicos de possíveis novas terapias. Modelos de doença alérgica das vias respiratórias foram desenvolvidos em várias espécies animais, mas modelos murinos são particularmente atraentes devido ao baixo custo, disponibilidade, e bem caracterizadas sistemas imunitários desses animais. 3 disponibilidade de uma variedade de estirpes de transgénicos aumenta ainda mais a capacidade de atracção destes modelos. 4 Descrevemos aqui dois modelos murinos de doença alérgica das vias aéreas, tanto a ovalbumina empregando como o antigénio. Após a sensibilização inicial, por injecção intraperitoneal, um modelo emitiu qualquerers o desafio antigénio por nebulização, a outra por entrega por via intratraqueal. Estes dois modelos oferecem vantagens complementares, com cada imitando as principais características da asma humana. 5
As principais características da asma aguda incluem uma resposta das vias aéreas exagerada a estímulos, como metacolina (vias aéreas hiper-responsividade; AHR) e eosinófilos rico inflamação das vias aéreas. Estes são também efeitos proeminentes de desafio alérgeno nos nossos modelos murinos, 5,6 e nós descrevemos técnicas para a sua medição e, assim, avaliar os efeitos da manipulação experimental. Especificamente, descrevem ambas as invasivos 7 e não-invasivo 8 técnicas de medição de hiper-responsividade das vias aéreas, bem como métodos para avaliar a infiltração de células inflamatórias para as vias aéreas e do pulmão. Células das vias respiratórias inflamatórias são recolhidos por lavagem broncoalveolar enquanto pulmão histopatologia é utilizado para avaliar os marcadores de inflamação por todo o órgão. Estestécnicas fornecem ferramentas poderosas para o estudo de asma de maneira que não seria possível em seres humanos.
Protocolo
I. sensibilização a alérgenos e Challenge (ver Figura 1)
A. Para o desafio intratraqueal
- Para a sensibilização inicial, injectar macho ou fêmea C57BL / 6 ou ratinhos BALB / c (6-8 semanas de idade) por via intraperitoneal no dia 0 e novamente no dia 7, com 20 ug de ovalbumina (OVA; Sigma-Aldrich, St. Louis, MO) emulsionado em 0,2 ml de fosfato estéril tamponada salina (PBS) contendo 2 mg de hidróxido de alumínio (Sigma-Aldrich) ou com 2 mg de hidróxido de alumínio em 0,2 ml de PBS estéril como controle.
- Desafio com o antigénio, conforme apropriado (por exemplo, nos dias 14, 16, 18, e 20). Procedimento desafio seguinte.
- Anestesiar rato com uma injecção intraperitoneal (ip) de uma mistura de cetamina (90 mg / kg) e xilazina (10 mg / kg). Garantir o rato é completamente anestesiados durante pelo menos 10 min.
- Superfície operação ângulo de 45 graus ou mais. Coloque o rato sobre esta superfície mantendo lado ventral para cima e cabeça para cima.
- Gancho thread sob incisivos da frente para segurar a cabeça para trás. Nível das patas com um outro para garantir a traquéia é reta e usar a fita etiqueta para segurar as pernas. Mergulhe sítio cirúrgico com 70% EtOH e cotonete.
- Aplicar bupivicaine (0,1 a 0,2 ml de solução a 0,25%) topicamente no local da incisão.
- Nip pele na garganta com uma pinça e puxe-o delicadamente para fora. Faça uma pequena incisão vertical com uma tesoura cirúrgica. Minimize o tamanho da incisão.
- Prepara-se uma seringa de 1 ml com 50 ul de PBS ou OVA 0,1% em PBS e inseri-lo de uma pipeta de repetitivo (Tridak Stepper, Torrington, CT). Tomar a pipeta numa mão e usar o outro para segurar o tecido para trás com as pinças e expor a traqueia.
- Segure a seringa como paralela à traquéia possível, inserir a agulha através da parede da traquéia e injetar a solução.
- Manter mouse em uma injeção vertical orientação a seguir para permitir tempo para solução para resolver nos pulmões.
- Área da ferida levemente e esterilizada estreita compinças e selo com sutura.
- Coloque o rato esterno para baixo sobre uma almofada de aquecimento e permitir-lhe recuperar até que esteja totalmente ambulatorial. Após a recuperação, retornar o mouse para a instalação de cuidados com animais e monitorá-lo diariamente para detectar sinais de seroma, inflamação ou infecção, deiscência da ferida e até que a ferida estiver totalmente curado.
B. Por Desafio por nebulização
- Sensibilizar ratinhos no dia 0 por injecção intraperitoneal de 20 mg de OVA (Sigma-Aldrich) emulsionada em 0,2 ml de PBS estéril contendo 2 mg de hidróxido de alumínio (Sigma-Aldrich) ou com 2 mg de hidróxido de alumínio em 0,2 ml de PBS estéril como controle .
- No dia 14, aumentar a sensibilização por injecção ip como descrito acima.
- No dia 21 r, 22, 23, 24 e 25 após a sensibilização inicial th, os ratinhos de desafio por exposição durante 30 min a OVA nebulizada 1% ou PBS sozinho entregue através de um nebulizador ultra-sons (Buxco Research Systems, Wilmington, NC).
- Colocar os ratinhos câmara principal de WBP; aclimatar-los dentro da câmara de pletismografia durante pelo menos 10 min.
- O local de 1 ml de OVA 0,1% em PBS estéril ou PBS estéril sozinho, como descrito nos passos 4-6 abaixo, através de uma ampola. Nebulização durante 30 min.
- Remova o copo de nebulizador e descartar a solução restante.
- A nebulização pode ser realizada em todos os ratinhos simultaneamente usando uma câmara de nebulização.
II. Determinação da hiperresponsividade brônquica à metacolina
A. Medição não-invasiva de hiperresponsividade das vias aéreas por pletismografia de corpo inteiro (WBP; Buxco Research Systems, Wilmington, NC)
- Permitir que a garrafa de metacolina em pó a aquecer até à temperatura ambiente antes da abertura (metacolina é muito higroscópico e irá formar grumos inúteis se permitido para absorver água). Prepara-se uma de 200 mg / ml de solução concentrada em PBS estéril, em seguida, fazer de série 2-diluições (por exemplo, 100, 50, 25, 12,5 e 60,25 mg / ml). Mantenha soluções frio.
- Configure o equipamento como se segue: ligue entrada principal do WBP para nebulizador, o viés de fluxo de entrada de ar da bomba, e saída WBP a armadilha de gás usando apertadas tubos de borracha. Anexar transdutor de pressão para colmatar as saídas das câmaras principais e referência do WBP. Ligue transdutor de pressão de pré-amplificador com os cabos fornecidos, e se conectar pré-amplificador para PC utilizando o cartão de aquisição de dados específico.
- Calibrar o pré-amplificador utilizando o software de acordo com as recomendações do fabricante.
- Colocar os ratinhos câmara principal de WBP; aclimatar-los dentro da câmara de pletismografia durante pelo menos 10 min, em seguida, as leituras da linha de base de registo (Penhbase) durante 3 min.
- O local de 1 ml de PBS estéril no copo do nebulizador. Nebulização durante 2 min e, em seguida, monitorar as variáveis respiratórias para um min 6 adicional durante a fase de secagem. Remova o copo de nebulizador e descartar qualquer PBS restante.
- O local de 1 ml de 6,25 metacolina mg / ml no copo do nebulizador e REPEAT nebulização durante 2 min mais um ciclo de controlo 6-min.
- Repita medição com 12,5, 25, 50 e 100 mg / ml de metacolina, usando o mesmo período de nebulização 2-min e 6-min ciclo de controlo.
- Retire os camundongos das câmaras e devolvê-los às suas gaiolas.
- Refil nebulizador copo com 1 ml de PBS estéril e executar outra seqüência para lavar a tubulação.
- Desligue os fluxos de ar, desmontar, e limpe todas as câmaras antes de executar um segundo conjunto de animais.
B. medida invasiva da responsividade das vias aéreas pelo computador controlado ventilador (flexiVent; SCIREQ Inc., Montreal, Canadá)
- Pesar o rato e anestesiar por injecção intraperitoneal (ip) de 60 mg por kg de peso corporal de sódio pentobarbital.
- Após anestesia adequada posição, os ratos ventro-dorsal para traqueostomia.
- Desinfectar a pele do pescoço com etanol 70%. Aplicar bupivicaine (0,1 a 0,2 ml de solução a 0,25%) por via tópica no incision local. Incisão e abrir a pele do pescoço. Separar os músculos do pescoço e expor a traquéia.
- Faça uma 1 - a 2 mm incisão na traquéia com uma tesoura fina (ter a certeza de não cortar a traquéia) e inserir o tubo traqueal com cautela. Amarre uma sutura ao redor da traquéia para evitar uma fuga de ar.
- Coloque o mouse na câmara pletismógrafo de corpo e conectar o tubo inserido traqueal ao ventilador.
- Iniciar ventilação mecânica. Ajuste a taxa respiratória apropriada e volume corrente / acidente vascular cerebral (AVC 150 / min e 200 ul, respectivamente, para um rato 20-g). Certifique-se que o tórax está se movendo em sincronia com o ventilador. Se o mouse está "lutando" com o ventilador (respiração auto-), injetar mais anestésico e esperar a sincronização.
- Após medidas de base, manter os ratos sob ventilação linha de base para outro 3 min, e então tomar a 2 ª série de medições de impedância. Este 2 º conjunto de medidas de base é usada para calcular os valores basais.
- Entregar PBS ou metacolina (MCH) desafios (6,25, 12,5, 25, 50 e 100 mg / ml) pela canalização de fluxo inspiratório do ventilador através de um nebulizador ultra-sónico.
- Após cada desafio com MCH (6,25, 12,5, 25, 50 e 100 mg / ml), retornar o pistão para entregar uma Vt de 10 ml / kg a 120 ciclos / min e tomar medidas de impedância.
III. Medição da infiltração celular no espaço aéreo
A. Perform lavado broncoalveolar (LBA)
- Após a medição da AHR, eutanásia camundongos com CO 2, e posicione cada rato em sua parte traseira no bloco cirúrgico.
- Mergulhar a área com EtOH a 70%.
- Começando na parte inferior do abdome, corte abrir a cavidade abdominal e remover a pele / músculo superior, subindo em direção às costelas.
- Uma vez que as costelas são visíveis, use uma tesoura para cuidadosamente punção do diafragma. Os pulmões devem entrar em colapso para longe do diafragma. Tenha especial careful não nick dos pulmões ou coração.
- Cortar a caixa torácica para expor totalmente os pulmões / coração (evitar o corte de todas as grandes vasos sanguíneos para manter o sangue de encher o site).
- Utilizando uma seringa de 1 ml com uma agulha de calibre 27 (BD seringas, Franklin Lakes, NJ), a punção dos ventrículos cardíacos e lentamente e cuidadosamente puxar para trás da seringa para recolher o sangue. Tome cuidado para evitar o colapso do coração.
- Recolher o soro de sangue utilizando este protocolo padrão. Armazenar a -70 ° C até à utilização.
- Cortar pele e do tecido a partir da garganta até a traqueia é revelada. Limpar o tecido suficiente para trabalhar facilmente dentro do campo (mais uma vez, evitar o corte de todas as grandes vasos sanguíneos).
- Com uma tesoura curva, corte sob a traquéia para limpar o caminho.
- Passar o ponto de uma pinça curvos sob a traqueia e agarrar a extremidade de um pedaço de sutura. Desenhe o fio de sutura sob a traquéia.
- Amarre um meio nó frouxo-sobre a traquéia, baixa na garganta.
- Carefully corte de um entalhe, suficiente em tamanho para a cânula, acima do fio de sutura.
- Cuidadosamente inserir a cânula no orifício e para baixo da traqueia para além do ponto do fio de sutura. Pressione suavemente para frente até que a cânula surge apenas na entrada para os pulmões (muito longe: pulmões punção; muito curtos: traquéia colapso ao tentar recuperar BAL).
- Apertar fio de sutura e nó completa para selar traqueia em torno da cânula.
- Bloqueio da seringa (contendo 1 ml de PBS) sobre a cânula, e pressionar suavemente o fluido para o pulmão. Lobos pulmonares devem individualmente inflar lentamente. Não excesso de preenchimento. Para um crescimento total de mouse 0,9-1,0 ml é o máximo absoluto. 0,8 ml pode ser mais seguro. Bloquear seringa vagamente a cânula, caso contrário, é susceptível de causar danos ao tentar desengatar.
- Retirar fluido a partir de pulmões. Se a resistência for encontrado (tecido sugado para dentro da cânula), prima cânula lentamente mais para dentro do pulmão e retomar a remoção. Tente também girar a cânula no lugar. Se todos os else não, retirar do caminho parte cânula, a traquéia é muito mais provável a entrar em colapso neste caso.
- Retire uma seringa de cânula, depósito LBA no recipiente, e repetir 2 vezes com solução PBS fresco.
- Manter a solução BAL em gelo até centrifugadas.
- Use o LBA e soro para medir a IgE OVA específica utilizando comercialmente disponível do mouse IgE ELISA kits (Bioproducts MD, St. Paul, MN).
B. contagem de células e determinar os diferenciais de
- Centrifugar a BAL fluido 5 min a ~ 600 × g, 4 ° C.
- Ressuspender o sedimento de células suavemente em PBS e manter em gelo.
- Coloque um hemocitômetro de Neubauer padrão com a suspensão diluída de células e contagem das células.
- Remover alíquotas de 2 × 10 4 células em 10 a 40 volumes ul para cytospins. Diluir as células, se necessário.
- Para cytospins, misture 2 × 10 4 células, 130 PBS ul e 10 ul FBS. Adicione a mistura de célula inteira para DOUBle cytospin funil e centrifugar 10 min a 700 rpm, utilizando cytoslides duplas para amostras em duplicado.
- Permitir que as lâminas para secar à temperatura ambiente durante 1 h antes da coloração.
- Coloração das lâminas usando Diff-Quick mancha (Siemens, Newark, DE).
IV. Os resultados representativos
Constrição das vias aéreas excessiva após estímulos provocativos é uma característica proeminente do clínico da asma. Descrevemos dois métodos para medir a hiper-responsividade das vias aéreas, tais à metacolina em ratinhos OVA-sensibilizadas e desafiados: corpo inteiro pletismografia (Figura 2) e oscilações forçadas utilizando o sistema de flexiVent (Figura 3). Ambos os métodos demonstram que a sensibilização OVA e desafio produz hiper-responsividade das vias aéreas em ratinhos.
Eosinófilos rico inflamação das vias aéreas é outra característica marcante de ambos clínico da asma e doença alérgica das vias aéreas em ratos. Como mostrado na Figura 4 , a sensibilização OVA e desafio aumenta grandemente o número total de células que podem ser recuperados a partir da vias respiratórias por BAL. Os números de eosinófilos e, em menor extensão, os neutrófilos são especialmente aumentada.
Evidências indicam que os resultados das vias respiratórias alérgicas doença de excesso de anticorpos IgE a antígenos sensibilizantes. Sensibilização e desafio com OVA, utilizando os protocolos aqui descritos aumenta os níveis de IgE em ambos soro e fluido BAL de ratinhos tratados (Figura 5).
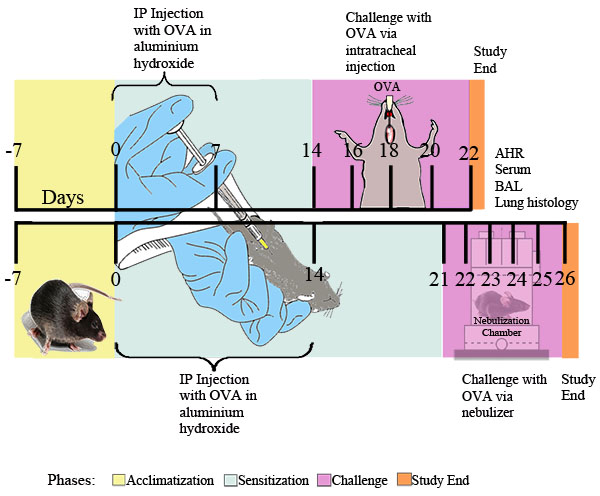
Figura 1. Esquema experimental para OVA induzida asma alérgica. Ratos foram sensibilizados por duas vezes ip com 20 mg de OVA emulsionado em 2 mg de hidróxido de alumínio em 0,2 ml de PBS estéril, ou 2 mg de hidróxido de alumínio em 0,2 ml de PBS estéril sozinho, seguido no pontos de tempo indicados por isso o desafio com 0,1% de OVA ou solução de PBS estéril ou por ex diária posure durante 30 minutos a nebulizada OVA a 1% em PBS ou PBS sozinho entregue através de um nebulizador ultra-sons (Buxco). Vinte e quatro horas após a exposição OVA final, responsividade das vias aéreas foi determinado. Subsequentemente, o fluido BAL, amostras de sangue, as células do pulmão, e os tecidos foram recolhidos para análise posterior.
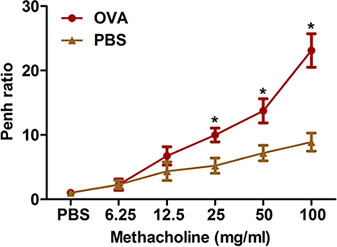
Figura 2. Ratos de avaliação de alérgeno-induzida hiperresponsividade das vias aéreas por método não invasivo. (N = 4/group) foram sensibilizados e desafiados com OVA. Vinte e quatro horas após o último desafio, hiper-responsividade das vias aéreas à metacolina inalado foi determinada utilizando todo o corpo pletismografia como descrito no protocolo. Penh foi determinada e expressa como Penh ratio (média Penh durante o intervalo de tempo de 8 min com metacolina, dividido pelo Penh média, durante o intervalo de 8-min com PBS). *, P <0,05 vs PBS.
iles/ftp_upload/3771/3771fig3.jpg "/>
Figura 3. Ratos de avaliação de alérgeno-induzida hiperresponsividade das vias aéreas através de um método invasivo (oscilação forçada). (N = 4/group) foram sensibilizados e desafiados com OVA. Vinte e quatro horas após o último desafio, hiper-responsividade das vias aéreas a concentrações crescentes de metacolina inalado foi determinada pelo oscilações forçadas (flexiVent) Método como descrito no protocolo. A, B) a resistência das vias aéreas; C) elastância pulmonar. *, P <0,05 vs PBS.
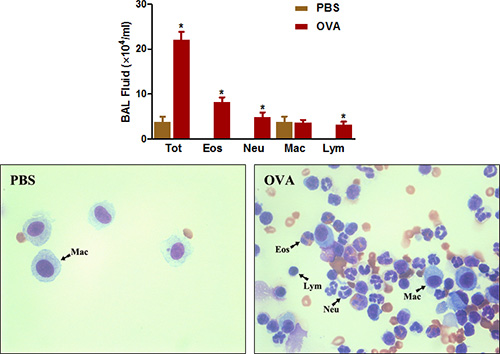
Figura 4. Contagem de células BAL fluido. Ratinhos (n = 4/group) foram sensibilizados e desafiados com OVA. Vinte e quatro horas após o último desafio, (Top) As células foram recolhidas e BAL células totais foram contadas como descrito no protocolo. (Bottom) slides citospina foram preparado e corados com Diff-Quick. Tot = total de células; Eos = eosinófilos; Neu = neutrófilos, macrófagos MAC =; LYM = linfócitos. *, P <0,05 vs PBS.
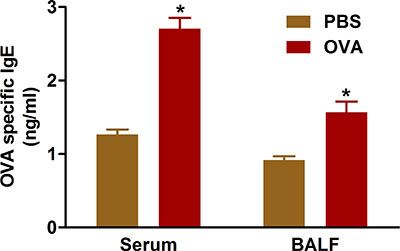
Figura 5. OVA-IgE específica. Os ratinhos (n = 4/group) foram sensibilizados e desafiados com OVA. Vinte e quatro horas após o último desafio, IgE foi medido no fluido BAL e no soro do sangue recolhido por punção cardíaca, tal como descrito no protocolo. *, P <0,05 vs PBS.
Discussão
Os modelos animais de doença alérgica das vias aéreas proporcionar ferramentas importantes para estudos relevantes para a asma clínica. Um certo número de modelos diferentes, empregando espécies variando e antigénios, têm sido desenvolvidos. O mouse, uma espécie de laboratório atraentes e freqüentemente usado, também oferece uma série de vantagens para os modelos de doença alérgica das vias aéreas. 9,10 Embora tais modelos não simulam asma em todos os aspectos, 11, com aspectos da ...
Divulgações
Experimentos em animais foram realizados de acordo com as diretrizes e regulamentos estabelecidos pelo VAMC Atlanta IACUC Comissão sob o protocolo n V010-10.
Agradecimentos
Este trabalho foi financiado pelo NIH Grant HL093196 (RCR) e da Pesquisa Atlanta e Education Foundation (AREF).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do material | Companhia | Número de Catálogo | Comentários |
| Ovalbumina | Sigma-Aldrich St. Louis, MO | A5503 | |
| Hidróxido de alumínio | Sigma-Aldrich | 239186 | |
| Acetil-β methylcholine-cloreto | Sigma-Aldrich | A2251 | |
| Sal de sódio pentobarbital | Sigma-Aldrich | P3761 | |
| Pletismografia de corpo inteiro (WBP) sistema | Buxco Systems Research Wilmington, North Carolina | http://www.buxco.com | |
| FlexiVent | SCIREQ, Inc. Montreal, Canadá | http://www.scireq.com | |
| Microscópio de luz | Leica Microsystems, Inc. Buffalo Grove, IL | ||
| Cytospin 4 | Thermo Scientific Asheville, NC | ||
| Diff-Quick mancha | Siemens Newark, DE | B4132-1A | |
| Pipeta repetitivo | Tridak Torrington, CT | STP4001-0025 |
Referências
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados