JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
알레르기 항원 유도 천식의 Murine 모델
요약
알레르기 천식의 실험 마우스 모델은 질병 pathogenesis를 공부하고 새로운 치료제 개발에 새로운 가능성을 제공합니다. 이러한 모델은 잘 알레르기 면역 반응,기도 염증과 폐의 pathophysiology을 규제하는 측정 요소에 적합합니다.
초록
천식은 전세계에 걸쳐 300 만명에 영향을 미치는, 병적 상태와 사망률의 주요 원인입니다. 미국 인구의 1 이상 8%는 그런 상황을 증가와 함께, 천식이 있습니다. 2 크게 촉진 다른 질병, 알레르기기도 질환의 동물 모델과 마찬가지로 기본 pathophysiology의 이해는 잠재적인 치료 표적을 식별하는 데 도움이, 그리고 가능한 새로운 치료법의 잠복기 테스트를 허용합니다. 알레르기기도 질환의 모델은 여러 동물의 종류로 개발하지만, murine 모델은 저렴한 비용, 준비 가용성 및 이들 동물의 잘 특성화 면역 체계로 인해 특히 매력적입니다되었습니다. 유전자 변형 종자 다양한 3 가용성이 더욱 매력을 증가 이러한 모델. 우리가 알레르기기도 질환의 두 murine 모델을 설명하는 다음 4 항원과 같은 고용 ovalbumin 둘. intraperitoneal 주사에 의한 초기 sensitization 한 모델 deliv 따라nebulization, intratracheal 전달하여 다른 의한 항원 도전 ERS. 이 두 모델은 각각 인간의 천식의 주요 기능을 흉내낸과 함께 상호 보완적인 장점을 제공합니다. 5
와 eosinophil 풍부한기도 염증, 급성 천식의 주요 기능은 methacholine (AHR기도 hyperresponsiveness)와 같은 자극에 과장기도 응답을 포함합니다. 이들은 또한 murine 모델, 5,6의 알레르기 항원의 도전 저명한 효과이며 우리는 그들을 측정하는 기술을 설명하기 때문에 실험 조작의 효과를 평가. 특히, 우리는기도 hyperresponsiveness을 측정뿐만 아니라기도와 폐에 염증 세포의 침투를 평가하기위한 방법에 대해 모두 7 침습과 비침습 8 기법을 설명합니다. 폐 조직 병리학은 장기에 걸쳐 염증의 마커를 평가하는 데 사용되는 동안기도 염증 세포 bronchoalveolar 세척에 의해 저장됩니다. 이들기술은 인간 불가능했을 방법으로 천식을 공부위한 강력한 도구를 제공합니다.
프로토콜
I.의 알레르기 항원의 Sensitization 및 챌린지 (그림 1 참조)
Intratracheal 도전에 대한 대답
- 초기 sensitization 들어, ovalbumin 20 μg (; 시그마 - 올드 리치, 세인트 루이스, 미주리 OVA)과 함께 일 0에 다시 일 7 수컷이나 암컷 C57BL / 6 또는 BALB / C 생쥐 (6-8주 이전) intraperitoneally 투입 멸균 인산의 0.2 ML에 유화 알루미늄 수산화 2 MG (시그마 - 올드 리치)를 포함하는 식염수 (PBS)는 버퍼 또는 제어 등의 멸균 PBS의 0.2 ML 2 MG 알루미늄 수산화 함께.
- 적절한 항원과 도전 (예, 일 14, 16, 18, 및 20). 도전 과정은 다음과 같습니다.
- intraperitoneal 300ml의 혼합물 (IP) 주입 (90 밀리그램 / kg)과 xylazine (10 밀리그램 / ㎏)와 마우스를 마취. 마우스가 적어도 10 분 완전 anesthetized한지 확인하십시오.
- 45도 이상의 각도 작업 표면. 이 위쪽으로 복부 측면을 유지하는 표면과 상단 머리에 장소 마우스.
- 후크 t다시 머리를 잡고 앞 incisors 아래 hread. 레벨 호흡 관이 바로 사용할 수 있도록 다리를 잡고 라벨 테이프를 사용하는 서로 싶단다. 70% EtOH와 면봉으로 외과 사이트를 만끽해보세요.
- 절개 사이트에서 몸에 붙이기 bupivicaine을 (0.25 % 솔루션의 0.1-0.2 ML) 적용합니다.
- 적군 포셉과 목에 피부와 부드럽게 바깥쪽으로 당기십시오. 수술용 가위로 작은 수직 절개를합니다. 절개의 크기를 최소화합니다.
- 50 PBS의 μl 또는 PBS에 0.1 %의 OVA로 1 ML의 주사기를 준비하고 반복적인 피펫 (Tridak 스테퍼, Torrington, CT)에 삽입합니다. 한손에 피펫을 가지고 핀셋으로 다시 조직을 보유하는 기타를 사용하고 호흡 관을 폭로.
- 가능한 한 호흡 관에 평행으로 주사기를 개최하는 것은기도 벽을 통해 바늘을 삽입하고 솔루션을 주입.
- 허파에 정착하기 위해 솔루션을위한 시간을 허용하도록 수직 방향의 다음 주입에 마우스를 유지합니다.
- 부드럽게하고 sterilely 가까이 부상 면적봉합사와 핀셋 및 인감.
- 장소 마우스는 가열 패드에서 흉골 다운하고 완벽하게 진료까지 복구할 수 있습니다. 상처가 완전히 나았 때까지 회복에 따라 동물 보호 시설에 마우스를 반환하고 seroma, 염증이나 감염과 상처 dehiscence의 흔적을 매일 그것을 모니터합니다.
Nebulization에 의한 과제의 경우 B.
- 제어로 멸균 PBS의 0.2 ML에 알루미늄 수산화 2 MG (시그마 - 올드 리치)를 포함하는 무균 PBS의 0.2 ML에서 또는 2 MG 알루미늄 수산화와 유화 OVA 20 μg의 intraperitoneal 주사 (시그마 - 올드 리치)에 의해 일 0에서 쥐를 감광성 .
- 위에서 설명한대로 일 14 일, IP 주사로 sensitization를 높이세요.
- 21, 22, 23 회, 24 일 그리고 25 일 당일 이후 초음파 천식 환자용 호흡 보조기를 두시 라고요 (Buxco 연구 시스템, Wilmi 통해 전달 혼자 nebulized 1 %의 OVA 또는 PBS ~ 30 분 노출에 의한 초기 sensitization, 도전 마우스ngton 노스캐롤라이나).
- WBP 메인 챔버의 장소 마우스, 적어도 10 분 동안 plethysmography 챔버 내에서 그들을 익히다.
- 천식 환자용 호흡 보조기를 두시 라고요 컵을 통해 멸균 PBS 또는 아래와 같이 4-6에 설명된 멸균 PBS 혼자에서 0.1 %의 OVA의 장소 1 ML. 30 분 동안 약액을 뿜다.
- 천식 환자용 호흡 보조기를 두시 라고요 컵을 제거하고 남은 용액을 버리고.
- Nebulization 동시에 nebulization 챔버를 사용하여 모든 마우스에서 수행할 수 있습니다.
II. Methacholine으로기도 Hyperresponsiveness의 결정
전체 - 바디 Plethysmography에 의한기도 Hyperresponsiveness의 A. 비침 투 측정 (WBP; Buxco 연구 시스템, 윌밍턴, 노스캐롤라이나)
- 가루 methacholine 병이 개막하기 전에 실내 온도로 따뜻하게하도록 허용 (methacholine는 매우 흡습이며 물을 흡수하도록 허용한다면 쓸모없는 대단히 짧은 시간을 형성합니다.) 멸균 PBS에서 200 MG / ML 주식 솔루션을 준비 다음, 직렬 2 배 dilutions (예, 100, 50, 25, 12.5, 6 확인0.25 밀리그램 / ML). 솔루션은 차가운 유지.
- 다음과 같이 장비를 설정 : 천식 환자용 호흡 보조기를 두시 라고요, 공기 펌프로 바이어스 흐름 입구와 꽉 끼는 고무 튜브를 사용하여 가스 트랩에 WBP 콘센트에 WBP의 메인 입구를 연결합니다. WBP의 기본과 참조 챔버의 출구에 다리를 놓으려고 압력 변환기를 연결합니다. 제공되는 케이블과 preamplifier에 압력 변환기를 연결하고, 구체적인 데이터 수집 카드를 사용하여 PC에 preamplifier를 연결합니다.
- 제조 업체의 권장 사항에 따라 소프트웨어를 사용 preamplifier를 보정.
- WBP 메인 챔버의 장소 마우스, 3 분 후 적어도 10 분, 녹음 기준 수치 (Penhbase)에 plethysmography 챔버 내에서 그들을 익히다.
- 천식 환자용 호흡 보조기를 두시 라고요 컵에 멸균 PBS의 장소 1 ML. 2 분 동안 약액을 뿜다 후 건조 단계에서 추가로 6 분 대한 호흡 변수를 모니터링합니다. 천식 환자용 호흡 보조기를 두시 라고요 컵을 제거하고 남아있는 PBS를 버리고.
- 천식 환자용 호흡 보조기를 두시 라고요 컵 및 R의 6.25 밀리그램 / ML methacholine 장소 1 ML2 분 더하기 6 분 모니터링주기위한 epeat의 nebulization.
- 같은 2 분 nebulization 기간 6 분 모니터링주기를 사용하여, 12.5, 25, 50 및 100 MG / ML의 methacholine과 측정을 반복합니다.
- 챔버에서 생쥐를 제거하고 그들의 연습장을 반환합니다.
- 리필 천식 환자용 호흡 보조기를 두시 라고요 한 ML 멸균 PBS로 한잔하고 튜빙을 내리려고 다른 시퀀스를 실행합니다.
- , 공기 흐름을 종료 해체, 그리고 동물의 두 번째 세트를 실행하기 전에 모든 챔버를 청소 닦으십시오.
컴퓨터 제어 환풍기에 의한기도 응답의 B. 침윤성 측정 (flexiVent; SCIREQ 주식, 몬트리올, 캐나다)
- 마우스를 저울질하고 kg의 체중 pentobarbital 나트륨 60 밀리그램의 intraperitoneal (IP) 주입에 의한 마취.
- 적절한 마취, 위치 ventro-dorsally tracheostomy 대한 생쥐 따라.
- 70 % 에탄올과 목 피부를 소독. I에 몸에 붙이기 bupivicaine을 (0.25 % 솔루션의 0.1-0.2 ML) 적용ncision 사이트. 목 피부를 절개하고 엽니다. 목 근육을 분리하고 호흡 관을 폭로.
- 미세 가위로기도에서도 2-mm 절개 (기관을 도려 내야하지 확신할)로하고 조심스럽게 tracheal 튜브를 삽입 - 1 확인하십시오. 공기 누출을 방지하기 위해 기관 주위 봉합을 묶어.
- 신체 plethysmograph 챔버에 마우스를 배치하고 환풍기에 삽입된 tracheal 튜브를 연결합니다.
- 기계 환기를 시작합니다. 적절한 호흡 속도와 조수 / 뇌졸중 볼륨 (150 스트로크 / 분 200 μl 각각 20 g의 마우스)를 설정합니다. 흉부는 환풍기와 synchrony 이사되어 있는지 확인하십시오. 마우스 환풍기 (자동 호흡)로 "싸우는"경우 더 많은 마취제를 주입하고 동기화를 기다립니다.
- 베이스 라인 측정에 이어, 또 다른 3 분 동안 기본적인 환기 하에서 마우스를 유지하고 임피던스 측정의 설정 제 2 가져가라. 기준 측정 집합이 2 기는 calc로 사용됩니다평균 기준 값을 ulate.
- 초음파 천식 환자용 호흡 보조기를 두시 라고요 통해 환풍기에서 쏟아야 inspiratory 흐름에 의해 PBS 또는 methacholine (MCh) 도전 (6.25, 12.5, 25, 50 및 100 밀리그램 / ML)를 제공합니다.
- MCh 각 과제 (6.25, 12.5, 25, 50 및 100 밀리그램 / ML)에 이어, 120 심호흡 / 분 10 ML / kg의 VT를 전달로 피스톤을 반환하고 임피던스 측정.
III. 영공으로 세포 침투 측정
A. 수행 Bronchoalveolar 세척 (BAL)
- AHR을 측정 후, CO 2와 쥐를 안락사시켜야하고, 수술 패드에 미치는 뒷면에 각각 마우스를 위치.
- 70 % EtOH로 영역을 만끽해보세요.
- 낮은 복부에서 시작하여 복강을 열고 잘라 갈비 향해 위쪽으로 이동, 피부 / 근육 상부를 제거합니다.
- 갈비뼈가 표시되면주의 깊게 찔린 다이어프램을에 가위를 사용합니다. 폐가 다이어프램에서 떨어져 축소해야합니다. 특히 CA한다reful하지 대화명 폐 또는 심장으로.
- 완전 폐 / 심장 (사이트를 작성에서 혈액을 유지하는 주요 혈관을 절단하지 않도록) 노출 ribcage 버려야.
- 27 게이지 바늘 (BD 주사기, 프랭클린 호수, 뉴저지), 찔린 심장 심실이 천천히 그리고 신중하게 혈액을 수집하기 위해 주사기를 다시 끌어와 한 ML의 주사기를 사용하여. 마음을 붕괴하지 않도록주의를 기울입니다.
- 표준 프로토콜을 사용하여이 혈액에서 혈청을 수집합니다. -70시 매장 ° C에서 사용까지.
- 호흡 관이 드러났습 때까지 피부와 인후의 조직을 버려야. 필드 내에서 쉽게 작업할 수있는 충분한 조직을 치워 (다시 모든 주요 혈관을 절단하지 않도록해야합니다.)
- 경로 선택을 취소한 기관 밑에 절단 곡선 가위를 사용합니다.
- 호흡 관 밑에 곡선 포셉의 지점을 통과하고 봉합 한 조각의 끝을 파악. 호흡 관 아래에 봉합 나사를 그리십시오.
- 목에 낮은 기관에 대한 반 매듭이 느슨하게 묶으 시요.
- Carefully 봉합 스레드 위에 정맥에 대한 크기의 충분한 수준을 했네요.
- 조심스럽게 봉합 스레드의 핵심이지나 구멍에와 호흡 관 아래로 정맥을 삽입합니다. 정맥 단지 (:; : BAL 복구하려고 시도 축소기도 너무 짧은 바늘 폐 너무 멀리) 폐로가는 입구에 나온다 때까지 부드럽게 앞으로 누르십시오.
- 정맥 주위 기관을 봉쇄하라는 봉합 나사와 완벽한 매듭을 조여.
- 정맥에 대한 잠금 주사기 (1 ML PBS를 포함), 그리고 부드럽게 폐로 액체를 누르십시오. 폐 엽 (叶)은 개별적으로 서서히 부풀게한다. 오버 채우기하지 마십시오. 전체 재배 마우스 0.9-1.0 ML 내용은 절대 최대입니다. 0.8 ML은 안전할 수 있습니다. 정맥에 느슨하게 주사기를 잠그고, 그렇지 않으면 그것은 해체하려 할 때 손상을 줄 가능성이 높습니다.
- 폐가에서 유체를 철회. 저항이 발생하는 경우 (정맥 빨려 조직), 기자 정맥 천천히 폐에 추가하고 제거하는 것은 이력서. 또한 장소에 정맥 돌려보십시오. 만약 모든 ELS전자가 실패, 정맥 부품 방식을 철회하고, 호흡 관이 훨씬이 경우에는 축소 가능성이 높습니다.
- 정맥, 컨테이너의 보증금 BAL 액에서 주사기를 분리하고 신선한 PBS 용액으로 2 번 반복합니다.
- 아래로 마구 휘저어 때까지 얼음 BAL 솔루션을 유지.
- BAL 유체 및 상용 마우스 IGE 엘리사 키트 (멀티 디스크 Bioproducts, 세인트 폴, MN)를 사용하여 OVA 특정 IGE을 측정하는 혈청을 사용합니다.
B.이 셀 백작과 차이를 결정
- ~ 600 × g에서 BAL 액 5 분, 4 ° C를 원심 분리기
- PBS에 부드럽게 세포 펠렛을 Resuspend 얼음 계속.
- 희석 세포 현탁액으로 표준 Neubauer의 hemacytometer을로드하고 세포를 계산합니다.
- cytospins위한 10-40 μl 볼륨에서 2 aliquots × 10 4 세포를 제거합니다. 필요하면 세포를 희석.
- cytospins 들어, 2를 섞어 × 10 4 세포를 130 μl PBS와 10 μl FBS합니다. doub하는 전체 세포 혼합물을 추가하십시오르 cytospin 중복 시료에 대해 두 cytoslides를 사용하여, 700 rpm으로 10 분 유입 경로와 원심 분리기.
- 슬라이드 염색법 이전 1 H 동안 실온에서 건조하도록 허용합니다.
- (지멘스, 뉴어크, DE) 비교 - 빠른 얼룩을 사용하여 슬라이드를 청바지.
IV. 대표 결과
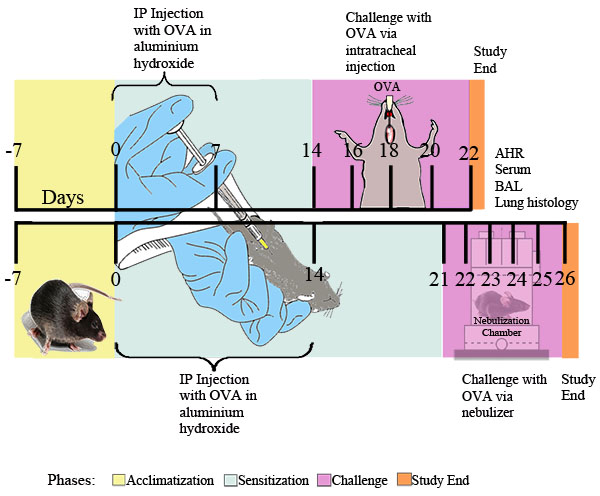
도발적인 자극에 따라 과도한기도 수축은 임상 천식의 눈에 띄는 기능입니다. flexiVent 시스템 (그림 3)을 사용하여 전체 - 신체 plethysmography (그림 2)과 강제 진동 : 우리는 OVA-sensitized과 도전 생쥐에서 methacholine에 그러한기도 hyperresponsiveness을 측정하는 두 가지 방법을 설명합니다. 두 가지 방법 OVA sensitization 도전은 생쥐의기도 hyperresponsiveness을 생산 것을 보여줍니다.
Eosinophil 풍부한기도 염증은 마우스의 임상 천식과 알레르기기도 질환 모두의 또 다른 두드러진 특징입니다. 그림 4에 나타난 바와 같이 , OVA sensitization과 과제는 크게 BAL하여기도에서 복구할 수있는 세포의 총 수를 증가시킵니다. 낮은 정도 호산구와의 번호는, neutrophils, 특히 증가하고 있습니다.
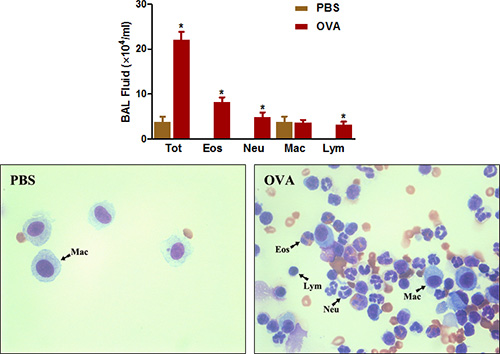
증거가 IGE에 항체의 생산 과잉에서 sensitizing 항원에 해당 알레르기기도 질환 결과를 나타냅니다. 우리가 설명하는 프로토콜을 사용 OVA와 Sensitization과 과제는 치료 생쥐의 혈청 및 BAL 두 유체 (그림 5)에 IGE 수준을 증가시킵니다.
1 그림. OVA 유도된 알레르 기성 천식에 대한 실험적 스키마. 맥주통에 따라, 멸균 PBS, 또는 멸균 PBS 혼자의 0.2 ML의 알루미늄 수산화 2 MG의 0.2 ML에서 알루미늄 수산화물의 2 MG에 유화 OVA 20 μg과 sensitized 두번 IP 있었다 그것에 의해 지정된 시간 지점은 0.1 OVA % 또는 멸균 PBS 용액이나 일상 전직에 의한 도전 PBS 또는 PBS의 nebulized 1 % OVA ~ 30 분 posure 혼자 초음파 천식 환자용 호흡 보조기를 두시 라고요 (Buxco)를 통해 전달. 스물 네 시간 최종 OVA 노출 후기도 응답이 결정되었다. 그 후, BAL 액, 혈액 샘플, 폐 세포와 조직은 추가 분석을 위해 수집되었다.
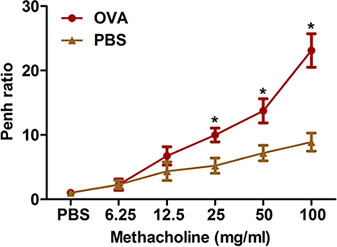
그림 2. 비침 투 방식에 의한 알레르기 항원 유발기도 hyperresponsiveness의 평가. 마우스 (N = 4/group)은 sensitized 있었고, OVA로 도전을했습니다. 마지막 도전에 따라 스물넷 시간을, 흡입된 methacholine에 대한기도 hyperresponsiveness는 같은 프로토콜에 설명된 전체 - 신체 plethysmography을 사용하여 결정되었다. Penh은 결정과 Penh 비율 (PBS로 8 분 간격 동안 평균 Penh으로 나눈 methacholine과 8 분 시간 간격 동안 평균 Penh)으로 표현되었다. *, P <0.05 대 PBS.
iles/ftp_upload/3771/3771fig3.jpg "/>
그림 3. 침입 방식에 의한 알레르기 항원 유발기도 hyperresponsiveness의 평가 (강제 진동). 마우스 (N = 4/group)은 sensitized 있었고, OVA로 도전을했습니다. 마지막 도전에 따라 스물넷 시간을, 흡입된 methacholine의 농도를 증가시키는기도 hyperresponsiveness는 같은 프로토콜에 설명된 강제 진동 (flexiVent) 메소드에 의해 결정되었다. A, B)기도 저항, C) 폐 elastance. *, P <0.05 대 PBS.
4 그림. BAL 유체 셀 개수. 마우스 (N = 4/group)은 sensitized 있었고, OVA로 도전을했습니다. 마지막 도전 (위)에 따라 스물 네 시간 BAL 세포가 수집되었고 프로토콜의 설명에 따라 총 세포 집계되었다. (아래) Cytospin 슬라이드는 P 있었다repared와 비교 - 퀵 물들일. 덧셈 = 총 세포; EOS = 호산구; NEU = neutrophils, macrophages 맥 =; Lym = lymphocytes. *, P <0.05 대 PBS.
그림 5. OVA 특정 IGE. 쥐 (N = 4/group)은 sensitized었고 OVA로 도전을했습니다. 마지막 도전에 따라 스물넷 시간을, IGE는 BAL 액과 프로토콜에 설명된대로 심장 주사에 의해 수집된 혈액의 혈청에서 측정되었다. *, P <0.05 대 PBS.
토론
알레르기기도 질환의 동물 모델은 임상 천식과 관련된 연구에 중요한 도구를 제공합니다. 다양한 수종과 항원을 고용하는 다른 모델의 번호가 개발되었습니다. 마우스, 매력적이고 자주 사용되는 실험 동물들은 또한 알레르기기도 질환의 모델에 대한 장점을 제공합니다. 9,10를 같은 모델을 재현해 특히 어렵게되는 만성 질병의 양상과 모든 점에서 천식, 11을 모방 있지 않지만,
공개
동물 실험 프로토콜 # V010-10 아래 애틀랜타 VAMC IACUC위원회가 정한 지침과 규정에 따라 수행되었다.
감사의 말
이 작품은 NIH 그랜트 HL093196 (RCR)와 애틀랜타 연구 및 교육 재단 (AREF)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 자재 명칭 | 회사 | 카탈로그 번호 | 댓글 |
| Ovalbumin | 시그마 - 올드 리치 세인트 루이스, 미주리 | A5503 | |
| 알루미늄 수산화물 | 시그마 - 올드 리치 | 239,186 | |
| 아세틸-β-methylcholine 염화 | 시그마 - 올드 리치 | A2251 | |
| Pentobarbital 나트륨 소금 | 시그마 - 올드 리치 | P3761 | |
| 온 몸이 plethysmography (WBP) 시스템 | Buxco 연구 시스템 윌밍턴, 노스캐롤라이나 | http://www.buxco.com | |
| FlexiVent | SCIREQ 주식 회사 몬트리올, 캐나다 | http://www.scireq.com | |
| 가벼운 현미경 | Leica 마이크로 시스템즈 주식 회사 버팔로 그로브, 일리노이 | ||
| Cytospin 4 | 써모 과학 애쉬빌, 노스캐롤라이나 | ||
| 비교 - 빠른 착색 | 지멘스 뉴어크, DE | B4132-1A | |
| 반복 피펫 | Tridak Torrington, CT | STP4001-0025 |
참고문헌
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유