Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensayo in vitro Liquidación mesoteliales que modela los pasos iniciales de la metástasis del cáncer ovárico
En este artículo
Resumen
El ensayo de depuración mesotelial se describe aquí se aprovecha de las células de la etiqueta fluorescente y time-lapse microscopía de vídeo para visualizar y medir cuantitativamente las interacciones de los esferoides multicelulares de cáncer de ovario y monocapas de células mesoteliales. Este ensayo permite simular las primeras etapas de la metástasis del cáncer de ovario.
Resumen
El cáncer de ovario es la quinta causa principal de muertes relacionadas con el cáncer en los Estados Unidos 1. A pesar de una respuesta inicial positiva a las terapias, del 70 al 90 por ciento de las mujeres con cáncer de ovario desarrollan metástasis a los nuevos, y la recurrencia es a menudo fatal 2. Es, por tanto, necesaria para entender cómo surgen metástasis secundarias con el fin de desarrollar mejores tratamientos para el cáncer de ovario en etapa intermedia y tardía. La metástasis del cáncer de ovario ocurre cuando las células malignas se desprenden de la localización del tumor primario y difundir toda la cavidad peritoneal. Las células diseminadas pueden formar grupos multicelulares, o esferoides, que o bien permanecerá sin conectar, o implantes en órganos dentro de la cavidad peritoneal 3 (Figura 1, la película 1).
Todos los órganos dentro de la cavidad peritoneal se revisten con una sola capa continua, de las células mesoteliales 4-6 (Figura 2). Sin embargo, las células mesoteliales están ausentes de debajolas masas tumorales peritoneales, como lo revelan los estudios de microscopio electrónico de secciones de tejidos humanos extirpados tumores 3,5-7 (Figura 2). Esto sugiere que las células mesoteliales se excluyen de debajo de la masa tumoral por un proceso desconocido.
Anterior en experimentos in vitro han demostrado que las células primarias de cáncer de ovario adjuntar más eficientemente a la matriz extracelular que a las células mesoteliales 8, y los estudios más recientes demostraron que las células primarias mesoteliales peritoneales realmente proporcionar una barrera para la adhesión celular de cáncer de ovario y la invasión (en comparación con la adhesión y la invasión sobre soportes que no fueron cubiertas con células mesoteliales) 9,10. Esto sugeriría que las células mesoteliales actuar como una barrera contra la metástasis de cáncer de ovario. Los mecanismos celulares y moleculares por los cuales las células de cáncer de ovario incumplan esta barrera, y no incluyen el mesotelio, hasta hace poco, sigue siendo desconocido.
A continuación se describe ºmetodología e para un ensayo in vitro que los modelos de la interacción entre los esferoides de ovario de células cancerosas y las células mesoteliales in vivo (Figura 3, la película 2). Nuestro protocolo es una adaptación de los métodos descritos anteriormente para el análisis de las interacciones de células de tumor de ovario con monocapas mesoteliales 8-16, y fue descrito por primera vez en un informe que muestra que las células tumorales de ovario utilizar una activación de la integrina-dependiente de la miosina y la fuerza de tracción para promover la exclusión de la las células mesoteliales de debajo de un esferoide del tumor 17. Este modelo toma ventaja de la microscopia de fluorescencia de lapso de tiempo para controlar las poblaciones de células de dos en tiempo real, proporcionando la información espacial y temporal de la interacción. Las células de cáncer de ovario expresan la proteína fluorescente roja (RFP), mientras que las células mesoteliales expresan la proteína verde fluorescente (GFP). RFP-expresando ovario esferoides celulares de cáncer de adjuntar a la monocapa mesotelial que expresan GFP. La difusión esferoides, invadir yforzar a las células mesoteliales lado creando un agujero en la monocapa. Este agujero se visualiza como el espacio negativo (negro) en la imagen de las buenas prácticas agrarias. El área del agujero se puede medir a analizar cuantitativamente diferencias en la actividad holgura entre el control y las poblaciones experimentales de cáncer de ovario y / o células mesoteliales. Este ensayo requiere sólo un pequeño número de células de cáncer de ovario (100 células por esferoides X 20-30 esferoides por condición), por lo que es factible realizar este ensayo utilizando preciosas muestras primarios de células tumorales. Además, este ensayo se puede adaptar fácilmente para el cribado de alto rendimiento.
Protocolo
1. Cáncer de ovario de la célula Esferoide Formación
- PP-expresando las células de cáncer de ovario se cultivan en medio de base 10% (un medio de cultivo celular personalizada que contiene una mezcla 50:50 de 199 y MCDB105, 10% suero bovino fetal inactivado y 1% de lápiz estreptococo). Para expresar RFP en las células de cáncer de ovario no etiquetados, transfectar las células con un plásmido que contiene solicitud de propuestas y seleccionar las células que expresan RFP. Alternativamente, los vectores virales pueden ser utilizados para expresar transitoriamente proteínas fluorescentes, o las células pueden ser pre-incuban con un color rojo fluorescente de células seguidor colorante (Invitrogen).
- Antes de formar esferoides de cáncer de ovario, es necesario preparar baja adherencia 96 platos de fondo redondo de cultivo así. Para producir las placas de cultivo de baja adherencia, 30μl poli-HEMA (6mg polihidroxietilmetacrilato en 1 ml de EtOH al 95%) solución se añade a cada pocillo de una placa de cultivo de 96 pocillos Corning celular. Las placas de 96 pocillos se incuban en un 37 ° C no incubador humidificado para evaporar el etanol, leaving una película de poli-HEMA en cada pocillo. Esta película de poli-HEMA evita que las células se adhieran a la parte inferior del pozo, forzando a las células para crecer en suspensión 18. [Alternativamente, ultra-bajo placas de cultivo de fijación (Corning) puede utilizarse en lugar de poli-HEMA platos recubiertos.]
- Después de las placas de baja adhesión de cultivo se preparan, trypsinize una placa de células de cáncer de ovario, pellet de las células en una centrífuga de mesa (Heraeus) a 900 RCF durante 3 minutos, Aspirar el sobrenadante y resuspender en medio de base 10%.
- Cuenta las células utilizando un hemocitómetro.
- Ajustar la concentración de tales células que hay 100 células por 50 l de medio de base 10%.
- Añadir 50 l de la suspensión de células uniformemente suspendido diluido a cada pocillo de la placa 96 así poli-HEMA cultura revestido.
- Se incuba la placa de 96 pocillos en un 37 ° C incubadora de cultivo celular durante 16 horas (esta cantidad de tiempo debe aumentarse o disminuirse dependiendo de la cantidad de tiempo que tardauna línea celular particular para formar esferoides multicelulares o deseadas condiciones experimentales) para permitir que las células de cáncer de ovario a agruparse entre sí, formando un esferoide sola multicelular en cada pocillo. Algunas células del tumor pueden someterse a la apoptosis durante este período, por lo que es importante elegir una hora antes de la inducción de la apoptosis.
2. Monocapa de células mesoteliales Formación
- En una campana de cultivo celular, pre-capa de los pocillos de un 6 bien de fondo de vidrio plato MatTek con fibronectina mediante la adición de 2 mL de una fibronectina 5μg / ml de solución de PBS a cada pocillo de la placa y la incubación a temperatura ambiente durante 30 minutos. La calidad óptica de los fondos de vidrio en los platos Mattek permiten imágenes de alta resolución microscópica.
- GFP-células que expresan mesoteliales se cultivan en medio de base 10%. Trypsinize una placa de células mesoteliales, la desaceleración en una centrífuga de mesa (Heraeus) a 900 rpm durante 3 minutos, aspirar el sobrenadante, y vuelva a suspender en el medio de base del 10%. Lacélulas mesoteliales utilizados aquí fueron ya expresando GFP cuando se obtuvieron, pero sin marcar las células mesoteliales pueden ser producidos por transfección con un plásmido GFP ADNc que contiene, o preincubating las células en un verde fluorescente de células seguidor colorante (Invitrogen).
- Después de la incubación de fibronectina de 30 minutos (en el paso 2.1), lavar los pocillos de la placa MatTek con 2 mL de PBS.
- Aspirar el PBS y placa de 6 x 10 5 células mesoteliales por pocillo en cada pocillo de la placa de 6 pocillos MatTek. Incubar el plato MatTek en un 37 ° C de cultivo celular durante la noche para permitir que las células mesoteliales para insertarse en el plato y forman una monocapa incubadora.
3. Ensayo de células mesoteliales Liquidación
- Utilizar una pipeta para recoger los esferoides de cáncer de ovario del 96 bien poli-HEMA placa revestida.
- Aspirar el medio de un pozo de la placa de MatTek 6 y que contiene una monocapa de células mesoteliales. Lavar una vez con 2 ml de PBS. Agregue todos los esferoides de la 96 y ptarde a un pocillo de la placa MatTek (~ 3 veces el número de esferoides que van a ser fotografiada para dar cuenta de aterrizaje esferoides en la parte del plato que no se pueden obtener imágenes).
- Coloque el plato MatTek en la etapa de un microscopio invertido campo amplio de fluorescencia capaz de realizar de lapso de tiempo de imágenes para la duración de al menos 8 horas. Utilice una platina motorizada de posiciones de la imagen múltiple en el plato, con múltiples eventos de intercalación esferoide, en un solo experimento. Usamos una cámara Nikon Ti-E invertido motorizado de fluorescencia de campo amplio lapso de tiempo microscopio con sistema integrado de enfoque perfecto y baja [20x-0.75 apertura numérica (NA)] Aumentos / NA de contraste de interferencia diferencial (DIC), la óptica, un transiluminador de halógeno Nikon con 0.52 NA de larga distancia de trabajo (LWD) condensador, Nikon rápida (<100 milisegundos de tiempo de conmutación) filtros de excitación y emisión de las buenas prácticas agrarias (ex 480/40, Em 525/50, PP-mCherry Ex 575/50 Em 640/50), Sutter rápida transmisión Apagar la luz y de epifluorescencia ruta inteligentetros, una Nikon lineal codificado etapa motorizada, un Hamamatsu ORCA-AG se enfrió dispositivo de carga acoplada (CCD), una cámara microscopio hecha a la medida de la incubación con temperatura y el CO 2 de control, Nikon NIS-Elements AR software de la versión 3, y un TMC aislamiento de vibraciones mesa.
- Los esferoides de cáncer de ovario de células se depositan en el fondo de un molde y se unen a la monocapa de células mesoteliales. Recopilar las buenas prácticas agrarias, RFP y las imágenes de fase de 20 + esferoide / monocapa interacciones, cada 10 minutos, durante 8 horas.
- En el PP-que expresan las células de cáncer de ovario esferoides va a invadir a la monocapa de células que expresan GFP mesotelial la creación de un agujero en la monocapa. Después de 8 horas, medir las dimensiones de los orificios mediante el trazado de los agujeros negros en las imágenes GFP utilizando software de Elementos (u otro software adecuado tal como J imagen). Normalizar el tamaño del agujero al tamaño esferoide inicial dividiendo el tamaño del agujero de 8 horas por el tamaño del esferoide en la correspondiente imagen RFP en el tiempo cero. En este exejemplo, el tamaño del agujero se midió una sola vez, pero se puede medir varias veces durante todo el experimento de ocho horas para comprender mejor la dinámica de la intercalación.
4. Los resultados representativos
En este ejemplo, se comparó la capacidad de depuración mesotelial de esferoides celulares OVCA433 de cáncer de ovario que tienen expresión atenuada de talina-1 para controlar OVCA433 esferoides. OVCA433 esferoides de cada grupo se añadieron a un plato MatTek contiene ZT monocapas de células mesoteliales. Seis esferoides de cada grupo se obtuvieron imágenes cada 10 minutos durante ocho horas (Figura 4, 3 Película, Película 4). Los agujeros producidos en la monocapa por los esferoides de propagación se midieron y seis posiciones de cada grupo se promediaron. La Figura 4 muestra que la zona de aclaramiento promedio creado por esferoides Talin desmontables 1 fue significativamente menor que el área media creado por esferoides de control, lo que sugiere que se requiere para talina aclaramiento mesotelial por OVCA433 esferoides de cáncer de ovario.
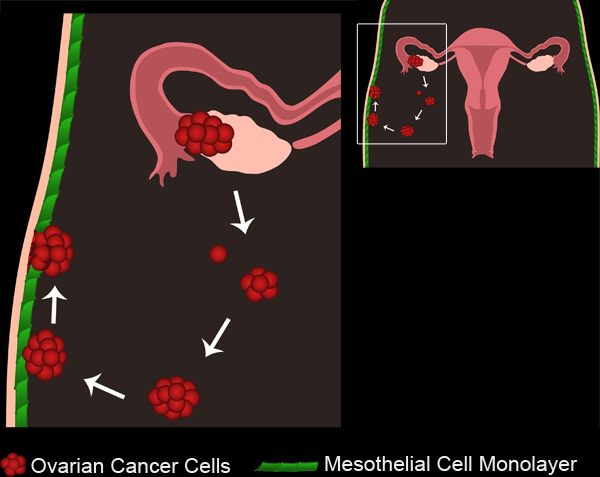
Figura 1. La metástasis del cáncer del ovario. Los tumores primarios de ovario desarrollan ya sea desde el epitelio superficial del ovario o trompas de Falopio. Las células tumorales o grupos se desprenden del tumor primario y se acumulan en la cavidad peritoneal. Las células tumorales a continuación, pueden agregarse para formar esferoides multicelulares. Esferoides continuación, se adhieren a las monocapas de células mesoteliales que recubren la cavidad peritoneal. Las células mesoteliales están excluidos de debajo del esferoide de cáncer de ovario adjunto, permitiendo que los esferoides para obtener acceso a la membrana basal subyacente.
Película 1. La metástasis del cáncer de ovario. Haga clic aquí para ver la película .
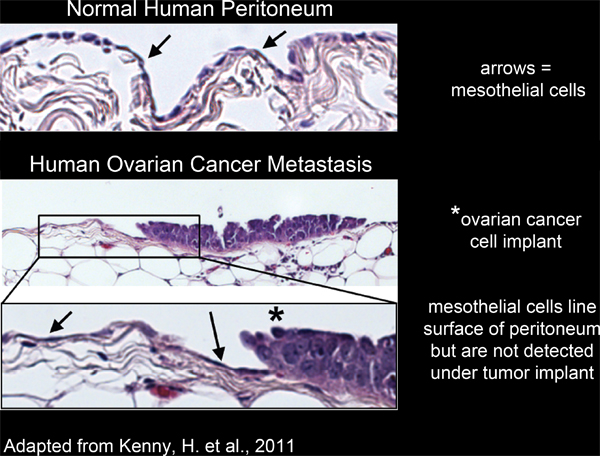
Figura 2. Línea células mesoteliales de la superficie del tejido peritoneal humano y se excluyen de debajo de los implantes de células cancerígenas de ovario.
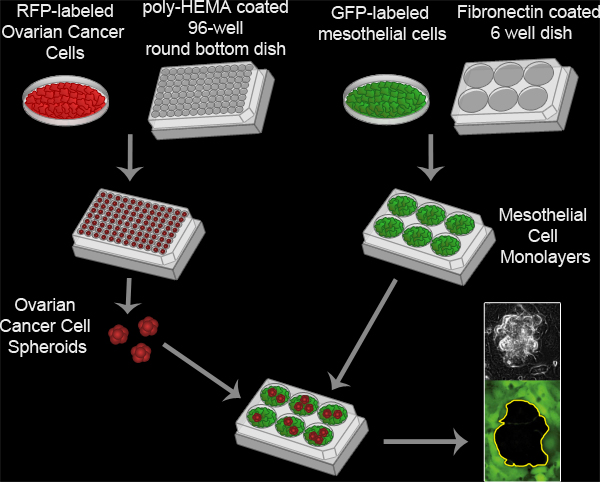
Figura 3. Ensayo de Liquidación mesoteliales. Esferoides de cáncer de ovario se forman mediante la incubación de 100 RFP-células que expresan el cáncer de ovario por pocillo en un poli-HEMA revestida 96 placa inferior la cultura y todo a 37 ° C durante 16 horas. Poli-HEMA evita que las células se adhieran a la placa de cultivo, permitiendo que las células permanezcan en suspensión y se adhieren entre sí para formar un solo grupo por pocillo. Monocapas de células mesoteliales se preparan mediante siembra de 6x10 5 células mesoteliales por pocillo en una fibronectina recubierto 6 así plato MatTek e incubando la placa a 37 ° C durante 16 horas. Los esferoides se transfieren luego al plato MatTek con la monocapa mesotelial y las dos poblaciones de células se visualizan cada 10 minutos durante 8 horas utilizando una Nikon Ti-EX Inverted motorizado de fluorescencia de campo amplio lapso de tiempo microscopio y software de los elementos.
Película 2. Ensayo de Liquidación mesoteliales. Haga clic aquí para ver la película .
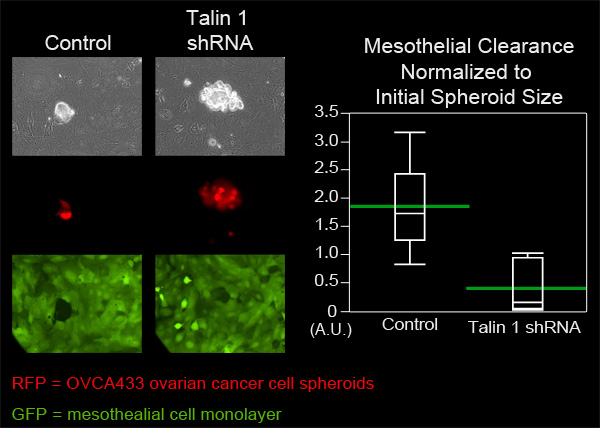
Atenuación de la Figura 4. Talina de una expresión en OVCA433 esferoides disminuye la capacidad de depuración mesotelial. OVCA433 esferoides (rojo) con y sin expresión atenuada de una talina se permite adjuntar a e invadir en una monocapa mesotelial ZT (verde). Las dos poblaciones de células se obtuvieron imágenes cada 10 minutos durante 8 horas utilizando una Nikon Ti-E invertido motorizado de fluorescencia de campo amplio lapso de tiempo microscopio y software de los elementos. El gráfico muestra que talina una atenuación dedisminuye significativamente el aclaramiento de células mesoteliales (parcela Quantile con barras verdes en el medio).
Película 3. Control de OVCA433 esferoides (rojo) invadiendo en una monocapa mesotelial (verde). Haga clic aquí para ver la película .
Atenuación de la película 4. De talina una expresión en OVCA433 esferoides (rojo) disminuye mesotelial (verde) la capacidad de depuración. Haga clic aquí para ver la película .
Discusión
El "Ensayo de Liquidación mesoteliales" que aquí se presenta utiliza lapso de tiempo de microscopía para controlar las interacciones de los esferoides multicelulares de cáncer de ovario y monocapas de células mesoteliales, con gran detalle espacial y temporal. Anteriormente, varios grupos de 8-14 había utilizado los ensayos de punto final para demostrar que las células de cáncer de ovario y de adherirse a invadir en monocapas de células mesoteliales. Este ensayo es único en que utiliza cé...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Nos gustaría dar las gracias a la Nikon Imaging Center de la Harvard Medical School, en concreto las aguas de Jennifer, Lara Petrak y Salmón Wendy, para la formación y el uso de microscopios sus timelapse. También nos gustaría dar las gracias a Rosa Ng y Besser Achim valiosa para los debates. Este trabajo fue apoyado por el NIH Grant 5695837 (a M. Iwanicki) y GM064346 de ACC, por una beca de la Dra. Miriam y Sheldon G. Adelson Fundación de Investigación Médica (con ACC).
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Empresa | Número de catálogo | Comentarios |
| OVCA433 células de cáncer ovárico | Regalo del Dr. Dennis Slamon | ||
| ZT células mesoteliales | Regalo del Dr. Tan Ince | ||
| Medio 199 | Gibco | 19950 | |
| MCDB105 | Aplicaciones de la célula Inc. | 117-500 | |
| FBS-inactivado por calor | Gibco | 10082 | |
| Pen-Strep | Gibco | 15070 | |
| Placas de 96 pocillos | Corning Costar | 3799 | |
| Polihidroxietilmetacrilato (poli-HEMA) | Sigma Aldrich | 192066-25G | Para poli-HEMA solución disolver 6mg poli-HEMA polvo en 1 ml de EtOH al 95% |
| EtOH | Pharmco-aaper | 111ACS200 | Diluir al 95% en dH 2 0 |
| Celular campana de la cultura | Nuaire | NU-425-300 | |
| Cultivo de tejidos incubadora | Thermo Scientific | 3110 | |
| incubadora de poli-HEMA placas | Labline Instruments | Imperial III 305 | |
| Centrífuga de mesa | Heraeus | 75003429/01 | |
| 6 y plato de fondo de vidrio | MatTek corp. | P06G-1.5-20-F | |
| La fibronectina | Sigma | F1141-1mg | |
| PBS | Cellgro | 21 a 040 CV | |
| Timelapse microscopio: | |||
| Microscopio | Nikon | Ti-E invertida motorizada de fluorescencia microscopio de lapso de tiempo con el sistema integrado de enfoque perfecto | |
| Lente | Nikon | 20X-0.75 apeture numérica | |
| Halógeno transiluminador | Nikon | 0.52 NA larga jornada de trabajo del condensador a distancia | |
| Filtros de excitación y emisión | Chroma filtros de una sola pasada en la vivienda de Nikon | Las buenas prácticas agrarias Ex 480/40, Em 525/50 SP-mCherry Ex 575/50 Em 640/50 | |
| Transmitido y Epifluoresce trayectoria de la luz | Sutter | Persianas inteligentes | |
| Lineal codificado platina motorizada | Nikon | ||
| Refrigerado de carga acoplada dispositivo de cámara | Hamamatsu | ORCA-AG | |
| Microscopio cámara de incubación con 2 temperatura y el control de CO | hecha a la medida | ||
| Vibración mesa de aislamiento | TMC | ||
| NIS-Elements | Nikon | La versión 3 |
Referencias
- Jemal, A. . CA Cancer J. Clin. 59, 225-249 (2009).
- Ries, L. G., Melbert, D., Krapcho, M., Stinchcomb, D. G., Howlader, N., Horner, M. J., Mariotto, A., Miller, B. A. . SEER Cancer Statistics Review, 1975-2005. , (2007).
- Burleson, K. M. Ovarian carcinoma ascites spheroids adhere to extracellular matrix components and mesothelial cell monolayers. Gynecol. Oncol. 93, 170-181 (2004).
- Birbeck, M. S., Wheatley, D. N. An Electron Microscopic Study of the Invasion of Ascites Tumor Cells into the Abdominal Wall. Cancer Res. 25, 490-497 (1965).
- Witz, C. A., Monotoya-Rodriguez, I. A., Schenken, R. S. Whole explants of peritoneum and endometrium: a novel model of the early endometriosis lesion. Fertil. Steril. 71, 56-60 (1999).
- Zhang, X. Y. Characteristics and growth patterns of human peritoneal mesothelial cells: comparison between advanced epithelial ovarian cancer and non-ovarian cancer sources. J. Soc. Gynecol. Investig. 6, 333-340 (1999).
- Kenny, H. A., Nieman, K. M., Mitra, A. K., Lengyel, E. The First Line of Intra-abdominal Metastatic Attack: Breaching the Mesothelial Cell Layer. Cancer Discovery. 1, 100-102 (2011).
- Niedbala, M. J., Crickard, K., Bernacki, R. J. Interactions of human ovarian tumor cells with human mesothelial cells grown on extracellular matrix. An in vitro model system for studying tumor cell adhesion and invasion. Exp. Cell. Res. 160, 499-513 (1985).
- Kenny, H. A., Krausz, T., Yamada, S. D., Lengyel, E. Use of a novel 3D culture model to elucidate the role of mesothelial cells, fibroblasts and extra-cellular matrices on adhesion and invasion of ovarian cancer cells to the omentum. Int. J. Cancer. 121, 1463-1472 (2007).
- Ksiazek, K. Senescent peritoneal mesothelial cells promote ovarian cancer cell adhesion: the role of oxidative stress-induced fibronectin. Am. J. Pathol. 174, 1230-1240 (2009).
- Burleson, K. M., Boente, M. P., Pambuccian, S. E., Skubitz, A. P. Disaggregation and invasion of ovarian carcinoma ascites spheroids. J. Transl. Med. 4, 6-6 (2006).
- Heyman, L. Vitronectin and its receptors partly mediate adhesion of ovarian cancer cells to peritoneal mesothelium in vitro. Tumour. Biol. 29, 231-244 (2008).
- Heyman, L. Mesothelial vitronectin stimulates migration of ovarian cancer cells. Cell. Biol. Int. 34, 493-502 .
- Lessan, K., Aguiar, D. J., Oegema, T., Siebenson, L., Skubitz, A. P. CD44 and beta1 integrin mediate ovarian carcinoma cell adhesion to peritoneal mesothelial cells. Am. J. Pathol. 154, 1525-1537 (1999).
- Leroy-Dudal, J., Heyman, L., Gauduchon, P., Carreiras, F. Adhesion of human ovarian adenocarcinoma IGROV1 cells to endothelial cells is partly mediated by the alphav integrins-vitronectin adhesive system and induces an alteration of endothelial integrity. Cell. Biol. Int. 29, 482-488 (2005).
- Leroy-Dudal, J. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves alphav integrins and the participation of MMP2. Int. J. Cancer. 114, 531-543 (2005).
- Iwanicki, M. Ovarian cancer spheroids use myosin-generated force to clear the mesothelium. Cancer Discovery. 1, 144-157 (2011).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Gregoire, L., Munkarah, A., Rabah, R., Morris, R. T., Lancaster, W. D. Organotypic culture of human ovarian surface epithelial cells: a potential model for ovarian carcinogenesis. In Vitro Cell Dev. Biol. Anim. 34, 636-639 (1998).
- Roberts, P. C. Sequential molecular and cellular events during neoplastic progression: a mouse syngeneic ovarian cancer model. Neoplasia. 7, 944-956 (2005).
- Okada, T., Okuno, H., Mitsui, Y. A novel in vitro assay system for transendothelial tumor cell invasion: significance of E-selectin and alpha 3 integrin in the transendothelial invasion by HT1080 fibrosarcoma cells. Clin. Exp. Metastasis. 12, 305-314 (1994).
- Zervantonakis, I. K., Kothapalli, C. R., Chung, S., Sudo, R., Kamm, R. D. Microfluidic devices for studying heterotypic cell-cell interactions and tissue specimen cultures under controlled microenvironments. Biomicrofluidics. 5, 13406-1310 (2011).
- Brandt, B. 3D-extravasation model -- selection of highly motile and metastatic cancer cells. Semin. Cancer Biol. 15, 387-395 (2005).
- Condeelis, J., Segall, J. E. Intravital imaging of cell movement in tumours. Nat. Rev. Cancer. 3, 921-930 (2003).
- Dai, J., Ting-Beall, H. P., Hochmuth, R. M., Sheetz, M. P., Titus, M. A. Myosin I contributes to the generation of resting cortical tension. Biophys. J. 77, 1168-1176 (1999).
- Laferriere, J., Houle, F., Taher, M. M., Valerie, K., Huot, J. Transendothelial migration of colon carcinoma cells requires expression of E-selectin by endothelial cells and activation of stress-activated protein kinase-2 (SAPK2/p38) in the tumor cells. J. Biol. Chem. 276, 33762-33772 (2001).
- Dong, C., Slattery, M. J., Rank, B. M., You, J. In vitro characterization and micromechanics of tumor cell chemotactic protrusion, locomotion, and extravasation. Ann. Biomed. Eng. 30, 344-355 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados