A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ב Assay עמילות חוץ גופית mesothelial כי מודלים השלבים המוקדמים של גרורות סרטן השחלות
In This Article
Summary
Assay אישור mesothelial המתוארת כאן מנצלת את התאים שכותרתו fluorescently ואת זמן לשגות מיקרוסקופיה וידאו להמחיש כמותית למדוד את יחסי הגומלין של סרטן השחלות spheroids תאיים ו monolayers התא mesothelial. Assay מתווך זה מדגים את השלבים המוקדמים של גרורות סרטן השחלות.
Abstract
סרטן השחלות הוא הגורם המוביל של 5 מקרי מוות מסרטן הקשורים בארצות הברית 1. למרות התגובה הראשונית חיובית לטיפולים, 70 עד 90 אחוז של נשים עם סרטן השחלות מפתחים גרורות חדשות, הישנות הוא לעיתים קרובות קטלני 2. זהו, אם כן, יש צורך להבין כיצד גרורות משניים להתעורר על מנת לפתח טיפולים טובים יותר עבור סרטן השחלות ביניים ומאוחר הבמה. גרורות סרטן השחלות מתרחש כאשר תאים ממאירים להתנתק מאתר הגידול הראשוני ולהפיץ ברחבי חלל הצפק. התאים המופץ יכול ליצור אשכולות תאיים, או spheroids, כי יהיה גם להישאר פנויות, או שתל על איברים בתוך חלל הצפק 3 (איור 1, סרט 1).
כל האיברים בתוך חלל הצפק מכוסים שכבה אחת, רציפה של תאים mesothelial 4-6 (איור 2). עם זאת, תאים mesothelial נעדרים מתחתגידול המוני הצפק, כפי שעולה מחקרים מיקרוסקופ אלקטרונים של האדם חלקים הכרותות רקמת הגידול 3,5-7 (איור 2). הדבר מצביע על כך התאים mesothelial אינם נכללים תחת מסת הגידול על ידי תהליך לא ידוע.
קודם ניסויים במבחנה הראו כי תאים ראשוניים סרטן השחלות לצרף ביעילות רבה יותר את תאי מטריקס מאשר תאים mesothelial 8, ומחקרים מאוחרים יותר הראו כי תאים ראשוניים mesothelial הצפק למעשה לספק מחסום הידבקות בסרטן השחלות תאים ופלישה (לעומת הידבקות ופלישה על מצעים שלא כוסו עם תאים mesothelial) 9,10. זה מראה כי תאים mesothelial לפעול כמחסום נגד גרורות סרטן השחלות. המנגנונים תאית ומולקולרית שבו תאים סרטניים בשחלות לפרוץ את המחסום הזה, לא לכלול mesothelium יש, עד לאחרונה, נותר לא ידוע.
כאן אנו מתארים את ההמתודולוגיה של ה ב assay חוץ גופית, כי מודלים של אינטראקציה בין סרטן השחלות spheroids תאים תאים mesothelial in vivo (איור 3, סרט 2). פרוטוקול שלנו מותאמת השיטות שתוארו קודם לכן לניתוח סרטן השחלות תאים אינטראקציות עם monolayers mesothelial 8-16, ו תוארה לראשונה בשנת הדוח מראה כי תאים סרטניים בשחלות לנצל ההפעלה integrin תלוי של שרירן וכוח המתיחה על מנת לקדם את הוצאת תאים mesothelial מתחת 17 אליפטית הגידול. מודל זה מנצל את זמן לשגות מיקרוסקופ פלואורסצנטי לעקוב אחר שתי אוכלוסיות תאים בזמן אמת, מתן מידע במרחב ובזמן על אינטראקציה. על תאים סרטניים בשחלות לבטא חלבון פלואורסצנטי אדום (RFP), בעוד התאים mesothelial לבטא חלבון פלואורסצנטי ירוק (GFP). RFP-להביע את סרטן השחלות spheroids סלולריים לצרף monolayer GFP-להביע mesothelial. התפשטות spheroids, לפלוש, ולהכריח את התאים mesothelial בצד יצירת חור monolayer. חור זה דמיינו כחלל שלילי (שחור) בתמונה GFP. האזור של החור לאחר מכן ניתן למדוד כמותית כדי לנתח את ההבדלים בין פעילות אישור שליטה אוכלוסיות הניסוי של סרטן השחלות ו / או תאים mesothelial. Assay זה דורש רק מספר קטן של תאים סרטן השחלות (100 תאים לכל אליפטית צילומי 20-30 spheroids בכל מצב), אז זה אפשרי לבצע את assay באמצעות יקרות דגימות תאים סרטניים ראשוניים. יתר על כן, assay זה ניתן להתאים בקלות לסינון תפוקה גבוהה.
Protocol
1. סרטן השחלות Cell אליפטית גיבוש
- RFP-לבטא בתאי סרטן השחלות הם בתרבית בינוני בסיס 10% (תא מותאם אישית התרבות בינוני המכיל תערובת 50:50 של 199 ו MCDB105, 10% מומת בסרום שור עוברית 1% עט סטרפטוקוקוס). להביע RFP בתאי סרטן השחלות שהוסרו מהן תוויות, transfect תאים עם פלסמיד המכיל RFP ובחר את התאים המבטאים RFP. לחלופין, וקטורים ויראליים ניתן להשתמש כדי להביע את זמני חלבוני ניאון, או התאים יכולים להיות מראש דגירה עם אדום ניאון תא גשש צבע (Invitrogen).
- לפני היווצרות spheroids סרטן השחלות, יש צורך להכין הדבקה נמוכה 96 עגולים גם תרבות הכלים התחתון. כדי לייצר את הידבקות נמוך צלחות תרבות, 30μl מרובה המה (6mg polyhydroxyethylmethacrylate ב 1 95% EtOH מ"ל) פתרון נוסף גם כל אחד 96 גם צלחת קורנינג התרבות התא. 96 צלחות גם מודגרת ב 37 ° C ללא humidified חממה להתאדות אתנול, אניeaving הסרט של פולי, המה על כן כל אחד. הסרט מרובה המה מונע תאים מצרף לתחתית הבאר, מה שאילץ את התאים לגדול ההשעיה 18. [לחלופין, נמוך במיוחד תרבות מצורף צלחות (Corning) יכול לשמש במקום מרובה המה הכלים מצופים.]
- לאחר הדבקה נמוכה תרבות לוחות מוכנים, trypsinize צלחת של תאים סרטניים בשחלות, גלולה התאים צנטריפוגות השולחן (Heraeus) בשעה RCF 900 במשך 3 דקות, aspirate supernatant מחדש להתלות על בסיס בינוני 10%.
- לספור את התאים באמצעות hemocytometer.
- התאם את הריכוז של תאים כאלה שיש 100 תאים לכל 50μl של המדיום בסיס 10%.
- הוסף 50μl של השעיה על תנאי באופן אחיד את התא מדולל היטב בכל מנה גם poly-96 המה התרבות מצופה.
- דגירה 96 צלחת יפה 37 ° C התרבות התא בחממה במשך 16 שעות (זה משך הזמן יש להגדיל או להקטין בהתאם לכמות הזמן שלוקחקו תא מסוים כדי ליצור spheroids תאיים או תנאי הניסוי הרצוי) כדי לאפשר תאים סרטניים בשחלות להתקבץ יחדיו, ויוצרים אליפטית תאיים אחד טוב כל אחד. כמה תאים סרטניים יכולים לעבור אפופטוזיס במהלך תקופה זו, ולכן חשוב לבחור את הזמן לפני הגיוס של אפופטוזיס.
2. תא mesothelial monolayer גיבוש
- בשכונה תרבית תאים, מעיל מראש את הבארות של מנה 6 גם MatTek זכוכית התחתונה עם fibronectin על ידי הוספת 2ml של fibronectin 5μg / פתרון מ"ל PBS היטב כל מאכל ו דוגרים בטמפרטורת החדר למשך 30 דקות. איכות אופטית של שנות תחתית זכוכית במנות MatTek לאפשר הדמיה ברזולוציה גבוהה מיקרוסקופיים.
- GFP-לבטא בתאי mesothelial הם בתרבית בינוני בסיס 10%. Trypsinize צלחת של תאים mesothelial, ספין למטה צנטריפוגות השולחן (Heraeus) ב 900RPM במשך 3 דקות, לשאוב supernatant, מחדש להתלות על בסיס בינוני 10%.תאים mesothelial משמש כאן כבר הביע GFP כאשר הם התקבלו, אבל התאים mesothelial שהוסרו מהן תוויות יכול להיות מיוצר על ידי transfecting עם GFP פלסמיד המכיל cDNA, או preincubating התאים ירוק ניאון תא גשש צבע (Invitrogen).
- לאחר דגירה של 30 דקות fibronectin (בשלב 2.1), לשטוף את הבארות של המנה MatTek עם 2ml PBS.
- Aspirate PBS ואת צלחת 6 x10 5 תאים לכל mesothelial היטב היטב כל מאכל MatTek 6 היטב. דגירה מנה MatTek ב 37 ° C התרבות התא בחממה במשך הלילה, כדי לאפשר את התאים mesothelial לצרף צלחת ויוצרים monolayer.
3. תא mesothelial עמילות Assay
- השתמש pipet לאסוף את סרטן השחלות spheroids מן הצלחת 96 פולי, המה גם מצופה.
- Aspirate בינוני מאחד גם מנה MatTek 6 היטב המכיל monolayer תא mesothelial. לשטוף פעם אחת עם 2ml PBS. להוסיף את כל spheroids את מ 96 גם עמ 'מאוחר 1 גם מנה MatTek (~ מספר 3x של spheroids כי הם הולכים להיות צילמו לחשבון לנחיתה spheroids מצד מנה שלא ניתן הדמיה).
- מניחים את צלחת MatTek על הבמה של מיקרוסקופ פלואורסצנטי הפוך widefield מסוגל לבצע זמן לשגות הדמיה למשך לפחות 8 שעות. השתמש הבמה ממונע לעמדות תמונה מרובים מנה, עם מספר רב של אירועים העיבור אליפטית, בניסוי אחד. אנו משתמשים TI-E Nikon היפוך ממונע widefield Fluorescence זמן לשגות מיקרוסקופ עם מערכת משולבת פוקוס מושלם נמוך [20x-0.75 צמצם המספרי (NA)] הגדלה / הפרעה במכורים אנונימיים דיפרנציאלי ניגודיות (DIC) אופטיקה, transilluminator הלוגן ניקון עם 0.52 NA מרחק עבודה ארוך (LWD) הקבל, ניקון מהירה (<100-אלפית שנייה מיתוג זמן) עירור ופליטה מסננים (GFP אקס 480/40, Em 525/50, RFP-mCherry Ex 575/50 Em 640/50), סאטר מהר המועברות ואור epifluorescence נתיב חכם עצומותהמאוחדות, שלב ליניארי בקידוד Nikon ממונע, Hamamatsu ORCA-AG מקורר תשלום מצמידים (CCD) למכשיר מצלמה, שהותקן הדגירה מיקרוסקופ חדר עם בקרת טמפרטורה CO 2, ניקון ש"ח אלמנטים AR תוכנה גרסה 3, בידוד TMC רעידות השולחן.
- את סרטן השחלות spheroids סלולריים יישב לתחתית צלחת ולצרף monolayer תא mesothelial. איסוף ה-GFP, RFP ותמונות שלב 20 + אליפטית / monolayer אינטראקציות, כל 10 דקות, במשך 8 שעות.
- המכרז-לבטא סרטן השחלות spheroids סלולריים יפלוש לתוך monolayer GFP-להביע את התא mesothelial יצירת חור monolayer. לאחר 8 שעות, למדוד את הגדלים של החורים על ידי מעקב אחר החורים השחורים בתמונות GFP שימוש באלמנטים תוכנה (או תוכנה מתאימה, כגון J תמונה). לנרמל את גודל החור לגודל אליפטית הראשונית על ידי חלוקת גודל החור של 8 שעות על ידי גודל של אליפטית בתמונה RFP המתאים בזמן אפס. ב לשעבר זהמספיק, גודל החור נמדד פעם אחת בלבד, אבל ניתן למדוד מספר פעמים במהלך הניסוי 8 שעות כדי להבין טוב יותר את הדינמיקה של העיבור.
4. נציג תוצאות
בדוגמה זו, השווינו את היכולת אישור mesothelial OVCA433 של סרטן השחלות spheroids תאים בעלי ביטוי מוחלש של תלין-1 לשלוט OVCA433 spheroids. OVCA433 spheroids של כל קבוצה נוספו צלחת MatTek המכיל זצ"ל monolayers התא mesothelial. שישה spheroids של כל קבוצה היו צילמו כל 10 דקות במשך שמונה שעות (איור 4, 3 סרט, סרט 4). החורים שנוצרו בשכבה ידי spheroids הפצת נמדדו שש עמדות של כל קבוצה היו בממוצע. איור 4 מראה כי השטח הממוצע אישור שנוצר על ידי תלין 1 spheroids מציאה היה קטן יותר באופן משמעותי בשטח ממוצע שנוצר על ידי spheroids שליטה, טוען כי תלין נדרש אישור mesothelial ידי OVCA433 סרטן השחלות spheroids.
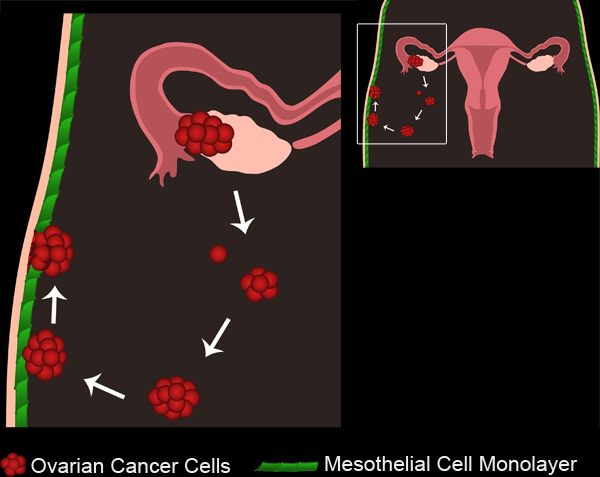
באיור 1. סרטן השחלות גרורה. גידולי השחלות ראשיים לפתח גם מן האפיתל פני השחלות או החצוצרות. תאים סרטניים / אשכולות לנתק מן הגידול הראשוני ולאסוף בחלל הצפק. תאים סרטניים יכולים מצטבר כדי ליצור spheroids תאיים. Spheroids מכן לצרף את monolayers התא mesothelial המצפים את חלל הצפק. התאים mesothelial ייכללו מתחת אליפטית השחלות המצורפת סרטן, המאפשר spheroids כדי לקבל גישה קרום במרתף שמתחת.
1. סרט השחלות סרטן גרורות. לחצו כאן לצפייה בסרט .
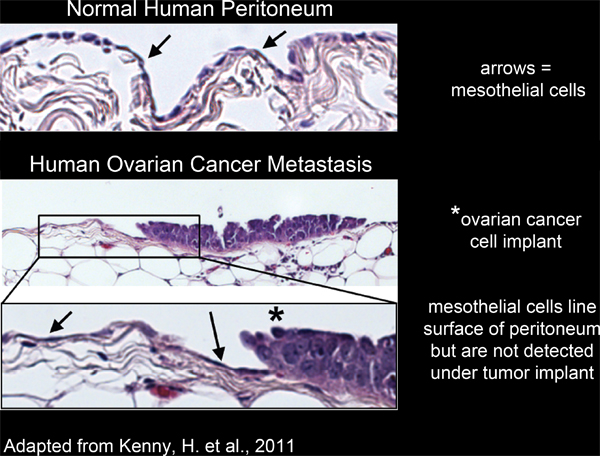
איור 2. mesothelial קו התאים את פני השטח של רקמת הצפק האדם אינם נכללים תחת סרטן השחלות שתלים סלולריים.
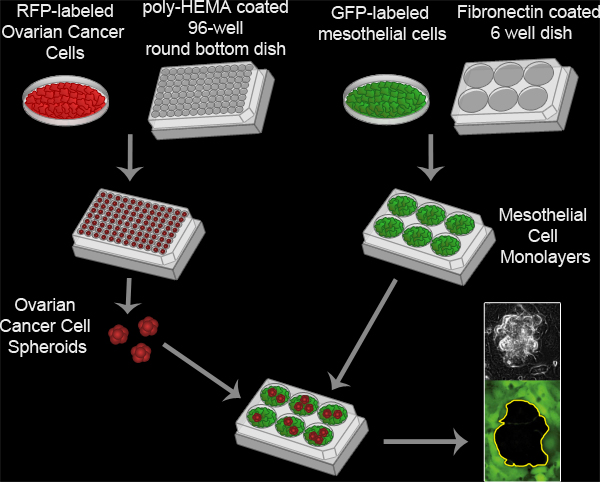
איור 3. Assay עמילות mesothelial. סרטן השחלות spheroids נוצרות על ידי דוגרים 100 RFP-לבטא בתאי סרטן השחלות לכל היטב מרובה המה צלחת מצופה 96 עגול גם בתחתית התרבות ב 37 מעלות צלזיוס במשך 16 שעות. פולי, המה מונע על התאים מפני היצמדות מנה תרבות, ומאפשר לתאים לרחף לדבוק זה בזה כדי ליצור קבוצה אחת בכל טוב. Monolayers התא mesothelial מוכנים ידי ציפוי 6x10 5 תאים לכל mesothelial היטב צלחת fibronectin מצופה 6 MatTek דוגרים היטב את הצלחת על 37 מעלות צלזיוס במשך 16 שעות. Spheroids מועברים לאחר מכן מנה MatTek עם monolayer mesothelial ושתי אוכלוסיות תאים הם צילמו כל 10 דקות במשך 8 שעות באמצעות TI-E ניקון אניnverted ממונע widefield Fluorescence זמן לשגות מיקרוסקופ ותוכנה אלמנטים.
סרט 2. Assay עמילות mesothelial. לחצו כאן לצפייה בסרט .
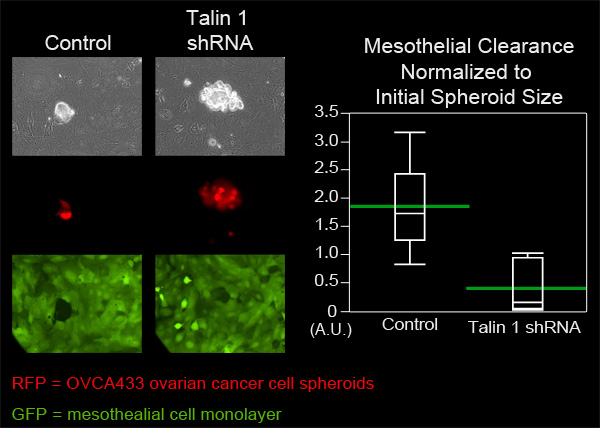
איור 4. הנחתה של הביטוי 1 תלין על OVCA433 spheroids פוחתת היכולת אישור mesothelial. OVCA433 spheroids (אדום) עם ובלי ביטוי נחלש תלין של 1 הורשו לצרף ולפלוש לתוך monolayer mesothelial ZT (ירוק). שתי אוכלוסיות תאים היו צילמו כל 10 דקות במשך 8 שעות באמצעות TI-E Nikon היפוך ממונע widefield Fluorescence זמן לשגות מיקרוסקופ ותוכנה אלמנטים. הגרף מראה כי תלין 1 הנחתהמקטין באופן משמעותי את אישור התא mesothelial (העלילה Quantile עם הפסים הירוקים בכל האמצעים).
סרט 3. בקרה OVCA433 spheroids (אדום) פולשים לתוך monolayer mesothelial (ירוק). לחץ כאן לצפייה בסרט .
סרט 4. הנחתה של הביטוי 1 תלין על OVCA433 spheroids (אדום) יורד mesothelial (ירוק) היכולת אישור. לחץ כאן לצפייה בסרט .
Discussion
"Assay עמילות mesothelial" המובא כאן עושה שימוש זמן לשגות מיקרוסקופ כדי לעקוב אחר אינטראקציות של סרטן השחלות spheroids תאיים ו monolayers התא mesothelial, בפירוט במרחב ובזמן רב. בעבר, מספר קבוצות 8-14 השתמשו מבחני נקודות קצה להראות כי תאים סרטניים בשחלות לצרף ולפלוש אל monolayers התא meso...
Disclosures
אין לנו מה למסור.
Acknowledgements
אנו רוצים להודות הדמיה Nikon מרכז בבית הספר לרפואה בהרווארד, במיוחד ג'ניפר ווטרס, לארה Petrak וסלמון וונדי, לאימונים השימוש של מיקרוסקופים timelapse שלהם. אנו רוצים גם להודות רוזה נג ו אחים בסר לדיונים חשובים. עבודה זו נתמכה על ידי NIH גרנט 5695837 (למ 'Iwanicki) ו GM064346 כדי JSB, על ידי מענק מטעם ד"ר מרים ושלדון אדלסון למחקר רפואי קרן (כדי JSB).
Materials
| Name | Company | Catalog Number | Comments |
| מגיב | חברה | מספר קטלוגי | תגובות |
| OVCA433 סרטן השחלות תאים | מתנת ד"ר דניס שלאמון | ||
| ZT תאים mesothelial | מתנת ד"ר טאן אינס | ||
| בינוני 199 | Gibco | 19950 | |
| MCDB105 | יישומים תא בע"מ | 117-500 | |
| FBS חום מומת | Gibco | 10082 | |
| עט סטרפטוקוקוס | Gibco | 15070 | |
| 96 צלחות גם | קורנינג שחקן המשנה | 3799 | |
| Polyhydroxyethylmethacrylate (פולי המה) | סיגמא אולדריץ' | 192066-25 גרם | פתרון מרובה המה לפזר אבקת 6mg מרובה המה ב 1ml של EtOH 95% |
| EtOH | Pharmco-aaper | 111ACS200 | לדלל עד 95% ב DH 2 0 |
| תרבית תאים מכסה המנוע | Nuaire | נו-425-300 | |
| רקמת התרבות חממה | Thermo Scientific | 3110 | |
| חממה מרובה המה צלחות | Labline מכשירים | אימפריאל III 305 | |
| השולחן צנטריפוגות | Heraeus | 75003429/01 | |
| 6 מנה גם הזכוכית התחתונה | MatTek קורפ. | P06G-1.5-20-F | |
| Fibronectin | סיגמא | F1141-במינון של 1 | |
| PBS | Cellgro | 21-040-CV | |
| Timelapse מיקרוסקופ: | |||
| מיקרוסקופ | ניקון | TI-E הפוכה ממונע מיקרוסקופ פלואורסצנטי זמן לשגות עם מערכת משולבת פוקוס מושלם | |
| עדשה | ניקון | 20X-0.75 המספרי apeture | |
| הלוגן transilluminator | ניקון | 0.52 NA עבודה ארוך מרחק הקבל | |
| עירור ופליטה מסננים | Chroma עוברים מסננים בודדים Nikon הדיור | GFP Ex 480/40, Em 525/50 RFP-mCherry Ex 575/50 Em 640/50 | |
| מועבר Epifluoresce נתיב האור | סאטר | חכמים תריסים | |
| יישור קווי בקידוד ממונע הבמה | ניקון | ||
| מקורר טעונה מצמידים מכשיר המצלמה | Hamamatsu | ORCA-AG | |
| הדגירה מיקרוסקופ חדר עם בקרת טמפרטורה CO 2 | שהותקן | ||
| בידוד רעידות השולחן | TMC | ||
| ש"ח אלמנטים תוכנה | ניקון | גרסה 3 |
References
- Jemal, A. . CA Cancer J. Clin. 59, 225-249 (2009).
- Ries, L. G., Melbert, D., Krapcho, M., Stinchcomb, D. G., Howlader, N., Horner, M. J., Mariotto, A., Miller, B. A. . SEER Cancer Statistics Review, 1975-2005. , (2007).
- Burleson, K. M. Ovarian carcinoma ascites spheroids adhere to extracellular matrix components and mesothelial cell monolayers. Gynecol. Oncol. 93, 170-181 (2004).
- Birbeck, M. S., Wheatley, D. N. An Electron Microscopic Study of the Invasion of Ascites Tumor Cells into the Abdominal Wall. Cancer Res. 25, 490-497 (1965).
- Witz, C. A., Monotoya-Rodriguez, I. A., Schenken, R. S. Whole explants of peritoneum and endometrium: a novel model of the early endometriosis lesion. Fertil. Steril. 71, 56-60 (1999).
- Zhang, X. Y. Characteristics and growth patterns of human peritoneal mesothelial cells: comparison between advanced epithelial ovarian cancer and non-ovarian cancer sources. J. Soc. Gynecol. Investig. 6, 333-340 (1999).
- Kenny, H. A., Nieman, K. M., Mitra, A. K., Lengyel, E. The First Line of Intra-abdominal Metastatic Attack: Breaching the Mesothelial Cell Layer. Cancer Discovery. 1, 100-102 (2011).
- Niedbala, M. J., Crickard, K., Bernacki, R. J. Interactions of human ovarian tumor cells with human mesothelial cells grown on extracellular matrix. An in vitro model system for studying tumor cell adhesion and invasion. Exp. Cell. Res. 160, 499-513 (1985).
- Kenny, H. A., Krausz, T., Yamada, S. D., Lengyel, E. Use of a novel 3D culture model to elucidate the role of mesothelial cells, fibroblasts and extra-cellular matrices on adhesion and invasion of ovarian cancer cells to the omentum. Int. J. Cancer. 121, 1463-1472 (2007).
- Ksiazek, K. Senescent peritoneal mesothelial cells promote ovarian cancer cell adhesion: the role of oxidative stress-induced fibronectin. Am. J. Pathol. 174, 1230-1240 (2009).
- Burleson, K. M., Boente, M. P., Pambuccian, S. E., Skubitz, A. P. Disaggregation and invasion of ovarian carcinoma ascites spheroids. J. Transl. Med. 4, 6-6 (2006).
- Heyman, L. Vitronectin and its receptors partly mediate adhesion of ovarian cancer cells to peritoneal mesothelium in vitro. Tumour. Biol. 29, 231-244 (2008).
- Heyman, L. Mesothelial vitronectin stimulates migration of ovarian cancer cells. Cell. Biol. Int. 34, 493-502 .
- Lessan, K., Aguiar, D. J., Oegema, T., Siebenson, L., Skubitz, A. P. CD44 and beta1 integrin mediate ovarian carcinoma cell adhesion to peritoneal mesothelial cells. Am. J. Pathol. 154, 1525-1537 (1999).
- Leroy-Dudal, J., Heyman, L., Gauduchon, P., Carreiras, F. Adhesion of human ovarian adenocarcinoma IGROV1 cells to endothelial cells is partly mediated by the alphav integrins-vitronectin adhesive system and induces an alteration of endothelial integrity. Cell. Biol. Int. 29, 482-488 (2005).
- Leroy-Dudal, J. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves alphav integrins and the participation of MMP2. Int. J. Cancer. 114, 531-543 (2005).
- Iwanicki, M. Ovarian cancer spheroids use myosin-generated force to clear the mesothelium. Cancer Discovery. 1, 144-157 (2011).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Gregoire, L., Munkarah, A., Rabah, R., Morris, R. T., Lancaster, W. D. Organotypic culture of human ovarian surface epithelial cells: a potential model for ovarian carcinogenesis. In Vitro Cell Dev. Biol. Anim. 34, 636-639 (1998).
- Roberts, P. C. Sequential molecular and cellular events during neoplastic progression: a mouse syngeneic ovarian cancer model. Neoplasia. 7, 944-956 (2005).
- Okada, T., Okuno, H., Mitsui, Y. A novel in vitro assay system for transendothelial tumor cell invasion: significance of E-selectin and alpha 3 integrin in the transendothelial invasion by HT1080 fibrosarcoma cells. Clin. Exp. Metastasis. 12, 305-314 (1994).
- Zervantonakis, I. K., Kothapalli, C. R., Chung, S., Sudo, R., Kamm, R. D. Microfluidic devices for studying heterotypic cell-cell interactions and tissue specimen cultures under controlled microenvironments. Biomicrofluidics. 5, 13406-1310 (2011).
- Brandt, B. 3D-extravasation model -- selection of highly motile and metastatic cancer cells. Semin. Cancer Biol. 15, 387-395 (2005).
- Condeelis, J., Segall, J. E. Intravital imaging of cell movement in tumours. Nat. Rev. Cancer. 3, 921-930 (2003).
- Dai, J., Ting-Beall, H. P., Hochmuth, R. M., Sheetz, M. P., Titus, M. A. Myosin I contributes to the generation of resting cortical tension. Biophys. J. 77, 1168-1176 (1999).
- Laferriere, J., Houle, F., Taher, M. M., Valerie, K., Huot, J. Transendothelial migration of colon carcinoma cells requires expression of E-selectin by endothelial cells and activation of stress-activated protein kinase-2 (SAPK2/p38) in the tumor cells. J. Biol. Chem. 276, 33762-33772 (2001).
- Dong, C., Slattery, M. J., Rank, B. M., You, J. In vitro characterization and micromechanics of tumor cell chemotactic protrusion, locomotion, and extravasation. Ann. Biomed. Eng. 30, 344-355 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved