Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
In vitro Mezotelyal Gümrükleme Assay o Yumurtalık Kanseri Metastaz Erken Adımlar modeller
Bu Makalede
Özet
Burada anlatılan mezotel klirensi tayini floresan ile işaretlenmiş hücreler ve zaman atlamalı video mikroskopi görselleştirmek ve kantitatif yumurtalık kanseri çok hücreli sferoidler ve mezotel hücre tek katmanlarının etkileşimleri ölçmek için yararlanır. Bu test yumurtalık kanseri metastaz erken adımları modeller.
Özet
Over kanseri Amerika Birleşik Devletleri 1 kansere bağlı ölümlerin beşinci önde gelen nedenidir. Tedavilere olumlu bir ilk yanıt rağmen, yumurtalık kanseri olan kadınların 70 ila 90 oranında yeni metastaz geliştirmek ve nüks genellikle 2 ölümcüldür. Bu, orta ve geç evre yumurtalık kanseri için daha iyi tedaviler geliştirmek için ikincil metastazlar ortaya nasıl anlamak için, bu nedenle gereklidir. Malign hücrelerin primer tümörün sitesinden ayırmak ve periton boşluğuna genelinde yaygınlaştırmak zaman yumurtalık kanseri metastazı oluşur. Dissemine hücrelerin periton boşluğuna 3 (Şekil 1, Movie 1) içindeki organlar üzerine çok hücreli kümeleri, ya da küresel cisimler, ya kalır ayrıldığı edecek, ya da implant oluşturabilir.
Periton boşluğu içinde organlarının Tüm mezotel hücreleri 4-6 (Şekil 2) bir tek, sürekli, tabaka ile kaplıdır. Ancak, mezotel hücre altından bulunmadığınaolarak eksize insan tümör doku kesitlerinde 3,5-7 (Şekil 2) elektron mikroskobu çalışmalarla ortaya peritoneal tümör kitleleri,. Bu mezotel hücreler bilinmeyen bir işlem tarafından tümör kitlesi altında dışında olduğunu göstermektedir.
In vitro deneylerde Önceki primer over kanseri hücreleri 8 mezotel hücrelere daha ekstraselüler matriks daha verimli takın ve daha yeni çalışmalar primer periton mezotel hücreleri aslında yumurtalık kanseri hücre adezyon ve invazyon (as adhezyon ve invazyon göre bir bariyer sağlamak gösterdi gösterdi ) mezotelyal hücrelerle 9,10 kapsamı dışında kalan yüzeylerde. Bu mezotel hücreleri yumurtalık kanseri metastazı karşı bir bariyer görevi öneririm. Yumurtalık kanseri hücreleri bu engeli ihlal ve sahip mesothelium hariç hangi hücresel ve moleküler mekanizmalar, yakın zamana kadar bilinmeyen kaldı.
İşte biz th tarifin vitro bir e metodolojisi bu modeller in vivo (Şekil 3, Movie 2) yumurtalık kanseri hücre sferoidler ve mezotel hücreleri arasındaki etkileşim. Bizim protokolü mezotel monotabaka 8-16 ile over tümör hücre etkileşimleri analiz etmek için daha önce açıklanan yöntemlerden adapte edildi ve önce o over tümör hücreleri hariç teşvik etmek miyozin ve çekiş kuvveti bir integrin bağımlı aktivasyon kullanmak gösteren bir rapor açıklanmıştır bir tümör sfero 17 altından mezotel hücreleri. Bu model etkileşime zamansal ve mekansal bilgi sağlayarak, gerçek zamanlı iki hücre popülasyonlarının izlenmesi için time-lapse floresan mikroskobu yararlanır. Mezotel hücreleri yeşil floresan protein (GFP) ifade ederken yumurtalık kanseri hücreleri kırmızı floresan proteini (TÇ) ifade eder. TTT-ifade yumurtalık kanseri hücresi sferoidler GFP-ifade mezotel monolayer iliştirin. Sferoidler yayılması, işgal vekenara tek tabakalı bir delik oluştururken mezotel hücreleri zorlamak. Bu delik GFP görüntü negatif boşluk (siyah) olarak görüntülenmiştir. Delik alanı ardından nicel kontrolü ve yumurtalık kanseri ve / veya mezotel hücrelerinin deneysel popülasyonlar arasındaki boşluk aktivite farklılıkları analiz etmek için ölçülebilir. Bu test yumurtalık kanseri hücreleri (koşul başına sfero X 20-30 sferoidler başına 100), hücrelerin sadece az sayıda gerektirir, bu yüzden değerli primer tümör hücre numuneleri kullanılarak bu deney yapmak mümkündür. Dahası, bu tahlilde kolayca yüksek verimli tarama teknikleri için adapte edilebilir.
Protokol
1. Yumurtalık Kanseri Hücre Sfero Oluşumu
- RFP-eksprese yumurtalık kanseri hücreleri% 10 baz ortamı (199 a ve MCDB105 ile 50:50 karışım,% 10 inaktive edilmiş fetal bovin serumu ile% 1 kalem Strep içeren bir özel hücre kültür ortamı) içinde kültürlenmiştir. Etiketsiz over kanseri hücrelerinde RFP ifade etmek için, bir plazmid içeren TTT ile hücreleri transfekte ve TÇD ifade hücreleri seçin. Alternatif olarak, viral vektörler geçici olarak floresan proteinleri ifade etmek için kullanılabilir, ya da hücre kırmızı bir floresan hücre izleyici boya (Invitrogen) ile ön-inkübe olabilir.
- Önceden yumurtalık kanseri sferoidler oluşturulması için, bir düşük yapışma 96 yuvarlak dipli bir kültür tabaklarında hazırlamak için gereklidir. , Düşük yapışma kültür plakaları üretmek için 30μl poli-HEMA çözeltisi (1 ml% 95 EtOH içerisinde 6 mg polyhydroxyethylmethacrylate), bir 96 Corning hücre kültürü çanağı, her oyuğa ilave edilir. 96 kuyucuğu ° C olmayan nemli inkübatör etanol, l buharlaştırmak için kullanılan bir 37 inkübe edilirher bir kuyunun üzerine poli-HEMA bir film eaving. Bu poli-HEMA filmi hücreleri süspansiyon 18 büyümeye zorluyor, kuyunun dibinde takılarak gelen hücreleri engeller. [Alternatif olarak, ultra-düşük Eklenti kültür plakları (Corning) poli-HEMA kaplı yemekler yerine kullanılabilir.]
- Düşük yapışma kültür plakaları hazırlandıktan sonra, yumurtalık kanseri hücreleri, pelet 3 dakika boyunca 900 RCF az bir masa üstü santrifüj (Heraeus) hücreleri, süpernatan aspire ve% 10 baz ortamı içinde tekrar askıya bir bord trypsinize.
- Bir hemasitometre kullanarak hücreleri hesaplama.
- Taban 10% Medium 50μl başına 100 hücreleri olduğu gibi hücrelerin konsantrasyonuna ayarlayın.
- 96 poli-HEMA kaplı kültür kaplarına her kuyuya eşit şekilde süspanse seyreltilmiş hücre süspansiyonu 50μl ekleyin.
- 16 saat boyunca 37 ° C'de hücre kültürü inkübatöründe (zaman bu miktar için gereken zaman miktarına bağlı olarak artan ya da azaltılması gerekir içinde 96 kuyulu plakanın inkübeher bir yanı içerisinde tek bir hücreli steoid oluşturan birbirine kümeye yumurtalık kanseri hücrelerinin izin vermek için çok hücreli sferoidler ya da arzu edilen deneysel koşullar) oluşturmak üzere, belirli bir hücre dizisi. Bazı tümör hücreleri bu dönemde apoptoza, bu nedenle önceden apoptozis indüksiyonu için bir zamanı seçmek önemlidir.
2. Mezotelyal Hücre Monolayer Oluşumu
- Bir hücre kültür davlumbaz, ön-kat çanağı, her sıra için bir 5μg fibronektin / ml PBS çözeltisi 2mL ekleyerek ve 30 dakika boyunca oda sıcaklığında kuluçkaya fibronektin sahip bir 6-alt yanı cam tabağın MatTek Corp kuyuları. MatTek Corp yemekler cam altları ve optik kalitesi yüksek çözünürlüklü mikroskopik görüntüleme için izin verir.
- GFP-salgılayan hücrelerin mezotel% 10 baz ortamı içerisinde kültüre edilir. Mezotel hücrelerinin bir tabak Trypsinize, 3 dakika için 900 RPM bir masaüstü santrifüj (Heraeus) aşağı spin süpernatan aspire, ve% 10 Base Orta yeniden askıya.Burada kullanılan mezotel hücreler elde edildi sırasında önceden GFP ifade edilmiştir, ancak etiketsiz mezotel hücreleri cDNA içeren bir plazmid GFP ile transfekte etmek ya da bir yeşil flöresanlı hücre izleyici boya (Invitrogen) içinde hücreleri preincubating tarafından üretilebilir.
- 30 dakikalık fibronektin inkübasyon (adım 2.1) sonra, 2 mL PBS ile MatTek Corp çanak kuyuları yıkayın.
- 6 sıra MatTek Corp çanak her iyi yanı başına PBS ve plaka 6 x10 5 mezotel hücre aspire. Mezotel hücre çanak takmak ve bir tek tabaka oluşturacak şekilde izin vermek için bir gecede 37 ° C hücre kültürü inkübatörde MatTek Corp çanak inkübe edin.
3. Mezotelyal Hücre Gümrükleme Testi
- 96 poli-HEMA kaplı plaka yumurtalık kanseri sferoidler toplamak için bir pipet kullanın.
- Bir mezotel hücre monolayer içeren 6 sıra MatTek Corp çanak iyi birinden orta aspire. 2mL PBS ile bir kez yıkayın. 96 p gelen parçacıklarının bütün ekleMatTek Corp çanak (yansıma edilemez çanak parçası üzerinde sferoidler iniş hesaba yansıması olacak parçacıklarının ~ 3x sayısı) iyi birine geç.
- En az 8 saat boyunca zaman atlamalı görüntüleme yapabilen bir ters Geniş açılı, floresan mikroskop sahnede MatTek Corp tabak yerleştirin. Tek bir deneyde, birden sfero ardalanması olaylar, çanak görüntü birden fazla pozisyon için motorlu bir sahne kullanın. Biz entegre Mükemmel odak sistemi ve düşük [20x-0.75 Sayısal açıklık (NA)] büyütme / NA diferansiyel müdahale kontrast (DIC) optik ile Nikon Ti-E Ters Motorlu Geniş açılı, Floresans time-lapse mikroskop kullanımı, 0.52 NA olan Nikon halojen transilluminator'de uzun çalışma mesafesi (LWD) kondenser, Nikon hızlı (<100 milisaniye anahtarlama zamanı) uyarılma ve emisyon filtreleri (GFP Ex 480/40, EM 525/50, TÇ-mCherry Ex 575/50 Em 640/50), Sutter hızlı bulaşan ve Epifloresans ışık yolu Akıllı Shutmektuplar, Nikon lineer kodlu motorlu sahne, bir Hamamatsu ORCA-AG şarj bağlı cihaz (CCD) kamera, sıcaklık ve CO 2 kontrolü ile özel-yerleşik mikroskop inkübasyon odası, Nikon NIS-Elements AR yazılım sürümü 3 adet soğutmalı ve TMC titreşim izolasyonu tablo.
- Yumurtalık kanseri hücre sferoidler yemeğin dibe ve mezotel hücre monolayer eklenecektir. 8 saat GFP, RFP ve 20 faz görüntüleri + sfero / monolayer etkileşimleri, her 10 dakikada, toplayın.
- TTT-ifade yumurtalık kanseri hücresi sferoidler tek tabakalı bir delik oluştururken GFP-ifade mezotel hücre tek tabaka halinde istila edecek. 8 saat sonra, Elements yazılımı (ya da örneğin, resim J gibi başka uygun bir yazılım) kullanılarak GFP resimlerde karadeliklerin izleme tarafından deliklerin boyutları ölçülür. Sıfır anındaki ilgili RFP görüntüde sfero büyüklüğü ile 8 saat delik boyutu bölerek ilk sfero boyutu delik boyutu Normale. Bu exbol, delik büyüklüğü sadece bir kez ölçüldü, ancak daha iyi ardalanması dinamiklerini anlamak için sekiz saatlik deney boyunca birden çok kez ölçülebilir.
4. Temsilcisi Sonuçlar
Bu örnekte, OVCA433 sferoidler kontrol etmek Talin-1 zayıflatılmış ifade var OVCA433 yumurtalık kanseri hücre parçacıklarının mezotel klirensi yeteneği karşılaştırıldı. Her bir gruptan OVCA433 sferoidler ZT mezotel hücre mono tabakaları içeren bir MatTek Corp çanağı ilave edildi. Her gruptan Altı sferoidler sekiz saat boyunca her 10 dakikada bir (Şekil 4, Movie 3, Movie 4) görüntülendi. Yayılma sferoidler tarafından üretilen tek tabakalı delikler ölçüldü ve her gruptan altı pozisyonları ortalaması alınmıştır. Talin 1 Knockdown sferoidler tarafından yaratılan ortalama açıklık kontrolü sferoidler tarafından yaratılan ortalama alan çok daha küçük olduğu Şekil 4, Talin O tarafından mezotel izni için gerekli olduğunu düşündürmektedirVCA433 yumurtalık kanseri sferoidler.
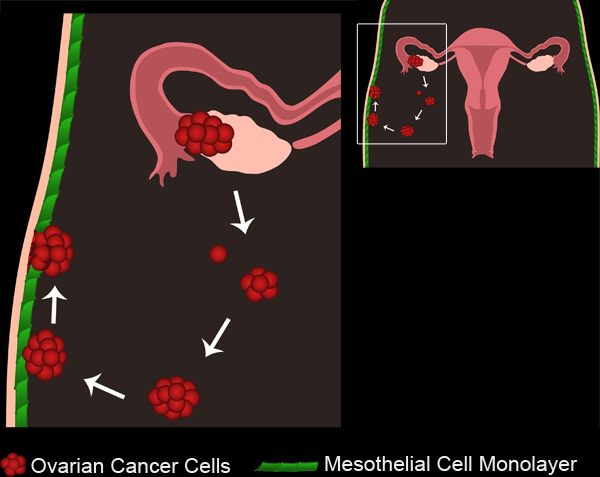
Şekil 1. Yumurtalık Kanseri Metastaz. Primer over tümörleri over yüzey epiteli veya fallop tüplerinden birini geliştirmek. Tümör hücreleri / kümeler primer tümörden kopar ve periton boşluğuna toplamak. Tümör hücreleri daha sonra çok hücreli sferoidler oluşturmak için toplamak olabilir. Spheroidlerinde periton boşluğuna döşeyen mezotel hücre mono tabakaları iliştirin. Mezotel hücre sferoidler alttaki bazal membran erişmek için izin ekli yumurtalık kanseri sfero altından dışındadır.
Film 1. Yumurtalık Kanseri Metastaz. filmi görmek için buraya tıklayın .
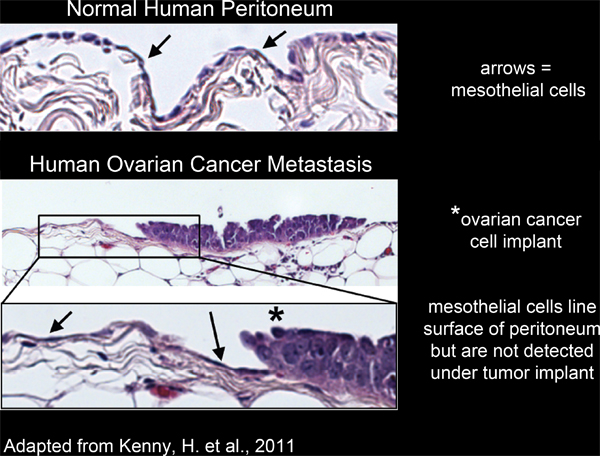
Şekil 2. Mezotelyal hücrelerin satır insan periton dokusunun yüzey ve yumurtalık kanseri hücre implantları altından dışındadır.
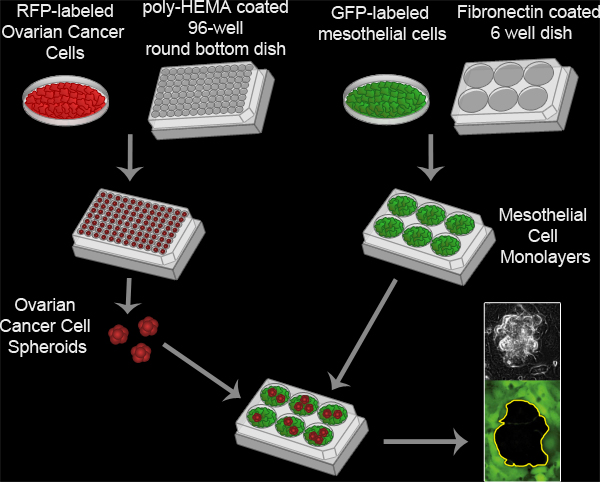
Şekil 3. Mezotelyal Boşluk Assay. Yumurtalık kanseri sferoidler 100 kuluçkaya tarafından oluşturulan RFP-eksprese 16 saat boyunca 37 ° C'de, bir poli-HEMA kaplanmış 96 tabanı yuvarlak bir kültür tabağına oyuk başına yumurtalık kanseri hücrelerinin. Poli-HEMA hücreleri süspansiyon kalır ve başı da tek bir küme oluşturacak şekilde birbirine yapışması sağlayan kültür kaplarına takılarak gelen hücreleri engeller. Mezotel hücre mono tabakaları bir fibronektin kaplı 6 sıra MatTek Corp tabağına oyuk başına 6x10 5 mezotel hücreleri kaplama ve 16 saat süreyle 37 ° C de kuluçkaya levha hazırlanır. Spheroidlerinde mezotel tek tabaka ile MatTek Corp kaba aktarılır ve iki tip hücre topluluğu bir Nikon Ti-E kullanıyorum 8 saat boyunca her 10 dakikada bir yansıması olannverted Motorlu Geniş açılı, Floresans time-lapse mikroskop ve Elements yazılımı.
Film 2. Mezotelyal Gümrükleme Assay. filmi görmek için buraya tıklayın .
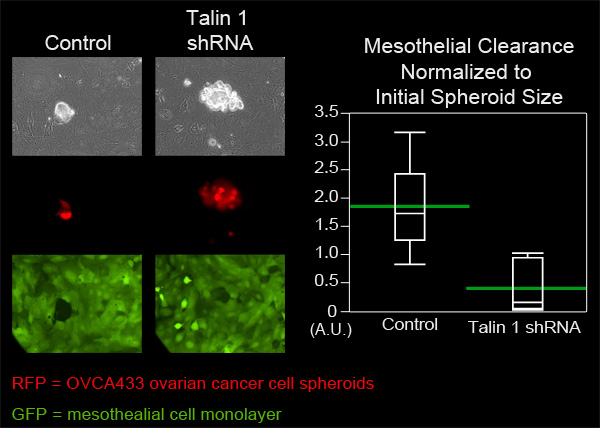
OVCA433 sferoidler yılında Talin 1 ifade Şekil 4. Zayıflama mezotel klirensi yeteneğini azaltır. Ve Talin 1 zayıflatılmış ifadesi olmadan OVCA433 sferoidler (kırmızı) için ve her bir ZT mezotel tek tabakalı (yeşil) içine işgal için izin verildi. İki hücre popülasyonlarının bir Nikon Ti-E Ters Motorlu Geniş açılı, Floresans time-lapse mikroskop ve elemanları yazılımı kullanarak 8 saat boyunca her 10 dakika görüntülendi. Grafiği, Talin 1 zayıflama gösterirönemli mezotel hücresi klirens (anlama geldiğine yeşil çubuklar ile Dilim arsa) azalır.
Film 3. Kontrol bir mezotel tek tabakalı (yeşil) içine işgalci OVCA433 sferoidler (kırmızı). filmi görmek için buraya tıklayın .
OVCA433 sferoidler yılında Talin 1 ekspresyonu (kırmızı) Film 4. Zayıflama (yeşil) temizleme yeteneği mezotel azalır. filmi görmek için buraya tıklayın .
Tartışmalar
Burada sunulan "Mezotelyal Gümrükleme Assay" büyük mekansal ve zamansal ayrıntılı olarak, yumurtalık kanseri çok hücreli sferoidler ve mezotel hücre tek katmanlarının etkileşimleri izlemek için time-lapse mikroskop kullanır. Daha önce, 8-14 çeşitli gruplar olduğu yumurtalık kanseri hücrelerine tutunur ve mezotel hücre mono tabakaları içine işgal göstermek için son nokta deneyleri kullandı. Bu tahlil benzersiz olduğunu da bu iki hücre popülasyonlarının dinamiklerini ...
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Biz Harvard Tıp Okulu'nda Nikon Görüntüleme Merkezi, özellikle Jennifer Waters, Lara Petrak ve Wendy Somon, eğitim ve timelapse mikroskopların kullanımı teşekkür etmek istiyorum. Biz de değerli tartışmalar için Rosa Ng ve Achim Besser teşekkür etmek istiyorum. Bu çalışma NIH hibe 5695837 (M. Iwanicki) ve JSB için GM064346 tarafından desteklenmiştir; Dr Miriam ve Sheldon Adelson G. Tıbbi Araştırma Vakfı (JSB için) bir hibe ile.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif | Şirket | Katalog Numarası | Yorumlar |
| OVCA433 Yumurtalık Kanseri Hücreleri | Dr Dennis Slamon gelen Hediye | ||
| Mezotelyal Hücreler ZT | Dr Tan dan Hediye Ince | ||
| Orta 199 | Gibco | 19950 | |
| MCDB105 | Hücre Uygulamaları A.Ş. | 117-500 | |
| FBS-ısı inaktive | Gibco | 10082 | |
| Kalem-Strep | Gibco | 15070 | |
| 96 oyuklu plakalar | Corning Costar | 3799 | |
| Polyhydroxyethylmethacrylate (poli-HEMA) | Sigma Aldrich | 192.066-25G | Poli-HEMA çözümü için% 95 EtOH 1ml içinde 6 mg poli-HEMA tozun |
| EtOH | Pharmco-aaper | 111ACS200 | DH 2 0% 95'e sulandırınız |
| Hücre kültürü kaput | Nuaire | NU-425-300 | |
| Doku kültürü inkübatör | Thermo Scientific | 3110 | |
| poli-HEMA plakaları için inkübatör | Labline Aletleri | Imperial III 305 | |
| Masaüstü santrifüj | Heraeus | 75003429/01 | |
| 6 sıra cam-alt tabak | MatTek Corp corp. | P06G-1,5-20-F | |
| Fibronektin | Sigma | F1141-1MG | |
| PBS | Cellgro | 21-040-CV | |
| Timelapse Mikroskop: | |||
| Mikroskop | Nikon | Entegre Mükemmel odak sistemi ile Ti-E Ters Motorlu Floresans time-lapse mikroskop | |
| Lens | Nikon | 20X-0.75 sayısal Aperture | |
| Halojen transilluminator'de | Nikon | 0.52 NA uzun çalışma mesafesi kondenser | |
| Uyarma ve emisyon filtreleri | Nikon konut Chroma tek geçiş filtreleri | GFP Ex 480/40, Em 525/50 TÇ-mCherry Ex 575/50 Em 640/50 | |
| Bulaşan ve ışık yolu Epifluoresce | Sutter | Akıllı Kepenkler | |
| Doğrusal kodlanmış motorlu sahne | Nikon | ||
| Soğutmalı şarj çiftli aygıt kamera | Hamamatsu | ORCA-AG | |
| Sıcaklık ve CO 2 kontrolü ile Mikroskop inkübasyon odası | isteğe göre yapılmış | ||
| Titreşim izolasyonu tablosu | TMC | ||
| NIS-Elements yazılımı | Nikon | Sürüm 3 |
Referanslar
- Jemal, A. . CA Cancer J. Clin. 59, 225-249 (2009).
- Ries, L. G., Melbert, D., Krapcho, M., Stinchcomb, D. G., Howlader, N., Horner, M. J., Mariotto, A., Miller, B. A. . SEER Cancer Statistics Review, 1975-2005. , (2007).
- Burleson, K. M. Ovarian carcinoma ascites spheroids adhere to extracellular matrix components and mesothelial cell monolayers. Gynecol. Oncol. 93, 170-181 (2004).
- Birbeck, M. S., Wheatley, D. N. An Electron Microscopic Study of the Invasion of Ascites Tumor Cells into the Abdominal Wall. Cancer Res. 25, 490-497 (1965).
- Witz, C. A., Monotoya-Rodriguez, I. A., Schenken, R. S. Whole explants of peritoneum and endometrium: a novel model of the early endometriosis lesion. Fertil. Steril. 71, 56-60 (1999).
- Zhang, X. Y. Characteristics and growth patterns of human peritoneal mesothelial cells: comparison between advanced epithelial ovarian cancer and non-ovarian cancer sources. J. Soc. Gynecol. Investig. 6, 333-340 (1999).
- Kenny, H. A., Nieman, K. M., Mitra, A. K., Lengyel, E. The First Line of Intra-abdominal Metastatic Attack: Breaching the Mesothelial Cell Layer. Cancer Discovery. 1, 100-102 (2011).
- Niedbala, M. J., Crickard, K., Bernacki, R. J. Interactions of human ovarian tumor cells with human mesothelial cells grown on extracellular matrix. An in vitro model system for studying tumor cell adhesion and invasion. Exp. Cell. Res. 160, 499-513 (1985).
- Kenny, H. A., Krausz, T., Yamada, S. D., Lengyel, E. Use of a novel 3D culture model to elucidate the role of mesothelial cells, fibroblasts and extra-cellular matrices on adhesion and invasion of ovarian cancer cells to the omentum. Int. J. Cancer. 121, 1463-1472 (2007).
- Ksiazek, K. Senescent peritoneal mesothelial cells promote ovarian cancer cell adhesion: the role of oxidative stress-induced fibronectin. Am. J. Pathol. 174, 1230-1240 (2009).
- Burleson, K. M., Boente, M. P., Pambuccian, S. E., Skubitz, A. P. Disaggregation and invasion of ovarian carcinoma ascites spheroids. J. Transl. Med. 4, 6-6 (2006).
- Heyman, L. Vitronectin and its receptors partly mediate adhesion of ovarian cancer cells to peritoneal mesothelium in vitro. Tumour. Biol. 29, 231-244 (2008).
- Heyman, L. Mesothelial vitronectin stimulates migration of ovarian cancer cells. Cell. Biol. Int. 34, 493-502 .
- Lessan, K., Aguiar, D. J., Oegema, T., Siebenson, L., Skubitz, A. P. CD44 and beta1 integrin mediate ovarian carcinoma cell adhesion to peritoneal mesothelial cells. Am. J. Pathol. 154, 1525-1537 (1999).
- Leroy-Dudal, J., Heyman, L., Gauduchon, P., Carreiras, F. Adhesion of human ovarian adenocarcinoma IGROV1 cells to endothelial cells is partly mediated by the alphav integrins-vitronectin adhesive system and induces an alteration of endothelial integrity. Cell. Biol. Int. 29, 482-488 (2005).
- Leroy-Dudal, J. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves alphav integrins and the participation of MMP2. Int. J. Cancer. 114, 531-543 (2005).
- Iwanicki, M. Ovarian cancer spheroids use myosin-generated force to clear the mesothelium. Cancer Discovery. 1, 144-157 (2011).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Gregoire, L., Munkarah, A., Rabah, R., Morris, R. T., Lancaster, W. D. Organotypic culture of human ovarian surface epithelial cells: a potential model for ovarian carcinogenesis. In Vitro Cell Dev. Biol. Anim. 34, 636-639 (1998).
- Roberts, P. C. Sequential molecular and cellular events during neoplastic progression: a mouse syngeneic ovarian cancer model. Neoplasia. 7, 944-956 (2005).
- Okada, T., Okuno, H., Mitsui, Y. A novel in vitro assay system for transendothelial tumor cell invasion: significance of E-selectin and alpha 3 integrin in the transendothelial invasion by HT1080 fibrosarcoma cells. Clin. Exp. Metastasis. 12, 305-314 (1994).
- Zervantonakis, I. K., Kothapalli, C. R., Chung, S., Sudo, R., Kamm, R. D. Microfluidic devices for studying heterotypic cell-cell interactions and tissue specimen cultures under controlled microenvironments. Biomicrofluidics. 5, 13406-1310 (2011).
- Brandt, B. 3D-extravasation model -- selection of highly motile and metastatic cancer cells. Semin. Cancer Biol. 15, 387-395 (2005).
- Condeelis, J., Segall, J. E. Intravital imaging of cell movement in tumours. Nat. Rev. Cancer. 3, 921-930 (2003).
- Dai, J., Ting-Beall, H. P., Hochmuth, R. M., Sheetz, M. P., Titus, M. A. Myosin I contributes to the generation of resting cortical tension. Biophys. J. 77, 1168-1176 (1999).
- Laferriere, J., Houle, F., Taher, M. M., Valerie, K., Huot, J. Transendothelial migration of colon carcinoma cells requires expression of E-selectin by endothelial cells and activation of stress-activated protein kinase-2 (SAPK2/p38) in the tumor cells. J. Biol. Chem. 276, 33762-33772 (2001).
- Dong, C., Slattery, M. J., Rank, B. M., You, J. In vitro characterization and micromechanics of tumor cell chemotactic protrusion, locomotion, and extravasation. Ann. Biomed. Eng. 30, 344-355 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır