Method Article
La personalización de Aspergillus niger Morfología través de la adición de talco micro partículas
En este artículo
Resumen
Un método para generar con precisión y para caracterizar exhaustivamente la morfología de hongos filamentosos Aspergillus niger Se describe, que permite la correlación matemática de aspecto morfológico y la productividad.
Resumen
El hongo filamentoso A. niger es una cepa muy utilizado en una amplia gama de procesos industriales de alimentos para la industria farmacéutica. Una de las características más intrigantes ya veces incontrolable, de este organismo filamentoso es su morfología compleja. Se extiende desde densos gránulos esféricos a viscoso micelio (Figura 1). Varios parámetros de proceso y los ingredientes se sabe que influyen en la morfología de hongos 1. Desde una óptima productividad se correlaciona fuertemente con una forma morfológica específica, la morfología de hongos a menudo representa un cuello de botella de la productividad en la producción industrial.
Un enfoque sencillo y elegante para controlar con precisión la forma morfológica es la adición de partículas inorgánicas insolubles micro (como silicato de magnesio hidratado, óxido de aluminio u óxido de titanio silicato) al medio de cultivo que contribuye a la producción de enzimas aumentó 2-6. Dado que no hay una obvcorrelación entre pagarés morfología de las partículas de micro dependiente y la producción de enzimas que es deseable para vincular matemáticamente la productividad y la apariencia morfológica. Por lo tanto una descripción morfológica cuantitativa precisa e integral está dirigido.
Por lo tanto, se presenta un método para generar y caracterizar micro partículas morfológicas estructuras dependientes y correlacionar la morfología de hongos con la productividad (Figura 1), que posiblemente contribuye a una mejor comprensión de la morfogénesis de microorganismos filamentosos.
La cepa recombinante A. niger SKAn1015 se cultiva durante 72 horas en una L 3 biorreactor de tanque agitado. Mediante la adición de talco micro partículas en concentraciones de 1 g / l, 3 g / L y 10 g / l antes de la inoculación de una variedad de estructuras morfológicas se reproducible generado. Muestras estériles se toman después de 24 horas, 48 y 72 para la determinación del progreso del crecimiento y la actividad de la enzima producida. Laproducto formado es la enzima de alto valor β-fructofuranosidasa, un biocatalizador importante para el neo-azúcar formación en los alimentos o la industria farmacéutica, que cataliza la reacción entre otros de la sacarosa en glucosa 7-9. Por lo tanto, la cuantificación de glucosa después de la adición de sacarosa implica la cantidad de β-fructofuranosidasa producida. Cuantificación de glucosa se realiza por un DIOS / POD Ensayo-10, que está modificado para análisis de alto rendimiento en placas de titulación de 96 pocillos de micro.
Morfología hongos después de 72 horas se examinaron al microscopio y se caracteriza por análisis de imagen digital. De este modo, los factores de forma de la partícula de la morfología de hongos, como la macro diámetro de Feret, el área proyectada, el perímetro, la circularidad, la relación de aspecto, solidez und redondez se calculan con la fuente abierta de procesamiento de imágenes ImageJ programa. Los parámetros relevantes se combinaron para un número adimensional Morfología (Mn) 11, que permite una caracterización completa demorfología de hongos. La estrecha relación del número de morfología y de la productividad se destacan por regresión matemática.
Protocolo
1. Reactor de instalación e inicio del cultivo
4 cultivos de biorreactores en total se llevan a cabo.
- Utilizar un 3 L agitó biorreactor tanque con un volumen de trabajo de 2,2 L para el cultivo de A. niger SKAn1015.
- Vierta 72,6 g de glucosa monohidrato en el reactor y llenarla con agua desionizada 1,9 L.
- Efectuar la instalación del reactor tales como 3 deflectores, un dos seis palas rodete de la turbina de disco, un electrodo de pH, una entrada de gas con filtro de aire, un dedo de enfriamiento, un enfriador de aire de escape con filtro de aire, un tubo de inmersión para el muestreo estéril con filtro de aire y las mangueras de entrada para el medio, el inóculo, el ácido y la base.
- Autoclave el reactor a 121 ° C durante 20 min.
- Conectar el reactor con el depósito de ácido-base (2 M HCl, 2 M de NaOH) y las bombas correspondientes y establecer un valor de pH de 5,0 ± 0,05 con la unidad de control del pH.
- Enlace del reactor con el sistema de refrigeración de agua y poner la camisa de calentamientoalrededor de la vasija del reactor.
- Instale el sensor de temperatura con la unidad de control correspondiente y establecer una temperatura de 37 ± 0,1 ° C en la unidad de control de la temperatura.
- Montar el motor de agitación encima del reactor y ponerla en servicio con una velocidad de agitación de 200 min -1.
- Añadir la estéril medio mínimo crecimiento 11 por una de las mangueras de entrada estériles (250 ml). Para la preparación de todos los componentes medio se trataron en autoclave a 121 ° C durante 20 min y se mezclan juntos. Por tres cultivos los componentes incluyen talco en polvo (3MgO • 4SiO 2 • H 2 O) en las concentraciones de 1 g / l (reactor 2), 3 g / L (reactor 3) y 10 g / l (reactor 4). Antes de usar, volver a suspender las partículas de micro en 50 mM de tampón de acetato sódico (pH 6,5) y añadirlo al medio estéril. En los cultivos de control (sin partículas) reemplazar la suspensión de partículas de micro por 50 mM de tampón de acetato sódico (pH 6,5).
- Añadir la suspensión de esporas (inóculo) uns preparado en Wucherpfenning et. otros (2011) 11 por una de las mangueras de entrada estériles (50 ml) de modo que la concentración de esporas cantidades a 1x10 6 ml -1. La inoculación marca el inicio del cultivo (h = 0 h).
- Iniciar la aireación con una tasa de 1,0 L min -1.
2. El muestreo estériles después de 24, 48 y 72 h de cultivo
- Tomar 50 ml de caldo de cultivo estéril en un tubo de frasco.
- El uso de la muestra para la determinación del peso seco de biomasa, la actividad β-fructofuranosidasa y el análisis microscópico.
3. Determinación del peso seco de biomasa después de 24, 48 y 72 h de cultivo
- Las muestras de biomasa deben ser tomadas al menos por duplicado.
- Peso un filtro de celulosa con una balanza micro después del secado en un desecador y colocar el filtro en un embudo Büchner con bomba conectada al vacío por chorro de agua.
- Filtrar un volumen de muestra definida (por ejemplo 10 ml) unaND enjuagar el filtro con 10 ml de agua desionizada para eliminar compuestos medio de la biomasa.
- Arruga el filtro una vez en el centro, colocarlo en una placa de Petri de vidrio y lo puso en un secador de compartimiento hasta constancia de peso (por lo menos 24 horas).
- Enfriar el filtro en un desecador y medir el peso.
- Calcular el peso de la biomasa seca como la diferencia entre el peso del filtro con y sin biomasa seca dividido por el volumen de la muestra utilizada.
4. Determinación de la actividad enzimática extracelular de la β-fructofuranosidasa por DIOS / POD-ensayo después de 24, 48 y 72 h de cultivo
Almacene las muestras en hielo constantemente mientras se trabaja con ellos.
- Filtrar 1,5 ml de cultivo suspensión través de un filtro de acetato de celulosa pulsando el cultivo en suspensión con una jeringa a través del filtro en un tubo de reacción. Almacenar el tubo de reacción a -20 ° C hasta su uso.
- Para la mezcla de reacción utiliza 20l muestra y añadir 200 l de sacarosa 1,65 M disuelto en tampón fosfato 0,05 M (pH 5,4) para iniciar la reacción de la sacarosa en glucosa. Cary a cabo la reacción al menos por duplicado.
- Incubar la mezcla de reacción a 40 ° C durante 20 min en un bloque de calentamiento. Se detiene la reacción mediante la incubación a 95 ° C durante 10 min en un bloque de calentamiento. Se enfría la mezcla de reacción mediante el almacenamiento en hielo y centrifugar el agua condensada por centrifugación a 13,000 g durante 10 min a 4 ° C.
- Para tener en cuenta el pH y la división dependiente de la temperatura de la sacarosa en glucosa, llevar a cabo un valor en blanco mediante el uso de agua de 20 l desionizada en lugar de 20 l de la muestra.
- Para dar cuenta de glucosa residual en el caldo de cultivo, llevar a cabo un control negativo para cada muestra. Para que el uso final 20 l de la muestra e inactivar β-fructofuranosidasa por calentamiento a 95 ° C durante 10 min antes de añadir la sacarosa y se incuba como se describe en el paso 4,3.
- Diluir las muestras de tal manera que las medi siguientesured adsorción está en el intervalo valor calibrado.
- Llevar a cabo todos los ensayos enzimáticos, por triplicado. Aplicar 2 muestra diluida l en una placa micro título así. Aplicar una gama estándar para la calibración en la placa de micro titulación por cada uno usando 2 l de diez soluciones de glucosa con diez concentraciones conocer diferentes (de 1 mM a 15 mM) en lugar de 2 l de la muestra. Para la calibración del cero punto dos utilizan el agua desionizada l en lugar de 2 l de la muestra.
- Añadir 200 l de la solución del reactivo a cada pocillo utilizando una pipeta multicanal.
- Incubar la mezcla durante 10 min a temperatura ambiente.
- Guarde la placa de titulación de micro a 6 ° C hasta que la medición (un par de horas a lo sumo).
- Medir la absorción a 450 nm utilizando un 96-así Amanecer lector de placas de micro y el software Magallanes recuperación de datos. Establecer el tiempo de mezcla hasta 5 seg. y el resto hasta el 1 seg.
- Abra la tabla de resultados con una hoja de cálculo y la construcción de una línea de calibración mediante el uso de la gama estándar:
glucose = concentración de absorción de una X + b - Calcular la actividad:
= actividad (absorción X factor de dilución-valor en blanco) a + b X - Calcular la actividad β-fructofuranosidasa mediante el cálculo de la diferencia entre las actividades de la muestra y el control negativo apropiado.
- Calcular la productividad específica para el uso siguiente, teniendo en cuenta el peso de biomasa seca y β-fructofuranosidasa de actividad de 11.
5. Microscopía y análisis automatizado de imágenes a las 72 h de cultivo
- Lugar en torno a 3 ml de suspensión de cultivo en una placa Petri de plástico ydiluir con solución fisiológica de cloruro sódico hasta que las estructuras morfológicas se separan.
- Situar la placa de Petri con un microscopio, que cuenta con una cámara integrada o conectada. Adquirir y guardar aproximadamente 100 imágenes (Figura 2) de las estructuras morfológicas por muestra. Preste atención a que en cada imagen por lo menos un objeto está completamente representado.
- Abra todas las imágenes de la misma muestra con el programa de procesamiento de imágenes ImageJ 12. Convierte las imágenes en blanco y negro mediante el uso de la herramienta de proceso de "Make binario" (Figura 2). Para aplicar el comando de toda la serie de imágenes utilizar un código de macro de la siguiente manera.
ejecutar (,, Hacer Binario ")
- Abra las imágenes binarias procesados con ImageJ nuevo. Calcular el diámetro de la forma de factores de Feret, la proyección del área, perímetro, circularidad, la relación de aspecto, solidez redondez und para cada imagen con el "Juego de Medición" herramienta de análisis. Para la aplicación de la orden de un serioES de imágenes utilizar un código de macro de la siguiente manera.
ejecutar ("8 bits");
ejecutar ("Make Binario");
ejecutar ("Escala de Ajuste ...", "distancia = X = 1000 píxeles conocidos = 1 unidad = m mundial");
ejecutar ("Medidas Set ...", "Área de visualización de la forma del perímetro de Feret límite reorientar = Ninguno decimal = 3");
ejecutar ("analizar partículas ...", "size = 10000-Infinity circularidad = 0.00-1.00 = mostrar contornos de pantalla");
Determinar X como el número de píxeles que se correlaciona con 1000 m mediante la construcción de una línea recta a través de una barra de escala. Correlacionar el número de pixels de la línea recta con la longitud de la barra de escala en micras. - Abra la tabla de resultado que contiene los valores para cada factor de forma de la imagen con una hoja de cálculo. Calcular el número de Morfología de la siguiente manera para cada imagen.
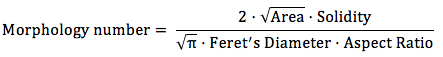
- Calcular el valor medio y la desviación estándar para el número de Morfología, teniendo en cuenta todas las imágenes de una muestra.
- Utilice un programa de gráficos y análisis de datos para la correlación gráfica del número de Morfología de la productividad específica y determinar la relación matemática de la regresión matemática.
6. Los resultados representativos
Mediante la adición de talco micro partículas A. niger SKAN 1015 se cambia la morfología de una verdadera morfología precipitado a una morfología dispersa o incluso micelial. Considerando que la morfología de pellets se exhibe en condiciones normales una morfología micelial se crea por la suplementación del medio con 10 g / L de talco micro partículas (Figura 4.). Al mismo tiempo la actividad de β-fructofuranosidasa aumenta alrededor de 3 veces 3-5. Un suplemento de 1 o 3 g / l de polvo de talco conduce a una morfología dispersa, con una actividad fructofuranosidasa duplicado (Figura 4.).
La morfología de las partículas depende de micro puede ser descrita con detalle por el Morfología número que puede ser calculada utilizando parámetros determinados por análisis de imágenes automático. Bolitas redondas y lisas que en las imágenes microscópicas aparecen como círculos perfectos. Para tales partículas en el número de Morfología tiene un valor de 1. El fragmento más pequeño de la morfología del micelio se puede simplificar como una línea unidimensional obteniéndose un número de 0 Morfología. Todas las formas morfológicas intermedias, como pastillas alargadas irregulares o grupos por lo tanto, tienen valores entre 0 y 1. Bastante partículas grandes se traducirá en partículas a altas, fúngicas con una gran superficie o partículas alargadas, en un número bastante bajo Morfología 11.
En condiciones normales la morfología en el reactor 1 muestra una serie Morfología en torno a 0,8. La morfología en el reactor 4 con 10 g de polvo / L talco tiene un Mn alrededor de 0,1. El número de morfología reactores 2 y 3, con concentraciones de polvo de talco de 1 y 3 g / l, se encuentra entre estos dos extremos, lo que demuestra una dispersa morfología. Desde morfología de las partículas depende de micro está estrechamente relacionado con la productividad de β-fructofuranosidasa, una correlación matemática del número de Morfología y productividad similar a la Figura 5 se obtiene.
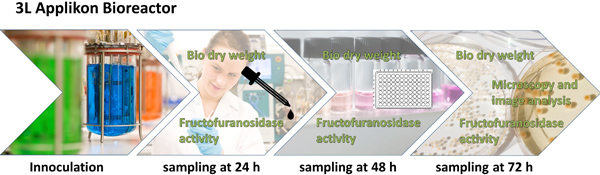
Figura 1. Esquema general del diseño experimental y el procedimiento analítico. A. niger se cultiva (con o sin micro partículas) en forma de L 3 biorreactor de tanque agitado durante 72 horas. Después de 24, 48 y 72 hectáreas muestra se toma para la determinación del peso de la biomasa seca y la actividad β-fructofuranosidasa, que de nuevo se utilizan para el cálculo de la productividad específica. Después de 48 h, la morfología de hongos es examinado por microscopio y se caracteriza por análisis de imagen digital. Los parámetros pertinentes de análisis de imagen se combinan para un número Morfología, que es matemático correlacionada con la productividad específica.

Figura 2. Pasos de procesamiento de imágenes microscópicas de las imágenes generadas por las estructuras morfológicas de A. niger. Paso 1: adquisición de imágenes por microscopio. Paso 2: mejora de la imagen si es necesario. Paso 3: binarización de la imagen, negro y negro (binario) de la imagen generada en ImageJ. Paso 4: la imagen binaria es procesada por objeto deseado y se borran. Paso 5: análisis morfológico se realizó con el "Análisis de partículas" en función de la fuente abierta del programa ImageJ.
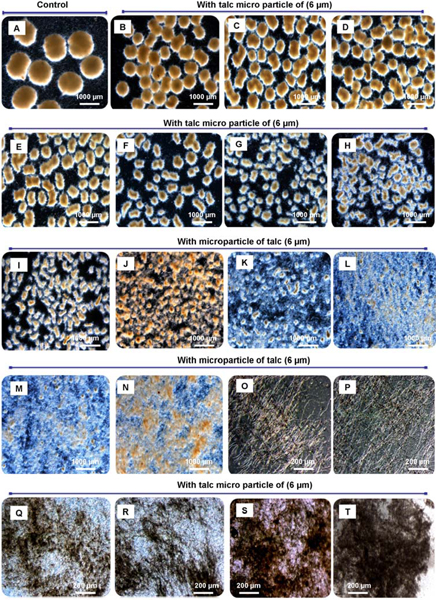
Figura 3. Diferentes formas morfológicas de A. dependiente de la concentración de agregado micro partículas niger. Con la creciente concentración de las partículas de micro agregó el tamaño de las pastillas puede ser, precisamente, disminuyó hasta pequeñas core-shell pellets, pequeñas bandadas y el micelio libremente, incluso dispersa. Morfología de ingeniería de ComoAspergillus niger SKAn1015 por la suplementación con micro partículas en cultivo sumergido. Sin micropartículas (A), 10 mg / l (B), 0,1 g / L (C), 0,2 g / L (D), 0,3 g / L (E), 0,6 g / L (F), 1,0 g / l (G), 1,5 g / L (H), 2,0 g / L (I), 2,5 g / L (J), 3,0 g / L (K), 3,5 g / L (L), 4,0 g / L (M ), 4,5 g / L (N), 5,0 g / L (S), 10 g / l (P), 15 g / l (Q), 20 g / l (R), 30 g / L (S) y 40-50 g / l (T). Las imágenes fueron tomadas por microscopía de luz después de 72 h de cultivo.
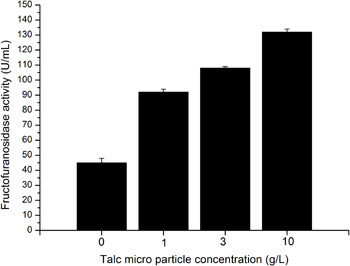
Figura 4. Actividad fructofuranosidasa en dependencia de talco micro partículas concentración de 1 g / l (reactor 2), 3 g / L (reactor 3) y 10 g / l (reactor 4). Reactor 1 no se complementa con micro partículas; aquí el cultivo se lleva a cabo bajo condiciones estándar.

Figura 5. Representante buena correlación (R2 = 0,91) de la morfologíanúmero y la productividad específica. El número Morfología se traza (abscisa) en contra de la productividad específica (ordenadas). Regresión no lineal se obtiene la correlación exponencial.
Discusión
La modificación de la morfología de hongos ha sido de interés en la biotecnología desde hace muchas décadas. Diversos estudios han tratado de variar los parámetros seleccionados del proceso tales como valor de pH, entrada de alimentación, temperatura, nutrientes medio o concentración de inóculo 1, pero sufren de control en lugar imprecisa e incompleta de la morfología, los altos costos de energía, los efectos de inhibición o la inestabilidad del producto, En contraste, la suplementación de micro partículas permite una ingeniería precisa de la morfología de hongos a través de afinado variación de tamaño de partícula y la concentración. Esto abre nuevas posibilidades de usar las partículas de micro para la optimización y de hecho a la medida del diseño de la morfología de alta producción en la producción biotecnológica con A. Níger y otros microorganismos filamentosos.
El análisis digital de imágenes es un método fácil para caracterizar la morfología reproducibles macro hongos. Sin embargo, la variedad de parámetros para características de tamaño, forma y superficieter de las estructuras morfológicas descritas en la literatura hace que la evaluación rápida de la morfología de hongos complicado. El número Morfología presenta como una combinación de parámetros relevantes, evita esta deficiencia y se puede utilizar no sólo para la caracterización integral de las estructuras morfológicas, sino también para la correlación directa con la productividad matemática. De nuevo, esto hace que una estimación de la productividad por la morfología dado y por lo tanto una personalización de la morfología de proceso necesita posible.
Utilizando el número de Morfología, es posible distinguir entre las diversas morfologías de las matas de pellets y 4,5. Para un mayor desarrollo del número de Morfología de la consideración de la dimensión fractal parece ser prometedor. Una dimensión fractal da una medida de la complejidad y la masa de relleno propiedades de un objeto 13 y por lo tanto predestinado para la caracterización integral de la morfología del micelio.
El creation de una alta morfología del micelio que produce, sin embargo, podría llevar a problemas con el rendimiento del proceso, especialmente en el cultivo a gran escala, debido a la forma de crecimiento del micelio se ha demostrado previamente para exhibir mucho mayores viscosidades caldo de cultivo 2. Esto conduce a problemas con la transferencia de calor y masa y la formación de zonas estancadas no mezclados, que requieren una potencia de entrada superior y hacer que el cultivo más caro de operar 1. Por lo tanto la relación entre la morfología de hongos y viscosidad caldo de cultivo debe ser considerado cuando se cambia la morfología y ser incorporado en otros modelos.
Divulgaciones
No tengo nada que revelar.
Agradecimientos
Los autores agradecen el apoyo financiero proporcionado por la Fundación Alemana de Investigación (DFG) a través del centro de investigación en colaboración SFB 578 "Del gen a la del producto" en la Universidad Técnica de Braunschweig, Alemania.
Materiales
Table of Equipment:
| Name | Company | Catalog Number | Comments |
| Equipment | Company | Catalogue Number/model | |
| autoclave | Systec | V150 | |
| Büchner funnel (plastic) | VWR | - | |
| cellulose filter (for biomass dry weight) | Sartorius Stedim Biotech | Filter Discs Grade 389 | |
| cellulose acetate filter (for air filtration at reactor) | Sartorius stedim biotech | Midisart 200 PTFE | |
| cellulose acetate filter (for enzyme activity) | Sartorius Stedim Biotech | Midisart NML | |
| centrifuge | Eppendorf | Centrifuge 5415R | |
| centrifuge | Heraeus | Biofuge fresco | |
| centrifuge | Heraeus sepatech | Varifuge 3.0R | |
| compartment dryer (105 °C) | Heraeus | Kelvitran t | |
| control unit (temperature) | Jumo | Jumo iTron 08 | |
| control unit (pH-value) | meredos | pH Control 2 | |
| desiccator | Duran | Vacuum stable | |
| Falcon tubes | Omnilab | FALC352070 | |
| heating block 40 °C | Biometra | TB1 Thermoblock | |
| heating block 95 °C | HLC | HBT 130 | |
| micro plate reader | Tecan | Sunrise-Microplate-Reader | |
| micro scales | Sartorius | CP 225 | |
| microscope (digital inverted) | AMG | EVOS xl | |
| micro pipettes and tips (different sizes) | Omnilab | 5283303 5283298 5283299 5283300 | |
| micro titer plate | Nunc | MaxiSorp | |
| multi pipette and tips | Eppendorf/ Omnilab | 5283611/ 5283611 | |
| pH-electrode | Schott | pH-Meter CG840 | |
| reaction tubes | Roth | E518.1 | |
| scale | Sartorius | CP 3202 S | |
| stirred tank bioreactor with equipment | Applikon Biotechnology | 2L Bioreactor set | |
| syringe | Eppendorf | Combitips Plus 5 mL |
Table of Reagents:
| Name of the reagent | Company |
| Acetic acid | Roth |
| Disodium hydrogen phosphate | Merck |
| Ethanol (95%) | Roth |
| Glucose monohydrate, (α-D-) | Roth |
| Glucose oxidase (Typ II from Aspergillus niger) | Sigma |
| Hydrochloride acid (37 % w/v) | Fiedel-de Haën |
| Hydrous magnesium silicate | Roth |
| Monopotassium phosphate | Merck |
| o-dianoisidine dihydrochloride | Sigma |
| Peroxidase (Typ II from horseradish) | Sigma |
| Sodium acetate | Roth |
| Sodium hydroxide | Merck |
| Sucrose, D-(+) | Fluka |
| Water (deionized) | - |
Table of Solutions and Medium Composition:
| Solution | Components | Amount |
| 50 mM sodium acetate buffer (pH 6.5) | Sodium acetate Bring to volume with deionized water Adjust at pH 6.5 with acetic acid | 4.1 g L-1 |
| 0.05 M monopotassium phosphate solution | Monopotassium phosphate Bring to volume with deionized water | 6.805 g L-1 |
| 0.05 M disodium hydrogen phosphate solution | Disodium hydrogen phosphate Bring to volume with deionized water | 7.1 g L-1 |
| 0.05 M phosphate buffer (pH 7.0) | 0.05 M disodium hydrogen phosphate solution Bring to volume with 0.05 M monopotassium phosphate solution | 61.2 mL |
| 0.05 M phosphate buffer (pH 5.4) | 0.05M disodium hydrogen phosphate solution Bring to volume with 0.05 M monopotassium phosphate solution | 3 mL |
| 1.65 M sucrose solution | D-(+)-sucrose Bring to volume with phosphate buffer (pH 5.4) | 564.8 g L-1 |
| reagent solution | o-Dianisidin-Dihydrochlorid Ethanol (95%) | 25 mg 10 mL |
| Glucose reagent solution | Glucose oxidase Peroxidase Phosphate buffer (pH 7.0) reagent solution | 10.5 mg 3 mg 90 mL 10 mL |
Referencias
- Wucherpfennig, T., et al. . Advances in Applied Microbiology. 72, 89-136 (2010).
- Driouch, H., Hänsch, R., Wucherpfennig, T., Krull, R., Wittmann, C. Improved enzyme production by bio-pellets of Aspergillus niger: Targeted morphology engineering using titanate microparticles. Biotechnology and Bioengineering. 109, 462-471 (2012).
- Driouch, H., Roth, A., Dersch, P., Wittmann, C. Optimized bioprocess for production of fructofuranosidase by recombinant Aspergillus niger. Applied Microbiology and Biotechnology. 87, 2011-2024 (2010).
- Driouch, H., Roth, A., Dersch, P., Wittmann, C. Filamentous fungi in good shape: Microparticles for tailor-made fungal morphology and enhanced enzyme production. Bioengineered Bugs. 2, 100-104 (2011).
- Driouch, H., Sommer, B., Wittmann, C. Morphology engineering of Aspergillus niger for improved enzyme production. Biotechnology and Bioengineering. 105, 1058-1068 (2010).
- Kaup, B. -. A., Ehrich, K., Pescheck, M., Schrader, J. Microparticle-enhanced cultivation of filamentous microorganisms: Increased chloroperoxidase formation by Caldariomyces fumago as an example. Biotechnology and Bioengineering. 99, 491-498 (2008).
- Hirayama, M., Sumi, N., Hidaka, H. Purification and characterization of a fructooligosaccharide-producing beta-fructofuranosidase from Aspergillus niger ATCC 20611. Agricultural and Biological Chemistry. 53, 667-673 (2006).
- Rajoka, M. I., Yasmeen, A. Improved productivity of beta-fructofuranosidase by a derepressed mutant of Aspergillus niger form conventional and non-conventional substrates. World Journal of Microbiology and Biotechnology. 21, 471-478 (2005).
- Zuccaro, A., Götze, S., Kneip, S., Dersch, P., Seibel, J. Tailor-made fructooligosaccharides by a combination of substrate and genetic engineering. ChemBioChem. 9, 143-149 (2008).
- Huggett, A. S. G., Nixon, D. A. Use of glucose oxidase, peroxidase, and o-dianisidin in determination of blood and urinary glucose. The Lancet. , 270-368 (1957).
- Wucherpfenning, T., Hestler, T., Krull, R. Morphology engineering - Osmolality and its effect on Aspergillus niger morphology and productivity. Microb. Cell Fact. 10, (2011).
- Rasband, W. S. . ImageJ. , (1997).
- Papagianni, M. Quantification of the fractal nature of mycelial aggregation in Aspergillus niger submerged cultures. Microbial Cell Factories. 5, 5 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados