Method Article
Personalização da Aspergillus niger Morfologia através da adição de partículas de talco Micro
Neste Artigo
Resumo
Um método para gerar e precisamente para caracterizar de forma abrangente morfologia do fungo filamentoso Aspergillus niger É descrito, que permite que a correlação matemática da aparência morfológica e produtividade.
Resumo
O fungo filamentoso A. niger é uma estirpe amplamente utilizado em uma ampla variedade de processos industriais de alimentos para a indústria farmacêutica. Uma das características mais intrigantes e muitas vezes incontrolável deste organismo filamentoso é a sua morfologia complexa. Ele varia de densas pelotas esféricas para micélios viscoso (Figura 1). Vários parâmetros de processo e ingredientes são conhecidos por influenciar morfologia fúngica 1. Dado que a produtividade ideal se correlaciona fortemente com uma forma específica morfológica, a morfologia de fungos freqüentemente representa o gargalo da produtividade na produção industrial.
Uma abordagem para a frente e elegante para controlar com precisão a forma morfológica é a adição de inorgânicos insolúveis micro partículas (como silicato de magnésio hidratado, óxido de alumínio ou óxido de titânio de silicato) ao meio de cultura que contribui para a produção da enzima aumentado 2-6. Uma vez que existe uma obvUSIO correlação entre a morfologia da partícula micro dependente e produção da enzima que é desejável para matematicamente ligar a produtividade ea aparência morfológica. Portanto, uma descrição precisa e holística quantitativa morfológica se destina.
Assim, apresentamos um método para gerar e caracterizar micro partículas dependentes estruturas morfológicas e correlacionar morfologia fúngica com a produtividade (Figura 1), que possivelmente contribui para uma melhor compreensão da morfogénese de microrganismos filamentosos.
A estirpe recombinante A. niger SKAn1015 é cultivada por 72 h em um biorreator agitado L 3 tanque. Por adição de partículas de talco micro, em concentrações de 1 g / L, 3 g / L e 10 g / L antes da inoculação de uma variedade de estruturas morfológicas é reprodutivelmente gerado. As amostras estéreis são tomadas após 24, 48 e 72 horas para determinação do progresso o crescimento ea actividade da enzima produzida. Oproduto formado é a enzima de alto valor β frutofuranosidase-, um biocatalisador importante para a formação de neo-açúcar em alimentos ou na indústria farmacêutica, que catalisa a reacção entre outros, de sacarose a glucose 7-9. Portanto, a quantificação da glucose após a adição de sacarose implica a quantidade de produzidos β frutofuranosidase. Quantificação da glicose é feita por um GOD / POD-Assay 10, que é modificado para alto rendimento análise em placas de 96 poços de micro titulação.
Morfologia fúngica após 72 horas é examinada ao microscópio e caracterizado por análise de imagem digital. Ao fazê-lo, os fatores de partículas forma de morfologia macro fungos como diâmetro Feret, a área projetada, perímetro, circularidade, proporção, solidez und circularidade são calculados com o open source de processamento de imagem programa ImageJ. Parâmetros relevantes são combinados para um número adimensional Morfologia (Mn) 11, que permite uma caracterização completa demorfologia fúngica. A estreita relação do número de Morfologia e produtividade são realçados por regressão matemática.
Protocolo
1. Instalação do reator eo início do cultivo
4 cultivos de biorreatores no total são conduzidas.
- Usar uma 3 L bioreactor de tanque agitado com um volume de trabalho de 2,2 L para o cultivo de A. niger SKAn1015.
- Despeje 72,6 g de glicose monohidratada no reator e preenchê-lo com 1,9 L de água deionizada.
- Instale o equipamento reator, tais como 3 defletores, um dois seis pás do rotor da turbina de disco, um eletrodo de pH, uma entrada de gás com filtro de ar, um dedo de refrigeração, um resfriador de ar de exaustão com filtro de ar, um tubo de imersão para a amostragem estéreis com filtro de ar e mangueiras de entrada para empresas de médio, inóculo de ácido e base.
- Autoclavar o reactor a 121 ° C durante 20 min.
- Ligue o reactor com o reservatório de ácido-base (HCl 2 M, 2 M de NaOH) e as bombas correspondentes e configurar um valor de pH de 5,0 ± 0,05 com a unidade de controlo do pH.
- Vincular o reactor com o sistema de resfriamento de água e colocar a camisa de aquecimentoem torno do recipiente de reactor.
- Instalar o sensor de temperatura com a unidade de controlo correspondente e configurar uma temperatura de 37 ± 0,1 ° C na unidade de controlo da temperatura.
- Coloque o motor agitação no topo do reator e trazê-lo em serviço com uma velocidade de agitação de 200 min -1.
- Adicionar a estéril mínima de crescimento médio 11 calha uma das mangueiras de entrada estéreis (250 mL). Para a preparação médio de todos os componentes foram autoclavadas a 121 ° C durante 20 min e misturados. Para três cultivos os componentes incluem talco em pó (3MgO • 4SiO 2 • H2O) nas concentrações de 1 g / L (reactor 2), 3 g / L (reactor 3) e 10 g / L (reactor 4). Antes de usar, re-suspender as partículas micro em 50 mM de tampão de acetato de sódio (pH 6,5) e adicioná-lo ao meio estéril. Em culturas de controlo (sem partículas), substituir a suspensão de partículas micro por 50 mM de tampão de acetato de sódio (pH 6,5).
- Adicionar a suspensão de esporos (inoculo) ums preparado no WUCHERPFENNIG et. ai (2011) 11 calha uma das mangueiras de entrada estéreis (50 ml), de modo que a concentração de esporos eleva-se a 1x10 6 mL -1. A inoculação marca o início do cultivo (h = 0 h).
- Iniciar o arejamento com uma taxa de 1,0 L min -1.
2. Amostragem estéril após 24, 48 e 72 horas de cultivo
- Tome 50 ml de caldo de cultura estéril em um tubo de frasco.
- Use amostra para determinação do peso da biomassa seca, β frutofuranosidase-atividade e análise microscópica.
3. Determinação da produção de biomassa seca após 24, 48 e 72 h de cultivo
- Amostras de biomassa estão a ser tomadas pelo menos em duplicado.
- Peso um filtro de celulose com um micro escalas, após secagem no exsicador e colocar o filtro num funil de Buchner com bomba de vácuo ligada a jacto de água.
- Filtrar um volume de amostra definido (por exemplo 10 mL) umand enxaguar o filtro com 10 mL de água desionizada para remover compostos de médio a partir da biomassa.
- Rugas no filtro uma vez no meio, colocá-lo numa placa de Petri de vidro e colocá-lo em um secador de compartimento até constância de peso (pelo menos 24 h).
- Arrefecer o filtro num exsicador e medir o peso.
- Calcular o peso de biomassa seca como a diferença entre o peso do filtro com e sem biomassa seca dividida pelo volume da amostra utilizada.
4. Determinação da atividade enzimática extracelular de β-frutofuranosidase por DEUS / POD-ensaio após 24, 48 e 72 h de cultivo
Armazenar as amostras em gelo constantemente enquanto trabalhava com eles.
- Filtrar 1,5 mL de suspensão de cultura calha um filtro de acetato de celulose, pressionando a suspensão de cultura com uma seringa através do filtro para um tubo de reacção. Armazenar o tubo de reacção a -20 ° C até utilização.
- Para utilizar a mistura de reacção 20amostra uL e adicionar 200 uL de 1,65 M de sacarose dissolvido em tampão fosfato 0,05 M (pH 5,4) para iniciar a reacção a partir de sacarose em glicose. Cary a cabo a reacção, pelo menos, em duplicado.
- Incubar a mistura de reacção a 40 ° C durante 20 min num bloco de aquecimento. Parar a reacção por incubação a 95 ° C durante 10 min num bloco de aquecimento. Arrefece-se a mistura de reacção por armazená-lo em gelo e girar para baixo a água condensada por centrifugação a 13,000 g durante 10 min a 4 ° C.
- Para explicar o pH e clivagem dependente da temperatura, de sacarose em glicose, efectuar um valor em branco, usando água de 20 uL deionizada em vez de 20 uL de amostra.
- Para ter em conta para a glucose residual no caldo de cultura, efectuar um controlo negativo para cada amostra. Para esse fim uL utilização 20 da amostra e inactivar β frutofuranosidase-por aquecimento a 95 ° C durante 10 min antes de adicionar a sacarose e incubar como descrito no passo 4.3.
- Diluir as amostras de tal modo que as medi seguintesured adsorção está na gama de valor calibrado.
- Realizar todos os ensaios enzimáticos em triplicata. Aplicar 2 uL de amostra diluída numa placa de micro titulação bem. Aplicar uma gama padrão para a calibração na placa de titulação por cada micro usando 2 ul de soluções de glicose dez, com dez concentrações sabem diferente (a partir de 1 mM a 15 mM) em vez de 2 amostra uL. Para a zero pontos de calibração usar 2 uL de água deionizada em vez de 2 uL da amostra.
- Adicionar 200 uL da solução de reagente a cada poço utilizando uma pipeta multi.
- Incubar a mistura durante 10 min à temperatura ambiente.
- Armazenar a placa de micro titulação a 6 ° C até a medição (algumas horas no máximo).
- Medir a absorção a 450 nm utilizando um de 96 poços Sunrise leitor de placas de micro eo Magellan software de recuperação de dados. Defina o tempo de mistura de até 5 seg. eo período de descanso até 1 seg.
- Abra o gráfico resultado com uma planilha e construir uma curva de calibração usando a escala padrão:
glucose = concentração uma absorção X + b - Calcular a atividade:
atividade = (absorção valor X fator de diluição em branco) X a + b - Compreenda-se a actividade β frutofuranosidase-através do cálculo da diferença entre as actividades da amostra e do controlo negativa adequada.
- Calcule a produtividade específica para o uso seguinte, tendo em conta o peso da biomassa seca e β frutofuranosidase-atividade 11.
5. Microscopia e Análise de Imagem automática após 72 h de cultivo
- O local de cerca de 3 mL de suspensão de cultura numa placa de Petri de plástico ediluí-los com uma solução fisiológica de cloreto de sódio até que as estruturas morfológicas são separadas.
- Situar a placa de Petri sob um microscópio, que possui uma câmera integrada ou conectados. Adquirir e guardar a cerca de 100 imagens (Figura 2) das estruturas morfológicas por amostra. Preste atenção que, em cada imagem, pelo menos, um objeto é completamente retratado.
- Abra todas as imagens de uma mesma amostra com o programa de processamento de imagens ImageJ 12. Converta as imagens a preto e branco, usando a ferramenta do processo "Faça Binário" (Figura 2). Para aplicar o comando para toda a série de imagens utilizar um código de macro como se segue.
executado (, Fazer Binário ")
- Abra as imagens binárias processados com ImageJ novamente. Calcule o diâmetro da forma fatores Feret, a área projetada, perímetro, circularidade, proporção, solidez circularidade und para cada imagem com a analisar "Medição Set" ferramenta. Para aplicar o comando para um series de imagens utilizar um código de macro como se segue.
executado ("8 bits");
executado ("Make Binary");
executado ("Scale Set ...", "distância = X = conhecido pixels 1000 = 1 unidade = mM global");
executado ("Medidas definir ...", "Exibir área de forma perímetro Féret limite redirect = decimal Nenhum = 3");
executado ("Analisar Partículas ...", "size = circularidade 10000-Infinito = mostrar = 0,00-1,00 Esboços display");
Determine X como o número de pixels que se correlaciona a 1000 mM através da construção de uma linha reta através de uma barra de escala. Correlacionar o número de pixels da linha recta com o comprimento da barra de escala na uM. - Abra o gráfico de resultado contendo valores de fator de forma para cada imagem com uma planilha. Calcular um número Morfologia como segue, para cada imagem.
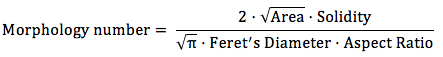
- Calcular o valor médio eo desvio padrão para o número Morfologia tendo em conta todas as imagens de uma amostra.
- Usar uma representação gráfica e um programa de análise de dados para a correlação gráfica do número morfologia com a produtividade específica e determinar a relação matemática por regressão matemática.
6. Os resultados representativos
Através da adição de talco micro partículas A. niger skan 1015 morfologia é alterada de uma morfologia pelete verdadeiro para uma morfologia dispersa ou mesmo micelial. Considerando que a morfologia pelete é exposto em condições padrão uma morfologia micelial é criado por suplementação de meio com 10 g / L de micro partículas de talco (Figura 4.). Paralelamente a atividade de β-frutofuranosidase aumenta cerca de 3 3-5 vezes. A suplementação de 1 ou 3 g / L de pó de talco conduz a uma morfologia dispersa, com uma actividade frutofuranosidase duplicou (Figura 4.).
A morfologia das partículas micro dependente pode ser amplamente descritos pela MorNúmero phology que pode ser calculado usando os parâmetros determinados por análise de imagem automático. Pelotas perfeitamente redonda e lisa vai em imagens microscópicas aparecem como círculos perfeitos. Para tais partículas o número Morfologia tem um valor de 1. O menor fragmento de morfologia micelial pode ser simplificada como uma linha unidimensional rendendo um número Morfologia de 0. Todas as formas intermédias morfológicas como peletes irregulares alongadas ou aglomerados, por conseguinte, ter valores entre 0 e 1. Partículas relativamente grandes irá resultar em um alto, partículas fúngicas com uma grande superfície ou partículas alongadas, em um número de Morfologia bastante baixo 11.
Em condições normais, o morfologia em reator 1 exibe um número em torno de 0,8 Morfologia. A morfologia no reactor 4 com 10 g / L de talco em pó possui um Mn cerca de 0,1. O número de Morfologia para os reactores 2 e 3, com concentrações de pó de talco de 1 e 3 g / L, situa-se entre estes extremos, demonstrando uma morfo dispersologia. Uma vez que a morfologia de partícula micro dependente está intimamente relacionado com a produtividade β frutofuranosidase, uma correlação matemática do número Morfologia e produtividade semelhante à Figura 5 é obtido.
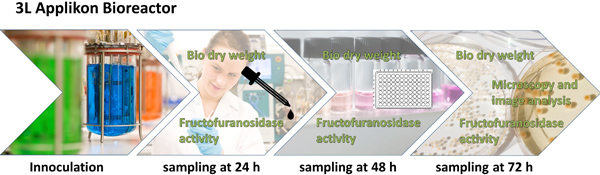
Figura 1. Esquema geral do desenho experimental e do procedimento analítico. A. niger é cultivada (com ou sem micro-partículas) em um L 3 agitada bioreactor tanque durante 72 h. Após 24, 48 e 72 ha amostra é levada para a determinação do peso de biomassa seca e β frutofuranosidase-actividade, o que novamente são utilizados para o cálculo da produtividade específica. Após 48 h, a morfologia fúngica é examinada ao microscópio e caracterizado por análise de imagem digital. Parâmetros relevantes da análise de imagem são combinados para um número de Morfologia, que é matemático correlacionada com a produtividade específica.

Figura 2. Passos de processamento de imagem para imagens geradas por microscopia de estruturas morfológicas de A. niger. Passo 1: aquisição de imagens por microscópio. Passo 2: melhoria da imagem, se necessário. Passo 3: binarização da imagem, em preto-e-branco (binário) gerado no ImageJ. Passo 4: a imagem binária é processado por objecto e indesejada são apagadas. Etapa 5: análise morfológica é realizada com o "Analisar partículas" função do open source programa ImageJ.
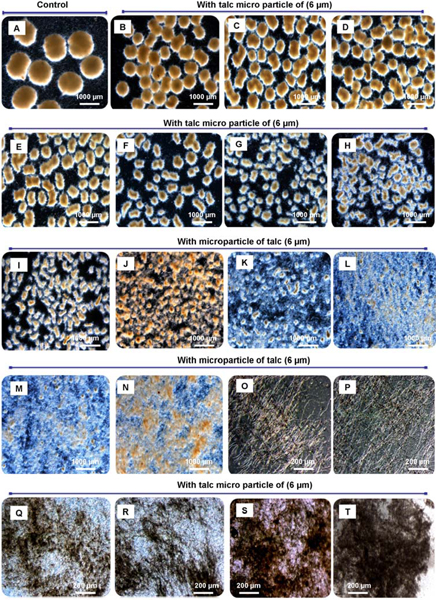
Figura 3. Diferentes formas morfológicas de A. niger dependente da concentração de micro-partículas agregado. Com o aumento da concentração de micro-partículas adicionado o tamanho pelete pode ser precisamente decresceu para pequenas core-shell pelotas, rebanhos pequenos e micélio mesmo livremente dispersa. Morfologia da engenharia comopergillus niger SKAn1015 por micro partículas suplementação em cultura submersa. Sem micropartículas (A), 10 mg / L (B), 0,1 g / L (C), 0,2 g / L (D), 0,3 g / L (E), 0,6 g / L (F), 1,0 g / L (G), 1,5 g / L (H), 2,0 g / L (I), 2,5 g / L (J), 3,0 g / L (K), 3,5 g / L (L), 4,0 g / L (M ), 4,5 g / L (N), 5,0 g / L (O), 10 g / L (P), 15 g / L (Q), 20 g / L (R), 30 g / L (S) e 40-50 g / L (T). Imagens foram feitas por microscopia de luz após 72 h de cultivo.
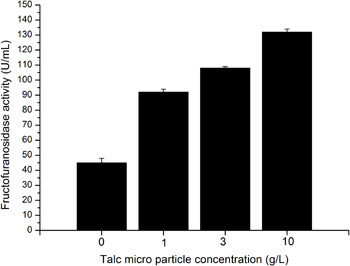
Figura 4. Actividade frutofuranosidase na dependência de talco micro partículas concentração de 1 g / L (reactor 2), 3 g / L (reactor 3) e 10 g / L (reactor 4). Reactor 1 não é suplementado com micro-partículas, aqui o cultivo é conduzido sob condições padrão.

Figura 5. Boa correlação representativas (R 2 = 0,91) do Morfologianúmero ea produtividade específica. O número de Morfologia é traçada (abcissas) contra a produtividade específica (ordenada). Regressão não linear produz a correlação exponencial.
Discussão
A modificação da morfologia fúngica tem sido de interesse em biotecnologia desde há várias décadas. Diferentes estudos têm tentado variar os parâmetros do processo seleccionados tais como o valor de pH, de entrada de alimentação, temperatura, nutrientes médio ou concentração de inóculo 1, mas sofrem de controlo em vez imprecisa e incompleta da morfologia, elevados custos de energia, efeitos de inibição ou instabilidade do produto, em contraste, a suplementação de micro partículas permite uma engenharia precisa da morfologia fúngica através afinadas variação do tamanho de partícula e da concentração. Isso abre novas possibilidades de usar micro-partículas para otimização e de tailor-made de design da morfologia produção de alta na produção biotecnológica com A. niger e outros microorganismos filamentosos.
A análise de imagem digital é um método reprodutível fácil de caracterizar a morfologia macro fungos. No entanto, a variedade de parâmetros para carac tamanho, forma e superfícieter de estruturas morfológicas descritas na literatura torna rápida avaliação da morfologia fúngica complicada. O número de Morfologia apresentado como uma combinação de parâmetros relevantes, evita esta deficiência, e pode ser usado não só para a caracterização completa de estruturas morfológicas, mas também para correlação matemática directo com a produtividade. Isso torna novamente uma estimativa de produtividade por meio da morfologia dado e, portanto, uma personalização da morfologia para o processo precisa possível.
Usando o número Morfologia, é possível distinguir entre vários pelete e morfologias clump 4,5. Para o desenvolvimento ainda maior do número de Morfologia da consideração da dimensão fractal parece ser promissor. Uma dimensão fractal dá uma medida da complexidade e de massa de enchimento propriedades de um objecto 13 e é, por conseguinte, predestinados para a caracterização da morfologia global micelial.
A creation de uma morfologia produção de alta micelial, no entanto, podem conduzir a problemas com o desempenho do processo especialmente no cultivo em larga escala, porque a forma de crescimento micelial foi previamente demonstrado que exibem viscosidades caldo de cultura muito maiores 2. Isto conduz a problemas com a transferência de calor e massa e formação de zonas não estagnadas mistos, as quais requerem uma entrada maior potência e tornar a cultura mais caro para operar 1. Por conseguinte, a relação entre a morfologia fúngica e viscosidade caldo de cultura deve ser considerada quando se muda a morfologia e ser incorporados em modelos adicionais.
Divulgações
Não tenho nada para revelar.
Agradecimentos
Os autores agradecem o apoio financeiro concedido pela Fundação Alemã de Pesquisa (DFG), através da pesquisa colaborativa centro SFB 578 "Do Gene ao Produto" na Technische Universität Braunschweig, Alemanha.
Materiais
Table of Equipment:
| Name | Company | Catalog Number | Comments |
| Equipment | Company | Catalogue Number/model | |
| autoclave | Systec | V150 | |
| Büchner funnel (plastic) | VWR | - | |
| cellulose filter (for biomass dry weight) | Sartorius Stedim Biotech | Filter Discs Grade 389 | |
| cellulose acetate filter (for air filtration at reactor) | Sartorius stedim biotech | Midisart 200 PTFE | |
| cellulose acetate filter (for enzyme activity) | Sartorius Stedim Biotech | Midisart NML | |
| centrifuge | Eppendorf | Centrifuge 5415R | |
| centrifuge | Heraeus | Biofuge fresco | |
| centrifuge | Heraeus sepatech | Varifuge 3.0R | |
| compartment dryer (105 °C) | Heraeus | Kelvitran t | |
| control unit (temperature) | Jumo | Jumo iTron 08 | |
| control unit (pH-value) | meredos | pH Control 2 | |
| desiccator | Duran | Vacuum stable | |
| Falcon tubes | Omnilab | FALC352070 | |
| heating block 40 °C | Biometra | TB1 Thermoblock | |
| heating block 95 °C | HLC | HBT 130 | |
| micro plate reader | Tecan | Sunrise-Microplate-Reader | |
| micro scales | Sartorius | CP 225 | |
| microscope (digital inverted) | AMG | EVOS xl | |
| micro pipettes and tips (different sizes) | Omnilab | 5283303 5283298 5283299 5283300 | |
| micro titer plate | Nunc | MaxiSorp | |
| multi pipette and tips | Eppendorf/ Omnilab | 5283611/ 5283611 | |
| pH-electrode | Schott | pH-Meter CG840 | |
| reaction tubes | Roth | E518.1 | |
| scale | Sartorius | CP 3202 S | |
| stirred tank bioreactor with equipment | Applikon Biotechnology | 2L Bioreactor set | |
| syringe | Eppendorf | Combitips Plus 5 mL |
Table of Reagents:
| Name of the reagent | Company |
| Acetic acid | Roth |
| Disodium hydrogen phosphate | Merck |
| Ethanol (95%) | Roth |
| Glucose monohydrate, (α-D-) | Roth |
| Glucose oxidase (Typ II from Aspergillus niger) | Sigma |
| Hydrochloride acid (37 % w/v) | Fiedel-de Haën |
| Hydrous magnesium silicate | Roth |
| Monopotassium phosphate | Merck |
| o-dianoisidine dihydrochloride | Sigma |
| Peroxidase (Typ II from horseradish) | Sigma |
| Sodium acetate | Roth |
| Sodium hydroxide | Merck |
| Sucrose, D-(+) | Fluka |
| Water (deionized) | - |
Table of Solutions and Medium Composition:
| Solution | Components | Amount |
| 50 mM sodium acetate buffer (pH 6.5) | Sodium acetate Bring to volume with deionized water Adjust at pH 6.5 with acetic acid | 4.1 g L-1 |
| 0.05 M monopotassium phosphate solution | Monopotassium phosphate Bring to volume with deionized water | 6.805 g L-1 |
| 0.05 M disodium hydrogen phosphate solution | Disodium hydrogen phosphate Bring to volume with deionized water | 7.1 g L-1 |
| 0.05 M phosphate buffer (pH 7.0) | 0.05 M disodium hydrogen phosphate solution Bring to volume with 0.05 M monopotassium phosphate solution | 61.2 mL |
| 0.05 M phosphate buffer (pH 5.4) | 0.05M disodium hydrogen phosphate solution Bring to volume with 0.05 M monopotassium phosphate solution | 3 mL |
| 1.65 M sucrose solution | D-(+)-sucrose Bring to volume with phosphate buffer (pH 5.4) | 564.8 g L-1 |
| reagent solution | o-Dianisidin-Dihydrochlorid Ethanol (95%) | 25 mg 10 mL |
| Glucose reagent solution | Glucose oxidase Peroxidase Phosphate buffer (pH 7.0) reagent solution | 10.5 mg 3 mg 90 mL 10 mL |
Referências
- Wucherpfennig, T., et al. . Advances in Applied Microbiology. 72, 89-136 (2010).
- Driouch, H., Hänsch, R., Wucherpfennig, T., Krull, R., Wittmann, C. Improved enzyme production by bio-pellets of Aspergillus niger: Targeted morphology engineering using titanate microparticles. Biotechnology and Bioengineering. 109, 462-471 (2012).
- Driouch, H., Roth, A., Dersch, P., Wittmann, C. Optimized bioprocess for production of fructofuranosidase by recombinant Aspergillus niger. Applied Microbiology and Biotechnology. 87, 2011-2024 (2010).
- Driouch, H., Roth, A., Dersch, P., Wittmann, C. Filamentous fungi in good shape: Microparticles for tailor-made fungal morphology and enhanced enzyme production. Bioengineered Bugs. 2, 100-104 (2011).
- Driouch, H., Sommer, B., Wittmann, C. Morphology engineering of Aspergillus niger for improved enzyme production. Biotechnology and Bioengineering. 105, 1058-1068 (2010).
- Kaup, B. -. A., Ehrich, K., Pescheck, M., Schrader, J. Microparticle-enhanced cultivation of filamentous microorganisms: Increased chloroperoxidase formation by Caldariomyces fumago as an example. Biotechnology and Bioengineering. 99, 491-498 (2008).
- Hirayama, M., Sumi, N., Hidaka, H. Purification and characterization of a fructooligosaccharide-producing beta-fructofuranosidase from Aspergillus niger ATCC 20611. Agricultural and Biological Chemistry. 53, 667-673 (2006).
- Rajoka, M. I., Yasmeen, A. Improved productivity of beta-fructofuranosidase by a derepressed mutant of Aspergillus niger form conventional and non-conventional substrates. World Journal of Microbiology and Biotechnology. 21, 471-478 (2005).
- Zuccaro, A., Götze, S., Kneip, S., Dersch, P., Seibel, J. Tailor-made fructooligosaccharides by a combination of substrate and genetic engineering. ChemBioChem. 9, 143-149 (2008).
- Huggett, A. S. G., Nixon, D. A. Use of glucose oxidase, peroxidase, and o-dianisidin in determination of blood and urinary glucose. The Lancet. , 270-368 (1957).
- Wucherpfenning, T., Hestler, T., Krull, R. Morphology engineering - Osmolality and its effect on Aspergillus niger morphology and productivity. Microb. Cell Fact. 10, (2011).
- Rasband, W. S. . ImageJ. , (1997).
- Papagianni, M. Quantification of the fractal nature of mycelial aggregation in Aspergillus niger submerged cultures. Microbial Cell Factories. 5, 5 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados