Method Article
Personalizzazione di Aspergillus niger Morfologia attraverso l'aggiunta di talco micro particelle
In questo articolo
Riepilogo
Un metodo per generare con precisione e caratterizzare completo morfologia di fungo filamentoso Aspergillus niger È descritto, che consente la correlazione matematica di aspetto morfologico e della produttività.
Abstract
Il fungo filamentoso A. niger è un ceppo ampiamente utilizzato in una vasta gamma di processi industriali, dal cibo all'industria farmaceutica. Una delle caratteristiche più intriganti e spesso incontrollabili di questo organismo filamentoso è la sua complessa morfologia. Si va da fitte palline sferiche di viscosa miceli (Figura 1). Vari parametri di processo e gli ingredienti sono noti influenzare la morfologia fungina 1. Poiché la produttività ottimale è strettamente correlato con un modulo specifico morfologica, la morfologia fungina rappresenta spesso il collo di bottiglia della produttività nella produzione industriale.
Un approccio semplice ed elegante per controllare con precisione la forma morfologica è l'aggiunta di particelle inorganiche insolubili micro (come silicato di magnesio idrato, ossido di alluminio o di ossido di titanio silicato) al mezzo di coltura che contribuiscono alla produzione enzimatica aumentata 2-6. Poiché vi è un obvious correlazione tra la morfologia delle particelle micro dipendente e la produzione di enzimi che è opportuno collegare matematicamente la produttività e l'aspetto morfologico. Quindi una precisa descrizione quantitativa e olistica morfologica si rivolge.
Così, presentiamo un metodo per generare e caratterizzare micro particelle strutture dipendenti morfologiche e di correlare morfologia fungina con produttività (figura 1) che contribuisce eventualmente ad una migliore comprensione della morfogenesi di microrganismi filamentosi.
Il ceppo ricombinante A. niger SKAn1015 è coltivato per 72 ore in una L 3 mosse bioreattore serbatoio. In aggiunta di talco micro particelle in concentrazioni di 1 g / L, 3 g / L e 10 g / L prima dell'inoculo una varietà di strutture morfologiche viene generato riproducibile. I campioni sterili sono presi dopo le ore 24, 48 e 72 per la determinazione del progresso crescita e l'attività dell'enzima prodotto. Ilprodotto formato è ad alto valore dell'enzima β-fructofuranosidase, uno biocatalizzatore importante per la neo-formazione di zuccheri negli alimenti o nell'industria farmaceutica, che catalizza la reazione tra gli altri di saccarosio in glucosio 7-9. Pertanto, la quantificazione del glucosio dopo l'aggiunta di saccarosio implica la quantità di prodotto β-fructofuranosidase. Quantificazione glucosio viene effettuata da un GOD / POD-test 10, che viene modificato per analisi ad alta produttività in 96-well micro piastre titolo anticorpale.
Morfologia fungina dopo 72 ore viene esaminato al microscopio e caratterizzata da analisi di immagine digitale. In tal modo, i fattori di forma di particelle per la morfologia macro fungine come diametro Feret, area proiettata, perimetro, circolarità, aspect ratio, und solidità rotondità sono calcolati con l'open source del programma di elaborazione delle immagini ImageJ. Parametri rilevanti sono combinati ad un numero adimensionale morfologia (Mn) 11, che consente una caratterizzazione completamorfologia fungina. La stretta correlazione del numero di Morfologia e la produttività sono evidenziati con la regressione matematica.
Protocollo
1. Reattore di installazione e avvio di coltivazione
4 coltivazioni bioreattore in totale sono condotte.
- Utilizzare un bioreattore 3 serbatoio L agitata con un volume di lavoro di 2,2 L per la coltura di A. niger SKAn1015.
- Versare monoidrato 72,6 g di glucosio nel reattore e riempirlo con 1,9 L di acqua deionizzata.
- Installare l'apparecchiatura reattore 3, come diaframmi, a due a sei pale della girante della turbina del disco, un elettrodo di pH, un ingresso di gas con filtro aria, un dito di raffreddamento, un dispositivo di raffreddamento dell'aria di scarico con filtro aria, un tubo di immersione per il campionamento sterile con filtro aria e tubi di carico per mezzo, inoculo, acidi e basi.
- Autoclavare il reattore a 121 ° C per 20 min.
- Collegare il reattore con l'acido-base del serbatoio (2 M HCl, 2 M NaOH) e le pompe corrispondenti e impostare un valore del pH di 5,0 ± 0,05 con l'unità di controllo del pH.
- Collegare il reattore con l'acqua di raffreddamento del sistema e mettere la camicia di riscaldamentoattorno al reattore.
- Installare il sensore di temperatura con unità di controllo corrispondente e impostare una temperatura di 37 ± 0,1 ° C presso l'unità di controllo della temperatura.
- Montare il motore agitazione cima del reattore e portare in servizio con una velocità di agitazione di 200 min -1.
- Aggiungere la sterile minima quantità di terreno di crescita 11 attraverso uno dei tubi di alimentazione sterili (250 mL). Per la preparazione mezzo tutti i componenti sono stati sterilizzati in autoclave a 121 ° C per 20 minuti e mescolati insieme. Per tre colture i componenti includono talco in polvere (3MgO • • 4SiO 2 H 2 O) nelle concentrazioni di 1 g / L (reattore 2), 3 g / L (reattore 3) e 10 g / L (reattore 4). Prima dell'uso, risospendere le microparticelle in tampone sodio acetato 50 mM (pH 6,5) e aggiungere al mezzo sterile. In colture di controllo (senza particelle) sostituire la sospensione micro particelle di tampone di acetato di sodio 50 mM (pH 6,5).
- Aggiungere la sospensione di spore (inoculo) as preparati in Wucherpfennig et. al (2011) 11 attraverso uno dei tubi di alimentazione sterili (50 mL) in modo che la concentrazione di spore pari a 1x10 6 mL -1. L'inoculazione segna l'inizio della coltivazione (h = 0 h).
- Avviare l'aerazione con un tasso di 1,0 L min -1.
2. Campionamento sterile dopo 24, 48 e 72 ore di coltivazione
- Prendere 50 ml di brodo di coltura sterile in un tubo flacone.
- Utilizzare campione per la determinazione del peso biomassa secca, β-fructofuranosidase attività e analisi microscopica.
3. Determinazione del peso biomassa secca dopo 24, 48 e 72 ore di coltivazione
- I campioni di biomassa devono essere prelevati almeno in doppio.
- Peso un filtro di cellulosa con una bilancia micro dopo l'essiccazione in un essiccatore e posizionare il filtro in un imbuto Buchner con collegata a getto d'acqua pompa da vuoto.
- Filtrare un volume di campione definito (ad esempio 10 mL) and risciacquare il filtro con 10 mL di acqua deionizzata per rimuovere i composti medi dalla biomassa.
- Wrinkle il filtro una volta al centro, collocarlo in un piatto di vetro Petri e metterla in un essiccatore vano fino a quando la costanza di peso (almeno 24 h).
- Raffreddare il filtro in un essiccatore e misurare il peso.
- Calcolare il peso secco biomassa come la differenza tra il peso del filtro con e senza biomassa essiccata diviso per il volume del campione utilizzato.
4. Determinazione dell'attività enzimatica extracellulare del β-fructofuranosidase da GOD / POD-saggio dopo 24, 48 e 72 h di Coltivazione
Conservare i campioni sul ghiaccio mentre si lavora costantemente con loro.
- Filtro 1,5 mL sospensione attraverso cultura un acetato di cellulosa filtro premendo la sospensione cultura con una siringa attraverso il filtro in un tubo di reazione. Conservare il tubo di reazione a -20 ° C fino utilizzo.
- Per utilizzare la miscela di reazione 20microlitri del campione e aggiungere 200 pl di saccarosio 1,65 M sciolto in tampone fosfato 0,05 M (pH 5,4) per innescare la reazione di saccarosio al glucosio. Cary la reazione almeno in doppio.
- Incubare la miscela di reazione a 40 ° C per 20 min in un blocco riscaldante. Arrestare la reazione mediante incubazione a 95 ° C per 10 min in un blocco riscaldante. Raffreddare il miscuglio di reazione mediante archiviazione su ghiaccio e centrifugare l'acqua condensata per centrifugazione a 13,000 g per 10 min a 4 ° C.
- Per tener conto del pH e scissione dipendente dalla temperatura di saccarosio in glucosio, effettuare un valore vuoto utilizzando 20 microlitri di acqua deionizzata, invece di campione di 20 microlitri.
- Per tenere conto glucosio residuo nel brodo di coltura, effettuare un controllo negativo per ciascun campione. A tal fine uso 20 pl del campione e inattivare β-fructofuranosidase mediante riscaldamento a 95 ° C per 10 minuti prima di aggiungere il saccarosio e incubare come descritto al punto 4.3.
- Diluire i campioni in modo tale che gli accordi multilaterali seguentirato adsorbimento è nell'intervallo valore di taratura.
- Eseguire tutti i test enzimatici in triplice copia. Applicare un campione di 2 pl diluito in un piatto titolo micro bene. Applicare una serie standard di calibrazione sulla piastra titolo micro da ciascuno utilizzando 2 microlitri di dieci soluzioni di glucosio con dieci concentrazioni conoscere diversi (da 1 mM a 15 mM) invece di 2 microlitri del campione. Per la calibrazione dello zero punto usare 2 microlitri di acqua deionizzata, invece di un campione di 2 pl.
- Aggiungere 200 pl della soluzione reagente per ogni pozzetto usando una pipetta multipla.
- Incubare la miscela per 10 minuti a temperatura ambiente.
- E conservare la piastrina micro titolo a 6 ° C fino alla misura (poche ore al massimo).
- Misurare l'assorbimento a 450 nm usando un 96 ben Alba lettore di piastre micro e il recupero dei dati software Magellan. Impostare il tempo di miscelazione fino a 5 sec. e il resto fino al 1 sec.
- Aprire la tabella risultato con un foglio di calcolo e costruire una retta di taratura utilizzando la gamma standard:
glucose concentrazione = a + b X assorbimento - Calcolare l'attività:
= attività (assorbimento fattore di diluizione X-valore vuoto) X a + b - Calcolare il β-fructofuranosidase attività calcolando la differenza tra le attività del campione e il controllo appropriato negativo.
- Calcolare la produttività specifica per l'utilizzo successivo, tenendo conto di peso biomassa secca e la β-fructofuranosidase attività 11.
5. Microscopia e analisi delle immagini automatico dopo 72 ore di coltivazione
- Luogo di circa 3 ml di coltura in sospensione in un piatto di plastica e Petridiluire con soluzione fisiologica di cloruro di sodio fino a quando le strutture morfologiche sono separati.
- Collocare il piatto Petri al microscopio, che dispone di una fotocamera integrata o collegata. Acquisire e salvare circa 100 immagini (Figura 2) di strutture morfologiche per campione. Prestare attenzione che su ogni immagine almeno un oggetto è completamente dipinto.
- Aprire tutte le immagini dello stesso campione con il programma di elaborazione delle immagini ImageJ 12. Convertire le immagini in bianco e nero utilizzando lo strumento processo di "Make Binary" (Figura 2). Per applicare il comando a tutta la serie di immagini utilizza un codice macro come segue.
run (,, Make Binary ")
- Aprire le immagini binarie trasformati con ImageJ di nuovo. Calcolare il diametro della forma fattori Feret, area proiettata, perimetro, circolarità, aspect ratio, und solidità rotondità per ogni immagine con l'analizzare "Measurement Set" strumento. Per applicare il comando per un serioes di immagini utilizza un codice macro come segue.
eseguire ("8-bit");
eseguire ("Make Binary");
eseguire ("Scale Set ..." "X = distanza conosciuta = 1000 pixel = 1 micron = unità globale",);
eseguire ("Misure Set ...", "limite di visualizzazione zona perimetrale forma Feret di redirect = decimale None = 3");
eseguire ("analizzare particelle ...", "size = 10000-Infinity circolarità = 0,00-1,00 show = Contorni display");
Determinare X come il numero di pixel che è correlato a 1000 um creando una linea retta attraverso una barra di scala. Correlare il numero di pixel della linea retta con la lunghezza della barra in scala micron. - Aprire la tabella contenente i valori risultato fattore di forma per ogni immagine con un foglio di calcolo. Calcolare un numero morfologia come segue per ciascuna immagine.
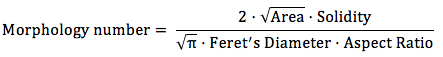
- Calcolare il valore medio e deviazione standard per il numero di Morfologia tenendo conto di tutte le immagini di un campione.
- Utilizzare un programma di grafica e di analisi dei dati per la correlazione statistica del numero Morfologia con la produttività specifica e determinare la relazione matematica con la regressione matematica.
6. Risultati rappresentativi
Mediante aggiunta di talco micro particelle A. niger Skan 1015 morfologia è cambiata da una morfologia vera pellet ad una morfologia disperse o micelio. Considerando morfologia pellet viene esposto a condizioni standard una morfologia micelio viene creato supplementazione di terreno con 10 g / L di talco micro particelle (Figura 4.). Allo stesso tempo l'attività di β-fructofuranosidase aumenta di circa 3 volte 3-5. Una supplementazione di 1 o 3 g / L di polvere di talco porta ad una morfologia disperso, con una attività fructofuranosidase raddoppiato (Figura 4.).
La morfologia delle particelle micro dipendente può essere ampiamente descritto dal Mormorfologia numero che può essere calcolato utilizzando parametri determinati mediante analisi di immagine automatica. Pellets perfettamente tondeggianti e lisce sarà in immagini al microscopio appaiono come cerchi perfetti. Per tali particelle il numero Morfologia ha un valore di 1. Il piccolo frammento di morfologia micelio può essere semplificato come linea unidimensionale producendo un numero morfologia di 0. Tutte le forme intermedie morfologiche come pellet irregolari allungati o grumi pertanto hanno valori compresi tra 0 e 1. Grandi particelle comporta un elevato, fungine particelle con una grande superficie o particelle allungate, in un numero morfologia piuttosto basso 11.
In condizioni normali la morfologia nel reattore numero 1 presenta una morfologia circa 0,8. La morfologia in reattore 4 con 10 g / L talco in polvere presenta un Mn di circa 0,1. Il numero Morfologia per reattori 2 e 3, con concentrazioni di polvere di talco 1 e 3 g / L, compreso tra questi due estremi, dimostrando un disperso morfologia. Poiché morfologia delle particelle micro dipendente è strettamente correlata con il β-fructofuranosidase produttività, una correlazione matematica di numero Morfologia e produttività simile alla Figura 5 si ottiene.
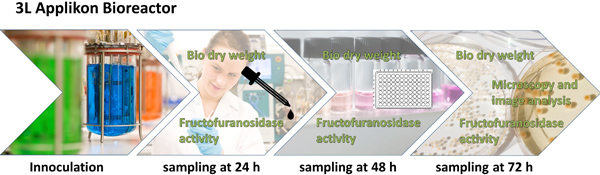
Figura 1. Schema generale del disegno sperimentale e la procedura analitica. A. niger è coltivato (con o senza micro particelle) in uno L 3 agitata bioreattore serbatoio per 72 h. Dopo 24, 48 e 72 ha campione viene prelevato per la determinazione del peso biomassa secca e β-fructofuranosidase attività, che vengono nuovamente usati per il calcolo della produttività specifica. Dopo 48 h la morfologia fungina è esaminata al microscopio e caratterizzati mediante analisi di immagine digitale. Relativi parametri di analisi di immagine sono combinati a un numero morfologia, che è correlata con la matematica produttività specifica.

Figura 2. Fasi di elaborazione delle immagini al microscopio per immagini generate al di strutture morfologiche da A. niger. Fase 1: acquisizione di immagini al microscopio. Fase 2: il miglioramento dell'immagine, se necessario. Fase 3: binarizzazione immagini, in bianco e nero (binario) immagine generata in ImageJ. Fase 4: l'immagine binaria viene elaborata da e oggetto indesiderato vengono cancellati. Fase 5: analisi morfologica è condotta con la funzione "Analizza le particelle" del programma ImageJ open source.
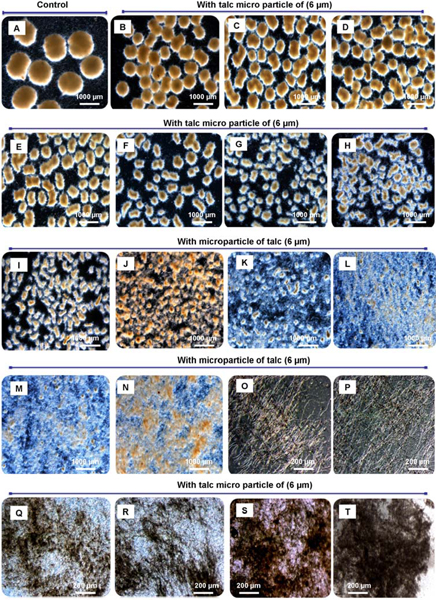
Figura 3. Differenti forme morfologiche di A. dipendente dalla concentrazione di particelle aggiunto micro niger. Con la crescente concentrazione di micro particelle aggiunto la dimensione del pellet può essere ridotta con precisione fino a piccoli core-shell pellets, greggi di piccole dimensioni e il micelio, anche liberamente dispersi. Morfologia engineering di Aspergillus niger SKAn1015 dalla supplementazione di micro particelle in coltura sommersa. Senza microparticelle (A), 10 mg / L (B), 0,1 g / L (C), 0,2 g / L (D), 0,3 g / L (E), 0,6 g / L (F), 1,0 g / L (G), 1,5 g / L (H), 2,0 g / L (I), 2,5 g / L (J), 3,0 g / L (K), 3,5 g / L (L), 4,0 g / L (M ), 4,5 g / L (N), 5,0 g / L (O), 10 g / L (P), 15 g / L (Q), 20 g / L (R), 30 g / L (S) e 40-50 g / L (T). Le immagini sono state prese al microscopio ottico dopo 72 ore di coltivazione.
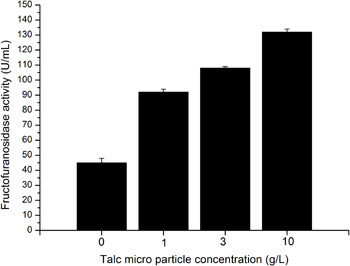
Figura 4. Attività Fructofuranosidase in dipendenza della concentrazione di particelle di talco micro 1 g / L (reattore 2), 3 g / L (reattore 3) e 10 g / L (reattore 4). Reattore 1 non è integrato con micro particelle, qui la coltivazione è condotta in condizioni standard.

Figura 5. Rappresentativa buona correlazione (R 2 = 0,91) del Morfologiail numero e la produttività specifica. Il numero Morfologia è tracciata (ascissa) contro la produttività specifica (ordinate). Regressione lineare produce la correlazione esponenziale.
Discussione
La modifica della morfologia fungina è stata di interesse nel settore delle biotecnologie in quanto molti decenni. Diversi studi hanno cercato di variare i parametri di processo selezionati come valore di pH, ingresso alimentazione, temperatura, concentrazione di nutrienti medio o inoculo 1, ma soffrono di controllo piuttosto imprecisa e incompleta della morfologia, gli alti costi energetici, effetti di inibizione o instabilità del prodotto, al contrario, l'integrazione di micro particelle permette una progettazione precisa della morfologia fungina messo a punto variazione di dimensione delle particelle e la concentrazione. Questo apre nuove possibilità di utilizzare micro particelle per l'ottimizzazione e per la progettazione su misura di alta morfologia produce in produzione biotecnologica con A. niger e altri microrganismi filamentosi.
L'analisi di immagine digitale è un metodo facilmente riproducibile per caratterizzare la morfologia fungina macro. Tuttavia, la varietà di parametri per caratteristiche dimensioni, forma e superficieter delle strutture morfologiche descritte in letteratura fa una rapida valutazione della morfologia fungina complicato. Il numero Morfologia presentato come una combinazione di parametri relativi, evita tale carenza e può essere utilizzato non solo per la caratterizzazione completa di strutture morfologiche, ma anche per diretta correlazione matematica con produttività. Questo rende ancora una volta una stima della produttività dato dalla morfologia e quindi una personalizzazione della morfologia per il processo ha bisogno di possibile.
Utilizzando il numero di morfologia, è possibile distinguere tra i vari pellet e morfologie ciuffo 4,5. Per lo sviluppo ulteriore del numero di Morfologia la considerazione della dimensione frattale sembra essere promettente. Una dimensione frattale dà una misura della complessità e massa di riempimento proprietà di un oggetto 13 ed è quindi predestinato per la caratterizzazione olistica di morfologia micelio.
Il creation di un alto morfologia del micelio che produce, tuttavia, potrebbe portare a problemi con le prestazioni dei processi in particolare nella coltivazione su larga scala, perché la forma crescita del micelio è stato precedentemente dimostrato che mostra molto maggiore viscosità brodo di coltura 2. Questo porta a problemi di trasferimento di calore e di massa e la formazione di zone stagnanti non misti, che richiedono un ingresso di potenza superiore e rendere la coltivazione più costose da gestire 1. Pertanto il rapporto tra morfologia funghi e brodo di viscosità cultura dovrebbe essere considerato quando si cambia la morfologia e essere incorporate in altri modelli.
Divulgazioni
Non ho nulla da rivelare.
Riconoscimenti
Gli autori ringraziano il sostegno finanziario offerto dalla Fondazione tedesca per la ricerca (DFG) attraverso il centro di ricerca in collaborazione SFB 578 "dal gene al prodotto" presso la Technische Universität Braunschweig, in Germania.
Materiali
Table of Equipment:
| Name | Company | Catalog Number | Comments |
| Equipment | Company | Catalogue Number/model | |
| autoclave | Systec | V150 | |
| Büchner funnel (plastic) | VWR | - | |
| cellulose filter (for biomass dry weight) | Sartorius Stedim Biotech | Filter Discs Grade 389 | |
| cellulose acetate filter (for air filtration at reactor) | Sartorius stedim biotech | Midisart 200 PTFE | |
| cellulose acetate filter (for enzyme activity) | Sartorius Stedim Biotech | Midisart NML | |
| centrifuge | Eppendorf | Centrifuge 5415R | |
| centrifuge | Heraeus | Biofuge fresco | |
| centrifuge | Heraeus sepatech | Varifuge 3.0R | |
| compartment dryer (105 °C) | Heraeus | Kelvitran t | |
| control unit (temperature) | Jumo | Jumo iTron 08 | |
| control unit (pH-value) | meredos | pH Control 2 | |
| desiccator | Duran | Vacuum stable | |
| Falcon tubes | Omnilab | FALC352070 | |
| heating block 40 °C | Biometra | TB1 Thermoblock | |
| heating block 95 °C | HLC | HBT 130 | |
| micro plate reader | Tecan | Sunrise-Microplate-Reader | |
| micro scales | Sartorius | CP 225 | |
| microscope (digital inverted) | AMG | EVOS xl | |
| micro pipettes and tips (different sizes) | Omnilab | 5283303 5283298 5283299 5283300 | |
| micro titer plate | Nunc | MaxiSorp | |
| multi pipette and tips | Eppendorf/ Omnilab | 5283611/ 5283611 | |
| pH-electrode | Schott | pH-Meter CG840 | |
| reaction tubes | Roth | E518.1 | |
| scale | Sartorius | CP 3202 S | |
| stirred tank bioreactor with equipment | Applikon Biotechnology | 2L Bioreactor set | |
| syringe | Eppendorf | Combitips Plus 5 mL |
Table of Reagents:
| Name of the reagent | Company |
| Acetic acid | Roth |
| Disodium hydrogen phosphate | Merck |
| Ethanol (95%) | Roth |
| Glucose monohydrate, (α-D-) | Roth |
| Glucose oxidase (Typ II from Aspergillus niger) | Sigma |
| Hydrochloride acid (37 % w/v) | Fiedel-de Haën |
| Hydrous magnesium silicate | Roth |
| Monopotassium phosphate | Merck |
| o-dianoisidine dihydrochloride | Sigma |
| Peroxidase (Typ II from horseradish) | Sigma |
| Sodium acetate | Roth |
| Sodium hydroxide | Merck |
| Sucrose, D-(+) | Fluka |
| Water (deionized) | - |
Table of Solutions and Medium Composition:
| Solution | Components | Amount |
| 50 mM sodium acetate buffer (pH 6.5) | Sodium acetate Bring to volume with deionized water Adjust at pH 6.5 with acetic acid | 4.1 g L-1 |
| 0.05 M monopotassium phosphate solution | Monopotassium phosphate Bring to volume with deionized water | 6.805 g L-1 |
| 0.05 M disodium hydrogen phosphate solution | Disodium hydrogen phosphate Bring to volume with deionized water | 7.1 g L-1 |
| 0.05 M phosphate buffer (pH 7.0) | 0.05 M disodium hydrogen phosphate solution Bring to volume with 0.05 M monopotassium phosphate solution | 61.2 mL |
| 0.05 M phosphate buffer (pH 5.4) | 0.05M disodium hydrogen phosphate solution Bring to volume with 0.05 M monopotassium phosphate solution | 3 mL |
| 1.65 M sucrose solution | D-(+)-sucrose Bring to volume with phosphate buffer (pH 5.4) | 564.8 g L-1 |
| reagent solution | o-Dianisidin-Dihydrochlorid Ethanol (95%) | 25 mg 10 mL |
| Glucose reagent solution | Glucose oxidase Peroxidase Phosphate buffer (pH 7.0) reagent solution | 10.5 mg 3 mg 90 mL 10 mL |
Riferimenti
- Wucherpfennig, T., et al. . Advances in Applied Microbiology. 72, 89-136 (2010).
- Driouch, H., Hänsch, R., Wucherpfennig, T., Krull, R., Wittmann, C. Improved enzyme production by bio-pellets of Aspergillus niger: Targeted morphology engineering using titanate microparticles. Biotechnology and Bioengineering. 109, 462-471 (2012).
- Driouch, H., Roth, A., Dersch, P., Wittmann, C. Optimized bioprocess for production of fructofuranosidase by recombinant Aspergillus niger. Applied Microbiology and Biotechnology. 87, 2011-2024 (2010).
- Driouch, H., Roth, A., Dersch, P., Wittmann, C. Filamentous fungi in good shape: Microparticles for tailor-made fungal morphology and enhanced enzyme production. Bioengineered Bugs. 2, 100-104 (2011).
- Driouch, H., Sommer, B., Wittmann, C. Morphology engineering of Aspergillus niger for improved enzyme production. Biotechnology and Bioengineering. 105, 1058-1068 (2010).
- Kaup, B. -. A., Ehrich, K., Pescheck, M., Schrader, J. Microparticle-enhanced cultivation of filamentous microorganisms: Increased chloroperoxidase formation by Caldariomyces fumago as an example. Biotechnology and Bioengineering. 99, 491-498 (2008).
- Hirayama, M., Sumi, N., Hidaka, H. Purification and characterization of a fructooligosaccharide-producing beta-fructofuranosidase from Aspergillus niger ATCC 20611. Agricultural and Biological Chemistry. 53, 667-673 (2006).
- Rajoka, M. I., Yasmeen, A. Improved productivity of beta-fructofuranosidase by a derepressed mutant of Aspergillus niger form conventional and non-conventional substrates. World Journal of Microbiology and Biotechnology. 21, 471-478 (2005).
- Zuccaro, A., Götze, S., Kneip, S., Dersch, P., Seibel, J. Tailor-made fructooligosaccharides by a combination of substrate and genetic engineering. ChemBioChem. 9, 143-149 (2008).
- Huggett, A. S. G., Nixon, D. A. Use of glucose oxidase, peroxidase, and o-dianisidin in determination of blood and urinary glucose. The Lancet. , 270-368 (1957).
- Wucherpfenning, T., Hestler, T., Krull, R. Morphology engineering - Osmolality and its effect on Aspergillus niger morphology and productivity. Microb. Cell Fact. 10, (2011).
- Rasband, W. S. . ImageJ. , (1997).
- Papagianni, M. Quantification of the fractal nature of mycelial aggregation in Aspergillus niger submerged cultures. Microbial Cell Factories. 5, 5 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon