Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Una expresión adecuada y el general de la Plataforma para la producción de proteínas secretadas por las células humanas
* Estos autores han contribuido por igual
En este artículo
Resumen
En la era genómica post-humana, la disponibilidad de proteínas recombinantes en conformaciones nativas es crucial para la investigación estructural, funcional y terapéutico y el desarrollo. Aquí se describe una prueba a gran escala y sistema de expresión de proteínas en células embrionarias humanas de riñón 293T que se pueden utilizar para producir una variedad de proteínas recombinantes.
Resumen
Expresión de proteínas recombinantes en bacterias, típicamente E. coli, ha sido la estrategia de mayor éxito para la expresión cantidad miligramo de proteínas. Sin embargo, huéspedes procariotas son a menudo no es tan adecuado para la expresión de proteínas humanas, virales o eucarióticos, debido a la toxicidad de la macromolécula exterior, las diferencias en la maquinaria plegamiento de proteínas, o debido a la falta de modificaciones particulares co-o post-traslacional en bacterias. Los sistemas de expresión basados en levadura (P. pastoris o S. cerevisiae) 1,2, baculovirus infectado insecto (S. frugiperda o T. ni) las células 3, y libre de células in vitro en los sistemas de traducción 2,4 han sido utilizados con éxito para producir proteínas de mamíferos. Intuitivamente, la mejor coincidencia es utilizar un huésped mamífero para asegurar la producción de proteínas recombinantes que contengan las adecuadas modificaciones post-traduccionales. Un número de líneas de células de mamíferos (Kid embriónico humanoney (HEK) 293, C V-1 en células O RIGEN que transportan el S V40 Larget antígeno T (COS), de ovario de hámster chino (CHO), y otros) se han utilizado con éxito para sobreexpresar cantidades de miligramos de un número de proteínas humanas 5-9. Sin embargo, las ventajas de utilizar células de mamífero son a menudo contrarrestada por mayores costos, requisito de equipo de laboratorio especializado, menores rendimientos de proteínas, y los tiempos prolongados para desarrollar líneas celulares estables de expresión. El aumento de rendimiento y las proteínas que producen más rápido, mientras mantiene los costos bajos, son factores importantes para muchos laboratorios académicos y comerciales.
A continuación, describimos un tiempo-y costo-eficiente, procedimiento en dos partes para la expresión de proteínas secretadas por las células humanas de adherentes HEK 293T. Este sistema es capaz de producir microgramos de cantidades de miligramos de proteína funcional para estudios estructurales, biofísicos y bioquímicos. La primera parte, las construcciones de múltiples del gen de interés son producird en paralelo y transfectadas transitoriamente en células HEK 293T adherentes en pequeña escala. La detección y el análisis de la proteína recombinante secretada en el medio de cultivo celular se lleva a cabo mediante análisis Western blot utilizando anticuerpos disponibles comercialmente dirigidos contra una proteína etiqueta vector codificado purificación. Posteriormente, las construcciones adecuadas para la producción de proteínas en gran escala son transfectadas transitoriamente utilizando polietilenimina (PEI) en fábricas de células 10-capa. Las proteínas secretadas en litros volúmenes de medio condicionado se concentran en cantidades manejables utilizando filtración de flujo tangencial, seguido de purificación por cromatografía de afinidad anti-HA. La utilidad de esta plataforma se demuestra por su capacidad para expresar cantidades de miligramos de citoquinas, receptores de citoquinas, receptores de la superficie celular, factores intrínsecos de restricción, y glicoproteínas virales. Este método también fue utilizado con éxito en la determinación estructural de los inhibidores de la glucoproteína 5,10 triméricas virus Ébola.
2, se requiere. Este procedimiento puede ser expandido rápidamente a los sistemas de mayor complejidad, tales como co-expresión de los complejos de proteínas, antígenos y anticuerpos, la producción de partículas similares a virus de vacunas, o la producción de adenovirus o lentivirus para la transducción de líneas celulares difíciles.
Protocolo
1. Preparación del trabajo - Construcciones y Cultivos Celulares
Antes de iniciar el protocolo, el gen de interés debe ser codón optimizado para la expresión en células de mamíferos, y se clonó en un vector de expresión apropiado utilizando técnicas estándar de biología molecular. Con el fin de asegurar la máxima probabilidad de éxito para la expresión, múltiples variantes del gen de interés se deben generar. Muchos vectores de expresión de mamíferos están disponibles comercialmente y tiene varias etiquetas de purificación (polihistidina, la hemaglutinina, estreptavidina, HALO-Tag, glutatión S-transferasa, entre otros). Nosotros preferimos utilizar el vector pDISPLAY, que codifica para un promotor de citomegalovirus humano fuerte, una Ig κ señal de secreción, la etiqueta de la hemaglutinina de purificación, y tiene un anclaje transmembrana C-terminal para orientar la proteína a través de la vía secretora para su visualización en la membrana plasmática. Por lo general, insertar un codón de parada en frente de la transmembrana ancho vector codificador para permitir que la proteína a ser secretada en el medio condicionado.
Riñón embrionario humano (HEK) Células 293T están ampliamente disponibles y fáciles de cultivar y transfectadas. HEK 293T se utilizan habitualmente para la expresión de proteínas de mamíferos, pero son considerados altamente peligrosos y deben ser manejados al nivel de bioseguridad 2. Por favor, use ropa de protección personal adecuado, el trabajo debe realizarse en una cabina de bioseguridad aprobada mediante una técnica aséptica. Todos los desechos y las superficies deben ser desinfectados de acuerdo a las directrices institucionales y gubernamentales. Se recomienda que las células se probaron para la contaminación por micoplasmas antes de su uso. Las células pueden ser tratadas con ciprofloxacina (10 mg / ml) durante diez días para erradicar cualquier fuente de Mycoplasma spp. contaminación. Los protocolos generales para la propagación de las células HEK 293T se presentan por separado (Cuadro 1).
Consideraciones adicionales para la prueba y la expresión de proteínas a gran escala son reviewed en 11-15.
2. En pequeña escala de prueba Expresión
Una vez que las construcciones han sido diseñados y generados a pequeña escala transfecciones de prueba se puede realizar utilizando HEK 293T células; un esquema que resume el proceso se presenta a continuación (Fig. 1).
- Utilice T75 cm 2 o T225 cm 2 frascos de cultivo celular (dependiendo del número de expresiones de prueba que se realiza) para cultivar las células HEK 293T y dividir las celdas cada 2-3 días cuando las células son 100% confluente (Cuadro 1).
- De semillas de 2,5 x 10 5 HEK 293T células por pocillo en una placa de 6 pocillos y añadir 2 ml de DMEM con 1X penicilina / estreptomicina y 10% (v / v) FBS, remolino suavemente la placa para asegurar una dispersión de células en cada pocillo, y incubar durante la noche a 37 ° C en un 5% de CO 2 cámara humidificada.
- Cuando las células HEK 293T llegan al 40% de confluencia, deseche los medios de comunicación y añadir 2 ml de DMEM fresco con la pluma 1X / estreptomicina y 10% (v / v) FBS a los pozos. Realizarensayos de transfección.
- Alícuota de 90 l DMEM libre de suero en un tubo de microcentrífuga estéril de 1,5 ml. Pipetear 3 GeneJuice l en el DMEM libre de suero y mezclar suavemente el tubo (vórtice de los dedos). Incubar durante 5 minutos a temperatura ambiente.
- Añadir 1 g de MiniPrep purificó ADN plásmido (ADN de stock = 100 ng / l) en DMEM-GeneJuice mezcla, vórtice dedo, y se incuba durante 15 minutos a temperatura ambiente.
- Pipetear la mezcla de transfección gota a gota en las células HEK 293T, y agitar la placa de 6 pocillos con suavidad para permitir una distribución uniforme de la mezcla de transfección. Se incuba la placa de 6 pocillos a 37 ° C en un 5% de CO 2 cámara humidificada.
- Añadir 1 ml de DMEM con 1X penicilina / estreptomicina y 10% (v / v) de FBS a cada pocillo 24 horas después de la transfección y se incuba durante otras 48 horas (total 72 horas).
- Cosecha 1 ml de sobrenadante de cada pocillo a tres días después de la transfección y microcentrífuga las muestras a 16.000 g durante 10 minutos a temperatura ambiente. Llevar a cabo western blot como se detalla en el Cuadro 2. Las muestras pueden ser almacenadas a 4 ° C. La longitud de almacenamiento a 4 ° C es la proteína dependiente.
3. A gran escala de pruebas Expresión y purificación
Una vez que un constructo ha sido identificado expresión cantidad miligramo de proteína recombinante se consigue mediante la transfección de células adherentes PEI HEK 293T utilizando 10-capa fábricas de células (Fig. 2; 6360 cm 2 de superficie). Para los estudios más exploratorios, pequeñas fábricas de células T o frascos (Tabla 1) se puede utilizar.
- Purificar 1 mg de ADN para la transfección utilizando un kit maxiprep purificación del plásmido. Un cultivo de 500 ml durante la noche del XL-1 Blue células deben producir al menos 1 mg de ADN puro. Ver pureza de ADN mediante la medición A 260 / A 280; debe estar por encima de 1,8.
- Ampliar el alcance de las células HEK 293T a 2.0 x 10 8 células. Cada T225 cm 2 frasco crecido el 100% de confluencia contains y el promedio de ~ 2,25 x 10 7 células.
- Añadir 1,2 l DMEM con FBS al 5% (v / v) para una fábrica de células 10-capa. Añadir 2,0 x 10 8 HEK 293T células a la fábrica de células y distribuir las células uniformemente a todas las capas de la embarcación. Es muy difícil visualizar la confluencia de las células en la fábrica de células. Como una alternativa, establecer un T75 cm 2 matraz con un número apropiado de células, utilizando el número de células misma proporción de área de superficie tal como se realizó con el recipiente 10-capa. Vigilar este frasco de las tasas de crecimiento. Vea el vídeo asociado para obtener instrucciones sobre el manejo de la fábrica de células. Incubar durante una noche a 37 ° C con 5% de CO 2 para permitir la fijación y el crecimiento celular.
- Lleve a cabo a gran escala, cuando la transfección HEK 293T células adherentes son el 70% confluente. Prepare la mezcla de transfección de ADN-PEI (3:1 w / w PEI relación entre el ADN) en un gabinete de bioseguridad mediante un estéril T75 cm 2 frasco. Mezclar 0,84 mg de ADN con 84 ml de PBS estéril 1X, a continuación, añadir 2,5 ml de PEI (2.5 mg en total PEI). Incubar a temperatura ambiente durante 15 minutos. La solución debe ser nublado.
- Verter la mezcla de transfección PEI-ADN lentamente en la fábrica de células y distribuir a fondo sobre todas las capas de la embarcación. Opcional: para los rendimientos de expresión mayores, añadir el ácido valproico (4 mM concentración final). Incubar a 37 ° C con 5% de CO 2 durante cuatro días.
- Cosecha sobrenadante cuatro días después de la transfección. Centrifugar los medios condicionados a 6000 x g durante 30 minutos a 4 ° C. Además filtrar el sobrenadante utilizando un aparato de vacío 0,22 micras Stericup filtro. La fábrica de células de 10 capas pueden ser reutilizados, véase el recuadro 3 para las instrucciones de limpieza. Es fundamental que la limpieza se inicia inmediatamente después de la cosecha sobrenadante, no dejes que las células en seco sobre la superficie del vaso.
- Se concentra el sobrenadante a 75 ml utilizando el sistema Centramate tangencial filtración de flujo.
- Añadir 500 ml de PBS y se re-concentrar a 75 ml. Repita tres Additional veces para amortiguar completamente intercambiar la muestra.
- Equilibrar un 1 ml de anti-HA columna de afinidad con 1X PBS y se aplican muestra concentrada por flujo por gravedad a una velocidad <1 ml / min.
- Lavar la columna con 30 ml de 1X PBS-Tween 20.
- Disolver HA péptido en 1X PBS (1,0 mg / ml) y se incuba a 37 ° C.
- Aplicar 1 ml del péptido HA a la columna de anti-HA y permitir que el péptido a fluir en la resina. Recoger el flujo a través. Parar el flujo cuando la solución de péptido alcanza la altura del lecho.
- Incubar toda la anti-HA columna a 37 ° C durante 15 minutos.
- Repita el paso 12 dos veces más.
- Aplicar 1 ml de 1X PBS a la columna de anti-HA y el flujo en la resina hasta que alcanza la altura del lecho. Recoger el flujo a través.
- Regenerar la columna anti-HA con 10 ml de glicina 0,1 M pH 2,2. Lavar con 10 ml de PBS y la columna de afinidad tienda a 4 ° C en PBS con 0,02% (w / v) de NaN 3.
- Realizar análisis SDS-PAGE y la piscina fractions en consecuencia. Nota: El péptido HA va a interferir con las mediciones de concentración de proteínas por A 280 o Bradford. Para estimar la cantidad de proteína presente, la carga 5, 10, 15, 25 g de BSA en el gel de SDS-PAGE como un estándar y comparar las intensidades de las bandas.
Pasos 9-17 se puede repetir para capturar proteína adicional a partir del medio condicionado.
4. Los resultados representativos
En este artículo se describen y demuestran una plataforma de expresión conveniente para miligramos cantidad de producción de proteínas humanas que posteriormente pueden ser utilizados para estudios estructurales y funcionales. La detección de la proteína humana construye utilizando células HEK 293T en placas de 6 pocillos es eficiente y eficaz en la identificación de conceptos que permiten una producción a gran escala. Vectores de expresión comerciales pueden ser transfectadas de manera eficiente en células HEK 293T usando una variedad de reactivos de transfección, tales como GeneJuice, HD FuGene o PE I. Se recomienda el uso de un reactivo de transfección comercial, como GeneJuice o HD FuGene, para las expresiones de ensayo, ya que estos reactivos son más eficaces para pobres que expresan proteínas (Fig. 3). Las construcciones seleccionadas para la expresión a mayor escala debería caracterizarse por una sola banda, intensidad fuerte, correspondiente al peso molecular adecuado en la transferencia Western (Fig. 3). Las glicoproteínas pueden migrar como una banda más amplia debido a la heterogeneidad en la glicosilación. Hemos demostrado que una variedad de macromoléculas, que van desde las glicoproteínas virales, citoquinas, receptores de citoquinas y otras proteínas de superficie, puede ser expresado y purificado para producir cantidades millgram de proteína utilizando esta plataforma expresión general (Fig. 4).
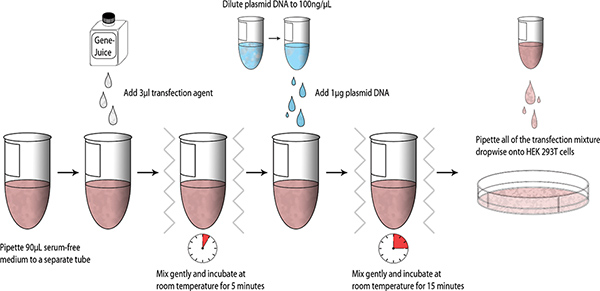
Figura 1. Esquema de flujo de trabajo de los pequeños transfecciones.tp_upload/4041/4041fig1large.jpg "target =" _blank "> Haga clic aquí para ver más grande figura.

Figura 2. Corning de 10 capas CellSTACK para ampliar la escala de expresión de la proteína. Cada capa contiene 636 cm 2 de superficie para la adhesión celular. Un estándar de laboratorio incubadora de CO 2 (6.0 pies cúbicos) cómodamente llevará a cabo cuatro de 10 fábricas de células de la capa.
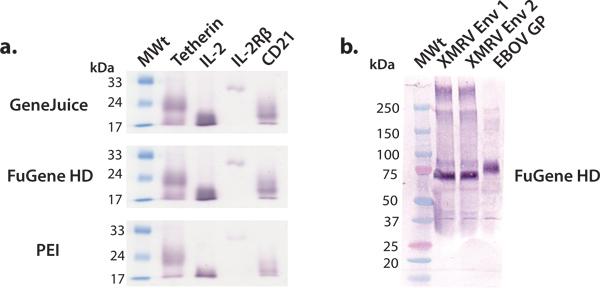
.. Figura 3 a pequeña escala la expresión de varias proteínas secretadas Se realizó una serie de expresiones de prueba a pequeña escala que utilizan reactivos de transfección comunes:. GeneJuice, HD FuGene y PEI (a) de detección de Western blot de una selección de las proteínas celulares humanos (tetherin), los receptores (IL-2R subunidad β) y citoquinas (IL-2). Tetherin es una glicoproteína de membrana humana que limita la liberación denacientes VIH-1 viriones 16. El dominio extracelular de tetherin existe como una glicosilada, por disulfuro dímero de ~ 36 kDa. En condiciones reductoras, como se muestra aquí, tetherin migra como un monómero con un peso molecular aparente de ~ 22 kDa. La interleucina-2 (IL-2) es una citoquina (~ 17 kDa) que participan en la proliferación de linfocitos 17. También está relacionada con la IL-2 complejo receptor, de que la IL-2R βsubunit (~ 26 kDa) es un componente 18. CD21 es una proteína de membrana implicados en la activación y la maduración de las células B por el sistema del complemento, y es también un receptor para el virus de Epstein-Barr. El dominio extracelular de CD21 glicosilado migra como un monómero con un peso molecular aparente de aproximadamente 20 kDa. (B) detección de transferencia Western de glicoproteínas de superficie seleccionadas virales (XMRV Env y GP ebolavirus). XMRV y el virus Ébola glicoproteínas transmembrana de anclaje (suprimido) existen en la membrana viral como picos triméricas y están involucrados en la fijación de la célula huéspedy la fusión. El ectodominio de XMRV Env y GP EBOV están muy decoradas con N-glicanos y migrar a las aparentes pesos moleculares de 70 kDa y 75, respectivamente.

Figura 4. Purificado las proteínas celulares humanos a gran escala HEK 293T culturas. Todas las proteínas se expresaron mediante una fábrica de células 10-capa, y se concentró y se purificó mediante cromatografía de anti-HA. Como se muestra por Coomassie manchado de análisis SDS-PAGE, los dominios extracelulares de los receptores de interleuquina-2 (IL-2R) α y γ subunidades migrar a pesos moleculares de 40 kDa y 46 kDa, respectivamente. El dominio extracelular de tetherin migra como un dímero, bajo condiciones no reductoras, con un peso molecular aparente de 36 kDa. Obsérvese que hay una cierta contaminación de BSA que aparece en un peso molecular aparente de 60 kDa. Además, la heterogeneidad de los glicanos unidos a N presentes en tetherin,La IL-2R α e IL-2R γ banda causas ampliación en el gel de SDS-PAGE. Estos complejos de tipo N-glicanos se puede eliminar mediante péptido N-glicosidasa F.
| Buque | Superficie |
| 6-así placa | 9,5 cm 2 (cada pocillo) |
| Placas de 100 mm | 55 cm 2 |
| 245 mm platos | 500 cm 2 |
| T75 cm 2 frasco | 75 cm 2 |
| T175 cm 2 frasco | 175 cm 2 |
| T225 cm 2 frasco | 225 cm 2 |
| Rodillo de botella ordinario | 850 cm 2 |
| Rodillo de botella expandida superficie | 1700 cm 2 |
| 1-capa CellSTACK | 636 cm 2 |
| 2-capa CellSTACK | 1272 cm 2 |
| 5-capa CellSTACK | 3180 cm 2 |
| 10-capa CellSTACK | 6360 cm 2 |
| 40-capa CellSTACK | 25.440 cm 2 |
Tabla 1. Comparación de los recipientes de cultivo de células utilizadas para la expresión de proteínas.
Lista de Recetas de reactivos
Ciprofloxacina 100X Para la solución de 10 ml, añadir 10 ml de agua desionizada a 10 mg de ciprofloxacino. Añadir 10 l de HCl 6N para disolver completamente la ciprofloxacina.
PEI (1 mg / ml) durante una solución de 100 ml, se disuelven 100 mg de 25 kDa lineal PEI en agua desionizada y se calienta a 80 ° C. Solución de enfriar a temperatura ambiente, ajustar el pH a 7.2, filtro de 0,22 um esterilizar, alícuota y congelar a -20 ° C durante long plazo de almacenamiento.
1X PBS durante 1 L solución acuosa: 8,0 g de NaCl, 0,2 g de KCl, 1,4 g de Na 2 HPO 4 (anhidro), 0,24 g de KH 2 PO 4. Ajustar el pH de la solución a 7,4 y llenar a 1,0 L.
1X PBS-Tween-20 Para la solución acuosa L 1: 8,0 g de NaCl, 0,2 g de KCl, 1,4 g de Na 2 HPO 4 (anhidro), 0,24 g de KH 2 PO 4, 1 ml de Tween-20. Ajustar el pH de la solución a 7,4 y llenar a 1,0 L.
1X tampón de transferencia Para la solución acuosa L 1: 3,0 g de Tris base, 14,4 g de glicina, 150 ml de metanol.
1X SDS-PAGE funcionamiento de amortiguación Para la solución acuosa de L 1: 3,0 g de Tris base, 14,4 g de glicina, 1,0 g de SDS.
SDS-PAGE reducir tampón de muestra para 10 ml de solución: 0,6 g de SDS, 3 ml de glicerol, 1,8 ml de 1,0 Tris-HCl pH 6,8, 1 mg de azul de bromofenol, 5% (v / v) 2-mercaptoetanol.
Cuadro 1. Los protocolos generales para la propagación de células- Se cultivan las células HEK 293T en medio modificado de Dulbecco Eagle (DMEM) suplementado con 10% (v / v) de suero bovino fetal (FBS), pluma 1X / estreptomicina a 37 ° C en un 5% de CO 2-humidificado atmósfera.
- Observar las células bajo un microscopio invertido. Cuando las células son al 100% de confluencia, retirar y desechar el medio de cultivo.
- Lavar las células con 5 ml de PBS estéril 1X para eliminar trazas de suero. Deseche el lavado con PBS.
- Añadir 2 ml de 0,05% (w / v) de tripsina-EDTA solución a un matraz de 2 cm T225 (o 1 ml de 0,05% (w / v) de tripsina-EDTA para T75 cm 2 matraz) y se incuba a temperatura ambiente hasta que las células separar desde la superficie. También es posible utilizar estéril 1X PBS-EDTA para separar las células HEK 293T.
- Añadir 13 ml de DMEM con FBS al 10% (v / v) a un matraz de 2 cm T225 (o 9 ml de DMEM con 10% (v / v) de FBS para T75 cm 2 matraz) para inhibir la reacción de tripsina.
- Dividir canas 01:05. Para un T225 cm 2 matraz, añadir 3 ml de suspensión celular a 27 ml de DMEM con 1X penicilina / estreptomicina y 10% (v / v) de FBS en un recipiente de cultivo nuevo. Para un T75 cm 2 matraz, añadir 2 ml de suspensión celular a 8 ml de medio de cultivo fresco. Incubar cultivos a 37 ° C en un 5% de CO 2-humidificado atmósfera. Las células deben crecer a 100% de confluencia en dos días.
Cuadro 2. Western blot
- Añadir 10 l de SDS-PAGE tampón de muestra para la reducción de 30 l sobrenadante de cultivo celular. Las muestras de carga y marcadores de peso molecular preteñidos en geles de poliacrilamida y electroforesis utilizando 1X tampón de SDS-PAGE funcionando a 175 V durante 1 hora o hasta que los marcadores de peso molecular son bien resueltas.
- Remoje el PVDF Immobilon-P membrana en 100% de metanol durante 1 minuto para activar.
- Montar un aparato de western blot. Asegurarse de la membrana de PVDF se enfrenta el electrodo positivo y mantener todos los componentes húmedos con tampón de transferencia 1X. Avoid burbujas entre el gel de poliacrilamida y la membrana.
- Llenar completamente la cámara de electroforesis con tampón de transferencia 1X y transferencia durante 1 hora a 100 V.
- Bloque de la membrana con 5% (w / v) de leche descremada en 1X PBS-Tween 20 durante 1 hora a temperatura ambiente, o durante la noche a 4 ° C.
- Incubar con el anticuerpo monoclonal primario (es decir dilución 1:1000 anti-HA AcMo u otro anticuerpo apropiado) disuelto en 5% (w / v) de leche descremada en 1X PBS-Tween 20 durante 1 hora a temperatura ambiente o durante la noche a 4 ° C.
- Lavar las membranas en 1X PBS-Tween 20 durante 10 minutos. Repita dos veces adicionales.
- Se incuba con un anticuerpo monoclonal secundario conjugado con fosfatasa alcalina (1:1000 dilución en 5% (w / v) de leche descremada en 1X PBS-Tween 20) durante 1 hora a temperatura ambiente, o durante la noche a 4 ° C.
- Lavar las membranas en 1X PBS-Tween 20 durante 10 minutos. Repita dos veces adicionales.
- Colocar la membrana en un recipiente pequeño, añadir 5 ml de fosfatasa alcalina substraTE (BCIP / NBT) solución. Desarrollo del color debe ocurrir dentro de 1-5 minutos. Una vez que la intensidad de la banda deseada se alcanza, se lava con agua desionizada y secar al aire. El color puede desvanecerse con el tiempo, un barrido de las membranas, una vez secos.
Cuadro 3. La limpieza y el reciclaje de los vasos de cultivo celular
Mientras fábricas de células están diseñados para ser de un solo uso, estos recipientes se pueden reciclar para adicionales a gran escala transfecciones utilizando el protocolo de limpieza siguiente:
- Inmediatamente después de decantar el sobrenadante de la fábrica de células 10-capa, añadir 20% (v / v) de cloro y agitar enérgicamente para separar las células. Incubar a temperatura ambiente durante tres horas.
- Vaciar el recipiente y añadir fresco 20% (v / v) de cloro y se incuba a temperatura ambiente durante la noche.
- Vaciar el recipiente y se lava con 1,5 L de agua desionizada. Repita tres veces.
- Vacíe la fábrica de células de 10 capas y añadir 0,5 l de PBS estéril 1X suplementado con 10X antibiótico / antimicótico solución. Almacenar el recipiente a temperatura ambiente y reemplazar las tapas de ventilación para el llenado de los puertos (estándar 33 mm tapas roscadas) antes del uso siguiente. Nota: todas las capas deben ser completamente claro después de la limpieza, si no, no lo use y deseche la fábrica de células de acuerdo con las directrices institucionales.
Discusión
Las fábricas de células 10-capa son un buque eficaz para la producción de cantidades de miligramos de proteína. Una ventaja importante del uso de la fábrica de células sobre otras embarcaciones tradicionales, tales como botellas de rodillos, matraces de agitación o spinner frascos, es que no requieren la compra de cualquier equipo de laboratorio adicional. Un estándar de incubadora de CO 2 (aproximadamente 6.0 pies cúbicos) fácilmente acomodar a cuatro capas de 10 fábricas de células (Fig....
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por un Ontario Tratamiento del VIH operativo de red Beca de Investigación (ROG-G645) y los Institutos Canadienses de Salud Investigator Award Nueva investigación (MSH-113554) de JEL, y la Universidad de Toronto Becas a la HA, la FCA, y JDC. Los autores desean agradecer a Marnie Fusco, Abelson Dafna y la Dra. Erica Saphire Ollmann en el Instituto de Investigación Scripps (La Jolla, CA) para las células que proporcionan, los virus Ébola vector de expresión GP y asesoramiento general.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre de reactivo | Empresa | Número de catálogo | Comentarios |
| La fosfatasa alcalina (BCIP / NBT) solución de sustrato líquido | Sigma | B6404 | |
| Antibiótico / antimicótico, 100X | Invitrogen | 15240062 | |
| Anti-HA matriz de afinidad, el clon 3F10 | Roche | 1815016 | |
| Anti-HA AcM murino, el clon 16B12 | Covance | MMS-101P | |
| Frasco de cultivo celular, T75 cm 2 de cultivo de tejidos tratados | Corning | 430641 | |
| Frasco de cultivo celular, T225 de 2 cm de cultivo de tejidos tratados | Corning | 431082 | |
| Placas de cultivo celular ,6-de cultivo de tejidos tratados | Corning | 3516 | |
| Fábrica de la célula, de 10 capas CellSTACK | Corning | 3312 | |
| Centramate Omega 5K cassette | Palio | OS005C12 | |
| Centramate Omega 30K cassette | Palio | OS030C12 | |
| Cromatografía en columna de vidrio, 1.0x10 cm | Kontes | 4204001010 | |
| Ciprofloxacino | Sigma | 17850 | |
| De CO 2 | |||
| Dulbecco modificado de Eagle medio (DMEM) | Sigma | D5796 | |
| Suero fetal bovino (FBS), inactivado por calor | Invitrogen | 12484-028 | |
| FuGENE HD reactivo de transfección | Promega | 4709691001 | |
| GeneJuice reactivo de transfección | EMD / Merck | 70967-6 | |
| Glicina | Sigma | G8898 | |
| Cabra anti-ratón IgG F (ab ') 2 alcalina | Thermo Scientific | 31324 | |
| anticuerpo conjugado con fosfatasa | |||
| La hemaglutinina (HA) péptido, 100 mg | Genscript | síntesis de la costumbre | |
| (Secuencia: YPYDVPDYA, y el 95% de pureza) | |||
| HEK 293T | ATCC | CRL-11268 | |
| Household cloro (4% w / v hipoclorito de sodio) | varias marcas de fábrica están disponibles | ||
| Immobilon-P membrana PVDF | Millipore | IPVH07850 | |
| MiniPrep kit de purificación de plásmido, PureLink rápida | Invitrogen | K2100-11 | |
| Maxiprep kit de purificación de plásmido, PureLink HiPure | Invitrogen | K2100-07 | |
| NaN 3 | Sigma | S8032 | |
| pDISPLAY vector de expresión | Invitrogen | V660-20 | |
| La penicilina / estreptomicina (penicilina / estreptomicina), 100X | Invitrogen | 15140-122 | |
| Tampón fosfato salino (PBS) estéril 1X | Sigma | D8537 | |
| Polietilenimina (PEI), lineales 25 kDa | Polyscience | 23966 | |
| Leche descremada en polvo en seco | Clavel | ||
| Stericup-GP de vacío PSE unidad de filtración, | Millipore | SCGPU05RE | |
| 0,22 mm, 500 ml de capacidad | |||
| El azul tripán | Invitrogen | 15250061 | |
| Tripsina-EDTA, 0,05% (w / v) | Invitrogen | 25300-054 | |
| Tween-20 al | Sigma | P7949 | |
| El ácido valproico | Sigma | P4543 | |
| Centramate sistema de flujo tangencial | Palio | ||
| CO 2 humidificado incubadora, 6.0 pies cúbicos estándar. pie | varias marcas de fábrica están disponibles | ||
| Electroforesis y transferencia de la unidad | varias marcas de fábrica están disponibles | ||
| Incubadora, 37 ° C | varias marcas de fábrica están disponibles |
Referencias
- Celik, E., Calik, P. Production of recombinant proteins by yeast cells. Biotechnol. Adv. , (2011).
- Yokoyama, S. Protein expression systems for structural genomics and proteomics. Curr. Opin. Chem. Biol. 7, 39-43 (2003).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J. Struct. Biol. 172, 55-65 (2010).
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: Applications come of age. Biotechnol. Adv. , (2011).
- Lee, J. E. Structure of the Ebola virus glycoprotein bound to an antibody from a human survivor. Nature. 454, 177-182 (2008).
- Bowden, T. A. Structural basis of Nipah and Hendra virus attachment to their cell-surface receptor ephrin-B2. Nat. Struct. Mol. Biol. 15, 567-572 (2008).
- Evans, M. J., Hartman, S. L., Wolff, D. W., Rollins, S. A., Squinto, S. P. Rapid expression of an anti-human C5 chimeric Fab utilizing a vector that replicates in COS and 293 cells. J. Immunol. Methods. 184, 123-138 (1995).
- Ye, J. High-level protein expression in scalable CHO transient transfection. Biotechnol. Bioeng. 103, 542-551 (2009).
- Wurm, F. M. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol. 22, 1393-1398 (2004).
- Lee, J. E., Fusco, M. H., Hessell, A. J., Burton, D. R., Saphire, E. O. Techniques and tactics used in determining the structure of trimeric, prefusion Ebola virus GP. Acta Cryst. 65, 1162-1180 (2009).
- Aricescu, A. R. Eukaryotic expression: developments for structural proteomics. Acta. Crystallogr. D Biol. Crystallogr. 62, 1114-1124 (2006).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta. Crystallogr. D Biol. Crystallogr. D62, 1243-1250 (2006).
- Chang, V. T. Glycoprotein structural genomics: solving the glycosylation problem. Structure. 15, 267-273 (2007).
- Lee, J. E., Fusco, M. H., Saphire, E. O. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nature Protocols. 4, 592-604 (2009).
- Nettleship, J. E., Rahman-Huq, N., Owens, R. J. The production of glycoproteins by transient expression in Mammalian cells. Methods Mol. Biol. 498, 245-263 (2009).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Nakamura, Y. Heterodimerization of the IL-2 receptor beta- and gamma-chain cytoplasmic domains is required for signalling. Nature. 369, 330-333 (1994).
- Wang, X., Rickert, M., Garcia, K. C. Structure of the quaternary complex of interleukin-2 with its alpha, beta, and gammac receptors. Science. 310, 1159-1163 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados