Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Удобный и общее выражение платформы для производства секретируемых белков из клеток человека
В этой статье
Резюме
В пост-человеческой эры геномики, наличие рекомбинантных белков в родной конформации имеет решающее значение для структурных, функциональных и терапевтических исследований и разработок. Здесь мы описываем испытаний и масштабные экспрессии белков системы человеческих эмбриональных почек 293T клетки, которые могут быть использованы для производства различных рекомбинантных белков.
Аннотация
Recombinant protein expression in bacteria, typically E. coli, has been the most successful strategy for milligram quantity expression of proteins. However, prokaryotic hosts are often not as appropriate for expression of human, viral or eukaryotic proteins due to toxicity of the foreign macromolecule, differences in the protein folding machinery, or due to the lack of particular co- or post-translational modifications in bacteria. Expression systems based on yeast (P. pastoris or S. cerevisiae) 1,2, baculovirus-infected insect (S. frugiperda or T. ni) cells 3, and cell-free in vitro translation systems 2,4 have been successfully used to produce mammalian proteins. Intuitively, the best match is to use a mammalian host to ensure the production of recombinant proteins that contain the proper post-translational modifications. A number of mammalian cell lines (Human Embryonic Kidney (HEK) 293, CV-1 cells in Origin carrying the SV40 larget T-antigen (COS), Chinese Hamster Ovary (CHO), and others) have been successfully utilized to overexpress milligram quantities of a number of human proteins 5-9. However, the advantages of using mammalian cells are often countered by higher costs, requirement of specialized laboratory equipment, lower protein yields, and lengthy times to develop stable expression cell lines. Increasing yield and producing proteins faster, while keeping costs low, are major factors for many academic and commercial laboratories.
Here, we describe a time- and cost-efficient, two-part procedure for the expression of secreted human proteins from adherent HEK 293T cells. This system is capable of producing microgram to milligram quantities of functional protein for structural, biophysical and biochemical studies. The first part, multiple constructs of the gene of interest are produced in parallel and transiently transfected into adherent HEK 293T cells in small scale. The detection and analysis of recombinant protein secreted into the cell culture medium is performed by western blot analysis using commercially available antibodies directed against a vector-encoded protein purification tag. Subsequently, suitable constructs for large-scale protein production are transiently transfected using polyethyleneimine (PEI) in 10-layer cell factories. Proteins secreted into litre-volumes of conditioned medium are concentrated into manageable amounts using tangential flow filtration, followed by purification by anti-HA affinity chromatography. The utility of this platform is proven by its ability to express milligram quantities of cytokines, cytokine receptors, cell surface receptors, intrinsic restriction factors, and viral glycoproteins. This method was also successfully used in the structural determination of the trimeric ebolavirus glycoprotein 5,10.
In conclusion, this platform offers ease of use, speed and scalability while maximizing protein quality and functionality. Moreover, no additional equipment, other than a standard humidified CO2 incubator, is required. This procedure may be rapidly expanded to systems of greater complexity, such as co-expression of protein complexes, antigens and antibodies, production of virus-like particles for vaccines, or production of adenoviruses or lentiviruses for transduction of difficult cell lines.
протокол
1. Подготовительные работы - Конструкции и клеточных культур
Перед началом протокола гена должны быть кодон оптимизированы для экспрессии в клетках млекопитающих, и клонируют в соответствующий вектор экспрессии с использованием стандартных методов молекулярной биологии. Для того, чтобы обеспечить самые высокие шансы для успешного выражения, несколько вариантов гена должны быть созданы. Многие векторов экспрессии млекопитающих имеются в продаже и имеют различные теги очистки (polyhistidine, гемагглютинин, стрептавидина, HALO-тегов, глутатион S-трансферазы и др.). Мы предпочитаем использовать pDISPLAY вектор, который кодирует сильный человек промоутер цитомегаловирус, Ig κ секреции сигнала, гемагглютинин очистки теги и имеет С-концевой трансмембранный якорь для целевой белок через секреторный путь для отображения на плазматической мембране. Мы обычно вставить стоп-кодон перед вектором в кодировке трансмембранного анчот, чтобы белок, секретируется в кондиционированной среды.
Человеческих эмбриональных почек (НЕК) 293T клеток, широко доступны и легко культивировать и трансфекции. HEK 293T обычно используются для выражения млекопитающих белков, но считаются биологически опасными и должны решаться на уровне биобезопасности 2. Пожалуйста, носите надлежащую индивидуальную защитную одежду, работа должна быть выполнена в утвержденных кабинет биобезопасности использованием асептических условиях. Все отходы и поверхности должны быть продезинфицированы в соответствии с институциональными и государственных принципов. Рекомендуется, что клетки быть проверены на заражение микоплазмой перед использованием. Клетки могут быть обработаны с ципрофлоксацин (10 мкг / мл) в течение десяти дней по искоренению любого источника микоплазмы SPP. загрязнения. Генеральный протоколов для распространения HEK 293T клеток представлены отдельно (вставка 1).
Дополнительная информация для испытаний и масштабные экспрессии белка являются revieweг в 11-15.
2. Малые испытания Выражение
После конструкций были разработаны и генерируется небольшой трансфекции испытания могут быть выполнены с использованием HEK 293T клеток, схема обобщения процесс представлен ниже (рис. 1).
- Используйте T75 см 2 и T225 см 2 клеточной культуры фляги (в зависимости от количества испытаний выражения должны быть выполнены) для выращивания клеток HEK 293T и разделить клетки каждые 2-3 дня, когда клетки на 100% сливной (вставка 1).
- Семенной 2,5 х 10 5 HEK 293T клеток на лунку в 6-луночного планшета и добавить 2 мл DMEM с 1X ручка / стрептококк и 10% (объем / объем) FBS, вращать пластину осторожно, чтобы обеспечить даже клетка разгона в каждую лунку, и инкубировать в течение ночи при 37 ° С в 5% CO 2 влажной камере.
- Когда HEK 293T клеток до 40% слияния, отказаться от средств массовой информации и добавить свежие 2 мл DMEM с 1X ручка / стрептококк и 10% (объем / объем) FBS в скважинах. Выполнятьтрансфекции анализов.
- Алиготе 90 мкл бессывороточной DMEM в стерильный 1,5 трубки микроцентрифужных мл. Внесите 3 мкл GeneJuice в бессывороточной DMEM и аккуратно перемешать трубу (палец вихря). Выдержите в течение 5 минут при комнатной температуре.
- Добавить 1 мкг MiniPrep очищенной ДНК плазмиды (ДНК акции = 100 нг / мкл) в DMEM-GeneJuice смеси, палец вихрь, и инкубировать в течение 15 минут при комнатной температуре.
- Пипеткой по каплям трансфекции смесь на HEK 293T клеток, и вихрь 6-луночного планшета мягко, чтобы равномерное распределение трансфекции смеси. Инкубируйте 6-луночного планшета при 37 ° С в 5% CO 2 влажной камере.
- Добавить 1 мл свежей DMEM с 1X ручка / стрептококк и 10% (объем / объем) FBS в каждую лунку 24 часа после трансфекции и инкубировать в течение еще 48 часов (всего 72 часов).
- Урожай 1 мл супернатанта из каждой лунки по три дня после трансфекции и микроцентрифужных образцов при 16000 г в течение 10 минут при комнатной температуре. Провести Уэсакрачка блот анализ, как описано во врезке 2. Образцы могут храниться при температуре 4 ° C. Срок хранения при 4 ° С белок зависимым.
3. Крупномасштабные испытания выражения и очистка
После того, как конструкция была определена миллиграмм выражение количества рекомбинантного белка достигается PEI трансфекции сторонник HEK 293T клеток с использованием 10-клеточного слоя заводов (рис. 2, 6360 см 2 площади поверхности). Для получения дополнительной поисковых исследований, меньше ячейка завода или Т-колбы (табл. 1) могут быть использованы.
- Очистите 1 мг ДНК трансфекции с использованием MaxiPrep плазмиды комплект очистки. 500 мл ночной культуры в XL-1 Blue клетки должны производить не менее 1 мг чистого ДНК. Проверьте чистоту ДНК путем измерения 260/280 соотношение, должна быть выше 1,8.
- Масштабирование HEK 293T клеток до 2,0 х 10 8 клеток. Каждый T225 см 2 колбы выросли на 100% слияния сотрудничестваntains и среднем ~ 2,25 х 10 7 клеток.
- Добавить 1,2 л DMEM с 5% (объем / объем) FBS к 10-клеточного слоя завода. Добавить 2,0 х 10 8 HEK 293T клетки к клетке завода и распространять клетки равномерно на все слои сосуда. Очень трудно представить себе слияния клеток в клетки завода. В качестве альтернативы созданию T75 см 2 колбы с соответствующим числом клеток, используя тот же номер мобильного на поверхность соотношение области, проводится с 10-слоя судна. Мониторинг этой колбы для роста. См. связанный видео инструкции по обращению с фабрики ячеек. Выдержите в течение ночи при 37 ° C с 5% CO 2, чтобы для прикрепления клеток и роста.
- Выполните крупномасштабных трансфекции, когда сторонник HEK 293T клеток на 70% вырожденная. Подготовка PEI-ДНК трансфекции смесь (3:1 / в PEI в отношении ДНК) в кабинете биологической безопасности с использованием стерильного T75 см 2 колбы. Смешать 0,84 мг ДНК с 84 мл стерильного 1X PBS, затем добавьте 2,5 мл PEI (2.5 мг общего PEI). Инкубируйте при комнатной температуре в течение 15 минут. Решение должно стать мутной.
- Вылейте PEI-ДНК трансфекции смесь медленно в клетки завода и тщательно распределять по всем слоям судна. Дополнительно: для повышения урожайности выражения, добавьте вальпроевая кислота (4 мм конечная концентрация). Инкубировать при температуре 37 ° C с 5% CO 2 в течение четырех дней.
- Урожай супернатант четыре дня после трансфекции. Центрифуга кондиционированной среде при 6000 х г в течение 30 минут при 4 ° C. Дальнейшая фильтрация супернатант использованием 0,22 мкм Stericup вакуумный фильтр аппарата. 10-клеточного слоя завода можно использовать повторно, см. вставку 3 для очистки инструкции. Это ключ, очистка начинается сразу же после сбора урожая супернатант, не позволяют клеткам сухой на поверхности сосуда.
- Концентрат супернатант до 75 мл, используя Centramate тангенциальной системой фильтрации потока.
- Добавить 500 мл PBS и вновь сосредоточиться на 75 мл. Повторить три допРациональная раз, чтобы полностью буфер обмена образца.
- Уравновешиваются 1 мл анти-HA аффинной колонке с 1X PBS и применять концентрированные образцы самотеком в размере <1 мл / мин.
- Промойте колонку с 30 мл 1X PBS-Tween20.
- Растворите HA пептида в 1X PBS (1,0 мг / мл) и инкубировать при температуре 37 ° C.
- Применяют по 1 мл пептида га анти-ГА и колонки позволяют пептид поступать в смоле. Соберите потока через. Остановить поток, когда пептид решение достигает высоты кровати.
- Выдержите все анти-HA колонки при 37 ° С в течение 15 минут.
- Повторите Шаг 12 два раза.
- Применяют по 1 мл PBS 1X к анти-HA колонки и впадают в смолу, пока не достигнет высоты кровати. Соберите потока через.
- Восстановить анти-HA колонку с 10 мл 0,1 М глицина рН 2.2. Промыть 10 мл PBS и близость магазина колонке при 4 ° С в PBS с 0,02% (вес / объем) NaN 3.
- Выполните SDS-PAGE анализа и бассейн еractions соответственно. Примечание: пептид HA будет мешать измерения концентрации белка на 280 или Брэдфорда. Чтобы оценить количество белка настоящее время нагрузка 5, 10, 15, 25 мкг BSA на SDS-PAGE гель в качестве стандарта и сравнить интенсивности полос.
Шаги 9-17 можно повторять, чтобы захватить дополнительный белок из кондиционированной среды.
4. Представитель Результаты
В этой статье мы описываем и продемонстрировать удобную платформу для выражения миллиграмм-серийное производство белков человека, которые могут быть впоследствии использованы для структурных и функциональных исследований. Скрининг человеческого белка конструкций использованием HEK 293T клеток в 6-луночных является эффективным и действенным в определении конструкции поддаются больших масштабах производства. Коммерческая векторов выражение может быть эффективной трансфекции в клетки HEK 293T с использованием различных реагентов трансфекции, таких как GeneJuice, FuGene HD или PE I. Мы рекомендуем использовать коммерческие реагенты трансфекции, таких как GeneJuice или FuGene HD, для тестирования выражений, так как эти реагенты являются более эффективными для бедных выражения белков (рис. 3). Конструкции выбраны для увеличения масштаба выражение должно характеризоваться единой сильной интенсивности полос, соответствующих надлежащей молекулярного веса на западной пятном (рис. 3). Гликопротеины могут мигрировать в широком группу из-за неоднородности в гликозилирования. Мы показали, что различные макромолекулы, начиная от вирусных гликопротеинов, цитокины, рецепторы цитокинов и других белков поверхности, может быть выражена и очищается для получения millgram количества белка с помощью этой общей платформе выражении (рис. 4).
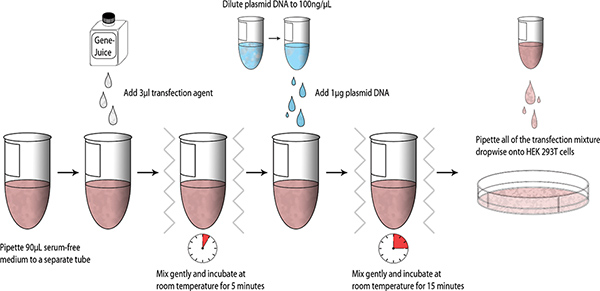
Рисунок 1. Workflow схема мелких трансфекции.tp_upload/4041/4041fig1large.jpg "целевых =" _blank "> Нажмите здесь, чтобы увеличить цифру.

Рисунок 2. Corning 10 CellSTACK слой для увеличения масштаба экспрессии белка. Каждый слой содержит 636 см 2 площади поверхности для мобильного приложения. Стандартных лабораторных CO 2 инкубатор (6,0 куб. Футов) будет комфортно провести четыре 10-слой заводов клетки.
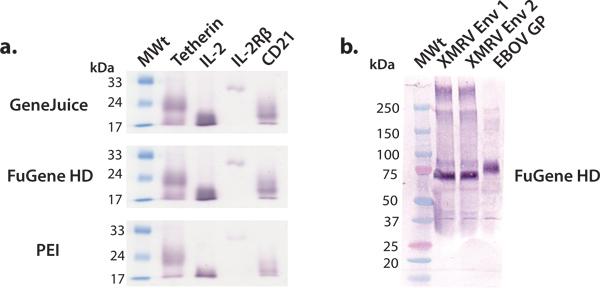
. Рисунок 3. Малые выражения различных секретируемых белков Мы провели ряд мелких тест выражений с помощью обычных реагентов трансфекции. GeneJuice, FuGene HD и PEI (а) Западной скрининг пятно отдельных человеческих клеточных белков (tetherin), рецепторы (IL-2R субъединицы β) и цитокинов (IL-2). Tetherin является человеком гликопротеина мембраны, которая ограничивает выпускзарождающегося ВИЧ-1 вирионов 16. Внеклеточного домена tetherin существует в виде гликозилированного, дисульфид-связанных димер ~ 36 кДа. В восстановительных условиях, как показано здесь, tetherin мигрирует в виде мономера с кажущейся молекулярной массой ~ 22 кДа. Интерлейкина-2 (IL-2) является цитокинов (~ 17 кДа), участвующих в пролиферации лимфоцитов 17. Он взаимодействует с ИЛ-2 рецепторного комплекса, в том числе IL-2R βsubunit (~ 26 кДа) является одним из компонентов 18. CD21 является мембранный белок, участвующий в активации и созревания В-клеток системы комплемента, а также является рецептором для вируса Эпштейна-Барра. Гликозилированного внеклеточный домен CD21 мигрирует в виде мономера с кажущейся молекулярной массой ~ 20 кДа. (Б) Вестерн блот проверки выбранных поверхности вирусных гликопротеинов (XMRV Env и ebolavirus GP). XMRV и ebolavirus гликопротеинов (трансмембранный якорь удален) существуют в вирусной мембране тримерной шипы и участвуют в принимающих вложений клеткии синтеза. Эктодомена из XMRV Env и EBOV GP сильно украшены N-связанных гликанов и мигрируют в кажущейся молекулярной массой 70 кДа и 75 кДа соответственно.

Рисунок 4. Очищенная человека клеточных белков от крупных HEK 293T культур. Все белки были выражены с использованием 10-клеточного слоя завода и концентрировали и очищали с помощью анти-HA хроматографии. Как показали Кумасси окрашенных SDS-PAGE анализа внеклеточной области рецептора интерлейкина-2 (IL-2R) α и γ подразделения мигрировать в молекулярной массой 40 кДа и 46 кДа соответственно. Внеклеточного домена tetherin мигрирует в виде димера, при невосстанавливающих условиях, кажущийся молекулярный вес 36 кДа. Обратите внимание, что некоторые BSA загрязнения, которое появляется на кажущийся молекулярный вес 60 кДа. Кроме того, неоднородность N-связанных гликанов представить на tetherin,IL-2R α и ИЛ-2R γ причин уширение полосы на SDS-PAGE гель. Эти сложные типа N-связанных гликанов можно удалить с помощью пептида N-гликозидазы F.
| Судно | Площадь |
| 6-луночного планшета | 9,5 см 2 (каждую лунку) |
| 100 мм блюда | 55 см 2 |
| 245 мм блюда | 500 см 2 |
| T75 см 2 колбы | 75 см 2 |
| T175 см 2 колбы | 175 см 2 |
| T225 см 2 колбы | 225 см 2 |
| Роликовые бутылки регулярное | 850 см 2 |
| Роликовые бутылки расширенной поверхностью | 1700 см 2 |
| 1-слой CellSTACK | 636 см 2 |
| 2-слойная CellSTACK | 1272 см 2 |
| 5-слойная CellSTACK | 3180 см 2 |
| 10-слойный CellSTACK | 6360 см 2 |
| 40-слой CellSTACK | 25440 см 2 |
Таблица 1. Сравнение культуры клеток суда, используемые для экспрессии белков.
Список реагентов Рецепты
100X ципрофлоксацин в течение 10 мл раствора, добавляют 10 мл дистиллированной воды до 10 мг ципрофлоксацина. Добавить 10 мкл 6N HCl до полного растворения ципрофлоксацина.
PEI (1 мг / мл) 100 мл раствора, растворите 100 мг 25 кДа линейной PEI в деионизированной воды и тепла до 80 ° C. Холодный раствор до комнатной температуры, регулировать рН до 7,2, 0,22 мкм фильтр стерилизуют, Алиготе и замораживают при температуре -20 ° С для LONг-срок хранения.
1X PBS за 1 л водного раствора: 8,0 г NaCl, 0,2 г хлорида калия, 1,4 г Na 2 HPO 4 (безводный), 0,24 г KH 2 PO 4. Отрегулируйте рН раствора до 7,4 и заполнить до 1,0 L.
1X PBS-Tween-20 на 1 л водного раствора: 8,0 г NaCl, 0,2 г хлорида калия, 1,4 г Na 2 HPO 4 (безводный), 0,24 г KH 2 PO 4, 1 мл Твин-20. Отрегулируйте рН раствора до 7,4 и заполнить до 1,0 L.
1X буфера передачи на 1 л водного раствора: 3,0 г Трис базы, 14,4 г глицина, 150 мл метанола.
1X SDS-PAGE работает буфер на 1 л водного раствора: 3,0 г Трис базы, глицин 14,4 г, 1,0 г SDS.
SDS-PAGE сокращение буфера образца в течение 10 мл раствора: 0,6 г SDS, 3 мл глицерина, 1,8 мл 1,0 Трис-HCl, рН 6,8, 1 мг бромфенола синий, 5% (объем / объем) 2-меркаптоэтанола.
Вставка 1. Генеральный протоколов для мобильных распространения- Рост HEK 293T клеток в средней Дульбеко изменения Орла (DMEM) с добавлением 10% (объем / объем) эмбриональной телячьей сыворотки (FBS), 1X ручка / стрептококк при 37 ° С в 5% CO 2-влажной атмосфере.
- Соблюдайте клетки под инвертированным микроскопом. Когда клетки на 100% слияния, удалить и уничтожить питательную среду.
- Промойте клетки с 5 мл стерильной 1X PBS для удаления следов сыворотки. Откажитесь от мытья PBS.
- Добавить 2 мл 0,05% (вес / объем) трипсин-EDTA решение T225 см 2 колбы (или 1 мл 0,05% (вес / объем) трипсин-ЭДТА для T75 см 2 колбы) и выдержите при комнатной температуре до клетки отделяются от поверхности. Кроме того, можно использовать стерильный 1X PBS-EDTA отделить HEK 293T клеток.
- Добавить 13 мл DMEM с 10% (объем / объем) FBS для T225 см 2 колбы (или 9 мл DMEM с 10% (объем / объем) FBS для T75 см 2 колбы) для подавления реакции трипсин.
- Разделить слоктя 1:5. Для T225 см 2 колбу, добавьте 3 мл клеточной суспензии до 27 мл свежей DMEM с 1X ручка / стрептококк и 10% (объем / объем) FBS в новом судне культуры. Для T75 см 2 колбы, добавляют 2 мл клеточной суспензии до 8 мл свежей питательной среды. Инкубируйте культур при 37 ° С в 5% CO 2-влажной атмосфере. Клетки должны вырасти на 100% слияния в течение двух дней.
Вставка 2. Вестерн-блот анализа
- Добавить 10 мкл SDS-PAGE снижения образец буфера 30 мкл клеточной культуры супернатант. Загрузка образцов и prestained маркеры молекулярного веса на полиакриламидном геле и electrophorese использования 1X SDS-PAGE работает буфер на 175 В в течение 1 часа или пока маркеров молекулярной массы хорошо решены.
- Замочите PVDF Immobilon-P мембраны в 100% метанола в течение 1 минуты для активации.
- Соберите западных аппарат пятна. Убедитесь, что мембраны PVDF сталкивается с положительным электродом и сохранить все компоненты мокрым 1X передачи буфера. АвоID пузырьков между полиакриламидном геле и мембраны.
- Полностью заполнить электрофорез камеры 1X буфер передачи и передачи в течение 1 часа при 100 В.
- Блок мембраны с 5% (вес / объем) обезжиренного молока в 1X PBS-Tween20 в течение 1 часа при комнатной температуре или на ночь при 4 ° C.
- Инкубируйте с помощью моноклональных антител первичной (то есть разведение 1:1000 анти-ГА МКА или другого соответствующего антитела) растворяют в 5% (вес / объем) обезжиренного молока в 1X PBS-Tween20 в течение 1 часа при комнатной температуре или на ночь при 4 ° C.
- Вымойте мембран в 1X PBS-Tween20 течение 10 минут. Повторите два дополнительных раза.
- Инкубируйте с моноклональных антител вторичного сопряженного с щелочной фосфатазы (1:1000 разведения в 5% (вес / объем) обезжиренного молока в 1X PBS-Tween20) в течение 1 часа при комнатной температуре или на ночь при 4 ° C.
- Вымойте мембран в 1X PBS-Tween20 течение 10 минут. Повторите два дополнительных раза.
- Поместите мембрану в небольшую емкость, добавить 5 мл щелочной фосфатазы substraТе (BCIP / NBT) решение. Цвет развитие должно происходить в течение 1-5 минут. Как только нужный диапазон интенсивности достигается, промыть дистиллированной водой и воздухом. Цвет может исчезать с течением времени, сканирование электронных оболочек после высыхания.
Таблица 3. Очистка и утилизация судов культуре клеток
В то время как клетки заводы предназначены для одноразового использования, эти суда могут быть переработаны для дополнительных крупномасштабных трансфекции, используя следующий протокол уборка:
- Сразу же после декантации супернатант из 10-клеточного слоя завода, добавить 20% (объем / объем) отбеливателя и энергично встряхивают, чтобы отделить клетки. Инкубируйте при комнатной температуре в течение трех часов.
- Очистка сосудов и добавить свежих 20% (объем / объем) отбеливателя и инкубировать при комнатной температуре в течение ночи.
- Очистить и вымыть судно с 1,5 л дистиллированной воды. Повторите три раза.
- Вылейте 10-клеточного слоя завод и добавить 0,5 л стерильной 1X PBS с добавлением 10X антибиотикам / противогрибковым раствором. Хранить сосуд при комнатной температуре и заменить вентиляционные заглушки для заполнения порта (стандартный 33 мм с резьбой крышки) до следующего использования. Примечание: Все слои должны быть совершенно ясно, после очистки, если нет, не пользоваться и распоряжаться клетки заводе в соответствии с ведомственным руководящим принципам.
Обсуждение
10-слойный заводов клетки являются эффективным судно для производства миллиграмм количества белка. Основное преимущество использования ячейки завода по сравнению с другими традиционными судами, такими как ролик бутылки, дрожание колбы или счетчика колбы, в том, что они не требуют прио...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана Онтарио лечению ВИЧ исследовательская сеть Операционная Грант (ROG-G645) и канадского Института исследований в области здравоохранения премию Новый следователь (MSH-113554) для JEL и Университет Торонто стипендии для HA, FCA, и Джойнт. Авторы хотели бы поблагодарить Марни Фуско, Дафна Абельсон и доктора Эрика Ollmann Saphire на Scripps Research Institute (Ла-Хойя, Калифорния) за предоставление клеток, ebolavirus GP вектор экспрессии и общие рекомендации.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Щелочной фосфатазы (BCIP / НБТ) жидкий раствор субстрата | Сигма | B6404 | |
| Антибиотикам / противогрибковым, 100X | Invitrogen | 15240062 | |
| Anti-HA близость матрицы, клон 3F10 | Roche | 1815016 | |
| Anti-HA мышиных МКА, клон 16B12 | Covance | MMS-101P | |
| Колба клеточной культуры, T75 см 2 ткани культуры рассматривается | Гранулирование | 430641 | |
| Колба клеточной культуры, T225 см 2 ткани культуры рассматривается | Гранулирование | 431082 | |
| Пластин клеточной культуры, 6-а культуры тканей лечение | Гранулирование | 3516 | |
| Сотовые завод, 10-слой CellSTACK | Гранулирование | 3312 | |
| Centramate Омега 5K кассеты | Надоедать | OS005C12 | |
| Centramate Омега 30К кассеты | Надоедать | OS030C12 | |
| Хроматографии стеклянную колонку, 1.0x10 см | Kontes | 4204001010 | |
| Ципрофлоксацин | Сигма | 17850 | |
| CO 2 | |||
| Дульбекко изменения Орла СМИ (DMEM) | Сигма | D5796 | |
| Эмбриональной телячьей сыворотки (FBS), тепло инактивированная | Invitrogen | 12484-028 | |
| FuGENE HD трансфекции реагент | Promega | 4709691001 | |
| GeneJuice трансфекции реагент | EMD / Merck | 70967-6 | |
| Глицин | Сигма | G8898 | |
| Антимышиного IgG F (аb ') 2 щелочные | Thermo Scientific | 31324 | |
| фосфатазы, конъюгированных антител | |||
| Гемагглютинина (HA) пептид, 100 мг | Genscript | синтез новых | |
| (Последовательность: YPYDVPDYA, 95% чистоты) | |||
| HEK 293T клеток | ATCC | CRL-11268 | |
| Householг хлорной извести (4% вес / объем гипохлорита натрия) | различных марок доступны | ||
| Immobilon-P PVDF мембраны | Millipore | IPVH07850 | |
| MiniPrep плазмиды комплект очистки, PureLink быстрого | Invitrogen | K2100-11 | |
| MaxiPrep плазмиды комплект очистки, PureLink HiPure | Invitrogen | K2100-07 | |
| NaN 3 | Сигма | S8032 | |
| вектор pDISPLAY выражение | Invitrogen | V660-20 | |
| Пенициллина / стрептомицина (ручка / стрептококк), 100X | Invitrogen | 15140-122 | |
| Фосфат-солевом буфере (PBS), стерильные 1X | Сигма | D8537 | |
| Полиэтиленимина (PEI), линейные 25 кДа | Polyscience | 23966 | |
| Обезжиренное молоко сухой порошок | Гвоздика | ||
| Stericup-GP PES блок фильтрации вакуума, | Millipore | SCGPU05RE | |
| 0,22 мкм, емкостью 500 мл | |||
| Трипановый синий | Invitrogen | 15250061 | |
| Трипсин-EDTA, 0.05% (вес / объем) | Invitrogen | 25300-054 | |
| Твин-20 | Сигма | P7949 | |
| Вальпроевая кислота | Сигма | P4543 | |
| Centramate тангенциальных потоков в системе | Надоедать | ||
| CO 2 увлажненном инкубаторе, стандартный 6,0 куб. футов | различных марок доступны | ||
| Электрофорез и передачи единицы | различных марок доступны | ||
| Инкубатор, 37 ° C | различных марок доступны |
Ссылки
- Celik, E., Calik, P. Production of recombinant proteins by yeast cells. Biotechnol. Adv. , (2011).
- Yokoyama, S. Protein expression systems for structural genomics and proteomics. Curr. Opin. Chem. Biol. 7, 39-43 (2003).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J. Struct. Biol. 172, 55-65 (2010).
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: Applications come of age. Biotechnol. Adv. , (2011).
- Lee, J. E. Structure of the Ebola virus glycoprotein bound to an antibody from a human survivor. Nature. 454, 177-182 (2008).
- Bowden, T. A. Structural basis of Nipah and Hendra virus attachment to their cell-surface receptor ephrin-B2. Nat. Struct. Mol. Biol. 15, 567-572 (2008).
- Evans, M. J., Hartman, S. L., Wolff, D. W., Rollins, S. A., Squinto, S. P. Rapid expression of an anti-human C5 chimeric Fab utilizing a vector that replicates in COS and 293 cells. J. Immunol. Methods. 184, 123-138 (1995).
- Ye, J. High-level protein expression in scalable CHO transient transfection. Biotechnol. Bioeng. 103, 542-551 (2009).
- Wurm, F. M. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol. 22, 1393-1398 (2004).
- Lee, J. E., Fusco, M. H., Hessell, A. J., Burton, D. R., Saphire, E. O. Techniques and tactics used in determining the structure of trimeric, prefusion Ebola virus GP. Acta Cryst. 65, 1162-1180 (2009).
- Aricescu, A. R. Eukaryotic expression: developments for structural proteomics. Acta. Crystallogr. D Biol. Crystallogr. 62, 1114-1124 (2006).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta. Crystallogr. D Biol. Crystallogr. D62, 1243-1250 (2006).
- Chang, V. T. Glycoprotein structural genomics: solving the glycosylation problem. Structure. 15, 267-273 (2007).
- Lee, J. E., Fusco, M. H., Saphire, E. O. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nature Protocols. 4, 592-604 (2009).
- Nettleship, J. E., Rahman-Huq, N., Owens, R. J. The production of glycoproteins by transient expression in Mammalian cells. Methods Mol. Biol. 498, 245-263 (2009).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Nakamura, Y. Heterodimerization of the IL-2 receptor beta- and gamma-chain cytoplasmic domains is required for signalling. Nature. 369, 330-333 (1994).
- Wang, X., Rickert, M., Garcia, K. C. Structure of the quaternary complex of interleukin-2 with its alpha, beta, and gammac receptors. Science. 310, 1159-1163 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены