Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une plate-forme d'expression pratique et général pour la production de protéines sécrétées à partir de cellules humaines
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Dans l'ère post-génomique humaine, la disponibilité de protéines recombinantes dans des conformations natives est cruciale pour la recherche structurelle, fonctionnelle et thérapeutique et le développement. Ici, nous décrivons un test et à grande échelle du système expression des protéines dans les cellules embryonnaires humaines de rein 293T qui peuvent être utilisés pour produire une variété de protéines recombinantes.
Résumé
Recombinant expression des protéines dans les bactéries, généralement E. coli, a été la stratégie la plus efficace pour l'expression quantité milligramme de protéines. Cependant, les hôtes procaryotes sont souvent pas aussi appropriée pour l'expression de l'homme, les protéines virales ou eucaryote en raison de la toxicité de la macromolécule étrangère, les différences dans le mécanisme de repliement des protéines, ou en raison de l'absence de modifications co-ou post-traductionnelle particulier chez les bactéries. Des systèmes d'expression basés sur la levure (P. pastoris ou S. cerevisiae) 1,2, infectées par le baculovirus d'insectes (S. frugiperda ou T. ni) des cellules 3 et acellulaire in vitro des systèmes de traduction 2,4 ont été utilisés avec succès pour produire des protéines de mammifères. Intuitivement, la meilleure correspondance est d'utiliser un hôte mammifère afin d'assurer la production de protéines recombinantes qui contiennent les bonnes modifications post-traductionnelles. Un certain nombre de lignées cellulaires de mammifères (Human Embryonic Kidney (HEK) 293, C V-1 des cellules dans O RIGINE portant le S V40 Larget l'antigène T (COS), ovaire de hamster chinois (CHO), et d'autres) ont été utilisées avec succès pour surexprimer milligrammes d'un certain nombre de protéines humaines 5-9. Toutefois, les avantages de l'utilisation des cellules de mammifères sont souvent contrés par des coûts plus élevés, des exigences de l'équipement de laboratoire spécialisé, les rendements en protéines plus faibles et les temps longs pour développer des lignées stables de cellules d'expression. Accroître le rendement et la production des protéines plus rapide, tout en gardant des coûts bas, sont des facteurs importants pour de nombreux laboratoires universitaires et commerciaux.
Ici, nous décrivons un temps et le coût-efficace, en deux parties la procédure pour l'expression de protéines sécrétées humaines à partir de cellules HEK adhérentes 293T. Ce système est capable de produire microgramme à quelques milligrammes de protéine fonctionnelle pour des études structurales, biophysiques et biochimiques. La première partie, plusieurs constructions du gène d'intérêt sont de produired en parallèle et transfectées de façon transitoire dans des cellules HEK adhérentes 293T à petite échelle. La détection et l'analyse de la protéine recombinante sécrétée dans le milieu de culture cellulaire est réalisée par analyse western blot en utilisant des anticorps dirigés contre disponibles dans le commerce un tag vecteur protéine codée par la purification. Par la suite, des constructions appropriées pour la production de protéines à grande échelle sont transfectées de façon transitoire à l'aide polyéthylèneimine (PEI) dans les usines de cellules 10-couche. Protéines sécrétées dans les volumes litre de milieu conditionné sont concentrées en un montant gérables en utilisant une filtration à flux tangentiel, suivie d'une purification par chromatographie d'affinité anti-HA. L'utilité de cette plate-forme est prouvé par sa capacité à exprimer quelques milligrammes de cytokines, de récepteurs de cytokines, des récepteurs de surface cellulaire, des facteurs de restriction intrinsèques, et des glycoprotéines virales. Cette méthode a également été utilisé avec succès dans la détermination de la structure des trimères 5,10 glycoprotéine Ebola.
2, est nécessaire. Cette procédure peut être rapidement étendu à des systèmes de plus grande complexité, comme la co-expression de complexes protéiques, des antigènes et des anticorps, la production de virus-like particules pour les vaccins, ou la production d'adénovirus ou des lentivirus pour la transduction de lignées cellulaires difficiles.
Protocole
1. Travail de préparation - Les constructions et les cultures cellulaires
Avant de commencer le protocole, le gène d'intérêt devrait être codon-optimisé pour l'expression dans les cellules de mammifères, et cloné dans un vecteur d'expression approprié en utilisant des techniques de biologie moléculaire. Afin d'assurer le plus de chance pour l'expression réussie, de multiples variantes du gène d'intérêt doit être généré. De nombreux vecteurs d'expression de mammifères sont disponibles dans le commerce et a les étiquettes de purification différents (polyhistidine, l'hémagglutinine, la streptavidine, HALO-Tag, glutathion S-transférase, entre autres). Nous préférons utiliser le vecteur pDISPLAY, qui code pour un promoteur du cytomégalovirus humain fort, un signal de sécrétion d'Ig κ, étiquette de purification hémagglutinine, et dispose d'un ancrage transmembranaire C-terminal de cibler la protéine à travers la voie de sécrétion pour l'affichage sur la membrane plasmique. Nous avons l'habitude d'insérer un codon stop en face de la transmembranaire vecteur codé anchor pour permettre à la protéine est sécrétée dans le milieu conditionné.
Embryonnaires humaines de rein (HEK) des cellules 293T sont largement disponibles, et facilement en culture et transfectées. 293T HEK sont couramment utilisés pour l'expression de protéines de mammifères, mais sont considérés comme présentant un risque biologique et doivent être traitées au niveau de biosécurité 2. S'il vous plaît porter des vêtements de protection individuelle, le travail doit être effectué dans un cabinet a approuvé la biosécurité en utilisant une technique aseptique. Tous les déchets et les surfaces doivent être désinfectés selon les directives institutionnelles et gouvernementales. Il est recommandé que les cellules soient testés pour contamination par des mycoplasmes avant de l'utiliser. Les cellules peuvent être traitées avec la ciprofloxacine (10 pg / ml) pendant dix jours pour éradiquer toute source de Mycoplasma spp. la contamination. Les protocoles généraux pour propager cellules HEK 293T sont présentés séparément (encadré 1).
Des considérations supplémentaires pour le test et l'expression des protéines à grande échelle sont reviewed dans 11-15.
2. Expression d'essai à petite échelle
Une fois les constructions ont été conçues et produites, transfections essais à petite échelle peut être effectuée en utilisant des cellules 293T HEK; un schéma résumant le processus est présenté ci-dessous (Fig. 1).
- Utilisation T75 cm 2 ou T225 cm 2 flacons de culture cellulaire (en fonction du nombre des expressions de test à exécuter) à cultiver les cellules HEK 293T et fractionner les cellules chaque 2-3 jours quand les cellules sont confluentes 100% (Boîte 1).
- Seed 2,5 x 10 5 HEK 293T cellules par puits dans une plaque à 6 puits et ajouter 2 ml de DMEM avec 1X pénicilline / streptomycine et 10% (v / v) de SVF, de remous doucement la plaque pour assurer une parfaite homogénéité de cellules dans chaque puits, et incuber une nuit à 37 ° C dans un chambre de CO 2 5% humidifié.
- Lorsque cellules HEK 293T atteindre 40% de confluence, jetez les médias et ajouter frais 2 ml de DMEM avec un stylo 1X / streptomycine et 10% (v / v) à la FBS puits. Effectuerdes expériences de transfection.
- Aliquoter 90 ul DMEM sans sérum dans un stérile de 1,5 ml microtube. Pipette 3 GeneJuice ul dans le DMEM sans sérum et mélanger délicatement le tube (vortex doigt). Incuber pendant 5 minutes à température ambiante.
- Ajouter 1 ug de Miniprep ADN plasmidique purifié (ADN = stock de 100 ng / ul) dans du DMEM-GeneJuice mélange, vortex doigt, et incuber pendant 15 minutes à température ambiante.
- Introduire à la pipette du goutte à goutte mélange de transfection sur HEK cellules 293T, et le tourbillon de la plaque à 6 puits doucement pour permettre une distribution du mélange de transfection. Incuber la plaque à 6 puits à 37 ° C dans un chambre de CO 2 5% humidifié.
- Ajouter 1 ml DMEM frais avec 1X pénicilline / streptomycine et 10% (v / v) à chaque FBS 24 et heures post-transfection et incuber pendant 48 heures (au total 72 heures).
- Récolte 1 ml de surnageant de chaque puits à trois jours post-transfection et microcentrifugeuse les échantillons à 16 000 g pendant 10 minutes à température ambiante. Effectuer wesUne analyse par transfert de sternes comme détaillé dans l'encadré 2. Les échantillons peuvent être conservés à 4 ° C. La durée de stockage à 4 ° C est une protéine dépendante.
3. Expression de test à grande échelle et purification
Une fois une construction a été identifié l'expression quantité milligramme de protéine recombinante est obtenue par transfection de cellules HEK PEI adhérentes 293T en utilisant les usines cellulaires 10-couche (Fig. 2; 6360 cm 2 de surface). Pour des études plus exploratoires, les petites usines cellulaires ou des T-flacons (Tableau 1) peuvent être utilisés.
- Purifier 1 mg d'ADN pour la transfection à l'aide d'un kit de purification Maxiprep plasmide. Une culture de 500 ml pendant la nuit de XL-1 Blue cellules devraient produire au moins 1 mg d'ADN pur. Vérifiez la pureté de l'ADN en mesurant A 260 / A ratio de 280; devrait être supérieur à 1,8.
- Intensifier HEK 293T à 2,0 x 10 8 cellules. Chaque flacon T225 cm 2 passé à la confluence de co 100%ntains et moyennes de ~ 2,25 x 10 7 cellules.
- Ajouter 1,2 L DMEM avec 5% (v / v) FBS à une usine de cellules 10-couche. Ajouter 2,0 x 10 8 cellules HEK 293T à l'usine de cellules et de distribuer les cellules uniformément à tous les couches de la cuve. Il est très difficile de visualiser la confluence des cellules dans l'usine cellulaire. Comme une alternative, mettre en place un T75 cm 2 fiole avec un nombre approprié de cellules, en utilisant le nombre de cellules même rapport surface comme effectuée avec le navire de 10 couches. Suivre ce ballon pendant les taux de croissance. Voir la vidéo associée à l'enseignement sur le traitement de l'usine cellulaire. Incuber pendant une nuit à 37 ° C avec 5% de CO 2 pour permettre la fixation des cellules et la croissance.
- Effectuer transfection à grande échelle lorsque adhérentes cellules HEK 293T sont de 70% de confluence. Préparer le mélange de transfection PEI-ADN (3:1 w / w Î ratio ADN) dans une enceinte de biosécurité en utilisant une solution stérile T75 cm 2 flacon. Mélanger 0,84 mg d'ADN avec 84 ml de solution stérile de PBS 1X, puis ajoutez 2,5 ml de l'Î (2.5 mg totale PEI). Incuber à température ambiante pendant 15 minutes. La solution devrait devenir trouble.
- Verser le mélange de transfection de la PEI-ADN lentement dans l'usine de cellules et à fond distribuer sur toutes les couches de la cuve. Facultatif: pour obtenir des rendements accrus d'expression, ajouter l'acide valproïque (4 mM de concentration finale). Incuber à 37 ° C avec 5% de CO 2 pour quatre jours.
- Récolte du surnageant quatre jours post-transfection. Centrifuger les milieux conditionnés à 6000 x g pendant 30 minutes à 4 ° C. En outre filtrer le surnageant à l'aide d'un appareil de 0,22 um Stericup filtre à vide. L'usine cellulaire 10-couche peut être réutilisé, voir l'encadré 3 pour les instructions de nettoyage. Il est essentiel que le nettoyage est lancé immédiatement après la récolte surnageant, ne laissez pas les piles sèches sur la surface du récipient.
- Concentrer le surnageant à 75 ml en utilisant le système de Centramate de filtration tangentielle.
- Ajouter 500 ml de PBS et re-concentrer à 75 ml. Répéter trois additional fois complètement échange de tampon de l'échantillon.
- S'équilibrer une colonne 1 ml d'affinité anti-HA avec du PBS 1X et appliquer échantillon concentré par écoulement par gravité à une vitesse <1 ml / min.
- Laver la colonne avec 30 ml de PBS 1X-Tween 20.
- Dissoudre peptide HA dans du PBS 1X (1,0 mg / ml) et incuber à 37 ° C.
- Appliquer une ml du peptide HA à la colonne anti-HA et permettre le peptide de s'écouler dans la résine. Recueillir l'écoulement à travers. Arrêter l'écoulement lorsque la solution de peptide atteint la hauteur du lit.
- Incuber l'ensemble anti-HA colonne à 37 ° C pendant 15 minutes.
- Répétez l'étape 12 deux fois supplémentaires.
- Appliquer 1 ml de PBS 1X à la colonne anti-HA et le débit dans la résine jusqu'à ce qu'il atteigne la hauteur du lit. Recueillir l'écoulement à travers.
- Régénérer la colonne anti-HA avec 10 ml pH 0,1 M de glycine 2.2. Laver avec 10 ml de PBS et de la colonne d'affinité conserver à 4 ° C dans du PBS avec 0,02% (p / v) NaN 3.
- Effectuer analyse SDS-PAGE et la piscine de l'fractions conséquence. Remarque: Le peptide HA va interférer avec les mesures de concentration de protéines par A 280 ou Bradford. Pour estimer la quantité de protéine présente, charge de 5, 10, 15, 25 pg de BSA sur le gel SDS-PAGE comme une norme et de comparer les intensités des bandes.
Étapes 9-17 peut être répété pour capturer des protéines supplémentaires à partir du milieu conditionné.
4. Les résultats représentatifs
Dans cet article, nous décrivons et démontrer une plate-forme d'expression commode pour milligramme quantité de production de protéines humaines qui peuvent ensuite être utilisés pour des études structurales et fonctionnelles. Le dépistage de la protéine humaine constructions en utilisant des cellules HEK 293T en plaques 6 puits est efficient et efficace dans l'identification des constructions qui se prêtent à la production à plus grande échelle. Vecteurs d'expression commerciaux peuvent être transfectées efficacement dans les cellules 293T HEK en utilisant une variété de réactifs de transfection, comme GeneJuice, FuGENE HD ou PE I. Nous recommandons l'utilisation d'un réactif de transfection commerciale, tels que GeneJuice ou FuGENE HD, pour les expressions de test, comme ces réactifs sont plus efficaces pour les plus pauvres protéines exprimant (Fig. 3). Les constructions sélectionnées pour l'expression à grande échelle devrait être caractérisé par une seule bande de forte intensité, correspondant au poids moléculaire appropriée sur le western blot (Fig. 3). Glycoprotéines peut migrer comme une bande plus large en raison de l'hétérogénéité dans la glycosylation. Nous avons montré qu'une variété de macromolécules, allant de glycoprotéines virales, des cytokines, récepteurs de cytokines, protéines de surface et d'autres, peut être exprimé et purifié pour obtenir des quantités de protéines en utilisant millgram cette plate-forme d'expression générale (fig. 4).
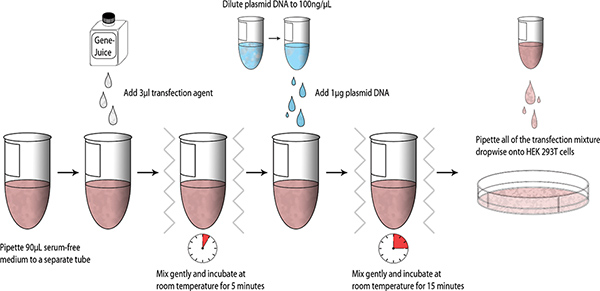
Figure 1. Schéma de workflow de petits transfections.tp_upload/4041/4041fig1large.jpg "target =" _blank "> Cliquez ici pour agrandir la figure.

Figure 2. Corning 10-couche pour l'expression CellSTACK protéine plus grande échelle. Chaque couche contient 636 cm 2 de surface pour la fixation des cellules. Une norme de laboratoire incubateur à CO 2 (6,0 pi ³) sera confortablement accueillir quatre usines cellulaires 10-couche.
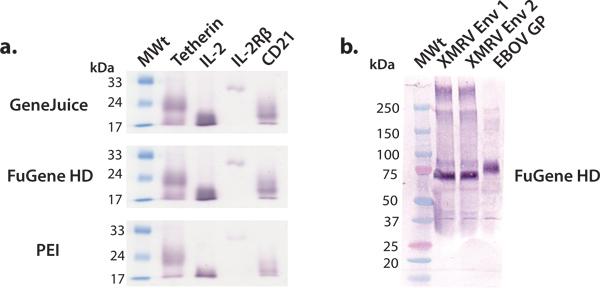
.. Figure 3 à petite échelle d'expression de différentes protéines sécrétées Nous avons effectué une série d'expressions d'essais à petite échelle utilisant des réactifs de transfection communs:. GeneJuice, FuGENE HD et de l'Î (a) de dépistage par Western blot de certains humains protéines cellulaires (tetherin), les récepteurs (IL-2R sous-unité β) et cytokines IL-2). Tetherin est une glycoprotéine membranaire humaine qui limite la libération denaissantes du VIH-1 virions 16. Le domaine extracellulaire de tetherin existe en tant que glycosylée, liaison disulfure dimère de ~ 36 kDa. Dans des conditions réductrices, tels quels, tetherin migre comme monomère avec un poids moléculaire apparent de ~ 22 kD. L'interleukine-2 (IL-2) est une cytokine (environ 17 kDa) impliquée dans la prolifération des lymphocytes 17. Elle interagit avec l'IL-2 complexe récepteur, dont l'IL-2R βsubunit (environ 26 kDa) est une composante 18. CD21 est une protéine membranaire impliqué dans l'activation et la maturation des cellules B par le système du complément, et est également un récepteur pour le virus d'Epstein-Barr. Le domaine extracellulaire de CD21 glycosylée migre comme monomère ayant un poids moléculaire apparent de ~ 20 kD. (B) la sélection Western blot de glycoprotéines de surface choisis virales (XMRV Env et Ebola GP). XMRV et glycoprotéines virus Ebola (ancrage transmembranaire supprimé) qui existent à la membrane virale comme des pointes trimères et sont impliqués dans la fixation des cellules d'accueilet la fusion. Le ectodomaine de XMRV Env et EBOV GP sont abondamment décorés avec de la N-glycanes et de migrer à des poids moléculaires apparents de 70 kDa et 75 kDa, respectivement.

Figure 4. Purifiée de l'homme protéines cellulaires à partir de cultures à grande échelle 293T HEK. Toutes les protéines ont été exprimées à l'aide d'une usine de cellules de 10 couches, et concentrée et purifiée par chromatographie anti-HA. Comme le montre par Coomassie teinté analyse SDS-PAGE, les domaines extracellulaires de récepteur de l'interleukine-2 (IL-2R) α et γ sous-unités migrer à des poids moléculaires de 40 kDa et 46 kDa, respectivement. Le domaine extracellulaire de tetherin migre sous forme de dimère, sous des conditions non réductrices, avec un poids moléculaire apparent de 36 kDa. Notez qu'il ya une certaine contamination BSA qui apparaît à un poids moléculaire apparent de 60 kDa. En outre, l'hétérogénéité des glycanes N-liés présents sur tetherin,IL-2R α et l'IL-2R γ des causes de bande élargissement sur le gel de SDS-PAGE. Ces complexes de type N-glycanes peuvent être retirés à l'aide peptide: N-glycosidase F.
| Navire | Surface |
| Des plaques 6 puits | 9,5 cm 2 (chaque puits) |
| Boîtes de 100 mm | 55 cm 2 |
| 245 plats mm | 500 cm 2 |
| T75 cm 2 flacon | 75 cm 2 |
| T175 cm 2 flacon | 175 cm 2 |
| T225 cm 2 flacon | 225 cm 2 |
| Rouleau bouteille régulière | 850 cm 2 |
| Rouleau bouteille élargi la surface | Cm 1700 2 |
| Une couche CellSTACK | 636 cm 2 |
| 2-couche CellSTACK | 1272 cm 2 |
| 5-couche CellSTACK | 3180 cm 2 |
| 10-couche CellSTACK | 6360 cm 2 |
| 40-couche CellSTACK | 25440 cm 2 |
Tableau 1. Comparaison des récipients de culture de cellules utilisées pour l'expression des protéines.
Liste des Recettes de réactifs
100X Ciprofloxacine Pour 10 ml de solution, ajouter de l'eau déminéralisée 10 ml à 10 mg ciprofloxacine. Ajouter 10 ul HCl 6N pour dissoudre complètement la ciprofloxacine.
PEI (1 mg / mL) pour une solution de 100 ml, dissoudre 100 mg de 25 kDa linéaire PEI dans l'eau déminéralisée et de la chaleur à 80 ° C. Solution refroidir à température ambiante, ajuster le pH à 7,2, 0,22 um filtre stériliser, aliquoter et congeler à -20 ° C pendant long terme de stockage.
PBS 1X Pour une solution à 1 L aqueuse: 8,0 g de NaCl, 0,2 g de KCl, 1,4 g de Na 2 HPO 4 (anhydre), 0,24 g de KH 2 PO 4. Ajuster le pH de la solution à 7,4 et à 1,0 L. remplir
1X PBS-Tween-20 Pour une solution à 1 L aqueuse: 8,0 g de NaCl, 0,2 g de KCl, 1,4 g de Na 2 HPO 4 (anhydre), 0,24 g de KH 2 PO 4, 1 ml de Tween-20. Ajuster le pH de la solution à 7,4 et à 1,0 L. remplir
1X tampon de transfert Pour une solution à 1 L aqueuse: 3,0 g de base Tris, 14,4 g de glycine, 150 ml de méthanol.
1X SDS-PAGE en cours d'exécution tampon pour une solution à 1 L aqueuse: 3,0 g de base Tris, 14,4 g de glycine, 1,0 g de SDS.
SDS-PAGE réduire tampon d'échantillon Pour 10 ml de solution: 0,6 g de SDS, 3 ml de glycérol, 1,8 1,0 ml de Tris-HCl pH 6,8, 1 mg de bleu de bromophénol, 5% (v / v) 2-mercaptoéthanol.
Encadré 1. Les protocoles généraux pour la propagation des cellules- Cultiver les cellules HEK 293T en milieu Dulbecco modifié Eagle (DMEM) supplémenté avec 10% (v / v) de sérum bovin fœtal (FBS), le stylo 1X / streptomycine à 37 ° C dans un 5% de CO 2-humidifié l'atmosphère.
- Observer les cellules sous un microscope inversé. Lorsque les cellules sont à confluence de 100%, retirez et jetez un milieu de culture.
- Rincer les cellules avec 5 ml de solution stérile de PBS 1X pour éliminer les traces de sérum. Jeter le lavage PBS.
- Ajouter 2 ml de 0,05% (p / v) de trypsine-EDTA à une T225 cm 2 flacon (ou 1 ml de 0,05% (p / v) de trypsine-EDTA pour T75 cm 2 flacon) et incuber à température ambiante jusqu'à cellules détacher de la surface. Il est également possible d'utiliser stérile 1X PBS-EDTA pour détacher les cellules HEK 293T.
- Ajouter 13 ml de milieu DMEM contenant 10% (v / v) à un FBS T225 cm 2 flacon (ou 9 ml de milieu DMEM contenant 10% (v / v) pour FBS T75 cm 2 flacon) pour inhiber la réaction trypsine.
- Diviser caunes 1:5. Pour un T225 cm 2 flacon, ajouter 3 ml de suspension cellulaire à 27 ml de DMEM frais avec 1X pénicilline / streptomycine et 10% (v / v) FBS dans un récipient nouvelle culture. Pour un flacon T75 cm 2, ajouter 2 ml de suspension cellulaire à 8 ml de milieu de croissance frais. Incuber les cultures à 37 ° C dans un 5% de CO 2-humidifié l'atmosphère. Les cellules doivent passer à 100% de confluence dans les deux jours.
Encadré 2. Analyse par Western blot
- Ajouter 10 ul de SDS-PAGE tampon d'échantillon de réduire à 30 ul de culture cellulaire surnageant. Charger les échantillons et précolorés marqueurs de poids moléculaire sur gel de polyacrylamide, et électrophorèse en utilisant 1X SDS-PAGE tampon fonctionnant à 175 V pendant 1 heure ou jusqu'à ce que des marqueurs de poids moléculaires sont bien résolus.
- Faire tremper le PVDF membrane Immobilon-P dans le méthanol à 100% pendant 1 minute pour l'activer.
- Monter appareil de western blot. Assurer la membrane de PVDF est confrontée l'électrode positive et de conserver tous les composants mouillés avec 1X tampon de transfert. Avobulles id entre le gel de polyacrylamide et la membrane.
- Remplir complètement la chambre d'électrophorèse avec 1X tampon de transfert et de transfert pour 1 heure à 100 V.
- Bloquer la membrane avec du lait écrémé 5% (p / v) dans du PBS 1X-Tween 20 pendant 1 heure à température ambiante, ou pendant une nuit à 4 ° C.
- Incuber avec un anticorps monoclonal primaire (c.-à-dilution 1:1000 anti-HA ou d'un autre anticorps monoclonal anticorps approprié) dissous dans 5% (p / v) de lait écrémé dans du PBS 1X-Tween 20 pendant 1 heure à température ambiante ou une nuit à 4 ° C.
- Laver les membranes dans du PBS 1X-Tween 20 pendant 10 minutes. Répétez deux fois supplémentaires.
- Incuber avec un anticorps monoclonal secondaire conjugué à la phosphatase alcaline (1:1000 dilution dans 5% (p / v) de lait écrémé dans du PBS 1X-Tween 20) pendant 1 heure à température ambiante, ou pendant une nuit à 4 ° C.
- Laver les membranes dans du PBS 1X-Tween 20 pendant 10 minutes. Répétez deux fois supplémentaires.
- Placer la membrane dans un petit récipient, ajouter 5 ml de phosphatase alcaline substrate (BCIP / NBT) solution. Développement de la couleur doit se faire dans 1-5 minutes. Une fois l'intensité des bandes désiré est atteint, se laver avec de l'eau déminéralisée et de l'air sec. La couleur peut s'estomper avec le temps; électronique numériser les membranes une fois sec.
Encadré 3. Nettoyage et recyclage des récipients de culture cellulaire
Alors que les usines cellulaires sont conçus pour être à usage unique, ces navires peuvent être recyclés pour d'autres grands transfections en utilisant le protocole de nettoyage ci-dessous:
- Immédiatement après décantation du surnageant de l'usine cellulaire 10-couche, ajouter 20% (v / v) l'eau de Javel et agiter vigoureusement pour détacher les cellules. Incuber à température ambiante pendant trois heures.
- Videz le récipient et ajouter frais de 20% (v / v) l'eau de Javel et incuber à température ambiante pendant une nuit.
- Videz la cuve et laver avec 1,5 L d'eau déminéralisée. Répétez trois fois.
- Videz l'usine cellulaire 10-couche et ajoutez 0,5 L de solution stérile de PBS 1X supplémenté avec 10Solution X antibiotique / antimycotique. Conserver le récipient à la température ambiante et remettre les capuchons de ventilation pour le remplissage des ports (capots standards 33 mm filetés) avant la prochaine utilisation. Remarque: toutes les couches doivent être tout à fait clair après le nettoyage, si elle n'est pas, ne pas utiliser et de disposer de l'usine cellulaire en fonction de directives institutionnelles.
Discussion
Les usines cellulaires 10-couche sont un navire efficace pour la production de quelques milligrammes de protéines. Un avantage majeur de l'utilisation de l'usine cellulaire par rapport aux autres bateaux traditionnels, tels que des bouteilles, flacons roulants secouer ou spinner, c'est qu'ils ne nécessitent pas l'achat de tout équipement de laboratoire supplémentaire. Une norme incubateur à CO 2 (environ 6,0 pi ³) sera facilement accueillir quatre usines cellulaires 10-couche
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par un réseau de traitement du VIH de l'Ontario Subvention de fonctionnement de la recherche (GOR-G645) et les Instituts canadiens de recherche en santé Bourse de nouveau chercheur (MSH-113554) pour JEL, et l'Université de Toronto à HA bourses, CAF, et le JDC. Les auteurs tiennent à remercier Marnie Fusco, Dafna Abelson et le Dr Erica Ollmann Saphire à The Scripps Research Institute (La Jolla, CA) pour les cellules fournissant, vecteur d'expression Ebola GP et des conseils généraux.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif | Entreprise | Numéro de catalogue | Commentaires |
| Phosphatase alcaline (BCIP / NBT) solution de substrat liquide | Sigma | B6404 | |
| Antibiotiques / antifongique, 100X | Invitrogen | 15240062 | |
| Anti-HA matrice d'affinité, clone 3F10 | Roche | 1815016 | |
| Anti-HA AcM murin, clone 16B12 | Covance | MMS-101P | |
| Flacon de culture cellulaire, culture de tissus T75 cm 2 traité | Corning | 430641 | |
| Flacon de culture cellulaire, culture de tissus T225 cm 2 traité | Corning | 431082 | |
| Plaques de culture cellulaire ,6-bien la culture de tissus traités | Corning | 3516 | |
| Usine cellulaire, 10-couche CellSTACK | Corning | 3312 | |
| Centramate Omega 5K cassette | Voile | OS005C12 | |
| Centramate Omega 30K cassette | Voile | OS030C12 | |
| Chromatographie Colonne de verre, cm 1,0.10 | Kontes | 4204001010 | |
| La ciprofloxacine | Sigma | 17850 | |
| CO 2 | |||
| Eagle modifié par Dulbecco des médias (DMEM) | Sigma | D5796 | |
| Sérum de veau fœtal (FBS), inactivé par la chaleur | Invitrogen | 12484-028 | |
| Réactif de transfection FuGENE HD | Promega | 4709691001 | |
| Réactif de transfection GeneJuice | EMD / Merck | 70967-6 | |
| Glycine | Sigma | G8898 | |
| De chèvre anti-IgG de souris F (ab ') 2 piles alcalines | Thermo Scientific | 31324 | |
| conjugué à la phosphatase anticorps | |||
| Hémagglutinine (HA) peptide, de 100 mg | GenScript | de synthèse sur mesure | |
| (Séquence: YPYDVPDYA; une pureté de 95%) | |||
| Cellules HEK 293T | ATCC | CRL-11268 | |
| Household blanchiment (4% d'hypochlorite de sodium en poids / volume) | différentes marques sont disponibles | ||
| Immobilon-P membrane de PVDF | Millipore | IPVH07850 | |
| Kit Miniprep purification de plasmide, Purelink rapide | Invitrogen | K2100-11 | |
| Kit Maxiprep purification de plasmide, Purelink HiPure | Invitrogen | K2100-07 | |
| NaN 3 | Sigma | S8032 | |
| Vecteur d'expression pDISPLAY | Invitrogen | V660-20 | |
| Pénicilline / streptomycine (pénicilline / streptomycine), 100X | Invitrogen | 15140-122 | |
| Tampon phosphate salin (PBS), stérile 1X | Sigma | D8537 | |
| Polyéthylèneimine (PEI), linéaires 25 kDa | Polyscience | 23966 | |
| Poudre de lait écrémé sec | Œillet | ||
| Stericup-GP unité du PSE filtration sous vide, | Millipore | SCGPU05RE | |
| 0,22 um, capacité de 500 ml | |||
| Le bleu trypan | Invitrogen | 15250061 | |
| Trypsine-EDTA, 0,05% (p / v) | Invitrogen | 25300-054 | |
| Tween-20 | Sigma | P7949 | |
| L'acide valproïque | Sigma | P4543 | |
| Centramate système à écoulement tangentiel | Voile | ||
| CO 2 incubateur humidifié, standard 6.0 cu. pi | différentes marques sont disponibles | ||
| Unité d'électrophorèse et le transfert | différentes marques sont disponibles | ||
| Incubateur, 37 ° C | différentes marques sont disponibles |
Références
- Celik, E., Calik, P. Production of recombinant proteins by yeast cells. Biotechnol. Adv. , (2011).
- Yokoyama, S. Protein expression systems for structural genomics and proteomics. Curr. Opin. Chem. Biol. 7, 39-43 (2003).
- Nettleship, J. E., Assenberg, R., Diprose, J. M., Rahman-Huq, N., Owens, R. J. Recent advances in the production of proteins in insect and mammalian cells for structural biology. J. Struct. Biol. 172, 55-65 (2010).
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: Applications come of age. Biotechnol. Adv. , (2011).
- Lee, J. E. Structure of the Ebola virus glycoprotein bound to an antibody from a human survivor. Nature. 454, 177-182 (2008).
- Bowden, T. A. Structural basis of Nipah and Hendra virus attachment to their cell-surface receptor ephrin-B2. Nat. Struct. Mol. Biol. 15, 567-572 (2008).
- Evans, M. J., Hartman, S. L., Wolff, D. W., Rollins, S. A., Squinto, S. P. Rapid expression of an anti-human C5 chimeric Fab utilizing a vector that replicates in COS and 293 cells. J. Immunol. Methods. 184, 123-138 (1995).
- Ye, J. High-level protein expression in scalable CHO transient transfection. Biotechnol. Bioeng. 103, 542-551 (2009).
- Wurm, F. M. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol. 22, 1393-1398 (2004).
- Lee, J. E., Fusco, M. H., Hessell, A. J., Burton, D. R., Saphire, E. O. Techniques and tactics used in determining the structure of trimeric, prefusion Ebola virus GP. Acta Cryst. 65, 1162-1180 (2009).
- Aricescu, A. R. Eukaryotic expression: developments for structural proteomics. Acta. Crystallogr. D Biol. Crystallogr. 62, 1114-1124 (2006).
- Aricescu, A. R., Lu, W., Jones, E. Y. A time- and cost-efficient system for high-level protein production in mammalian cells. Acta. Crystallogr. D Biol. Crystallogr. D62, 1243-1250 (2006).
- Chang, V. T. Glycoprotein structural genomics: solving the glycosylation problem. Structure. 15, 267-273 (2007).
- Lee, J. E., Fusco, M. H., Saphire, E. O. An efficient platform for screening expression and crystallization of glycoproteins produced in human cells. Nature Protocols. 4, 592-604 (2009).
- Nettleship, J. E., Rahman-Huq, N., Owens, R. J. The production of glycoproteins by transient expression in Mammalian cells. Methods Mol. Biol. 498, 245-263 (2009).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Nakamura, Y. Heterodimerization of the IL-2 receptor beta- and gamma-chain cytoplasmic domains is required for signalling. Nature. 369, 330-333 (1994).
- Wang, X., Rickert, M., Garcia, K. C. Structure of the quaternary complex of interleukin-2 with its alpha, beta, and gammac receptors. Science. 310, 1159-1163 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon