Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Grabación óptica de la actividad neural suprathreshold con la resolución de una sola célula y único punta-
En este artículo
Resumen
La comprensión de la función del sistema nervioso central de vertebrados requiere grabaciones de muchas neuronas porque la función cortical surge en el nivel de las poblaciones de neuronas. Aquí se describe un método óptico para registrar la actividad neuronal con suprathreshold resolución unicelular y único punta-, vaciló al azar escaneado en acceso. Este método graba somáticas fluorescencia señales de calcio de hasta 100 neuronas con alta resolución temporal. Un algoritmo de máxima probabilidad deconvolves la actividad neural subyacente suprathreshold partir de las señales de fluorescencia de calcio somáticas. Este método detecta de forma fiable con los picos de alta eficiencia de detección y una baja tasa de falsos positivos y se puede utilizar para estudiar las poblaciones neuronales In vitro Y In vivo.
Resumen
Señalización de información en el sistema nervioso central de vertebrados se realiza a menudo por las poblaciones de neuronas en vez de las neuronas individuales. También propagación de la actividad suprathreshold spiking implica poblaciones de neuronas. Los estudios empíricos que abordan directamente la función cortical por lo tanto requieren las grabaciones de las poblaciones de neuronas con alta resolución. Aquí se describe un método óptico y un algoritmo de deconvolución para registrar la actividad neuronal de hasta 100 neuronas con resolución unicelular y único punta-. Este método se basa en la detección de los aumentos transitorios en la concentración intracelular de calcio somático asociado con picos suprathreshold eléctricas (potenciales de acción) en las neuronas corticales. Alta resolución temporal de las grabaciones ópticas se consigue mediante una técnica de escaneo rápido de acceso aleatorio utilizando deflectores acústico-ópticos (ordenadores delegados) 1. Excitación de dos fotones de los resultados sensible al calcio de tinte en una alta resolución espacial en tis cerebrales opacosdemandar 2. Reconstrucción de los picos de las grabaciones de fluorescencia de calcio se consigue mediante un método de máxima probabilidad. Simultáneas registros electrofisiológicos y óptica indican que nuestro método detecta de forma fiable espigas (> 97% de eficiencia de detección de pico), tiene una baja tasa de detección de falsos positivos espiga (<0,003 espigas / s), y una alta precisión temporal (aproximadamente 3 ms) 3. Este método óptico de detección de pico puede utilizarse para registrar la actividad neuronal in vitro y en animales anestesiados in vivo 3,4.
Protocolo
1. Configuración óptica (Figura 1)
- Para dos fotones de excitación un sistema de infrarrojos láser pulsado con pulsos de femtosegundos se utiliza. Un láser de potencia de salida alta (en algunos casos> 2W en longitud de onda nm 890) es necesaria para compensar las grandes pérdidas introducidas por los componentes ópticos del sistema.
- Un sistema prechirper que consta de dos prismas imparte una dispersión grupo velocidad negativa (EVI) en los pulsos de láser antes de los deflectores acústico-ópticos (ordenadores delegados) para compensar la dispersión temporal introducida por el ordenadores delegados 1.
- Dos ordenadores delegados con aberturas grandes (10 mm para un objetivo de inmersión en agua 40x con NA 0,8) desviar el haz de láser en dos dimensiones.
- Una red de difracción reflexivo con 100 huertos / mm se coloca 13 cm por detrás de los ordenadores delegados para compensar la dispersión espacial introducida por los ordenadores delegados al usar pulsos cortos de láser.
- El rayo láser se dirige con dos telescopios de relé en el puerto de la cámara de un montante microscope.
- Iris están colocados a intervalos regulares para la alineación de los componentes ópticos.
- Un divisor de haz dicroico en frente del objetivo transmite la luz de excitación infrarroja para la muestra y refleja la luz de fluorescencia de la muestra a un detector.
- Detectores de Epi-y transfluorescence (fotomultiplicadores, PMT) recoger la señal de fluorescencia a través del objetivo y - en su caso - a través del condensador.
- Filtros de vidrio de color (BG-39, 3-5 mm) se colocan delante de los detectores para evitar que la luz de excitación alcanzar los detectores.
- Los ángulos de deflexión de AOD están controlados por un ordenador equipado con una tarjeta digital-analógico convertidor (156,25 kHz frecuencia de reloj), que a su vez acciona tensión osciladores controlados.
- La señal de los fotomultiplicadores se retransmite a través de un filtro de paso bajo Butterworth (frecuencia de corte de 100 kHz) y digitalizada por un convertidor analógico-digital converter (156,25 tasa de reloj kHz) antes de ser almacenado enun ordenador para su análisis.
- La alineación y el ruido eléctrico se prueban mediante el registro de la distribución de las señales de fluorescencia con y sin luz láser, en ganancia baja y alta de los fotomultiplicadores, así como con y sin indicador. El escáner está correctamente configurado y protegido cuando la anchura de la distribución de las señales de fluorescencia en ganancia alta y con indicador es mucho más grande que las anchuras de las otras distribuciones de señales de fluorescencia (Fig. 2).
2. Los procedimientos experimentales
- Dithered azar escaneado en acceso se basa en la detección de los aumentos intracelulares de calcio. Un gran número de neuronas se pueden teñir utilizando inyección en bolo de la forma de éster de un indicador de calcio (por ejemplo Oregon Green 488 Bapta-1 AM) en el tejido neural 5.
- Varios lugares de cada soma neuronal se registran, cada uno por un corto tiempo ("dithering", 4 lugares, 6,4 ms para cada ubicación = 25,6 ms de tiempo de grabación para el correoACH neurona en cada ciclo, la fig. 3C). Para seleccionar las neuronas de interés un marco completo que consta de 256x256 píxeles se adquiere (Fig. 3A). El centro de cada soma neuronal a grabar se selecciona manualmente dentro de esta imagen. El software de control añade tres puntos a una distancia de 2 m alrededor de este centro.
- En cada ciclo, la señal de fluorescencia se registra a partir de cada una de las 40 neuronas (Fig. 3B). Este proceso se repite para toda la duración de una grabación (5 segundos de grabación = 3255 ciclos, 1 ciclo = 1,536 ms).
3. Las herramientas en línea de software para maximizar la eficiencia de detección de pico
- Detección de pico de las señales de fluorescencia de calcio somáticas se basa en una alta relación señal-ruido (S / N) de las señales de calcio somáticas de fluorescencia. Una alta relación S / N se puede lograr mediante el aumento de la intensidad de excitación. Intensidad de excitación, sin embargo, sólo se puede aumentar hasta un cierto límite, porque de fotodaño. Detección Spike es alta dentro de una windo muy pequeñow de las intensidades de excitación sólo cuando las señales de fluorescencia tienen una alta relación S / N, pero sólo muy poco daño solar es observado 3. Con el fin de garantizar que las señales grabadas están dentro de la ventana de detección de pico de alta durante grabaciones que controlar la frecuencia de fotones (véase la ecuación 3,2) y disminución del nivel de referencia de fluorescencia utilizando el análisis en línea.
- Tasa de fotón aproximado por neurona se calcula a partir de una ventana de tiempo corto (100-200 ms) de ruido de línea base. Tasa de número de fotones (N λ) y el fotón (λ = λ N / Dt) se calcula a partir de los valores de fluorescencia mediante el ajuste de la distribución (σ) de los cambios relativos de fluorescencia con la siguiente ecuación:
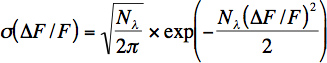
Esta ecuación representa la distribución de Poisson para el ruido de disparo fotón con un cambio de variable con el cambio de fluorescencia relativa: Df / F = (G * N λ (t)-G * N + lambda, 0,) / G * N λ, 0 donde G denota la ganancia acumulada del fotomultiplicador y todos los componentes electrónicos. Tenga en cuenta que esta ecuación no determina correctamente el número de fotones detectados para grabaciones en vivo porque hay otras fuentes de ruido (artefactos de movimiento), además de ruido de disparo fotón. Sin embargo, esta ecuación es útil para grabaciones en vivo para estimar el ruido.
- De fluorescencia base se calcula a partir de la misma ventana de tiempo y se representa como una función del tiempo o ensayos. El descenso medio de línea de base se mantiene por debajo de 0,0002 / s mediante el ajuste de la potencia del láser ya que la detección pico disminuye rápidamente cuando se excede este límite.
- Cada 10-20 minutos las posiciones somas neuronales son verificados por la adquisición de nuevo una imagen a pantalla completa. Si es necesario, las ubicaciones de grabación son ajustados. Las localizaciones pueden ser ajustados para todas las neuronas a la vez, o para las neuronas individuales.
4. Reconstruction de horarios pico de las señales de fluorescencia (deconvolución)
- Las señales de fluorescencia resultantes de la actividad neural a menudo summate en el tiempo debido a la descomposición de los transitorios de calcio es largo (varios cientos de milisegundos). Un método de deconvolución reconstruye horarios pico y pico de las señales de fluorescencia.
- Para determinar el tren pico más probable que subyace a la señal de fluorescencia registrada, diferentes modelos se comparan. Aquí hemos utilizado un algoritmo genético para determinar el modelo - y por tanto el tren de pico y tiempos de punta - con la máxima verosimilitud.
- En las poblaciones no homogéneas de las neuronas, la espiga-evocado señal de calcio puede variar entre las neuronas. Para el análisis no supervisado de los conjuntos de datos que hemos diseñado un algoritmo que tiene en cuenta la variación de la señal de calcio espiga-evocada de una neurona a otra.
- Para evitar un gran número de detecciones de falsos positivos es útil para constreñir la amplitud permitida y el tiempo constante de desintegración del modelo de la señal de calcio punta-evocado. La distribución conjunta de la amplitud y el tiempo constante de desintegración de un solo pico transitorios de calcio evocadas se registran en un conjunto separado de experimentos del mismo tipo de neuronas en las mismas condiciones experimentales usando simultáneas registros electrofisiológicos y óptica.
- Para dar cuenta de los cambios lentos de referencia y reducir los costes computacionales de deconvolving, grabaciones más largas se dividen en varios trazos cortos de 1-5 segundos.
- Para cada neurona y cada grabación, el algoritmo de deconvolución puede probar un gran número de modelos (de hasta un millón de diferentes modelos o más). Para acelerar la deconvolución, un experimento se deconvolved en hasta 10 equipos diferentes en paralelo.
- Después de la deconvolución, la espiga de datos se analiza y se inspeccionó. Un histograma de tiempo de peri-estímulo, la probabilidad de espiga, y la tasa de disparo (media espiga por las neuronas) se calculan de una manera automatizada.
5.Los resultados representativos
El éxito de espiga bisagras de detección en una alta relación señal a ruido de las señales de fluorescencia grabadas calcio somáticas. Simplemente usando altas tasas de excitación (láser de alta potencia) puede resultar en un impacto adverso de photoeffects en material biológico (fotoenvejecimiento). En fotodaño interpolado de exploración de acceso aleatorio se manifiesta como una disminución en la fluorescencia basal y disminuye las señales de calcio punta-evocados fluorescencia. La disminución en la señal de pico-evocó rápidamente puede resultar en una falta de detección de picos. Sólo hay una ventana muy pequeña de la intensidad de excitación en la detección de pico de las señales de fluorescencia es alta. En el extremo superior esta ventana está limitada por fotodaño, en el extremo inferior de las señales de fluorescencia tienen una baja relación señal-ruido. Para neuronas corticales en rodajas agudas usamos la potencia del láser se traduce en tasas de fotones de unos 400,000-1,500,000 fotones / s cuando se graba a unos 100 m por debajo de la superficie de corte. Cuando se usa un alto-Afinidad indicador - aquí Oregon Green 488 BAPTA - 1 - Esta señal es suficiente para detectar picos individuales. La figura. 3E muestra un ejemplo de una señal de fluorescencia de excitación grabar a una velocidad muy baja, un ejemplo de una grabación dentro de la ventana de detección, y uno a la tasa de excitación muy alta.
En comparación con otras técnicas para registrar la actividad neuronal en la resolución de una sola célula y de un solo pico, interpolado de acceso aleatorio exploración puede grabar de un mayor número de neuronas de la misma población, local, y es menos invasiva, por ejemplo, en comparación con las grabaciones tetrodo / multielectrode . Así interpolado de acceso aleatorio escaneado se puede utilizar para registrar la actividad neural de muchas neuronas para medir la información mutua señalado por la actividad supra-6 (Fig. 4A), los cambios de actividad neural en una población de neuronas (plasticidad cortical), y la propagación de la actividad suprathreshold a través de poblaciones de neuronas 14 (Fig. 4B)
alt = "Figura 1" src = "/ files/ftp_upload/4052/4052fig1.jpg" />
Figura 1. Diseño óptico de la configuración de acceso aleatorio interpolado-exploración.
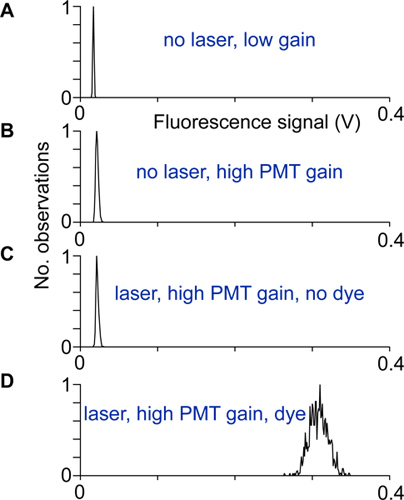
Figura 2 Alineación y pruebas:. Distribuciones de señales de fluorescencia grabadas en diferentes condiciones. A) No hay luz láser y la ganancia del fotomultiplicador bajo, B) En PMT ganancia más alta, pero no la luz láser, la distribución es más amplia debido a la actual fotomultiplicador oscuro. C) Con el láser y grabado en alta ganancia PMT. Una diferencia entre las distribuciones se muestran en B y distribución, esto indicaría que la luz de excitación llega a los detectores PMT. D) La distribución de las señales de fluorescencia grabado en alta ganancia de neurona somata. Si no hay ninguna otra fuente de ruido contribuye, esta distribución surge de fotón único disparo-ruido.
. Jpg "/>
Figura 3 A) Imagen de marco completo de fluorescencia para detectar y seleccionar las posiciones de neuronas Somata, B) trayectoria de exploración de un ciclo, C) Ilustración del principio tramado;. En cada Soma (círculo) varios lugares se registran antes de mover el haz hacia la siguiente soma, D) Ilustración de la salida del convertidor D / dos canales A. Para cada soma neuronal, la señal de fluorescencia se registraron desde 4 puntos diferentes en cada soma (S1-S4). La ubicación de cada punto viene dada por su posición x e y. El posiciones x e y para todos los puntos y las neuronas se envían todos al convertidor digital a analógico de una manera secuencial. Mientras que el haz se mueve entre dos cuerpos celulares de neuronas, la señal no ha adquirido (en blanco). E) Los ejemplos de señales de fluorescencia. Tenga en cuenta que cada ejemplo se muestra la respuesta a una espiga (según se mide con electrofisiológico celular conectado a la grabación).
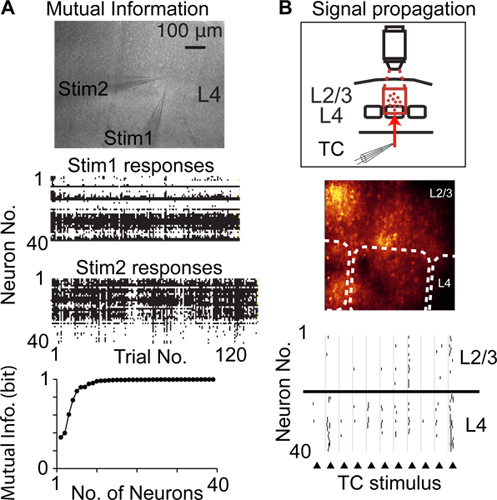
Figura 4. Estudiar cortifunción de cal usando tramado aleatorio escaneado en acceso. A) Medición de la información mutua señalado por poblaciones de neuronas. La imagen superior muestra una fotomicrografía de cortes de cerebro agudo y dos pipetas de estimulación situados en la misma columna cortical en la capa 4 (L4). Centro gráficos muestran respuestas neuronales para cada repetición de un estímulo. Gráfico inferior muestra la información mutua de Shannon señalado por la población registrada de neuronas. B) Medición de propagación de la actividad suprathreshold enriquecimiento (propagación de la señal) entre las poblaciones de neuronas corticales. Gráfico superior ilustra el diseño experimental, la imagen del centro muestra la imagen de fluorescencia, las líneas punteadas indican las fronteras barril, gráfico inferior muestra picos detectados en respuesta a la estimulación eléctrica de las fibras talamocorticales (triángulos).
Discusión
Dithered azar escaneado en acceso indirecto detecta actividad suprathreshold adición de los incrementos en el calcio intracelular somático asociado con cada aumento en una somata neurona. Los incrementos en el calcio intracelular se detecta por los colorantes de calcio fluorescentes. Las limitaciones de interpolado de acceso aleatorio escaneado surgen en gran medida de la de la limitada señal-a-ruido de las señales de fluorescencia de calcio. La relación de señal-a-ruido es a su vez limitada por fotodaño, que no ...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Agradecemos al Dr. Randy Chitwood para la lectura crítica del manuscrito. Este trabajo fue apoyado por la Fundación Whitehall y la Alfred P. Sloan Foundation otorga a HJK.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Los componentes ópticos se enumeran en orden, empezando por el láser | |||
| Titan: Sapphire láser | Coherente Inc. | Camaleón Ultra 2 | Alta potencia de salida recomendado (> 2 W a 900 nm) |
| Lente acromático f = 30 mm | Thor laboratorios | AC254-030-B | Anti-reflejo (AR) 650-1050 nm para |
| Lente acromático f = 100 mm | Thor laboratorios | AC254-100-B | AR 650-1050 nm |
| Objetivo f = 75 mm | Thor laboratorios | LA1608-B | AR 650-1050 nm |
| Objetivo f = 175 mm | Thor laboratorios | LA1229-B | AR 650-1050 nm |
| Lente acromático f = 300 mm | Thor laboratorios | AC254-300-B | AR 650-1050 nm |
| Lente acromático f = 100 mm | Thor laboratorios | AC254-100-B | AR 650-1050 nm |
| Lente acromático f = 100 mm | Thor laboratorios | AC254-100-B | AR 650-1050 nm |
| Acústico-óptico deflectores | Intraaction Corp | ATD 6510CD2 | |
| Rejilla de difracción reflectante | Newport | 53-011R | 100 surcos / mm para los ordenadores delegados con ancho de banda de 65 MHz ángulo de exploración de 45 mrad |
| 21,6 mm Brewster prismas | Lambda Investigación Optics Inc. | IBP21.6SF10 | |
| Vidrio coloreado | Schott | BG-39 | |
| Espejo dicroico | Chroma Technology Corp | Z532RDC | |
| Módulos fotomultiplicadores | Hamamatsu | H9305-03 | |
| DAC-ADC bordo | National Instruments | PCI-6115 | |
| Oregon Green 488 Bapta-1 AM | Invitrogen | O-6807 |
Referencias
- Iyer, V., Hoogland, T. M., Saggau, P. Fast functional imaging of single neurons using random-access multiphoton (RAMP) microscopy. J. Neurophysiol. 95, 535-545 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73 (1990).
- Ranganathan, G. N., Koester, H. J. Optical recording of neuronal spiking activity from unbiased populations of neurons with high spike detection efficiency and high temporal precision. J. Neurophysiol. 104, 1812-1824 (2010).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nat. Methods. 7, 399-405 (2010).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc. Natl. Acad. Sci. U.S.A. 100, 7319-7324 (2003).
- Pita-Almenar, J. D., Ranganathan, G. N., Koester, H. J. Impact of cortical plasticity on information signaled by populations of neurons in the cerebral cortex. J. Neurophysiol. 106, 1118-1124 (2011).
- Kerr, J. N., Greenberg, D., Helmchen, F. Imaging input and output of neocortical networks in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 14063-14068 (2005).
- Lin, B. J., Chen, T. W., Schild, D. Cell type-specific relationships between spiking and [Ca2+]i in neurons of the Xenopus tadpole olfactory bulb. J. Physiol. 582, 163-175 (2007).
- Zeng, S., Lv, X., Zhan, C., Chen, W. R. Simultaneous compensation for spatial and temporal dispersion of acousto-optical deflectors for two-dimensional scanning with a single prism. Opt. Lett. 31, 1091-1093 (2006).
- Otsu, Y., Bormuth, V., Wong, J., Mathieu, B. Optical monitoring of neuronal activity at high frame rate with a digital random-access multiphoton (RAMP) microscope. J. Neurosci. Methods. 173, 259-270 (2008).
- Vogelstein, J. T., Watson, B. O., Packer, A. M., Yuste, R. Spike inference from calcium imaging using sequential Monte Carlo methods. Biophys. J. 97, 636-655 (2009).
- Yaksi, E., Friedrich, R. W. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nat. Methods. 3, 377-383 (2006).
- Hendel, T., Mank, M., Schnell, B., Griesbeck, O. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro. J. Neurosci. 28, 7399-7411 (2008).
- Ranganathan, G. N., Koester, H. J. Correlations decrease with propagation of spiking activity in the mouse barrel cortex. Front Neural Circuits. 5, 8 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados