Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Optische Aufnahme überschwellige neuronale Aktivität mit Single-Cell-und Single-Spike Auflösung
In diesem Artikel
Zusammenfassung
Das Verständnis der Funktion des zentralen Nervensystems in Wirbeltieren erfordert Aufnahmen aus, weil viele Neuronen kortikale Funktion entsteht auf der Ebene der Populationen von Neuronen. Hier haben wir ein optisches Verfahren zur überschwelligen neuronale Aktivität mit Single-Cell-und Single-Spike Auflösung aufzeichnen beschreiben, gedithert Random-Access-Scans. Diese Methode records somatischen Fluoreszenz-Calcium-Signale von bis zu 100 Neuronen mit hoher zeitlicher Auflösung. Ein Maximum-Likelihood-Algorithmus deconvolves die darunterliegende überschwellige neuronale Aktivität von den somatischen Fluoreszenz Calcium Signale. Diese Methode erkennt zuverlässig Spikes mit hohen Erkennungsraten Wirkungsgrad und eine geringe Rate der False Positives und kann verwendet werden, um neuronale Populationen zu untersuchen In vitro Und In vivo.
Zusammenfassung
Signalisieren von Informationen in dem Vertebraten zentralen Nervensystems wird oft von Populationen von Neuronen statt einzelner Neuronen durchgeführt. Auch Ausbreitung überschwellige spiking Tätigkeit umfasst Populationen von Neuronen. Empirische Studien zu kortikalen Funktion direkt erfordern daher Aufnahmen von Populationen von Neuronen mit hoher Auflösung. Hier beschreiben wir ein optisches Verfahren und eine Entfaltungs-Algorithmus auf neurale Aktivität von bis zu 100 Neuronen mit Single-Cell-und Single-Spike-Auflösung aufzeichnen. Diese Methode beruht auf dem Nachweis der transienten Anstieg der intrazellulären Kalziumkonzentration somatischen mit überschwelligen elektrischen Spitzen (Aktionspotentiale) in kortikalen Neuronen verbunden. Hohe zeitliche Auflösung der optischen Aufnahmen wird durch eine schnelle Random-Access-Scanning-Technik mit akusto-optische Deflektoren (bevollmächtigten Anweisungsbefugten) 1 erreicht. Zwei-Photonen-Anregung der Calcium-sensitiven Farbstoff Ergebnisse in hoher räumlicher Auflösung in undurchsichtigen Gehirn tisSue 2. Rekonstruktion der Spitzen von den Fluoreszenz-Calcium-Aufnahmen durch eine Maximum-Likelihood-Methode erreicht. Simultane elektrophysiologische und optische Aufnahmen zeigen, dass unsere Methode zuverlässig erkennt Spikes (> 97% Spike Detektionseffizienz) weist eine geringe Rate an falsch positiven Spitzen-Detektionssignals (<0,003 Spikes / s) und einer hohen zeitlichen Genauigkeit (etwa 3 ms) 3. Diese optische Methode der Spitzen-Detektionssignals können verwendet werden, um neuronale Aktivität in vitro und in vivo in narkotisierten Tieren 3,4 aufzuzeichnen.
Protokoll
Ein. Optischer Aufbau (Abbildung 1)
- Für Zwei-Photonen-Anregung ein Infrarot gepulstes Lasersystem mit Femtosekunden-Pulsen verwendet wird. Eine hohe Laserausgangsleistung (teilweise> 2W bei 890 nm Wellenlänge) ist erforderlich, um die großen Verluste durch die optischen Komponenten des Systems eingebracht wird, ausgeglichen.
- Ein prechirper bestehend aus zwei Prismen verleiht eine negative Gruppengeschwindigkeitsdispersion (GVD) auf die Laserpulse vor den akustooptischen Ablenker (bevollmächtigten Anweisungsbefugten) für die zeitliche Dispersion durch den bevollmächtigten Anweisungsbefugten 1 eingeführt kompensieren.
- Zwei bevollmächtigten Anweisungsbefugten mit großen Öffnungen (10 mm für eine 40x Wasser Immersionsobjektiv mit NA 0,8) lenken den Laserstrahl in zwei Dimensionen.
- Eine reflektierende Beugungsgitter mit 100 Hainen / mm platziert ist 13 cm hinter den bevollmächtigten Anweisungsbefugten, um die räumliche Verteilung von bevollmächtigten Anweisungsbefugten eingeführt kompensieren, wenn unter Verwendung kurzer Laserpulse.
- Der Laserstrahl wird mit zwei Relais-Teleskope in den Kamera-Anschluss eines aufrechten Mikroskopie gerichtetpe.
- Irisblenden sind in regelmäßigen Abständen für die Ausrichtung der optischen Komponenten angeordnet.
- Ein dichroitischer Strahlteiler vor dem Ziel überträgt das Infrarot Anregungslicht auf die Probe und reflektiert das Fluoreszenzlicht aus der Probe auf einen Detektor.
- Epi-und transfluorescence Detektoren (Photomultiplier, PMT) zu sammeln Fluoreszenzsignals durch das Objektiv und - falls vorhanden - durch den Kondensator.
- Farbglasfilter (BG-39, 3-5 mm) vor der Detektoren angeordnet, um Anregungslicht zu verhindern Erreichen der Detektoren.
- Die AOD Ablenkwinkel werden von einem Computer mit einem Digital-Analog-Wandler Karte (156,25 kHz Taktrate), die wiederum treibt spannungsgesteuerte Oszillatoren ausgestattet gesteuert.
- Das Signal von den Photomultipliern wird durch eine Tiefpaß-Butterworth-Filter (Grenzfrequenz von 100 kHz) weitergeleitet und digitalisiert durch einen Analog-Digital-Wandler (156,25 kHz Taktrate), bevor sie in gespeichertenein Computer für die Analyse.
- Ausrichtung und elektrischem Rauschen werden durch Aufzeichnung der Verteilung der Fluoreszenz-Signalen mit und ohne Laserlicht getestet, bei niedrigen und bei hohen Verstärkung der Photomultiplier, sowie mit und ohne Indikator. Der Scanner ist korrekt einzustellen und abgeschirmt, wenn die Breite der Verteilung der Fluoreszenzsignale bei hoher Verstärkung und mit Indikator ist viel größer als die Breiten der anderen Verteilungen von Fluoreszenzsignalen (Abb. 2).
2. Experimentelle Verfahren
- Dithered Random-Access-Scans beruht auf Detektion von intrazellulären Anstieg der Kalzium. Eine große Anzahl von Neuronen können angefärbt unter Verwendung Bolusinjektion des Esters Form eines Calcium-Indikator (beispielsweise Oregon Green 488 Bapta-1 AM) in neuronale Gewebe 5 ist.
- Mehreren Orten aus jedem Neuron Soma aufgezeichnet sind, jeweils für eine kurze Zeit ("Dithering", 4 Orten 6,4 us für jeden Ort = 25,6 us Aufnahmezeit für Each Neuron in jedem Zyklus, Fig. 3C). Um Neuronen von Interesse wählen Sie eine Full-Frame aus 256x256 Pixel erworben wird (Abb. 3A). Die Mitte jedes Neuron Soma aufzuzeichnenden wird manuell innerhalb dieses Bildes ausgewählt. Die Steuerungs-Software fügt automatisch drei Punkte bei 2 um Abstand um dieses Zentrum.
- In jedem Zyklus wird die Fluoreszenz-Signal von jedem der 40 Neuronen (3B) aufgezeichnet. Dieser Prozess wird für die gesamte Dauer einer Aufnahme (5 = zweiten Aufzeichnungsbereich 3255 Zyklen, 1 Zyklus = 1,536 ms) wiederholt.
3. Online Software-Tools zur Spike-Erkennung zu maximieren
- Spike Detektion von Fluoreszenz-Signalen somatischen Calcium beruht auf einem hohen Signal-zu-Rauschen (S / N) Verhältnis der somatischen Fluoreszenz Calcium Signale. Ein hohes S / N durch Erhöhen Anregungsintensität erreicht werden. Anregungsintensität kann jedoch nur bis zu einem gewissen Grenzwert aufgrund Lichtschäden erhöht werden. Spike-Erkennung ist in einem sehr kleinen windo hohenw von Anregungsintensitäten nur wo Fluoreszenzsignale ein hohes S / N haben aber nur eine sehr geringe Lichtschäden wird 3 beobachtet. Um sicherzustellen, dass die aufgenommenen Signale innerhalb des Fensters der hohen Spike-Erkennung sind bei Aufnahmen überwachen wir Photonen-Rate (siehe Gleichung 3.2) und Rückgang der Fluoreszenzgrundlinienmessungen mit Online-Analyse.
- Grobe Photon pro Neuron ausgewählt ist aus einem kurzen Zeitfenster (100-200 ms) des Basislinienrauschen berechnet. Anzahl von Photonen (λ N) und Photonen Rate (λ = N λ / At) aus den Fluoreszenz-Werte durch die Verteilung (σ) der relativen Fluoreszenz ändert sich mit der folgenden Gleichung berechnet:
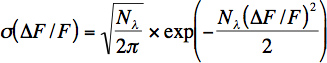
Diese Gleichung stellt die Poisson-Verteilung für Photonen Schrotrauschen mit einer Änderung der Variable relative Fluoreszenz Änderung: &Dgr; F / F = (G * N λ (t)-G * N & lambda;, 0) / G * N λ, 0, wobei G bezeichnet die kumulative Gewinn von Photomultiplier und alle anderen elektronischen Komponenten. Man beachte, dass diese Gleichung nicht korrekt bestimmt die Anzahl der detektierten Photonen für die in vivo-Aufnahmen weil andere Lärmquellen (Bewegungsartefakte), zusätzlich zu Photon Schrotrauschen sind. Dennoch ist diese Gleichung nützlich für die in vivo-Aufnahmen, um das Rauschen zu schätzen.
- Fluoreszenzbasismesswert aus dem gleichen Zeitfenster berechnet und als Funktion der Zeit oder Studien. Der durchschnittliche Rückgang der Grundlinie unter 0,0002 / s durch Anpassung Laserleistung, weil Spike-Erkennung rasch ab, wenn diese Grenze überschreiten, gehalten.
- Jedes 10-20 min das Neuron Somata Positionen werden durch erneutes Erwerb ein Vollbild überprüft. Falls erforderlich, werden Aufnahmeorte angepasst. Standorte können für alle Neuronen auf einmal, oder für einzelne Neuronen eingestellt werden.
4. Reconstruction von Spike Timings von Fluoreszenz-Signalen (Dekonvolution)
- Die Fluoreszenz-Signale, die aus neuronalen Aktivität oft in summieren Zeit, weil der Zerfall der Calciumtransienten ist lang (einige hundert Millisekunden). A Dekonvolutionsverfahren rekonstruiert Spike und Spike Timings von Fluoreszenz-Signalen.
- Um die wahrscheinlichste Spike Train zugrundeliegenden aufgezeichneten Fluoreszenzsignal zu bestimmen, werden verschiedenen Modellen verglichen. Hier haben wir einen genetischen Algorithmus, um das Modell zu bestimmen - und damit die Spike Train und Spike-Timings - mit der höchsten Wahrscheinlichkeit.
- In inhomogenen Populationen von Neuronen, kann der Spike-evozierte Kalzium-Signal zwischen den Neuronen variieren. Für den unbeaufsichtigten Analyse der Datensätze gestalteten wir einen Algorithmus, der unter Berücksichtigung der Variation des Spike-evozierte Calcium Signal von Neuron zu Neuron.
- Um eine große Anzahl von Fehlalarmen zu vermeiden, ist es sinnvoll zu verengen den zulässigen Amplitude und Abklingzeitkonstante des modell der Spitze hervorgerufenen Calcium-Signal. Die gemeinsame Verteilung der Amplitude und Abklingzeitkonstante Single-Spike evozierte Kalzium Transienten werden in einer separaten Reihe von Experimenten aus der gleichen Art von Neuronen unter den gleichen Versuchsbedingungen mit gleichzeitiger elektrophysiologische und optische Aufnahmen aufgezeichnet.
- Um für langsame Baseline Veränderungen ausmachen und Rechenaufwand der Entfalten zu reduzieren, werden längere Aufnahmen in mehrere kürzere Spuren von 1-5 Sekunden geteilt.
- Für jedes Neuron und jeder Aufzeichnung kann der Entfaltungs-Algorithmus Testen einer Vielzahl von Modellen (bis zu 1.000.000 verschiedene Modelle oder mehr). Zur Beschleunigung Dekonvolution, ist ein Experiment auf bis zu 10 verschiedenen Rechnern parallel entfalteten.
- Nach Dekonvolution, wird der Dorn Daten analysiert und geprüft. Eine peri-Stimulus-Histogramm, dem Spike-Wahrscheinlichkeit, und Feuerungsrate (Durchschnitt pro Spike Neuronen) werden in einer automatisierten Art und Weise berechnet.
5.Repräsentative Ergebnisse
Erfolgreiche Spitzen-Detektionssignals Scharniere auf einem hohen Signal-Rausch-Verhältnis der erfassten Fluoreszenz somatischen Calcium Signale. Einfach mit hoher Anregungsraten (hohe Laserleistung) kann in einem negativen Auswirkungen der Photoeffekte auf biologisches Material (Lichtschäden) führen. In geditherten Random-Access-Scans Lichtschäden manifestiert sich als Rückgänge in Fluoreszenzgrundlinienmessungen und sinkt der Spike-evozierte Calcium Fluoreszenzsignale. Der Rückgang in der Spike-evozierten Signals kann schnell zu einem Ausfall, um Spitzen aufzudecken. Es ist nur noch ein sehr kleines Zeitfenster Anregungsintensität wo Spitzen-Detektionssignals aus Fluoreszenz-Signale hoch ist. Am oberen Ende dieses Fenster wird durch Lichtschäden begrenzt, am unteren Ende die Fluoreszenzsignale ein niedriges Signal-zu-Rausch-Verhältnis aufweisen. Für kortikalen Neuronen in akuten Schnitten verwenden wir Laserleistung was Photonen Raten von etwa 400,000-1,500,000 Photonen / s bei der Aufnahme um 100 um unterhalb Scheibenoberfläche. Bei Verwendung einer hohenAffinität Anzeige - Hier Oregon Green 488 BAPTA - 1 - dieses Signal ist ausreichend, um einzelne Spitzen zu erkennen. Fig. 3E zeigt ein Beispiel eines Fluoreszenzsignals bei sehr niedrigen Anregungsrate, die ein Beispiel einer Aufnahme innerhalb des Detektionsfensters, und man bei sehr hohen Anregungsrate aufgezeichnet.
Im Vergleich zu anderen Techniken, um neuronale Aktivität mit Single-Cell-und Single-Spike-Auflösung aufzuzeichnen, gedithert Random-Access-Scanning kann aus einer größeren Anzahl von Neuronen aus dem gleichen, Bevölkerung aufzuzeichnen, und ist weniger invasiv beispielsweise gegenüber Tetrode / Multielektroden Aufzeichnungen . So geditherten Random-Access-Scanning kann verwendet werden, um neuronale Aktivität von vielen Neuronen aufzeichnen, um die gegenseitige Information von überschwelligen Aktivität 6 (Abb. 4A), Veränderungen der neuronalen Aktivität in einer Population von Neuronen (kortikale Plastizität) signalisiert zu messen, und die Vermehrung von überschwelligen Aktivitäten werden Populationen von Neuronen durch 14 (4B)
alt = "Abbildung 1" src = "/ files/ftp_upload/4052/4052fig1.jpg" />
Abbildung 1. Optische Gestaltung der Dithering-random access Scanning Setup.
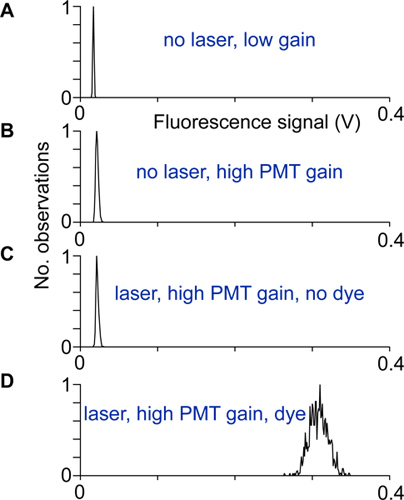
Abbildung 2 Ausrichtung und Prüfung:. Ausschüttungen von Fluoreszenz-Signalen unter verschiedenen Bedingungen aufgezeichnet. A) Nr. Laserlicht und niedrigen Photovervielfacher Verstärkungsfaktor, B) Bei höheren PMT-Verstärkung, aber kein Laserlicht ist die Verteilung breiter wegen der Photovervielfacher Dunkelstroms. C) Mit der Laser auf und erfasst bei hohen PMT-Verstärkung. Ein Unterschied zwischen den Verteilungen in in B gezeigt und dieser Verteilung würde anzeigen, dass Anregungslicht erreicht die PMT Detektoren. D) Die Verteilung von Fluoreszenz-Signalen bei hoher Verstärkung von Neuron Somata aufgezeichnet. Wenn keine andere Lärmquelle beiträgt, stellt sich diese Verteilung von Photonen Schrotrauschen nur.
. Jpg "/>
Abbildung 3 A) Full-Frame-Fluoreszenz-Bild zu erkennen und auszuwählen Neuron Somata Positionen, B) Scan Weg eines Zyklus, C) Illustration des Dithering-Prinzip;. In jedem soma (Kreis) mehrere Standorte sind, bevor Sie den Strahl auf die nächste aufgezeichnete Soma, D) Illustration von dem Ausgang der zwei D / A-Kanäle. Für jedes Neuron Soma wird Fluoreszenzsignal aus 4 verschiedenen Stellen in jedem Soma (s1-s4) aufgezeichnet. Die Lage von jedem Fleck wird durch seine x-und y-Position gegeben. Die x-und y-Positionen für alle Flecken und allen Neuronen werden dem Digital-zu-Analog-Umsetzer in einer sequentiellen Weise gesendet. Während der Strahl zwischen zwei Neuronen Somata bewegt wird, wird kein Signal erworben (leer). E) Beispiele von Fluoreszenzsignalen. Beachten Sie, dass jedes Beispiel als Reaktion auf eine Spitze zeigt (wie bei elektrophysiologischen Cell-Attached-Aufnahme gemessen).
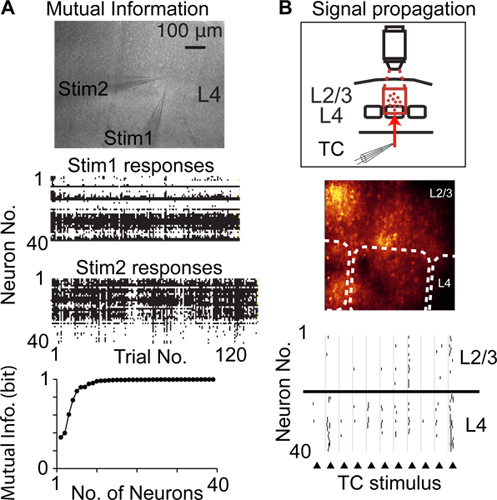
Abbildung 4. Studieren cortical Funktion mit Dithering Random-Access-Scans. A) Messung der gegenseitigen Information von Populationen von Neuronen signalisiert. Oberes Bild zeigt mikroskopische Aufnahme eines akuten Hirnschnittkultur und zwei Stimulation Pipetten in der gleichen Spalte in kortikalen Schicht 4 (L4) angeordnet ist. Zentrum Graphen zeigen neuronale Antworten für jede Wiederholung eines Reizes. Untere Graph zeigt Shannons gegenseitige Information von der aufgenommenen Population von Neuronen signalisiert. B) Messen Ausbreitung überschwellige Spiking Aktivität (Signallaufzeit) zwischen den Populationen von kortikalen Neuronen. Obere Graph zeigt experimentelle Design, mittlere Bild Fluoreszenzbild zeigt, gestrichelt Barrel Grenzen anzugeben, zeigt untere Graph detektierten Spitzen in Reaktion auf elektrische Stimulation des thalamokortikalen Fasern (Dreiecke).
Diskussion
Dithered Random-Access-Scans indirekt erkennt überschwellige Spiking-Aktivität aus dem Anstieg der intrazellulären Calcium-somatischen mit jedem Spike in einem Neuron Somata verbunden. Der Anstieg der intrazellulären Calcium durch fluoreszierende Kalzium Farbstoffe nachgewiesen. Die Grenzen der geditherten Random-Access-Überprüfung ergeben weitgehend aus der begrenzten Signal-zu-Rausch-Verhältnis der Calcium Fluoreszenzsignalen. Das Signal-zu-Rausch-Verhältnis wird wiederum durch Lichtschäden, die es nicht erla...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Dr. Randy Chitwood für die kritische Durchsicht des Manuskripts. Diese Arbeit wurde von der Whitehall-Stiftung und der Alfred P. Sloan Foundation Zuschüsse für HJK unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Optische Komponenten werden in Reihenfolge, beginnend von dem Laser | |||
| Titan: Saphir-Laser | Coherent Inc. | Chameleon Ultra 2 | Hohe Leistung empfohlen (> 2W bei 900 nm) |
| Achromatische Linse f = 30 mm | Thor Labors | AC254-030-B | Anti-Reflex-Beschichtung (AR) für 650-1050 nm |
| Achromatische Linse f = 100 mm | Thor Labors | AC254-100-B | AR 650-1050 nm |
| Objektiv f = 75 mm | Thor Labors | LA1608-B | AR 650-1050 nm |
| Objektiv f = 175 mm | Thor Labors | LA1229-B | AR 650-1050 nm |
| Achromatische Linse f = 300 mm | Thor Labors | AC254-300-B | AR 650-1050 nm |
| Achromatische Linse f = 100 mm | Thor Labors | AC254-100-B | AR 650-1050 nm |
| Achromatische Linse f = 100 mm | Thor Labors | AC254-100-B | AR 650-1050 nm |
| Akusto-optische Deflektoren | Intraaction Corp | ATD 6510CD2 | |
| Reflektierende Beugungsgitter | Newport | 53-011R | 100 Rillen / mm bevollmächtigten Anweisungsbefugten mit 65 MHz Bandbreite und Scan-Winkel von 45 mrad |
| 21,6 mm Brewster-Prismen | Lambda Research Optics Inc. | IBP21.6SF10 | |
| Colored Glass | Schott | BG-39 | |
| Dichroitischen Spiegel | Chroma Technology Corp | Z532RDC | |
| Photomultiplier-Module | Hamamatsu | H9305-03 | |
| DAC-ADC Bord | National Instruments | PCI-6115 | |
| Oregon Green 488 BAPTA-01.00 | Invitrogen | O-6807 |
Referenzen
- Iyer, V., Hoogland, T. M., Saggau, P. Fast functional imaging of single neurons using random-access multiphoton (RAMP) microscopy. J. Neurophysiol. 95, 535-545 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73 (1990).
- Ranganathan, G. N., Koester, H. J. Optical recording of neuronal spiking activity from unbiased populations of neurons with high spike detection efficiency and high temporal precision. J. Neurophysiol. 104, 1812-1824 (2010).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nat. Methods. 7, 399-405 (2010).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc. Natl. Acad. Sci. U.S.A. 100, 7319-7324 (2003).
- Pita-Almenar, J. D., Ranganathan, G. N., Koester, H. J. Impact of cortical plasticity on information signaled by populations of neurons in the cerebral cortex. J. Neurophysiol. 106, 1118-1124 (2011).
- Kerr, J. N., Greenberg, D., Helmchen, F. Imaging input and output of neocortical networks in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 14063-14068 (2005).
- Lin, B. J., Chen, T. W., Schild, D. Cell type-specific relationships between spiking and [Ca2+]i in neurons of the Xenopus tadpole olfactory bulb. J. Physiol. 582, 163-175 (2007).
- Zeng, S., Lv, X., Zhan, C., Chen, W. R. Simultaneous compensation for spatial and temporal dispersion of acousto-optical deflectors for two-dimensional scanning with a single prism. Opt. Lett. 31, 1091-1093 (2006).
- Otsu, Y., Bormuth, V., Wong, J., Mathieu, B. Optical monitoring of neuronal activity at high frame rate with a digital random-access multiphoton (RAMP) microscope. J. Neurosci. Methods. 173, 259-270 (2008).
- Vogelstein, J. T., Watson, B. O., Packer, A. M., Yuste, R. Spike inference from calcium imaging using sequential Monte Carlo methods. Biophys. J. 97, 636-655 (2009).
- Yaksi, E., Friedrich, R. W. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nat. Methods. 3, 377-383 (2006).
- Hendel, T., Mank, M., Schnell, B., Griesbeck, O. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro. J. Neurosci. 28, 7399-7411 (2008).
- Ranganathan, G. N., Koester, H. J. Correlations decrease with propagation of spiking activity in the mouse barrel cortex. Front Neural Circuits. 5, 8 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten