È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Registrazione ottica di attività neurale suprathreshold con risoluzione singola cellula e single-picco
In questo articolo
Riepilogo
Comprensione della funzione del sistema nervoso centrale dei vertebrati richiede registrazioni da molti neuroni perché funzione corticale pone a livello di popolazioni di neuroni. Qui si descrive un metodo ottico per registrare l'attività neurale suprathreshold con risoluzione di singola cellula e single-spike, dithering casuale scansione in accesso. Questo metodo registra somatiche segnali di calcio di fluorescenza da un massimo a 100 neuroni con alta risoluzione temporale. Un algoritmo di massima verosimiglianza deconvolves l'attività sottostante suprathreshold neurale dai segnali di calcio fluorescenza somatiche. Questo metodo rileva affidabile picchi con alta efficienza di rivelazione e un basso tasso di falsi positivi e possono essere utilizzati per studiare popolazioni neuronali In vitro E In vivo.
Abstract
Segnalazione di informazioni nel sistema nervoso centrale dei vertebrati sono spesso realizzate da popolazioni di neuroni anziché singoli neuroni. Anche propagazione dell'attività suprathreshold spiking coinvolge popolazioni di neuroni. Gli studi empirici riguardanti funzione corticale direttamente quindi richiedono registrazioni da popolazioni di neuroni ad alta risoluzione. Qui si descrive un metodo ottico e un algoritmo di deconvoluzione per registrare l'attività neurale da un massimo di 100 neuroni con risoluzione di singola cellula e single-picco. Questo metodo si basa sul rilevamento degli aumenti transitori delle concentrazioni di calcio intracellulare somatica associata a punte suprathreshold elettrici (potenziali d'azione) in neuroni corticali. Alta risoluzione temporale delle registrazioni ottiche viene raggiunto da un rapido accesso casuale tecnica di scansione utilizzando acusto-ottici deflettori (AOD) 1. A due fotoni di eccitazione dei risultati di calcio-colorante sensibile in alta risoluzione spaziale in tis cerebrali opachicitare in giudizio 2. Ricostruzione delle punte delle registrazioni di calcio fluorescenza viene raggiunto da un metodo di massima verosimiglianza. Simultanee registrazioni elettrofisiologiche e ottiche indicano che il nostro metodo rileva con sicurezza picchi (> 97% efficienza di rivelazione spike), ha un basso tasso di falsi positivi spike (<0,003 spikes / s), e una elevata precisione temporale (circa 3 ms) 3. Questo metodo ottico di rilevazione spike può essere utilizzato per registrare l'attività neurale in vitro e in vivo in animali anestetizzati 3,4.
Protocollo
1. Configurazione ottica (Figura 1)
- Per eccitazione a due fotoni un sistema a infrarossi laser pulsato con impulsi a femtosecondi viene utilizzato. Un laser ad alta potenza di uscita (in alcuni casi> 2W a 890 nm) è necessario per compensare le perdite introdotte dai grandi componenti ottici del sistema.
- Un sistema prechirper costituito da due prismi conferisce un negativo dispersione di velocità di gruppo (GVD) sulle impulsi laser prima delle acusto-ottici deflettori (AOD) per compensare la dispersione temporale introdotta dalla AOD 1.
- Due AOD con grandi aperture (10 mm per un obiettivo 40x immersione in acqua con NA 0,8) deviare il fascio laser in due dimensioni.
- Un reticolo di diffrazione riflettente con 100 alberi / mm è situata 13 cm dietro le AOD da compensare la dispersione spaziale introdotto AOD usando brevi impulsi laser.
- Il raggio laser è diretto con due telescopi relè alla porta fotocamera di un montante microscope.
- Iridi sono posti a intervalli regolari per l'allineamento delle ottiche.
- Un separatore di fascio dicroico davanti all'obiettivo trasmette la luce infrarossa di eccitazione al campione e riflette la luce di fluorescenza dal campione su un rivelatore.
- Rilevatori di Epi-e transfluorescence (fotomoltiplicatori, PMT) raccogliere segnale di fluorescenza attraverso l'obiettivo e - se del caso - attraverso il condensatore.
- Filtri di vetro colorato (BG-39, 3-5 mm) sono posti davanti ai rivelatori per impedire alla luce di eccitazione raggiunge i rivelatori.
- Gli angoli di deviazione AOD sono controllati da un computer dotato di un convertitore digitale-analogico-convertitore bordo (156,25 frequenza di clock kHz), che a sua volta aziona oscillatori controllati in tensione.
- Il segnale dai fotomoltiplicatori viene trasmesso attraverso un passa basso Butterworth filtro (cut-off frequenza di 100 kHz) e digitalizzato da un convertitore analogico-digitale-convertitore (156,25 frequenza di clock kHz) prima di essere memorizzati inun computer per l'analisi.
- Allineamento e disturbi elettrici sono testati registrando la distribuzione dei segnali di fluorescenza con e senza luce laser, a guadagno alto e basso dei fotomoltiplicatori, nonché con e senza indicatore. Lo scanner è impostata correttamente e schermato quando la larghezza della distribuzione dei segnali di fluorescenza ad alto guadagno e con indicatore è molto più grande della larghezza delle altre distribuzioni di segnali di fluorescenza (Fig. 2).
2. Procedure sperimentali
- Retinato casuale scansione in accesso si basa sul riscontro di un aumento del calcio intracellulare. Un gran numero di neuroni possono essere colorate usando bolo della forma estere di un indicatore di calcio (per esempio Oregon verde 488 Bapta-1 AM) nel tessuto neurale 5.
- Parecchie posizioni di ogni soma neurone vengono registrati, ciascuno per un breve periodo di tempo ("dithering", 4 punti, 6.4 ms per ogni posizione = 25,6 ms per il tempo di registrazione each neurone in ogni ciclo, Fig. 3C). Per selezionare i neuroni di interesse un telaio completo composto da 256x256 pixel sia acquisito (Fig. 3A). Il centro di ogni neurone soma da registrare viene selezionata manualmente all'interno di questa immagine. Il software di controllo aggiunge automaticamente tre punti a distanza di 2 micron intorno a questo centro.
- In ciascun ciclo, viene registrato il segnale di fluorescenza da ciascuno dei 40 neuroni (Fig. 3B). Questo processo viene ripetuto per l'intera durata di una registrazione (5 registrazione secondo = 3255 cicli, 1 ciclo = 1,536 ms).
3. Strumenti software online per massimizzare l'efficienza di rilevamento picco
- Rilevamento di picco di fluorescenza segnali di calcio somatiche si basa su un alto rapporto segnale-rumore (S / N) dei segnali di calcio fluorescenza somatici. Un alto S / N può essere ottenuto aumentando intensità di eccitazione. Intensità di eccitazione, tuttavia, non può essere aumentata fino ad un certo limite a causa di radiazioni solari. Rilevamento Spike è alto all'interno di un windo molto piccolow di intensità di eccitazione solo se segnali di fluorescenza hanno un alto S / N, ma solo fotodanneggiamento molto poco si osserva 3. Al fine di garantire che i segnali registrati sono all'interno della finestra di rilevamento ad alta spike durante registrazioni monitoriamo tasso fotoni (vedi equazione 3.2) e declino basale fluorescenza usando analisi online.
- Tasso di fotoni approssimativo per neurone è calcolata da un intervallo di tempo breve (100-200 ms) di rumore di base. Numero di fotoni (N λ) e fotone rate (λ = λ N / At) viene calcolato in base ai valori di fluorescenza inserendo la distribuzione (σ) delle relative variazioni di fluorescenza con la seguente equazione:
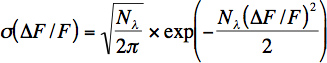
Questa equazione rappresenta la distribuzione di Poisson per il rumore photon shot con un cambio di variabile relativa variazione di fluorescenza: Af / F = (G * N λ (t)-G * N & lambda,, 0) / G * N λ, 0 dove G indica il guadagno cumulativo di fotomoltiplicatore e di tutti gli altri componenti elettronici. Si noti che questa equazione non determina correttamente il numero di fotoni rivelati per registrazioni in vivo perché ci sono altre fonti di rumore (artefatti da movimento), oltre al rumore di sparo fotoni. Tuttavia questa equazione è utile per registrazioni in vivo per stimare il rumore.
- Fluorescenza basale è calcolata dalla finestra contemporaneamente e riportati in funzione del tempo o prove. Il calo medio della linea di base viene mantenuto al di sotto di 0,0002 / s per la regolazione della potenza del laser per il rilevamento picco declina rapidamente in caso di superamento di questo limite.
- Ogni 10-20 minuti le posizioni somata neuroni vengono verificati dai nuovamente l'acquisizione di una immagine full frame. Se necessario, le posizioni di registrazione sono regolati. Località può essere regolata per tutti i neuroni in una volta, o per singoli neuroni.
4. Reconstruction di temporizzazioni spike di segnali di fluorescenza (deconvoluzione)
- I segnali di fluorescenza derivanti da attività neurale spesso sommare nel tempo a causa del decadimento dei transienti di calcio è lungo (diverse centinaia di millisecondi). Un metodo di deconvoluzione ricostruisce tempi e spike spike da segnali di fluorescenza.
- Per determinare il treno più probabile spike sottostante il segnale registrato di fluorescenza, modelli differenti vengono confrontate. Qui abbiamo usato un algoritmo genetico per determinare il modello - e quindi il treno picco e tempi spike - con la massima verosimiglianza.
- Nelle popolazioni di neuroni non omogenei, il picco-evocato segnale di calcio può variare tra i neuroni. Per l'analisi dei dati incontrollato imposta abbiamo progettato un algoritmo che tiene conto della variazione del segnale calcio-spike evocata da neurone a neurone.
- Per evitare un gran numero di rilevazioni di falsi positivi è utile costringere l'ampiezza consentita e tempo costante di decadimento del modello di spike-evocato segnale calcio. La distribuzione congiunta di tempo e ampiezza costante di decadimento del singolo spike transienti di calcio evocati sono registrati in una serie separata di esperimenti dello stesso tipo di neuroni nelle stesse condizioni sperimentali utilizzando simultanee registrazioni elettrofisiologiche e ottici.
- Per tenere conto dei cambiamenti di base lenti e per ridurre i costi computazionali di deconvolving, registrazioni più lunghe sono suddivisi in diverse tracce più brevi di 1-5 secondi.
- Per ogni neurone e ogni registrazione, l'algoritmo di deconvoluzione può verificare un gran numero di modelli (fino a 1.000.000 diversi modelli o più). Per accelerare deconvoluzione, un esperimento è deconvolved su un massimo di 10 computer diversi in parallelo.
- Dopo deconvoluzione, i dati vengono analizzati e punta ispezionato. A peri-stimolo istogramma tempo, probabilità picco e frequenza di scarica (picco medio per i neuroni) sono calcolati in modo automatico.
5.Risultati rappresentativi
Successo cerniere rilevazione spike su un alto rapporto segnale-rumore rapporto tra i segnali registrati fluorescenza calcio somatiche. Semplicemente utilizzando i tassi di eccitazione ad alta potenza del laser (elevata) può causare un impatto negativo della photoeffects su materiale biologico (radiazioni solari). In retinato ad accesso casuale fotodanneggiamento scansione si manifesta come diminuzione fluorescenza basale e diminuisce dei segnali di calcio spike-evocati fluorescenza. La diminuzione del segnale spike-evocata può rapidamente determinare un errore per rilevare i picchi. C'è solo una finestra molto piccola di intensità di eccitazione in cui la rilevazione picco di segnali di fluorescenza è alto. Sull'estremità superiore questa finestra è limitata da fotodanneggiamento, sull'estremità inferiore dei segnali di fluorescenza hanno un basso rapporto segnale-rumore. Per i neuroni corticali in fettine acute usiamo potenza del laser con conseguente tasso di fotoni di circa 400,000-1,500,000 fotoni / s quando si registra a circa 100 micron sotto la superficie fetta. Quando si utilizza un elevato-Indicatore di affinità - qui Oregon verde 488 BAPTA - 1 - il segnale è sufficiente per rilevare picchi individuali. Fig. 3E mostra un esempio di un segnale di fluorescenza rilevati al tasso di eccitazione molto bassa, un esempio di registrazione all'interno della finestra di rivelazione, e uno al tasso di eccitazione molto alto.
Rispetto ad altre tecniche per registrare l'attività neurale con risoluzione di singola cellula e single-spike, dithering casuale la scansione in accesso è possibile registrare da un maggior numero di neuroni della stessa popolazione locale, ed è meno invasiva, ad esempio rispetto a tetrodo / multielettrodo registrazioni . Così dithered accesso casuale scansione può essere utilizzato per registrare l'attività neurale da molti neuroni per misurare le informazioni reciproca segnalato da attività suprathreshold 6 (Fig. 4A), cambiamenti di attività neurale in una popolazione di neuroni (plasticità corticale), e la propagazione dell'attività suprathreshold attraverso popolazioni di neuroni 14 (Fig. 4B)
alt = "Figura 1" src = "/ files/ftp_upload/4052/4052fig1.jpg" />
Figura 1. Disegno ottico del dithering casuale configurazione scansione in accesso.
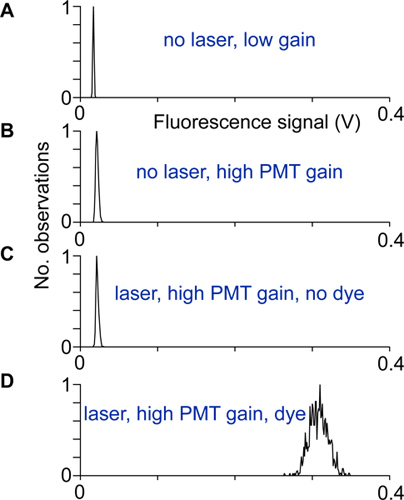
Figura 2 Allineamento e test:. Distribuzioni di segnali di fluorescenza registrati in condizioni diverse. A) Nessuna luce laser e guadagno fotomoltiplicatore basso, B) al guadagno PMT più alta, ma non la luce laser, la distribuzione è più ampia a causa della corrente fotomoltiplicatore al buio. C) Con il laser e registrato a guadagno PMT alta. Una differenza tra le distribuzioni in B e mostrati in questa distribuzione indicherebbe che la luce di eccitazione raggiunge i rivelatori PMT. D) La distribuzione dei segnali di fluorescenza registrate ad alto guadagno da neurone somata. Se non altro contribuisce sorgente di rumore, questa distribuzione nasce dalla fotone colpo-solo rumore.
. Jpg "/>
Figura 3 A) immagine full frame fluorescenza per individuare e selezionare le posizioni somata neurone, B) il percorso di scansione di un ciclo, C) Illustrazione del principio di dithering,. (In ogni cerchio) località soma diversi sono registrati prima di spostare il fascio al successivo soma, D) Illustrazione dell'uscita dei due D / A canali. Per ogni soma neurone, segnale di fluorescenza viene registrato da 4 punti diversi in ogni soma (S1-S4). La posizione di ciascun punto è dato dalla sua posizione xey. Le posizioni X e Y per tutte le macchie e tutti i neuroni sono inviati al digitale-analogico convertitore in modo sequenziale. Mentre il fascio viene spostato tra due somata neurone, nessun segnale viene acquisito (vuoto). E) Esempi di segnali di fluorescenza. Si noti che ogni esempio mostra risposta ad uno spike (come misurato con elettrofisiologico cell-registrazione allegata).
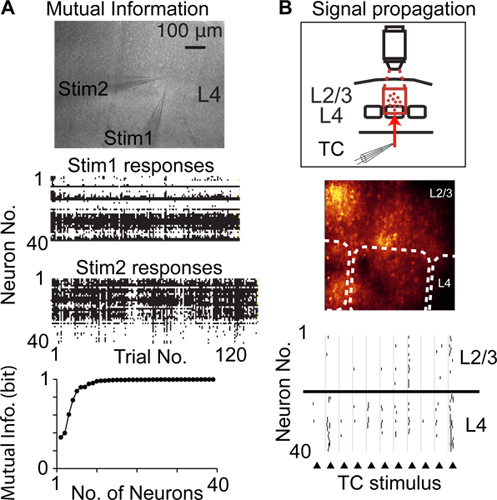
Figura 4. Studiare cortifunzione cal con dithering casuale scansione in accesso. A) Misura informazione reciproca segnalato da popolazioni di neuroni. Immagine superiore mostra microfotografia di una fetta cerebrale acuto e due pipette stimolazione inseriti nella stessa colonna corticale a livello 4 (L4). Centro grafici mostrano risposte neurali per ogni ripetizione di uno stimolo. Bassa grafico mostra informazione reciproca di Shannon segnalato dalla popolazione registrata di neuroni. B) la propagazione di misura di attività suprathreshold chiodare (propagazione del segnale) tra le popolazioni di neuroni corticali. Grafico superiore illustra disegno sperimentale, immagine centrale mostra immagine di fluorescenza, le linee tratteggiate indicano confini barile, inferiore grafico mostra picchi rilevati in risposta alla stimolazione elettrica delle fibre talamo (triangoli).
Discussione
Retinato ad accesso casuale la scansione rileva indirettamente attività suprathreshold spiking dagli aumenti del calcio intracellulare somatico associato ad ogni picco di un somata neurone. Gli aumenti di calcio intracellulare sono rilevati da coloranti fluorescenti di calcio. Le limitazioni di dithering accesso casuale scansione derivano principalmente dalla limitata del segnale-rumore dei segnali di fluorescenza del calcio. Il rapporto segnale-rumore è a sua volta limitato da fotodanneggiamento, che non consente di ...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Ringraziamo il Dott. Randy Chitwood per la lettura critica del manoscritto. Questo lavoro è stato sostenuto dalla Fondazione Whitehall e la Alfred P. Sloan sovvenzioni della Fondazione per HJK.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
| Componenti ottici sono elencati in ordine, partendo dal laser | |||
| Titan: Sapphire Laser | Coherent Inc. | Chameleon Ultra 2 | Alta potenza di uscita consigliata (> 2W a 900 nm) |
| Lente acromatica f = 30 mm | Thor laboratori | AC254-030-B | Antiriflesso (AR) di rivestimento per 650-1050 nm |
| Lente acromatica f = 100 mm | Thor laboratori | AC254-100-B | AR 650-1050 nm |
| lenti f = 75 mm | Thor laboratori | LA1608-B | AR 650-1050 nm |
| lenti f = 175 mm | Thor laboratori | LA1229-B | AR 650-1050 nm |
| Lente acromatica f = 300 mm | Thor laboratori | AC254-300-B | AR 650-1050 nm |
| Lente acromatica f = 100 mm | Thor laboratori | AC254-100-B | AR 650-1050 nm |
| Lente acromatica f = 100 mm | Thor laboratori | AC254-100-B | AR 650-1050 nm |
| Acusto-ottico deflettori | Intraaction Corp | ATD 6510CD2 | |
| Diffrazione riflettente | Newport | 53-011R | 100 scanalature / mm per AOD con 65 MHz di larghezza di banda e l'angolo di scansione di 45 mrad |
| 21,6 millimetri Brewster prismi | Lambda Research Optics Inc. | IBP21.6SF10 | |
| Vetro colorato | Schott | BG-39 | |
| Specchio dicroico | Chroma Technology Corp | Z532RDC | |
| Fotomoltiplicatori moduli | Hamamatsu | H9305-03 | |
| DAC-ADC bordo | National Instruments | PCI-6115 | |
| Oregon verde 488-Bapta 01:00 | Invitrogen | O-6807 |
Riferimenti
- Iyer, V., Hoogland, T. M., Saggau, P. Fast functional imaging of single neurons using random-access multiphoton (RAMP) microscopy. J. Neurophysiol. 95, 535-545 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73 (1990).
- Ranganathan, G. N., Koester, H. J. Optical recording of neuronal spiking activity from unbiased populations of neurons with high spike detection efficiency and high temporal precision. J. Neurophysiol. 104, 1812-1824 (2010).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nat. Methods. 7, 399-405 (2010).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc. Natl. Acad. Sci. U.S.A. 100, 7319-7324 (2003).
- Pita-Almenar, J. D., Ranganathan, G. N., Koester, H. J. Impact of cortical plasticity on information signaled by populations of neurons in the cerebral cortex. J. Neurophysiol. 106, 1118-1124 (2011).
- Kerr, J. N., Greenberg, D., Helmchen, F. Imaging input and output of neocortical networks in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 14063-14068 (2005).
- Lin, B. J., Chen, T. W., Schild, D. Cell type-specific relationships between spiking and [Ca2+]i in neurons of the Xenopus tadpole olfactory bulb. J. Physiol. 582, 163-175 (2007).
- Zeng, S., Lv, X., Zhan, C., Chen, W. R. Simultaneous compensation for spatial and temporal dispersion of acousto-optical deflectors for two-dimensional scanning with a single prism. Opt. Lett. 31, 1091-1093 (2006).
- Otsu, Y., Bormuth, V., Wong, J., Mathieu, B. Optical monitoring of neuronal activity at high frame rate with a digital random-access multiphoton (RAMP) microscope. J. Neurosci. Methods. 173, 259-270 (2008).
- Vogelstein, J. T., Watson, B. O., Packer, A. M., Yuste, R. Spike inference from calcium imaging using sequential Monte Carlo methods. Biophys. J. 97, 636-655 (2009).
- Yaksi, E., Friedrich, R. W. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nat. Methods. 3, 377-383 (2006).
- Hendel, T., Mank, M., Schnell, B., Griesbeck, O. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro. J. Neurosci. 28, 7399-7411 (2008).
- Ranganathan, G. N., Koester, H. J. Correlations decrease with propagation of spiking activity in the mouse barrel cortex. Front Neural Circuits. 5, 8 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon