このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
単一セルと単スパイク分解能で閾値上神経活動の光記録
要約
皮質機能は、多数のニューロン集団のレベルで発生するので、脊椎動物の中枢神経系の機能を理解することは、多くのニューロンからの記録が必要になります。ここでは、単一セルと単スパイク解像度、ディザリングされたランダムアクセスのスキャンと閾値上の神経活動を記録する光学的方法を説明します。この方法は、高時間分解能で、最大100からニューロンに蛍光体のカルシウムシグナルを記録します。最尤アルゴリズムは、体蛍光カルシウムシグナルから基礎閾値上神経活動をdeconvolves。この方法は、確実に高い検出効率と誤検知率の低さとスパイクを検出し、神経集団を研究するために使用することができます in vitroでと。
要約
脊椎動物の中枢神経系における情報のシグナリングは、多くの場合、神経細胞ではなく、個々のニューロンの集団によって運ばれる。また、閾値上スパイク活動の伝播は、ニューロンの集団が含まれます。皮質機能に対処する実証研究では、直接こうして高解像度の神経細胞の集団からの録音を必要とします。ここでは、光学的手法および単一セルと単スパイクの分解能で、最大100からニューロンへの神経活動を記録するためのデコンボリューションアルゴリズムを記述する。この方法では、皮質ニューロンにおける閾値上電気スパイク(活動電位)に関連付けられている細胞内の体細胞内カルシウム濃度の一過性増加の検出に依存しています。光学録音の高時間分解能は音響光学偏向(AODs 1)を用いて高速なランダムアクセスのスキャン技術によって達成される。不透明な脳TISにおける高空間分解能でのカルシウム感受性色素結果の二光子励起2を訴える。蛍光カルシウム録音からスパイクの再建は最尤法によって達成される。同時電気生理学的および光学録音は我々の方法が確実に、(> 97%スパイク検出効率)のスパイクを検出する偽陽性スパイク検出(<0.003スパイク/ s)、および高い時間精度(約3ミリ)3率の低さがありますことを示しているスパイク検出のこの光学的な方法は 、in vitro および in vivo における 3,4麻酔動物の神経活動を記録するために使用することができます。
プロトコル
1。光学装置(図1)
- 二光子励起フェムト秒パルスを用いて赤外パルスレーザーシステムが使用されます。高いレーザ出力パワー(890 nmの波長でいくつかのケースでは> 2W)は、システムの光学部品によって導入された大規模な損失を相殺するために必要です。
- つのプリズムから成るprechirperシステムはAODs 1で導入された時間的分散を補償するために、事前の音響光学偏向(AODs)へのレーザーパルスに負の群速度分散(GVD)を付与する。
- 大きな開口部を持つ2つのAODs(NA 0.8で40倍の水浸対物レンズは10mm)が2次元でレーザビームを偏向させる。
- 100木立/ mmの反射型回折格子は、短いレーザーパルスを用いAODsによって導入された空間的な分散を補償するAODs 13センチメートルの背後に配置されている。
- レーザービームは直立microscoのカメラポートに2リレー望遠鏡で指示されるPE。
- アイリスは、光学部品の位置合わせのために一定の間隔で配置されます。
- 対物レンズの前でイックビームスプリッタは、試料に赤外励起光を透過し、検出器上に標本からの蛍光光を反射する。
- 該当する場合 - - コンデンサーを通してエピとtransfluorescence検出器(光電子増倍管、光電子増倍管)が対物レンズを通して、蛍光シグナルを収集します。
- 色ガラスフィルター(BG-39、3-5 mm)を検出器に到達する励起光を防ぐために、検出器の前面に配置されます。
- AODの偏向角は順番に電圧制御発振器を駆動するデジタルアナログコンバータボード(156.25 kHzのクロックレート)を装備したコンピュータによって制御されます。
- 光電子増倍管からの信号は、次の場所に格納される前にローパスバタワースフィルタ(100 kHzのカットオフ周波数)を介して中継され、アナログ - デジタル·コンバータ(156.25 kHzのクロックレート)によってデジタル化さ解析のためのコンピュータ。
- アライメントや電気的ノイズは、レーザー光の有無にかかわらず、光電子増倍管の低域と高ゲインで、同様に、インジケータなしで蛍光シグナルの分布を記録することによってテストされています。スキャナが正しくセットアップされ、高利得で、インジケーターの蛍光シグナルの分布の幅は蛍光信号(図2)の他のディストリビューションの幅よりもはるかに大きい場合にはシールドされています。
2。実験手順
- ディザリングされたランダムアクセススキャンは、カルシウムの細胞内増加の検出に依存しています。ニューロンは多数の神経組織5にカルシウム指示薬のエステル体のボーラス注射(例えば、AMオレゴングリーン488 BAPTA-1)を用いて染色することができる。
- 各ニューロン細胞体からのいくつかの場所は、( "ディザリング"、4箇所、それぞれの場所で6.4μsのeの= 25.6μsの記録時間は、短時間ずつ記録します各サイクルにおけるACHニューロンは、図。 3C)。興味のあるニューロンを選択するには256x256ピクセルで構成されるフルフレーム(図3A)が取得される。記録しようとする各ニューロンソーマの中心はこの画像内で手動で選択されています。制御ソフトウェアは、自動的にこのセンターの周りには2μm間隔で3つの点を追加します。
- 各サイクルにおいて、蛍光シグナルは40ニューロン(図3B)の各々から記録されている。このプロセスは、1つの記録の全期間(5秒の録音が= 3255サイクル、1サイクル= 1.536ミリ秒)ごとに繰り返されます。
3。スパイク検出効率を最大化するためにオンラインソフトウェアツール
- 蛍光体細胞のカルシウムシグナルからスパイク検出は、体蛍光カルシウムシグナルの高い信号対雑音(S / N)比に依存しています。 S / Nが高く、励起強度を増加させることによって達成することができます。励起強度は、しかし、唯一の光損傷のため、一定の限度まで増やすことができます。スパイクの検出は非常に小さいWINDO内に高いです蛍光信号はS / Nが高いを持っていますが、ごくわずかしか光損傷が3を観測した場合にのみ、励起強度のワット記録された信号は、録音時に高スパイク検出のウィンドウ内にあることを確実にするために、我々は光子率(式3.2参照)、オンライン分析を使用してベースラインの蛍光の減少を監視します。
- ニューロンあたりのおおよその光子率がベースラインノイズの短い時間窓(100から200ミリ秒)から計算されます。光子の数(Nλ)と光子率(λ= Nλ/Δtが)は、次式とした相対蛍光変化の分布(σ)をフィッティングすることにより蛍光値から計算されます:
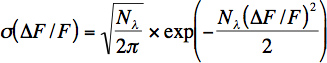
この方程式は、相対的な蛍光変化への変数の変化に伴うフォトンショットノイズのポアソン分布を表しています。ΔF/ F =(G * Nλ(t)は、-G * N&ラムBDA、Gは光電子増倍管と他のすべての電子部品の累積利得を表し、0)/ G * Nλ、0。フォトンショットノイズに加えて、ノイズ発生源が(動きのアーチファクト)があるので、この式は正しくvivoでの録音のために検出された光子の数を決定しないことに注意してください。それにもかかわらず、この方程式は、ノイズを推定するために生体内で録音するのに便利です。
- ベースライン蛍光は同じ時間枠から計算され、時間や試験の関数としてプロットしている。ベースラインの平均減少はこの制限を超えたときにスパイクの検出が急激に低下するので、レーザーパワーを調整することによって、0.0002 /秒以下に保たれます。
- ニューロン細胞体の位置毎に10〜20分間は再度フルフレーム画像を取得することで検証されます。必要に応じて、記録位置が調整されます。場所は、一度にすべてのニューロンのための、または個々のニューロンのために調整することができます。
4。 Reconstructio蛍光シグナルからスパイクタイミングのn(デコンボリューション)
- カルシウムトランジェントの減衰が長いので頻繁に合計する時の神経活動から得られた蛍光シグナル(数百ミリ秒)。デコンボリューション法では、蛍光シグナルからスパイクとスパイクタイミングを再構築します。
- 記録された蛍光信号の基礎となる可能性が最も高いスパイク列を判別するには、異なるモデルが比較されます。最尤法で - したがって、スパイク列とスパイクタイミング - ここでは、モデルを決定するために遺伝的アルゴリズムを使用していました。
- ニューロンの不均一な集団では、スパイク誘発カルシウムシグナルはニューロン間で異なることができます。データの教師なし分析設定のために私達は考慮ニューロンからニューロンへのスパイク誘発カルシウムシグナルの変動を取るアルゴリズムを設計しました。
- 誤検出が多数を避けるためには、mの許容振幅と減衰時間が一定で収縮するのに便利ですスパイク誘発カルシウムシグナルのodel。シングルスパイク誘発カルシウムトランジェントの一定の振幅と減衰時間の同時分布は、同時電気生理学的および光学録音を使用して同じ実験条件下でのニューロンと同じ種類の実験からの別個のセットに記録されます。
- 遅いベースラインの変化を考慮し、デコンボリューションの計算コストを削減するため、長い録音は1-5秒から数短いトレースに分かれています。
- 各ニューロンと各記録については、デコンボリューションアルゴリズムは、モデルの数が多い(最大1,000,000の異なるモデル以上)をテストすることができる。デコンボリューションをスピードアップするために、一つの実験を並行して10の異なるコンピュータに上にデコンボリューションされています。
- デコンボリューション後、スパイクのデータが分析され、検査されます。周囲の刺激時間のヒストグラム、スパイク確率、発射速度は(ニューロンあたりの平均スパイク)自動化された方法で計算されます。
5。代表的な結果
記録された蛍光体細胞のカルシウムシグナルの高い信号対雑音比で成功スパイク検出のヒンジ。単に高励起率(高いレーザパワー)を使用すると、生物学的物質(光損傷)にphotoeffectsの悪影響をもたらすことができます。ディザリングされたランダムアクセスでは光損傷をスキャンすると、ベースラインの蛍光とスパイク誘発カルシウム蛍光シグナルの減少の減少として現れる。スパイク誘発シグナルの減少はすぐにスパイクを検出するために失敗することがあります。蛍光シグナルからスパイク検出が高い励起強度の非常に小さな窓しかありません。ハイエンドでは、このウィンドウが下端に蛍光シグナルが低い信号対雑音比を有し、光損傷によって制限されます。スライス面下約100μmで録音するときに急性スライスにおける皮質ニューロンのために私達は約400,000-1,500,000フォトン/ sの光子率をもたらすレーザーパワーを使用します。高を使用している場合親和性の指標 - ここオレゴングリーン488 BAPTA - 1 - この信号は個々のスパイクを検出するために十分である。図。 3Eは非常に低い励起率、検出ウィンドウ内の記録の一例であり、非常に高い励起レートで1で記録した蛍光シグナルの例を示しています。
単一セルと単スパイク分解能で神経活動を記録するために他の技術に比べて、ランダム·アクセス·スキャンが同じ、地元住民からのニューロンの多くから録音することができ、ディザリングとテトロード/多電極録音に比べて例えば低侵襲で。したがってディザリングされたランダム·アクセス·スキャンが閾値上活動6(図4A)、神経細胞(皮質可塑性)の人口における神経活動の変化によって合図相互情報量を測定するために多くのニューロンからの神経活動を記録し、閾値上の活動の伝播に使用することができニューロンは14の個体(図4B)を介して
ALT = "図1" SRC = "/ files/ftp_upload/4052/4052fig1.jpg" />
図1ディザリングされたランダム·アクセススキャンセットアップの光学設計。
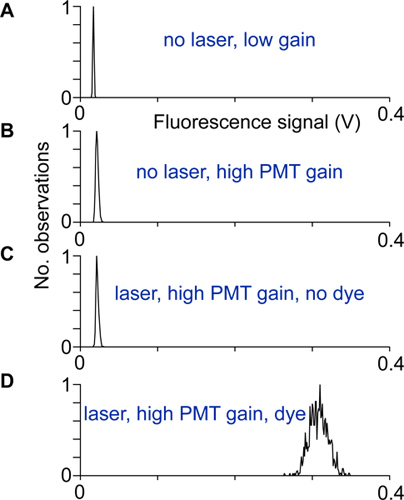
図2アライメントとテスト:異なる条件下で記録された蛍光シグナルの分布。 A)は、より高い光電子増倍管のゲインが、ないレーザ光が全くレーザー光電子増倍管と低ゲイン、B)は、分布があるため、暗電流を光電子増倍管の幅が広い。 C)にレーザーで光電子増倍管と高ゲインで記録。 Bとは、このディストリビューションに示すにおけるディストリビューションの違いは、励起光がPMT検出器に到達したことを示すことになる。 D)の蛍光シグナルの分布は、ニューロン細胞体から高利得で記録。他のノイズ源が寄与していない場合、この分布はショット雑音光子から生じる。
jpgの "/>
図は、3つのディザリング原理の1サイクルのニューロン細胞体の位置を検出して選択する)フルフレーム蛍光画像A、B)スキャン·パス、C)がイラスト;各ソーマ(円)いくつかの場所では、次回にビームを移動する前に記録されている2つのD / Aチャネルの出力のソーマ、D)のイラスト。各ニューロンソーマは、蛍光信号は、各ソーマで4つの異なるスポット(S1〜S4)から記録されている。各スポットの位置は、そのx座標とy座標で与えられる。すべてのスポットやすべてのニューロンのxとyの位置が連続的にデジタル·アナログ変換器に送信されます。ビームは2ニューロンの細胞体との間を移動している間、信号は(空白)を取得されていません。 E)の蛍光シグナルの例は。それぞれの例は(電気生理学的細胞接着型の記録で測定)1スパイクへの応答を示していることに注意してください。
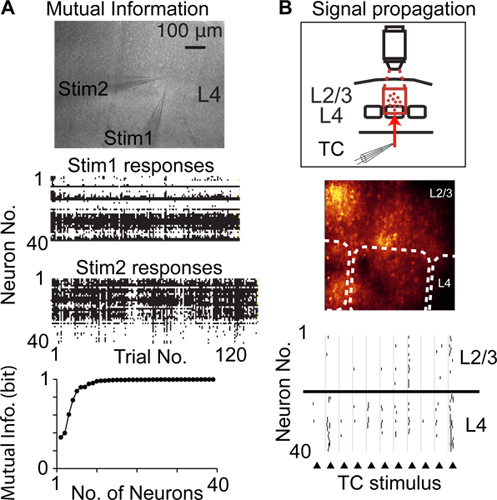
図4コルティを学ぶcalはディザリングされたランダム·アクセス·スキャンを使用して機能する。 A)は、多数のニューロン集団によって合図相互情報量を測定します。上の画像は、急性脳スライスとレイヤ4(L4)の同じ皮質カラムに配置された2つの刺激ピペットの顕微鏡写真を示す。中央のグラフは、刺激の各繰返しの神経反応を示しています。下のグラフは、ニューロンの記録された人口によって合図シャノンの相互情報量を示しています。皮質ニューロンの集団間の閾値上スパイク活動のB)測定伝播(信号伝播)。上のグラフは、実験設計を示し、中央の画像は、蛍光画像を示し、破線はバレルの境界を示し、下のグラフは、視床皮質線維(三角形)の電気刺激に応答して、検出されたスパイクを示しています。
ディスカッション
ディザリングされたランダム·アクセス·スキャンが間接的に神経細胞体の各スパイクに関連付けられている細胞内の体細胞内カルシウムの増加から閾値上スパイク活動を検出します。細胞内カルシウムの増加は、蛍光カルシウム色素で検出されます。ディザリングされたランダムアクセススキャンの制限は、カルシウム蛍光信号の限られた信号対雑音比のから大きく生じる。信号対雑音比は...
開示事項
特別な利害関係は宣言されません。
謝辞
私たちは、批判的に原稿を読み取るための博士ランディChitwoodに感謝します。この作品は、ホワイトホール財団とHJKにアルフレッド·P·スローン財団の補助金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | コメント(オプション) |
| 光学部品はレーザーから順にリストされています | |||
| タイタン:サファイアレーザー | コヒレント社 | カメレオンウルトラ2 | ハイパワー出力を推奨(900 nmでの> 2W) |
| 色消しレンズf = 30mmの | トールラボ | AC254-030-B | 650-1050 nmの反射防止(AR)コーティング |
| 色消しレンズf = 100mmの | トールラボ | AC254-100-B | アーカンソー650-1050 nmの |
| レンズf = 75ミリメートル | トールラボ | LA1608-B | アーカンソー650-1050 nmの |
| レンズf = 175ミリメートル | トールラボ | LA1229-B | アーカンソー650-1050 nmの |
| 色消しレンズf = 300ミリメートル | トールラボ | AC254-300-B | アーカンソー650-1050 nmの |
| 色消しレンズf = 100mmの | トールラボ | AC254-100-B | アーカンソー650-1050 nmの |
| 色消しレンズf = 100mmの | トールラボ | AC254-100-B | アーカンソー650-1050 nmの |
| 音響光学偏向 | Intraactionコープ | ATD 6510CD2 | |
| 反射型回折格子 | ニューポート | 53-011R | 65 MHzの帯域幅を持つAODsに100本/ mm、45 mradの角度をスキャン |
| 21.6ミリメートルブリュースタープリズム | ラムダリサーチ光学株式会社 | IBP21.6SF10 | |
| 色ガラス | ショット | BG-39 | |
| ダイクロイックミラー | クロマ·テクノロジー株式会社 | Z532RDC | |
| 光電子増倍管モジュール | 浜松市 | H9305-03 | |
| DAC-ADCボード | ナショナルインスツルメンツ | PCI-6115 | |
| オレゴングリーン488 BAPTA-1 AM | インビトロジェン | O-6807 |
参考文献
- Iyer, V., Hoogland, T. M., Saggau, P. Fast functional imaging of single neurons using random-access multiphoton (RAMP) microscopy. J. Neurophysiol. 95, 535-545 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73 (1990).
- Ranganathan, G. N., Koester, H. J. Optical recording of neuronal spiking activity from unbiased populations of neurons with high spike detection efficiency and high temporal precision. J. Neurophysiol. 104, 1812-1824 (2010).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nat. Methods. 7, 399-405 (2010).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc. Natl. Acad. Sci. U.S.A. 100, 7319-7324 (2003).
- Pita-Almenar, J. D., Ranganathan, G. N., Koester, H. J. Impact of cortical plasticity on information signaled by populations of neurons in the cerebral cortex. J. Neurophysiol. 106, 1118-1124 (2011).
- Kerr, J. N., Greenberg, D., Helmchen, F. Imaging input and output of neocortical networks in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 14063-14068 (2005).
- Lin, B. J., Chen, T. W., Schild, D. Cell type-specific relationships between spiking and [Ca2+]i in neurons of the Xenopus tadpole olfactory bulb. J. Physiol. 582, 163-175 (2007).
- Zeng, S., Lv, X., Zhan, C., Chen, W. R. Simultaneous compensation for spatial and temporal dispersion of acousto-optical deflectors for two-dimensional scanning with a single prism. Opt. Lett. 31, 1091-1093 (2006).
- Otsu, Y., Bormuth, V., Wong, J., Mathieu, B. Optical monitoring of neuronal activity at high frame rate with a digital random-access multiphoton (RAMP) microscope. J. Neurosci. Methods. 173, 259-270 (2008).
- Vogelstein, J. T., Watson, B. O., Packer, A. M., Yuste, R. Spike inference from calcium imaging using sequential Monte Carlo methods. Biophys. J. 97, 636-655 (2009).
- Yaksi, E., Friedrich, R. W. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nat. Methods. 3, 377-383 (2006).
- Hendel, T., Mank, M., Schnell, B., Griesbeck, O. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro. J. Neurosci. 28, 7399-7411 (2008).
- Ranganathan, G. N., Koester, H. J. Correlations decrease with propagation of spiking activity in the mouse barrel cortex. Front Neural Circuits. 5, 8 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved