Method Article
Sustrato Generación para endonucleasas de CRISPR / Cas Sistemas
En este artículo
Resumen
CRISPR / Cas sistemas median la inmunidad adaptativa en bacterias y arqueas. Muchas proteínas CAS se propone actuar como endoribonucleases que actúan sobre los precursores crRNA de longitud variable. Aquí se ilustran tres enfoques diferentes para generar pre-crRNA sustratos para el análisis bioquímico de la actividad endonucleasa de Cas.
Resumen
La interacción de los virus y sus anfitriones procarióticos forma a la evolución de la vida bacteriana y Arqueales. Los procariotas desarrollado varias estrategias para evadir los ataques virales que incluyen modificación de la restricción, la infección abortiva y sistemas CRISPR / Cas. Estos sistemas adaptativos inmunes encontradas en muchas bacterias y Archaea consisten de más Abrillantado c r i egularly nterspaced s hort t alindromic r EPEAT (CRISPR) secuencias y un número de C RISPR como asociado (CAS) genes (Fig. 1) 1-3. Los distintos conjuntos de proteínas Cas y repite definir al menos tres grandes tipos divergentes de CRISPR / Cas sistemas 4. Las proteínas universales cas1 y cas2 se proponen para participar en la absorción del ADN viral quegenerará un nuevo elemento separador entre dos repeticiones en el extremo 5 'terminal de un clúster de CRISPR se extiende 5. El clúster completo se transcribe en un precursor-crRNA que contiene todos espaciador y secuencias de repetición y es posteriormente procesada por una enzima de la familia diversa CAS6 en pequeños crRNAs 6-8. Estos crRNAs consisten en la secuencia espaciadora flanqueado por una 5 'terminal (8 nucleótidos) y un 3' terminal de etiqueta derivada de la secuencia de repetición 9. Una infección repetida del virus ahora se puede bloquear como el nuevo crRNA será dirigido por un complejo de proteínas Cas (Cascade) en el ADN viral y lo identifican como tales a través de complementariedad de base 10. Por último, para CRISPR / Cas sistemas de tipo 1, el CAS3 nucleasa va a destruir al invasor detectó DNA 11,12.
Estos procesos definen CRISPR / CAS como un sistema inmune adaptativo de los procariotas y abrió un campo de investigación fascinante para el estudio de las proteínas implicadas Cas.La función de muchas proteínas Cas sigue siendo difícil de alcanzar y las causas de la aparente diversidad de los sistemas CRISPR / Cas aún no se han iluminado. Las actividades potenciales de la mayoría de las proteínas de Cas se predijo a través de detallados análisis computacionales. Una fracción importante de las proteínas Cas son o bien se muestra o propuesto para funcionar como endonucleasas de 4.
A continuación, se presentan los métodos para generar crRNAs y precursor ARNc-para el estudio de endoribonucleases Cas. Diferentes ensayos endonucleasa requieren secuencias de repetición ya sea directamente cortas que pueden ser sintetizados como oligonucleótidos de ARN o secuencias ya crRNA y pre-crRNA que se generan in vitro a través de la ARN polimerasa T7 escorrentía transcripción. Esta metodología permite la incorporación de nucleótidos radiactivos para la generación de sustratos de endonucleasa internos etiquetados y la creación de crRNAs sintéticos o mutante. CAS6 actividad endonucleasa se utiliza para madurar pre-crRNAs en crRNAs con 5'-hydroxilo y un 2 ', 3'-termini cíclicos de fosfato.
Protocolo
1. Generación de tiempo pre-crRNA sustratos a través de PCR
- Diseño de PCR primers dirigidos a las regiones espaciadoras de un clúster CRISPR. Añadir la ARN polimerasa T7 (T7RNAP) promotor de la secuencia (5 '-taatacgactcactata-3') para el cebador directo y sitios de restricción para la clonación del producto de PCR en un vector para ambos cebadores (por ejemplo, BamHI y Hind III para pUC19, fig. 2A) .
Nota: El T7RNAP requiere un residuo de guanidina para la iniciación apropiada de la transcripción. - Amplíe su pre-crRNA secuencia de interés a partir de ADN genómico por PCR.
- Separar los productos de PCR por electroforesis en gel de agarosa y gel de extraer la banda deseada. Se digiere el producto de PCR con las enzimas de restricción para crear extremos pegajosos (por ejemplo, BamHI y HindIII, fig. 2A). Se purifica el producto de PCR con un kit de purificación de PCR para eliminar la escisión de los subproductos.
- Configurar una reacción de ligación que contiene ADN ligasa de T4, tampón de T4 ADN ligasa yuna relación molar 3:1 de la exfoliados producto de la PCR y el vector desfosforilado lineal pUC con los correspondientes extremos cohesivos. Incubar la mezcla a 16 ° C durante la noche. Transformar la mezcla de ligación en células competentes de Escherichia coli DH5a por protocolos estándar y analizan el blanco en azul para identificar la ligadura exitosa.
- Aislar los plásmidos de las colonias de blancos usando un kit de preparación de plásmido. Identificar los clones positivos por secuenciación del plásmido. Alternativamente, la PCR de colonias podría ser utilizada para el cribado.
2. Generación del intermedio pre-crRNA sustratos a través de la hibridación de oligonucleótidos de ADN
- Diseño de avance y retroceso oligonucleótidos con el CRISPR deseado repetir / espaciador secuencia. Los oligonucleótidos contienen la secuencia de un promotor T7 RNAP, así como sitios de restricción terminales (por ejemplo, BamHI y Hind III para pUC19). Terminar los oligonucleótidos para garantizar que forma extremos pegajosos después de recocido (véase la fig. 2B ).
- 5'-fosforilan 1 nmol de cada oligonucleótido en una reacción separada 20μl que contiene 5 l de T4 polinucleótido quinasa (PNK), 2 l de tampón T4 PNK 10x, 2 l ATP (10 mM). Incubar cada muestra durante 1 hora a 37 ° C.
- Hibridar los dos oligonucleótidos fosforilados. Combinar 1μl de la mezcla de oligo fosforilados hacia adelante (de 2,2.), 1 l de la mezcla de oligo inverso fosforilado (de 2,2.), 1 l de tampón de T4 ADN ligasa 10x en una reacción de 10 l. Se incuban las muestras durante 5 min a 95 ° C en un bloque de calentamiento o en agua hirviendo, apague la fuente de calor y dejar que la mezcla se enfríe a temperatura ambiente (~ 2-3 horas).
Nota: En este paso crítico, el proceso de enfriamiento lento favorece la hibridación de los dos oligonucleótidos en comparación con la formación de estructuras dentro de cada oligonucleótido único. - Ligar 4 l de la mezcla de hibridación, 1μl de digerido y desfosforilado vector pUC (0,1 g /l) con ADN ligasa de T4, tampón de T4 ADN ligasa 10x y 10 mM ATP en una mezcla de ligación 20 l. Incubar la muestra a 16 ° C durante la noche.
- Transformar los plásmidos ligados a células competentes de Escherichia coli DH5a de protocolos estándar y utilizar cribado blanco azul. Aislar plásmidos y identificar los clones positivos por digestión (para cribar para insertos del tamaño deseado) y la secuenciación del plásmido posterior.
3. Generación de corto sustratos Cas ARN a través de la síntesis de encargo oligonucleótido de ARN
Diseño corto Cas ARN sustratos (por ejemplo, repetir secuencias individuales, fig. 2C) y utilizar las instalaciones personalizadas de síntesis de oligonucleótidos de ARN.
Nota: La inclusión de un desoxirribonucleótido en una posición especificada de un oligonucleótido de ARN (Fig. 2C) se puede utilizar para identificar el sitio de escisión del ARN.
4. In vitro T7 RNA polimerasa de transcripción
- Aislar los plásmidos con el constructo diseñado (de 1,9. 2,7 o.) Utilizando un kit de purificación de plásmido maxiprep.
- Linealizar el plásmido con la enzima de restricción que corta aguas abajo del fragmento clonado (por ejemplo, HindIII). Asegurar la digestión completa.
Nota: Si un divergente 3 define 'terminal del transcrito de ARN se desea, el constructo diseñado debe contener un sitio adicional de restricción específica para "run-off" transcripción aguas arriba de la secuencia HindIII. - Se purificó el plásmido linealizado mediante extracción con fenol: cloroformo extracción (1:1) y precipitación con etanol. Recuperar los ácidos nucleicos mediante resuspensión del sedimento en DEPC estéril agua tratada.
- Crear una in vitro T7 RNAP correr mezcla de transcripción que contiene 40 mM Hepes / KOH (pH 8), 22 mM de MgCl 2, ditiotreitol 5 mM, espermidina 1 mM, 4 mM de cada trifosfato de nucleósido (ATP, CTP, GTP, UTP ), 40-100 g / ml de digeridoplásmido y 0,1 mg / ml T7 RNAP en agua tratada con DEPC. Incubar durante 3 horas a 37 ° C.
- Analizar los transcritos de ARN obtenidos en un gel desnaturalizante de poliacrilamida urea 8 M 12% (Fig. 3A). Las transcripciones de ARN se puede purificar a través de Mono Q cromatografía de intercambio aniónico 13 y se recupera por precipitación con etanol de las fracciones de ARN y la resuspensión del sedimento en agua estéril tratada con DEPC. Para uso futuro, almacenar el ARN a -80 ° C.
5. CAS6 endonucleasa de ensayo
- Establecer un 20 l in vitro T7 RNAP correr mezcla de transcripción (ver 4,4) que contiene una cantidad reducida de 2 mM ATP y se complementa con 2,5 l α-[32 P]-ATP (10 mCi / ml, 5000 Ci / mmol). Purificar los productos de reacción a través de la extracción de gel a partir de una desnaturalización del 8 M urea gel de poliacrilamida al 12%. Visualice bandas por autorradiografía.
- Producir y purificar las proteínas recombinantes deseados Cas. En este ejemplo, CAS6 de Clostridium thermocellum se purificó por medio de calor precipitación y cromatografía de Ni-NTA.
- Establecer un ensayo de reacción de endonucleasa (por ejemplo, para Clostridium thermocellum CAS6, la mezcla de reacción contiene 20 mM Hepes (KOH pH 8), 250 mM KCl, 2 mM de MgCl 2, 1 mM DTT, 12.000 cpm de ARN sustrato y enzima 1 mM y se incubó a 37 ° C durante 30 min).
- Cargar 5 l de la mezcla de reacción (+ 10 l tampón de carga de ARN que contiene 95% de formamida) en un gel de urea 8 M de poliacrilamida al 12%. Visualice los productos de degradación después de electroforesis por autorradiografía.
6. Los resultados representativos
Un ejemplo de sustratos de ARN para el análisis de la actividad endonucleasa de Cas se muestra en la Figura 3A. Una parte alícuota de 5 l de un sistema analítico de 100 l en la reacción de transcripción in vitro fueron cargados. Tenga en cuenta que la eficiencia de la producción de ARN varía entre diferentes construcciones. Algunos factores de tsombrero se observaron para influir en la cantidad de ARN obtenidos son (i) la secuencia inicial que sigue a la G +1 requiere para iniciar la transcripción, (ii) la posibilidad de la formación de la estructura del ARN durante la transcripción y (iii) la elección del sitio de restricción para la generación de la posición de escisión segunda vuelta.
La investigación de la actividad endonucleasa de ARN requiere tanto de proteínas altamente purificada recombinante Cas (Fig. 3B) y adecuados controles negativos. Idealmente, esta muestra de control negativo difiere tan poco como sea posible a partir de la reacción de endonucleasa investigado Cas. Esto puede lograrse mediante la incubación del ARN con tampón de reacción y de lisado celular sin Cas-expresión (y siguiendo el procedimiento de purificación idénticas). Un control negativo ideal es la adición de un desoxirribonucleótido en el sitio de corte propuesto. En la Figura 3C, la escisión de una secuencia de repetición 5 'terminal con la etiqueta se muestra por Clostridium thermocellum CAS6. Bajo idénticas condiciones, esta repetición no es un sustrato más cuando un desoxirribonucleótido se introduce en la posición -9. Este método también proporciona información sobre el sitio de escisión. Finalmente, un tiempo marcado internamente pre-crRNA se escinde por CAS6 y dos fragmentos de escisión se observan.
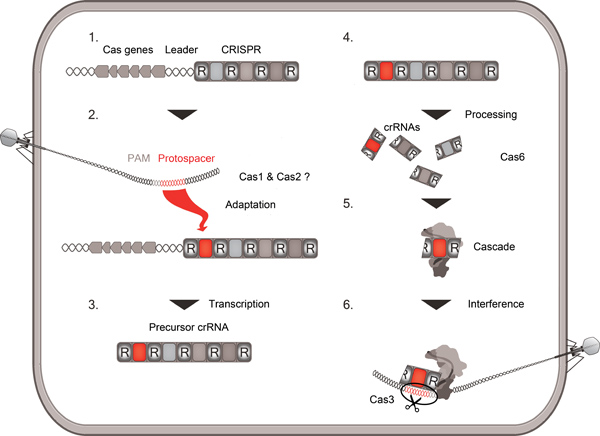
Figura 1. Esquema general de CRISPR / Cas actividad. La descripción general siguiente de la inserción de una secuencia de ADN viral (protospacer) en el clúster CRISPR (adaptación), la transcripción y el procesamiento de la matriz de CRISPR en crRNAs pequeños por una endonucleasa de CAS6, la absorción de crRNAs en el complejo de Cascade y la interferencia de un repetido ataque viral basado en la complementariedad entre crRNA y protospacer. Protospacer adyacentes motivos (PAM) secuencias virales protospacer marca.
igura 2 "src =" / files/ftp_upload/4277/4277fig2.jpg "/>
Figura 2. Generación de sustratos de ARN de las proteínas Cas. El esquema muestra el flujo de trabajo para la generación de (A) de largo pre-crRNA sustratos, (B) intermedio pre-crRNA sustratos y (C) corto Cas sustratos de ARN para pre-crRNA producción. Ejemplos de secuencias se presentan para el conjunto CRISPR de Clostridium thermocellum. Haga clic aquí para ampliar la cifra .

Figura 3. CAS6 ensayo endonucleasa. A.) azul de toluidina gel de poliacrilamida teñido de un oligonucleótido de ARN de diseño personalizado (250 pmol) y dos transcripciones de ARN in vitro (5 l de una reacción típica de 100 l). B.) SDS-PAGE en gel de una preparación CAS6 (80 pmol) de Clostridium thermocellum después de calorprecipitación a 50 ° C durante 1 hora y cromatografía de Ni-NTA. C) Detección de actividad endonucleolítica CAS6 para las secuencias 5 'de repetición terminal etiquetados y pre-crRNA transcritos in vitro. La introducción de un dNTP en la posición -9 suprime CAS6 de escisión para una corta sustrato Cas ARN (S, fig. 2C). A 5 'terminal 8 nt etiqueta también se genera para la maduración de largo crRNA pre-crRNA sustratos (L, Fig. 2A). Las bandas se separaron en un gel desnaturalizante de urea 8 M de poliacrilamida al 12% y se visualizaron por autorradiografía.
Discusión
Los métodos presentados permiten la generación de Cas sustratos endonucleasas de tamaños diferentes y con mayor o menor libertad en el diseño de la secuencia. El enfoque más directo para la generación de sustratos sintéticos de oligonucleótidos de ARN se limita a diseños de ARN cortos debido a los costes crecientes y las limitaciones técnicas en la creación de más oligómeros de ARN. Si bien el éxito la síntesis de ARN se ha informado de oligómeros de ARN no modificadas de más de 100 nucleótidos de longitud, el máximo práctico y económico para la síntesis de ARN de ratón se encuentra por debajo de 40 nucleótidos. Sin embargo, cualquier secuencia dada se puede sintetizar y la introducción dirigida de nucleótidos modificados (por ejemplo, desoxirribonucleótidos) puede ser utilizada para analizar los sitios de escisión en detalle. Más pre-ARNc debe ser generada a través de la transcripción in vitro.
La hibridación de oligonucleótidos que contienen un promotor de ARN polimerasa de T7 permite la producción de longitud intermedia pre-CRRNComo. La longitud máxima de forma rutinaria y económicamente oligonucleótidos de ADN sintetizados es justo por encima de 150 nucleótidos y representa el máximo de pre-sintéticos crRNAs través de este método. El conjunto de varios pares hibridados de oligonucleótidos de ADN que forman extremos pegajosos con cada otro puede extender esta longitud máxima, pero requiere retos crecientes en la clonación de la construcción. La principal ventaja de este método es la capacidad de generar pre-crRNA construcciones (y por lo tanto Cas endonucleasa de sustratos) con cualquier secuencia deseada. Esto permite que el ensayo de diseños crRNA sintéticos.
Por último, grandes y pre-crRNAs se puede obtener de PCR amplificados de elementos genómicos enteros CRISPR o fracciones de los mismos. Las alteraciones en la transcripción in vitro en plantilla de plásmido puede ser introducido a través de mutagénesis dirigida al sitio para la generación de pre-crRNA variantes. Estas construcciones se pueden utilizar para analizar el patrón global de la escisión endonucleolítica dentro de un enteropre-crRNA.
El trabajo pionero para la producción de ARN no modificado a través de T7 ARN polimerasa en transcripción in vitro se basa en el 14 ARN de transferencia y ARN virus del mosaico del bromo 15. El consenso T7 promotor de ARN polimerasa consiste de un dominio de reconocimiento (-17 a través de -5) y un dominio de iniciación (-4 a través +6) con iniciación de la transcripción en una guanosina esencial +1 16. Aguas abajo de las posiciones +1 puede ser variada que permite la transcripción de casi cualquier secuencia de ARN deseado. Los métodos presentados en las plantillas para generar in vitro de transcripción run-off para permitir la síntesis in vitro de concluir la fase de crRNAs que responden a regiones genómicas CRISPR o sintéticas variantes pre-crRNA. Las transcripciones se generan con un presente trifosfato 5'-terminal a menos que la reacción de transcripción se ceba con GMP para obtener 5 'monofosfato termini 14. Estos terminales son necesarios si las transcripciones deben ser etiquetadoscon polinucleótido quinasa de T4 y γ-[32 P]-ATP. Actividad de escisión de CAS6 y enzimas similares a CAS6 genera crRNA que contienen 5'-hidroxilo y un 2 ', 3'-termini cíclicos de fosfato. Estos ARN se pueden analizar para el reconocimiento por el complejo Cascade.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a Jeanette Schermuly para la preparación recombinante de ARN polimerasa T7 y Ebelt Norman para la asistencia en la preparación de la figura 1. Este trabajo fue financiado con fondos de la Deutsche Forschungsgemeinschaft (DFG FOR1680) y la Sociedad Max Planck.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Antártico Fosfatasa | NEB | M0289L | |
| en trifosfato de transcripción in vitro ultrapura grado de nucleótidos | Bioscience Jena | NU-1010 - NU-1013 | |
| Cromatografía de líquidos, ktapurifier 100 | GE Healthcare | ||
| Oligonucleótidos de ADN | GTM Operon | ||
| Oligonucleótidos de ARN | GTM Operon | ||
| Gel Extraction Kit | QIAGEN | 28704 | |
| PCR kit de purificación | QIAGEN | 28104 | |
| Spin Miniprep Kit | QIAGEN | 27106 | |
| Kit Plasmid Maxi | QIAGEN | 12163 | |
| BamHI | NEB | R0136L | |
| HindIII | NEB | R0104L | |
| ADN ligasa de T4 | NEB | M0202S | |
| T4 polinucleótido quinasa | Ambion | AM2310 | |
| T7 ARN polimerasa | preparación propia | ||
| Mezcle la solución desoxinucleótido | NEB | N0447L | |
| Mini-Protean Tetra Sistema de Electroforesis | Bio-Rad | 165-8001 | |
| Storm 840 Scanner | GE Healthcare | 163723 | |
| Almacenamiento Phosphorscreen | Dinámica Molecular | 63-0034-81 | |
| Mono Q 5/50 GL | GE Healthcare | 17-5166-01 | |
| Phusion de alta fidelidad de ADN polimerasa | NEB | M0530L | utilizar el tampón GC |
| Azul de toluidina | Sigma | T3260 | |
| pUC19 | NEB | N3041S | |
| γ-[32 P]-ATP, α-[32 P]-ATP | Hartmann Analítica | SRP-401, SRP-307 |
Referencias
- Barrangou, R. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 315, 1709-1712 (2007).
- Makarova, K. S., Grishin, N. V., Shabalina, S. A., Wolf, Y. I., Koonin, E. V. A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action. Biol. Direct. 1, 7 (2006).
- Lillestøl, R. K., Redder, P., Garrett, R. A., Brugger, K. A putative viral defence mechanism in archaeal cells. Archaea. 2, 59-72 (2006).
- Makarova, K. S. Evolution and classification of the CRISPR-Cas systems. Nat. Rev. Microbiol. 9, 467-477 (2011).
- Brouns, S. J. Small CRISPR RNAs guide antiviral defense in prokaryotes. Science. 321, 960-964 (2008).
- Carte, J., Pfister, N. T., Compton, M. M., Terns, R. M., Terns, M. P. Binding and cleavage of CRISPR RNA by Cas6. RNA. 16, 2181-2188 (2010).
- Haurwitz, R. E., Jinek, M., Wiedenheft, B., Zhou, K., Doudna, J. A. Sequence- and structure-specific RNA processing by a CRISPR endonuclease. Science. 329, 1355-1358 (2010).
- Gesner, E. M., Schellenberg, M. J., Garside, E. L., George, M. M., Macmillan, A. M. Recognition and maturation of effector RNAs in a CRISPR interference pathway. Nat. Struct. Mol. Biol. 18, 688-692 (2011).
- Carte, J., Wang, R., Li, H., Terns, R. M., Terns, M. P. Cas6 is an endoribonuclease that generates guide RNAs for invader defense in prokaryotes. Genes Dev. 22, 3489-3496 (2008).
- Wiedenheft, B. Structures of the RNA-guided surveillance complex from a bacterial immune system. Nature. 477, 486-489 (2011).
- Garneau, J. E. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 468, 67-71 (2010).
- Sinkunas, T. Cas3 is a single-stranded DNA nuclease and ATP-dependent helicase in the CRISPR/Cas immune system. EMBO J. 30, 1335-1342 (2011).
- Jahn, M. J., Jahn, D., Kumar, A. M., Söll, D. Mono Q chromatography permits recycling of DNA template and purification of RNA transcripts after T7 RNA polymerase reaction. Nucleic Acids Res. 19, 2786-2787 (1991).
- Sampson, J. R., Uhlenbeck, O. C. Biochemical and physical characterization of an unmodified yeast phenylalanine transfer RNA transcribed in vitro. Proc. Natl. Acad. Sci. USA. 85, 1033-1037 (1988).
- Dreher, T. W., Bujarski, J. J., Hall, T. C. Mutant viral RNAs synthesized in vitro show altered aminoacylation and replicase template activities. Nature. 311, 171-175 (1984).
- McGinness, K. E., Joyce, G. F. Substitution of ribonucleotides in the T7 RNA polymerase promoter element. J. Biol. Chem. 277, 2987-2991 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados