Method Article
Análisis del perfil metabólico de embriones de pez cebra
En este artículo
Resumen
Pez cebra representan un modelo vertebrado poderosa que ha sido infrautilizado para estudios metabólicos. Aquí se describe una forma rápida para medir la In vivo Metabólico perfil de pez cebra en desarrollo que permite la comparación de diferentes parámetros de la función mitocondrial entre genética o farmacológicamente embriones manipulados, aumentando así la aplicabilidad de este organismo.
Resumen
Una meta que crece en el campo del metabolismo es determinar el impacto de la genética en diferentes aspectos de la función mitocondrial. La comprensión de estas relaciones ayudará a entender la etiología subyacente para una serie de enfermedades relacionadas con la disfunción mitocondrial, tales como la diabetes y la obesidad. Los recientes avances en la instrumentación, ha permitido a la monitorización de parámetros distintos de la función mitocondrial en líneas celulares o explantes de tejido. Aquí presentamos un método para un análisis rápido y sensible de parámetros de la función mitocondrial en vivo durante el desarrollo embrionario del pez cebra mediante el Seahorse biociencia XF 24 analizador de flujo extracelular. Este protocolo utiliza la captura Islet microplacas en un único embrión se coloca en cada pocillo, permitiendo la medición de la bioenergética, incluyendo: (i) la respiración basal, (ii) la respiración mitocondrial basal (iii) la respiración mitocondrial debido a la rotación de ATP; (iv) mitocondrial respiración desacoplada o proton fuga y (iv) de respiración máxima. Al utilizar este enfoque de embriones de pez cebra parámetros de respiración pueden ser comparados entre el tipo salvaje y embriones genéticamente alterados (mutante del gen sobre-expresión de genes o caída) o aquellos manipulados farmacológicamente. Se prevé que la difusión de este protocolo proporcionará a los investigadores con nuevas herramientas para analizar la base genética de los trastornos metabólicos in vivo en este modelo animal vertebrado pertinente.
Protocolo
Parte 1: Tratamiento químico de embriones de pez cebra
- Recoger embriones de pez cebra después de la fertilización. Se incuba a 28,5 º C en medio E3 en 100 × 15 mm placas de Petri Nota:. Para la hibridación in situ o de aceite-Red-O tinción, 1-fenil-2-tiourea (PTU) a una concentración final de 0,2 mM a inhibir la formación de pigmento, 1 pero no es necesaria para el análisis Seahorse.
- Para los estudios farmacológicos, añadir la química necesaria a una concentración final apropiada para el desarrollo de embriones de pez cebra en alrededor de 26 horas después de la fertilización (hpf) con un adecuado vehículo de sólo control Nota:. Sensibles a la luz inhibidores farmacológicos, los embriones se puede permitir que se desarrollan en la oscuridad antes del análisis.
Parte 2: Perfil metabólico en directo con el Seahorse XF 24 Analyser
- Antes de cada ejecución, el Seahorse XF 24 Analyser cartucho que alberga la 2 O y H + fluoróforos se calibra a través de un proceso automatizado realizado por el analizador.
- Preparación de la placa de 24-así XF islote 24. La secuencia experimental se emplea el siguiente:
- Dado que el consumo de oxígeno es sensible a las fluctuaciones de temperatura, cuatro pozos se utilizan para controlar las fluctuaciones de temperatura posibles en toda la placa. Estos pozos no contienen embriones, pero se llenan con 700 l de medio de E3 (Figura 2A).
- Los otros 20 pozos (véase el punto 2.2) se llenan con 700 l de medio E3 y un embrión de cada uno (Figura 2B).
- Para cada experimento, 10 embriones se trataron con vehículo solo (control) y 10 tratados con inhibidor químico (tratada). Embriones de control y tratados se alternan (por ejemplo, el pocillo A2: embrión de control; así A3: embrión tratado: A4 bien: embrión de control; así embrión tratado A5, etc).
- Una captura de pantalla de los islotes, se añade en la parte superior de. cada pocillo para asegurar que la muestra permanece en la cámara de medición durante todo el ensayo (Figura 2B) Nota: tratadas químicamente embriones permanecen con su solución química original durante todo el procedimiento, sin necesidad de lavar el producto químico antes de ejecutar el analizador Seahorse programa.
- Una vez terminado, la placa se carga en el analizador de Seahorse y el ensayo se inicia.
- Análisis de muestras. Dos ensayos diferentes se realizan rutinariamente.
- Basal respiración / Máximo respiración programa (duración aprox. 90 min). Las alteraciones en la respiración basal apuntalar la disfunción metabólica, mientras que la respiración máxima es una medida de la capacidad total de producción de energía y alteraciones en este parámetro asociado con un número de estados patológicos y fisiológicos tanto. La capacidad respiratoria de repuesto, o la capacidad de sistema para aumentar aún más la producción de ATP, también se calculade esta prueba por la sustracción de basal de la respiración máxima. Tres repeticiones de cada mezcla (2 min) / WAIT (1 min) / medición (2 min) ciclo se realiza para establecer primera respiración basal. Al final del tercer ciclo, una concentración final de 2,5 M de FCCP (mitocondrial protonophore / desacoplador) se añadió a cada pocillo que permite la medición de respiración máxima. El ciclo de medición se repite 5 a 8 veces (Figura 3).
- ATP facturación / Protón fuga programa (duración aprox. 60 min). La respiración debido a la rotación ATP representa la principal función de las mitocondrias en la forma de producción de ATP, mientras que la respiración debido a la fuga de protones, o respiración desacoplada, está inextricablemente vinculado con otros parámetros de la función mitocondrial, incluyendo la respiración basal y la formación de especies reactivas del oxígeno. Respiración debido a la rotación ATP está representada por la diferencia en la respiración después de la adición de oligomicina mu M 25 (un inhibidor de unaSintasa TP) en comparación con la respiración basal. Respiración no acoplado, o respiración debido a fugas de protones, se determina calculando la diferencia entre oligomicina mediada por la respiración y la respiración después de la adición de rotenona mu M 25 (un complejo inhibidor I). Ciclos de medición se repiten 8 veces después de la adición de cada inhibidor mitocondrial.
Al final de las carreras, los valores medios de control 10 y 10 embriones tratadas químicamente se calculan.
Parte 3: Oil-Red-O tinción
- Los embriones en 50 hpf se dechorionated utilizando unas pinzas finas y se fijaron en PFA al 4% durante la noche a 4 ° C.
- Oil-Red-O tinción se lleva a cabo, como se ha descrito anteriormente 2 (ver Figura 4).
Resultados
Estamos interesados en entender el papel que los genes específicos en el metabolismo, en particular la tasa de respiración y el metabolismo lipídico. Por lo tanto, se trataron embriones de pez cebra de tipo silvestre de 26 en adelante HPF con un inhibidor farmacológico específico de la enzima codificada por uno de estos genes. En 50 hpf, medio del vehículo y los embriones tratados con inhibidores de la fueron analizados utilizando el Seahorse para la función mitocondrial, mientras que la mitad restante se fijaron en PFA al 4% durante la noche a 4 ° C y posteriormente se tiñeron para la deposición de lípidos con Oil-Red-O. El tratamiento con el inhibidor de la enzima específica dirigida a ~ 2 veces mayor en la respiración basal (Figura 4A), lo que se asoció con un aumento en la deposición de lípidos especialmente en el telencéfalo y debajo de la vesícula ótica (Figura 4B, C).
pload/4300/4300fig1highres.jpg "/>
Figura 1. Representación esquemática del tratamiento químico de los embriones de pez cebra. Wildtype, genéticamente manipulados o tratados farmacológicamente embriones de pez cebra son de fondo.
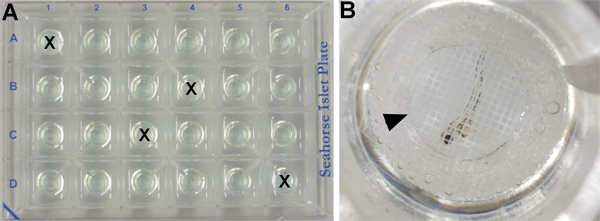
Figura 2. XF24 placa islote de configurar. (A) Cuatro pozos contienen medio embrionario sólo como control de la temperatura (marcado con una X) y los otros contienen un embrión / pocillo. (B) Primer plano de un bien (C6) que muestra un embrión de 50 hpf tipo salvaje tratados con vehículo (DMSO) cubierta por una pantalla de captura de islote (punta de flecha).
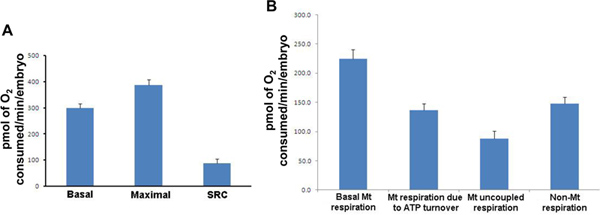
Figura 3. Respiratparámetros de iones de tipo salvaje embriones de pez cebra 50 HPF. (A) Para cada medición, la media de los 20 embriones individuales se presenta. Respiración basal (media: 299,7; SD: 75,7; SEM: 16,9), la respiración máxima (media: 387,4; SD: 93,3; SEM: 20,9), la capacidad respiratoria de repuesto (media: 87,7; DE: 72,0; SEM: 16,1). (B) Para cada medición, la media de los resultados individuales 20 se presenta. Respiración basal mitocondrial; respiración mitocondrial debido a la rotación ATP; respiración mitocondrial desacoplada y la respiración no mitocondrial. Mt: mitocondrial; SRC: la capacidad respiratoria de repuesto; SD: desviación estándar, SEM: error estándar de la media. Los resultados se presentan en pmol de O 2 consumido / min / embrión. Haga clic aquí para ampliar la cifra .
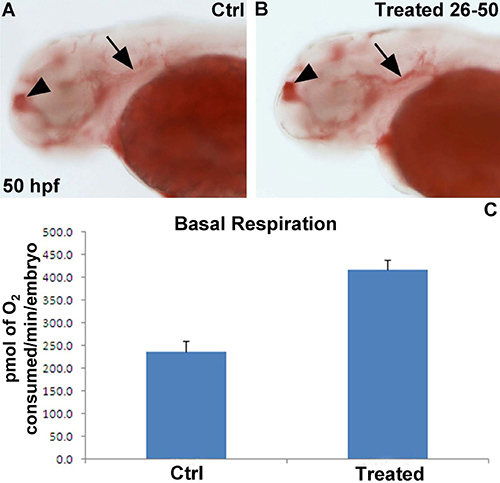
Figura 4. Reprelos resultados representativos de la exposición química en la respiración basal y la deposición de lípidos. (A, B) 50 hpf embriones se tiñeron con Oil-Red O en vista lateral. El embrión se incubó con el inhibidor selectivo (B) muestra más de tinción Oil-Red-O en el telencéfalo (punta de flecha) y por debajo de la vesícula ótica (flecha) en comparación con un embrión de control tratado con vehículo. (C) respiración basal muestra un ~ 2 veces mayor en los embriones tratados químicamente (n = 10 embriones por grupo). Los resultados se presentan en pmol de O 2 / min / embrión.
Discusión
El pez cebra es un modelo genético bien establecido para tanto hacia adelante (ENU mutagénesis) y reversa (Tilling, dedo de zinc nucleasa específica knock-out, desmontables morfolino) enfoques genéticos 3,4, mientras que la función de genes en embriones de pez cebra también puede ser fácilmente bloqueado o activado usando compuestos selectivos farmacológicos específicos para los productos codificados. Debido a su desarrollo externo y pequeño tamaño, embriones de pez cebra son particularmente adecuados para el análisis del metabolismo. Sin embargo, robusta medición de perfil metabólico y la función mitocondrial in vivo en embriones de pez cebra no se ha conseguido, con sólo una descripción preliminar reportado 5. Análisis Seahorse fue diseñado originalmente para los estudios metabólicos basados en células y se ha demostrado que dan resultados precisos y fiables 6. La aplicación de esta nueva metodología a los embriones de pez cebra es significativo, y es probable que aumentar el uso más amplio de este modelo para estudios metabólicos.
En este estudio, hemos demostrado la medición de un rango de parámetros de respiración en embriones de pez cebra utilizando el Analizador de Seahorse, incluyendo la respiración basal, la respiración máxima, la capacidad respiratoria de recambio, el recambio de ATP y las fugas de protones. También proporcionamos un ejemplo de cómo dichas mediciones se pueden correlacionar con otros parámetros fisiológicos, en este caso la acumulación de lípidos, y de la utilización de inhibidores farmacológicos en este sistema de ensayo. En combinación con el uso de embriones genéticamente alterados, lo que proporciona una potente plataforma experimental para la comprensión de los factores que influyen en el metabolismo.
Hay una gran variedad de aplicaciones para esta nueva metodología, con la disfunción mitocondrial está implicada en muchas enfermedades humanas, tales como diabetes mellitus 7, 8 obesidad, esclerosis múltiple 9, enfermedades de Parkinson 10, enfermedad de Alzheimer 11 y algún tipo de cáncer 12. Es importante destacar que, our trabajo se realiza in vivo, donde todas las influencias ambientales - tales como las citoquinas, etc relacionados con el desarrollo del crecimiento - están activas, proporcionando de este modo una vista fisiológicamente relevante en la respiración y el perfil metabólico in vivo. Como las pantallas de químicos también se realiza de manera rutinaria en el tipo salvaje y mutante embriones de pez cebra de fondo (Figura 1), los productos farmacéuticos novedosos que la respiración influencia, la función de las mitocondrias o el metabolismo pueda ser fácilmente identificados con el analizador Seahorse. Los resultados generados utilizando el analizador de Seahorse podría ser usado en conjunción con otros ensayos para proporcionar información adicional. Esto puede incluir el análisis fisiológico, tal como aceite rojo tinción, o análisis molecular, tal como la hibridación in situ para marcadores específicos de adipocitos como cebpα, PPAR, PPAR, FAS etc
Quedan algunas limitaciones a esta metodología. A pesar de que nosotros y otros fueron capaces de utilizar oligomicina a mediure producción de ATP y fuga de protones en embriones jóvenes 5 (ver Figura 3), en embriones mayores de 60 hpf tratamiento oligomicina es ineficiente. Creemos que en los embriones más viejos oligomicina no se puede difundir con la misma facilidad que en los embriones más jóvenes poniendo los resultados imposibles de interpretar. Dado que los resultados oligomicina son obligatorios para la determinación de la respiración debido a la rotación ATP y la respiración no acoplado, actualmente estamos investigando concentraciones más altas de oligomicina para mayores embriones. Sin embargo, la antimicina A tratamientos siguen siendo eficacia más duradera, con otras mediciones, tales como la respiración basal, respiración máxima y la capacidad respiratoria de repuesto, se puede realizar en embriones de pez cebra mayores, hpf hasta 68 (no se muestra).
Otra limitación en el uso de la configuración Seahorse Analyser actual es el espacio físico dentro de cada placa de captura de islote bien, de tal manera que sólo son adecuados para los embriones de pez cebra y larvas jóvenes. Por lo tanto, la realización de Metabolestudios de IC en obesidad inducida por dieta en peces adultos, por ejemplo, no es aún técnicamente factible. Sin embargo, este estudio puede llevar al desarrollo de placas especialmente diseñadas para los juveniles o adultos, ampliando así el alcance de los análisis posibles.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a los miembros del personal del Fondo para la Universidad Deakin de pez cebra para proporcionar una excelente atención cría en curso. YG es apoyado por una beca de investigación postdoctoral Alfred Deakin y una Beca de Investigación Central de la Universidad de Deakin. SLM es apoyado por una beca de Desarrollo Profesional NHMRC. ACW es apoyado por una beca NHMRC Habilitación. Todos los autores son apoyadas por el Centro de Investigación de Investigación Molecular y Medicina Estratégica en la Universidad de Deakin.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| XF 24 analizador de flujo extracelular | Seahorse Bioscience | 100737-101 | Formato de 24 y |
| Islet microplaca de captura | Seahorse Bioscience | 101122-100 | Formato de 24 y |
| XF calibrante Solution | Seahorse Bioscience | 100840-000 | |
| XF Medio de Ensayo | Seahorse Bioscience | 101022-100 | |
| Oil-Red-O | Sigma-Aldrich | O0625 | |
| 1-fenil-2-tiourea (PTU) | Sigma-Aldrich | P7629 | / Zfbook/chapt10.html # wptohtml51 "target =" _blank "> http://zfin.org/zf_info/zfbook/chapt10.html # wptohtml51 |
| E3 (medio embrionario) | Self made | - | http://zfin.org/zf_info/zfbook/chapt10.html # wptohtml16 |
| 100x15 mm placas de Petri | Halcón | 35-1029 | |
| FCCP | Sigma | C2920 | |
| Oligomicina | Sigma | 75351 | |
| Antimicina A | Sigma | A8674 |
Referencias
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Schlombs, K., Wagner, T., Scheel, J. Site-1 protease is required for cartilage development in zebrafish. Proc. Natl. Acad. Sci. U.S.A. 100, 14024-14029 (2003).
- Ingham, P. W. The power of the zebrafish for disease analysis. Hum. Mol. Genet. 18, R107-R112 (2009).
- Nasevicius, A., Ekker, S. C. Effective targeted gene 'knockdown' in zebrafish. Nat. Genet. 26, 216-220 (2000).
- Stackley, K. D., Beeson, C. C., Rahn, J. J., Chan, S. S. Bioenergetic profiling of zebrafish embryonic development. Plos One. 6, e25652 (2011).
- McGee, S. L., Sadli, N., Morrison, S., Swinton, C., Suphioglu, C. DHA protects against zinc mediated alterations in neuronal cellular bioenergetics. Cell Physiol. Biochem. 28, 157-162 (2011).
- Sivitz, W. I., Yorek, M. A. Mitochondrial dysfunction in diabetes: from molecular mechanisms to functional significance and therapeutic opportunities. Antioxid. Redox Signal. 12, 537-577 (2010).
- Bournat, J. C., Brown, C. W. Mitochondrial dysfunction in obesity. Curr. Opin. Endocrinol. Diabetes Obes. 17, 446-452 (2010).
- Ghafourifar, P., et al. Mitochondria in multiple sclerosis. Front Biosci. 13, 3116-3126 (2008).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochim. Biophys. Acta. 1802, 29-44 (2010).
- Maruszak, A., Zekanowski, C. Mitochondrial dysfunction and Alzheimer's disease. Prog. Neuropsychopharmacol. Biol. Psychiatry. 35, 320-330 (2011).
- de Moura, M. B., dos Santos, L. S., S, L., Van Houten, B. Mitochondrial dysfunction in neurodegenerative diseases and cancer. Environ. Mol. Mutagen. 51, 391-405 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados