Method Article
Analyse du profil métabolique des embryons de poisson zèbre
Dans cet article
Résumé
Poisson-zèbre constituent un modèle vertébré puissant qui a été sous-utilisée pour les études métaboliques. Nous décrivons ici un moyen rapide pour mesurer la In vivo Profil métabolique du poisson zèbre développement qui permet de comparer les différents paramètres de la fonction mitochondriale entre génétiquement ou pharmacologiquement embryons manipulés, ce qui augmente l'applicabilité de cet organisme.
Résumé
L'un des objectifs de plus en plus dans le domaine du métabolisme est de déterminer l'impact de la génétique sur les différents aspects de la fonction mitochondriale. La compréhension de ces relations aidera à comprendre l'étiologie sous-jacente à toute une gamme de maladies liées à un dysfonctionnement mitochondrial, comme le diabète et l'obésité. Les récents progrès dans l'instrumentation, a permis à la surveillance des paramètres distincts de la fonction mitochondriale dans des lignées cellulaires ou des explants de tissus. Nous présentons ici une méthode pour une analyse rapide et sensible des paramètres de la fonction mitochondriale in vivo au cours du développement embryonnaire du poisson zèbre en utilisant le Seahorse biosciences XF 24 analyseur de flux extracellulaire. Ce protocole utilise la capture Islet microplaques où un seul embryon est placé dans chaque puits, permettant la mesure de la bioénergétique, y compris: (i) la respiration de base, (ii) la respiration mitochondriale basale (iii) la respiration mitochondriale en raison de renouvellement de l'ATP, (iv) des mitochondries respiration découplée ou prOton fuite et de la respiration maximale (iv). En utilisant cette approche embryonnaires paramètres de la respiration du poisson zèbre peut être comparé entre le type sauvage et d'embryons génétiquement modifiés (mutants, la sur-expression du gène ou inactivation génique) ou les manipuler pharmacologiquement. Il est prévu que la diffusion de ce protocole permettra aux chercheurs de nouveaux outils pour analyser les bases génétiques des maladies métaboliques in vivo dans ce modèle animal vertébré pertinente.
Protocole
Partie 1: Traitement chimique des embryons de poisson zèbre
- Recueillir des embryons de poisson zèbre après la fécondation. Incuber à 28,5 ° C dans du milieu E3 dans 100 × 15 mm boîtes de Pétri. Remarque: Pour l'hybridation in situ ou d'huile rouge-O coloration, le 1-phényl-2-thio-urée (PTU) à une concentration finale de 0,2 mM est ajouté à inhiber la formation de pigment, 1 mais n'est pas nécessaire pour l'analyse hippocampe.
- Pour les études pharmacologiques, ajouter le produit chimique nécessaire à une concentration finale appropriée pour le développement d'embryons de poisson zèbre à environ 26 h après la fécondation (HPF) avec un véhicule approprié seule commande. Remarque: sensibles à la lumière inhibiteurs pharmacologiques, les embryons peuvent être autorisés à se développer dans l'avant sombre à l'analyse.
Partie 2: Profil métabolique direct Utilisation de l'hippocampe XF 24 Analyseur
- Avant chaque essai, la cartouche d'hippocampe XF analyseur 24 qui abrite le 2 O et H fluorophores est étalonné par un processus automatisé effectuée par l'analyseur.
- Préparation de la plaque de 24 puits XF îlot 24. La séquence expérimentale suivante est utilisée:
- Comme la consommation d'oxygène est sensible aux variations de température, quatre puits sont utilisés pour contrôler les fluctuations de température possibles à travers la plaque. Ces puits ne contiennent pas d'embryons, mais sont remplis avec 700 pi de milieu E3 (figure 2A).
- Les 20 autres puits (voir partie 2.2) sont remplies avec 700 ul de milieu E3 et un embryon de chacun (figure 2B).
- Pour chaque expérience, 10 embryons sont traités avec le véhicule seul (témoin) et 10 patients traités avec des produits chimiques inhibiteur (traité). Embryons témoins et traités sont alternés (par exemple, ainsi A2: embryon de contrôle; ainsi A3: embryon traité: A4 ainsi: embryon de contrôle; ainsi embryon A5 traités, etc.)
- Un îlot de capture d'écran est ajouté sur le dessus de. chaque puits afin de s'assurer que l'échantillon reste dans la chambre de mesure tout au long de l'essai (figure 2B) Remarque: traités chimiquement embryons restent avec leur solution chimique d'origine pendant toute la procédure, sans qu'il soit nécessaire de laver le produit chimique avant l'exécution de l'analyseur Seahorse programme.
- Une fois terminé, la plaque est chargé dans l'analyseur hippocampe et le test est commencé.
- L'analyse des échantillons. Deux tests différents sont effectués régulièrement.
- Basale programme de la respiration respiration / maximum (durée environ 90 min.). Altérations de la respiration basale sous-tendent la dysfonction métabolique, tandis que la respiration maximale est une mesure de la capacité de production d'énergie totale et des modifications de ce paramètre associé à un certain nombre de pays à la fois physiologiques et pathologiques. La capacité respiratoire de secours, ou la capacité du système pour augmenter encore la production d'ATP, est également calculéà partir de ce test par la soustraction de base de respiration maximale. Trois répétitions de chaque mélange (2 min) / d'attente (1 min) / mesure (2 min) cycle est effectué d'abord établir la respiration basale. A la fin du troisième cycle, une concentration finale de 2,5 uM de FCCP (mitochondrial protonophore / découpleur) est ajouté à chaque puits permettant la mesure de la respiration maximale. Le cycle de mesure est répété de 5 à 8 fois (figure 3).
- Programme ATP fuite chiffre d'affaires / Proton (durée environ 60 min.). La respiration à cause de renouvellement de l'ATP représente la fonction majeure de mitochondries dans la forme de la production d'ATP, tandis que la respiration à cause de fuite de protons, ou la respiration découplée, est inextricablement liée à d'autres paramètres de la fonction mitochondriale dont la respiration basale et formation d'espèces réactives d'oxygène. Respiration en raison du roulement ATP est représenté par la différence de respiration après l'addition de 25 pM oligomycine (un inhibiteur de l'ATP synthase) par rapport à la respiration basale. Respiration désaccouplée, ou en raison de la respiration fuite de protons, est déterminée en calculant la différence entre oligomycine médiée par la respiration et la respiration après l'addition de 25 pM roténone (un inhibiteur du complexe I). Cycles de mesure sont répétées 8 fois après l'addition de chaque inhibiteur mitochondrial.
A la fin des essais, les valeurs moyennes de la commande 10 et 10 embryons traités chimiquement sont calculés.
Partie 3: huile rouge O coloration
- Embryons à 50 hpf sont dechorionated l'aide de pinces fines et fixées dans 4% PFA nuit à 4 ° C.
- Huile rouge O-coloration est effectuée, comme décrit précédemment 2 (voir Figure 4).
Résultats
Nous sommes intéressés à comprendre le rôle des gènes spécifiques sur le métabolisme, en particulier le taux de respiration et le métabolisme des lipides. Par conséquent, nous avons traité sauvages embryons de poisson zèbre à partir du mois de type HPF 26 avec un inhibiteur pharmacologique spécifique de l'enzyme codée par l'un de ces gènes. À 50 hpf, la moitié du véhicule et un inhibiteur embryons traités ont été analysées en utilisant le Seahorse pour la fonction mitochondriale, tandis que l'autre moitié a été fixé à 4% PFA nuit à 4 ° C et ensuite colorées pour le dépôt des lipides avec de l'huile-rouge-O. Le traitement par l'inhibiteur de l'enzyme spécifique mené une ~ 2 fois plus de respiration basale (figure 4A), qui a été associée à une augmentation des dépôts de lipides en particulier dans le télencéphale et au-dessous de la vésicule otique (Figure 4B, C).
pload/4300/4300fig1highres.jpg "/>
Figure 1. Représentation schématique du traitement chimique des embryons de poisson zèbre. Type sauvage, génétiquement manipulés, ou pharmacologiquement traitées embryons de poisson zèbre sont arrière-plan.
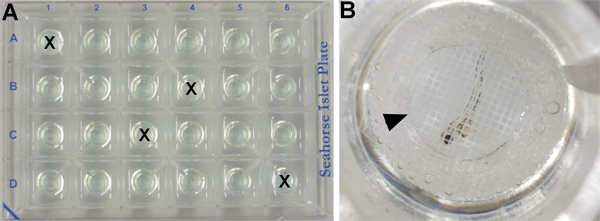
Figure 2. XF24 plaque îlot mis en place. (A) Quatre puits contiennent un milieu embryonnaire seulement comme contrôle de la température (marqué par un X) et les autres contiennent un embryon / puits. (B) Close-up d'un puits (C6) montrant un embryon de 50 hpf type sauvage traitées avec le véhicule (DMSO) couvert par une capture d'écran îlot (tête de flèche).
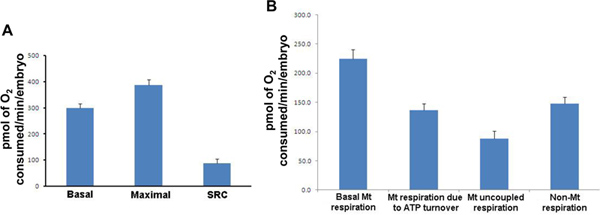
Figure 3. Respiratparamètres d'ions de type sauvage pour 50 embryons de poisson zèbre HPF. (A) Pour chaque mesure, la moyenne des 20 embryons individuels est présenté. Respiration basale (moyenne: 299,7; SD: 75,7; SEM: 16,9), la respiration maximale (moyenne: 387,4; SD: 93,3; SEM: 20,9), la capacité respiratoire de secours (moyenne: 87,7; SD: 72,0; SEM: 16,1). (B) pour chaque mesure, la moyenne des résultats individuels 20 est présenté. Basale respiration mitochondriale; respiration mitochondriale en raison de renouvellement de l'ATP; mitochondrial respiration découplée et non mitochondrial respiration. Mt: mitochondriale; SRC: Pièce de rechange Capacité respiratoire; SD: écart-type, SEM: erreur standard de la moyenne. Les résultats sont présentés en pmoles de O 2 consommée / min / embryon. Cliquez ici pour agrandir la figure .
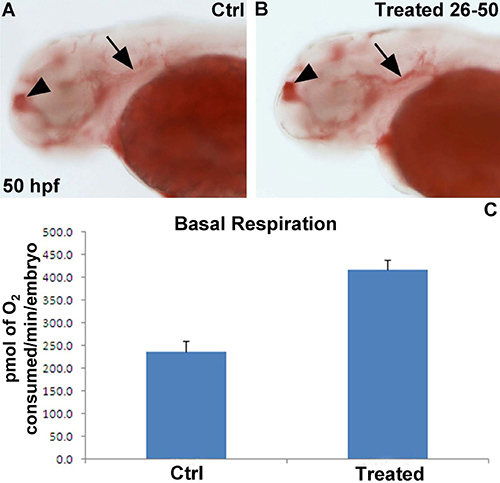
Figure 4. Représentantdes résultats représentatifs de l'exposition chimique sur la respiration basale et le dépôt de lipides. (A, B) 50 embryons hpf colorées avec l'huile rouge O en vue latérale. L'embryon incubé avec l'inhibiteur sélectif (B) affiche plus d'huile coloration rouge-O dans le télencéphale (tête de flèche) et en dessous de la vésicule otique (flèche) par rapport à un embryon de contrôle traité par le véhicule. (C) la respiration basale montre un ~ 2 fois plus chez les embryons traités chimiquement (n = 10 embryons par groupe). Les résultats sont présentés en pmoles de O 2 / min / embryon.
Discussion
Le poisson zèbre est un modèle génétique bien établie à la fois vers l'avant (ENU mutagenèse) et arrière (Tilling, doigt de zinc nucléase ciblée knock-out, knock-down morpholino) 3,4 approches génétiques, tandis que la fonction des gènes dans les embryons de poisson zèbre peut également être facilement bloqué ou activé l'aide sélective de composés pharmacologiques spécifiques pour les produits codés. En raison de leur développement externe et de petite taille, embryons de poisson zèbre sont particulièrement adaptés à l'analyse métabolique. Cependant, la mesure robuste du profil métabolique et la fonction mitochondriale in vivo chez des embryons de poisson zèbre n'a pas été atteint, avec une seule description préliminaire rapportée 5. Analyse Seahorse a été conçu à l'origine pour les études métaboliques cellulaires et a été démontré pour donner des résultats précis et fiables 6. L'application de cette nouvelle méthode d'embryons de poisson zèbre est importante, et susceptible d'augmenter le plus large utilisation de ce modèle pour les études métaboliques.
Dans cette étude, nous démontrons la mesure de toute une gamme de paramètres de la respiration dans les embryons de poisson zèbre à l'aide de l'analyseur Seahorse, y compris la respiration basale, la respiration maximale, la capacité respiratoire de secours, renouvellement de l'ATP et la fuite de protons. Nous fournissons également un exemple de la façon dont ces mesures peuvent être mises en corrélation avec d'autres paramètres physiologiques, dans ce cas, l'accumulation de lipides et de l'utilisation d'inhibiteurs pharmacologiques de ce système de dosage. Combinée à l'utilisation d'organismes génétiquement modifiés par les embryons, cela donne une puissante plate-forme expérimentale pour la compréhension des facteurs qui influent sur le métabolisme.
Il existe une variété d'applications pour cette nouvelle méthodologie, un dysfonctionnement mitochondrial est impliqué dans de nombreuses maladies humaines, telles que le diabète sucré 7, l'obésité 8, la sclérose en plaques 9, la maladie de Parkinson 10, la maladie d'Alzheimer 11 et certains types de cancers 12. Surtout, our travail est effectuée in vivo, où les influences de l'environnement - tels que les cytokines, lié au développement de croissance etc - sont actifs, en fournissant ainsi une vue physiologiquement pertinente de la respiration et le profil métabolique in vivo. Comme les écrans chimiques sont aussi couramment effectuée dans le type sauvage et mutantes embryons de poisson zèbre fond (figure 1), les produits pharmaceutiques novateurs que la respiration influence, la fonction mitochondriale ou le métabolisme pourrait être facilement identifiés à l'aide de l'analyseur hippocampe. Les résultats obtenus en utilisant l'analyseur hippocampe pourrait être utilisée en conjonction avec d'autres dosages de fournir des informations supplémentaires. Cela peut inclure l'analyse physiologique, tels que l'huile rouge de coloration, ou l'analyse moléculaire, telles que l'hybridation in situ pour les marqueurs adipocytaires spécifiques tels que cebpα, PPARa, PPARy, etc SAF
Il reste quelques limites à cette méthode. Bien que nous et d'autres avons pu utiliser oligomycine à la mesureure la production d'ATP et de fuite de protons sur les embryons jeunes 5 (voir figure 3), dans des embryons de plus de 60 hpf oligomycine traitement est inefficace. Nous croyons que dans les anciens embryons oligomycine ne peut pas diffuser aussi facilement que chez les jeunes embryons rendant les résultats impossibles à interpréter. Comme les résultats oligomycine sont obligatoires pour la détermination de la respiration à cause de renouvellement de l'ATP et la respiration découplée, nous étudions actuellement des concentrations plus élevées de oligomycine pour les anciens embryons. Cependant, antimycine A traitements restent efficaces plus longtemps, avec d'autres mesures, telles que la respiration basale, la respiration maximale et la capacité respiratoire de secours, peut être effectuée dans embryons de poisson zèbre âgés, jusqu'à 68 hpf (non représentée).
Une autre limitation dans l'utilisation de la configuration actuelle Seahorse Analyser est l'espace physique au sein de chaque plaque de capture et d'îlots, de sorte qu'ils ne conviennent que pour les embryons de poisson zèbre et les jeunes larves. Par conséquent, l'exécution metabolic études sur le régime alimentaire induite par l'obésité chez les poissons adultes, par exemple, n'est pas encore techniquement possible. Cependant, cette étude pourrait inciter le développement des plaques spécialement conçues pour les poissons juvéniles et adultes, étendant ainsi la portée des analyses possibles.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Les auteurs tiennent à remercier les membres du personnel du Fonds pour l'Université de Deakin poisson zèbre pour fournir d'excellents soins d'élevage en cours. YG est soutenu par une bourse de recherche postdoctorale Alfred Deakin et une subvention de recherche du Centre de l'Université Deakin. SLM est pris en charge par une bourse de développement de carrière NHMRC. ACW est soutenu par une subvention NHMRC d'habilitation. Tous les auteurs sont pris en charge par le Centre de recherche sur la recherche moléculaire et médicale à l'Université Deakin stratégique.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| XF 24 analyseur de flux extracellulaire | Seahorse Bioscience | 100737-101 | Format 24 puits |
| Microplaque capture Islet | Seahorse Bioscience | 101122-100 | Format 24 puits |
| XF Calibrant Solution | Seahorse Bioscience | 100840-000 | |
| Milieu de dosage XF | Seahorse Bioscience | 101022-100 | |
| Huile rouge O- | Sigma-Aldrich | O0625 | |
| 1-phényl-2-thio-urée (PTU) | Sigma-Aldrich | P7629 | / Zfbook/chapt10.html # wptohtml51 "target =" _blank "> http://zfin.org/zf_info/zfbook/chapt10.html # wptohtml51 |
| E3 (moyenne embryonnaire) | Self made | - | http://zfin.org/zf_info/zfbook/chapt10.html # wptohtml16 |
| 100x15 mm boîtes de Pétri | Faucon | 35-1029 | |
| FCCP | Sigma | C2920 | |
| Oligomycine | Sigma | 75351 | |
| Un antimycine | Sigma | A8674 |
Références
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Schlombs, K., Wagner, T., Scheel, J. Site-1 protease is required for cartilage development in zebrafish. Proc. Natl. Acad. Sci. U.S.A. 100, 14024-14029 (2003).
- Ingham, P. W. The power of the zebrafish for disease analysis. Hum. Mol. Genet. 18, R107-R112 (2009).
- Nasevicius, A., Ekker, S. C. Effective targeted gene 'knockdown' in zebrafish. Nat. Genet. 26, 216-220 (2000).
- Stackley, K. D., Beeson, C. C., Rahn, J. J., Chan, S. S. Bioenergetic profiling of zebrafish embryonic development. Plos One. 6, e25652 (2011).
- McGee, S. L., Sadli, N., Morrison, S., Swinton, C., Suphioglu, C. DHA protects against zinc mediated alterations in neuronal cellular bioenergetics. Cell Physiol. Biochem. 28, 157-162 (2011).
- Sivitz, W. I., Yorek, M. A. Mitochondrial dysfunction in diabetes: from molecular mechanisms to functional significance and therapeutic opportunities. Antioxid. Redox Signal. 12, 537-577 (2010).
- Bournat, J. C., Brown, C. W. Mitochondrial dysfunction in obesity. Curr. Opin. Endocrinol. Diabetes Obes. 17, 446-452 (2010).
- Ghafourifar, P., et al. Mitochondria in multiple sclerosis. Front Biosci. 13, 3116-3126 (2008).
- Winklhofer, K. F., Haass, C. Mitochondrial dysfunction in Parkinson's disease. Biochim. Biophys. Acta. 1802, 29-44 (2010).
- Maruszak, A., Zekanowski, C. Mitochondrial dysfunction and Alzheimer's disease. Prog. Neuropsychopharmacol. Biol. Psychiatry. 35, 320-330 (2011).
- de Moura, M. B., dos Santos, L. S., S, L., Van Houten, B. Mitochondrial dysfunction in neurodegenerative diseases and cancer. Environ. Mol. Mutagen. 51, 391-405 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon