Method Article
Fabricación y uso de Piggy-back Multibarrel Electrodos para
En este artículo
Resumen
La iontoforesis de agonistas y antagonistas neuronales durante extracelular In vivo Grabaciones es una poderosa manera de manipular microambiente de una neurona. Estas manipulaciones pueden más fácilmente ser hecho a través de piggy-back multibarrel electrodos. Aquí se describe cómo fabricarlos y usarlos durante las grabaciones auditivas.
Resumen
En grabaciones in vivo de las neuronas individuales permiten a un investigador para examinar las propiedades de descarga de las neuronas, por ejemplo en respuesta a estímulos sensoriales. Las neuronas reciben típicamente múltiples entradas aferentes y / o eferente excitatorias e inhibitorias que se integran entre sí, y los últimos medidos propiedades de respuesta de la neurona son impulsadas por las integraciones neuronales de estas entradas. Para estudiar el procesamiento de información en los sistemas neuronales, es necesario entender las distintas entradas a una neurona o sistema neural, y las propiedades específicas de estas entradas. Un método poderoso y relativamente sencillo técnicamente para evaluar el papel funcional de ciertos insumos que una neurona dada está recibiendo es suprimir dinámicamente y de manera reversible o eliminar estas entradas, y medir los cambios en la salida de la neurona causados por esta manipulación. Esto se puede lograr por farmacológicamente alterar entorno inmediato de la neurona con piggy-back multibarrel eléctrodas. Estos electrodos consisten en un electrodo de cilindro de impresión único y un electrodo de drogas multibarrel que puede llevar hasta 4 diferentes agonistas o antagonistas sinápticas. Los agentes farmacológicos pueden ser aplicados iontoforéticamente en el momento deseado durante el experimento, lo que permite controlada en el tiempo de entrega y reconfiguración reversible de entradas sinápticas. Como tal manipulación, farmacológicos del microambiente constituye un método de gran alcance y sin precedentes para poner a prueba hipótesis específicas sobre el funcionamiento del circuito neural.
Aquí se describe cómo piggy-back electrodos se fabrican y cómo se utilizan en experimentos in vivo. El sistema de lengüeta permite a un investigador combinar un electrodo de cilindro de impresión único de cualquier propiedad arbitraria (resistencia, tamaño de la boquilla, etc forma) con un electrodo de fármaco multibarrel. Esta es una ventaja importante sobre estándar con múltiples electrodos, donde todos los barriles tienen más o menos las formas y propiedades similares. Multibarrel electrodes se introdujo por primera vez hace 40 años 1-3, y han sido objeto de varias mejoras de diseño de 2,3 hasta que el tipo piggy-back se introdujo en la década de 1980 4,5. Aquí les presentamos una serie de mejoras importantes en la producción de laboratorio de piggy-back electrodos que permiten la penetración profunda del cerebro intacto en las preparaciones en animales in vivo debido a un cuerpo de electrodos relativamente delgada que causa un daño mínimo. Además, estos electrodos se caracterizan por grabaciones de bajo ruido, y tienen bajos barriles de resistencia a fármacos para iontoforesis muy eficaz de los agentes farmacológicos deseados.
Protocolo
Tire de los electrodos de vidrio
Tire de los electrodos de vidrio- Tire electrodo solo barril. El uso de vidrio solo barril capilar con filamento y tire de la punta de un diámetro de aproximadamente 1-2 micrómetros, longitud de eje de 10-12 mm, y la resistencia de electrodo correspondiente de aproximadamente 12 MOhm (rango 5-20 MOhms) según se mide en 0,9% de solución de NaCl. Más bajas resistencias de electrodo tendría como resultado más actividad de fondo y por lo tanto más dificultad en el aislamiento de la actividad unitaria de las neuronas individuales. Para extraer este electrodo, utilizar horizontal o vertical con un extractor de filamentos que se calientan ya sea o bobinas de calentamiento.
- Tire electrodo multibarrel. Debido al diámetro mucho más grande de vidrio multibarrel y la necesidad de una distribución uniforme del calor alrededor de la multibarrel todo, un extractor de gran alcance con una bobina de calefacción diámetro más grande, no es un filamento de calefacción, que se necesita. Una pipeta multibarrel tiene que ser insertado en el centro del filamento de calefacción con no ponerse en contacto a la bobina de calentamiento. Tenga en cuenta que además de las pipetas 5-barril descrito aquí, pipetas 3-barril o barril 7-son alternativas comercialmente disponibles. Tire de vidrio a una punta de pipeta de aproximadamente 10 micrómetros de diámetro total, o menos. La punta se romperá al diámetro correcto en la siguiente etapa, por lo que el tamaño de la punta exacta es menos crítico durante la operación de extracción de la forma general de la punta del electrodo, que debe ser relativamente largo y delgado. Se refieren a la imagen en la Figura 1C para la forma electrodo de punta deseado. Formas de electrodos cortas y gruesas (Figura 1B) hará que una cantidad sustancial de daño en el tejido cuando está avanzado en el cerebro, mientras que las formas de los electrodos muy largos y delgados (Figura 1A) se dobla y por lo tanto será más difícil de romper la punta del electrodo a la correcta diámetro (véase el paso 2).
Modificar puntas de los electrodos
Modificar puntas de los electrodos. Antes de que los dos electrodos se pueden pegar juntos, Tienen que ser modificados. El eje del electrodo solo necesita ser doblado antes de que pueda estar unido a la multibarrel para asegurarse de que el eje combinado del acabado de lengüeta electrodo es lo más fina posible. Además, la punta del electrodo multibarrel tiene que ser interrumpido con el fin de asegurar una baja resistencia para iontoforesis.- Doble árbol de un electrodo solo barril de unos 20 grados. Use la menor llama del quemador Bunsen posible. Típicos "pequeñas" mecheros Bunsen estándar de las compañías de suministro de laboratorio crear tamaños de llama que son demasiado grandes para esta aplicación. Para sortear este problema utilice la menor quemador Bunsen comercial y garantizar una aguja de jeringa (~ 18 gauge) a la parte superior del quemador, y sellar la conexión con cemento dental. Cuando funciona, la llama debe ser difícil de ver, sobre 5 mm o menos de diámetro, y aproximadamente 8 mm de altura. Cualquier movimiento del aire en la habitación se apaga la llama, así que es una buena idea para hacer funcionar el quemador en unahabitación cerrada, o usar escudos de viento. Mueva el electrodo solo barril a través de la llama de doblarla por cerca de 20 grados. Tender a que la llama del quemador fundir el vidrio en la zona de transición en alrededor de 10 milímetros de distancia de la punta del electrodo. Para evitar la fusión de la punta del electrodo, se aconseja que el electrodo se mantiene a aproximadamente 45 grados, la punta señalando hacia abajo, y mover el electrodo a través de la llama de forma relativamente rápida.
- Rompa la punta del electrodo multibarrel. Para asegurar un control visual ya romper la punta del electrodo, use un microscopio con un objetivo mínimo de 10x y 10x oculares. Una escala de medición insertado en el ocular también se necesita para medir tamaños de boquilla. Coloque una pieza de plexiglás para el microscopio de tal manera que el extremo de la plexiglás se puede ver en alrededor de un tercio a la mitad del campo de visión del microscopio. En nuestro caso, la pieza de plexiglás es de aproximadamente 25 x 70 mm y 5 mm de espesor y unido mediante un tornillo que puede fijarse en una costumbrehizo hilo en la platina del microscopio. Es importante tener un diseño que permite el movimiento independiente de plexiglás de la diapositiva. Coloque el electrodo multibarrel en una cama de plastilina sobre un portaobjetos de vidrio, e insertar la diapositiva que contiene el electrodo en la fase de soporte de diapositivas microscopio. Usando manipuladores xy la platina del microscopio, la mueva suavemente la punta del electrodo contra la pieza de plexiglás y observe la rotura de la punta a través de los oculares del microscopio. Tratar de romper limpiamente la punta multibarrel a un diámetro acumulativo de unos 25-35 micrómetros. Deseche las pipetas con diámetros de punta que se desprendieron demasiado grande, o consejos con pausas irregulares. Descartamos aproximadamente el 30% de nuestros electrodos multibarrel debido a formas de las puntas indeseables.
Ensamble Piggy-back Electrodo
Ensamble piggy-back electrodo.- Posición electrodos. Retire la pieza de plexiglás utilizado en el paso 2.2 de la platina del microscopio. Asegure terminadomultibarrel electrodo en plastilina sobre un portaobjetos de vidrio, punta apuntando ligeramente hacia arriba. Apuntando hacia arriba será importante para el paso 3,2, el encolado de los dos electrodos. Consejos que apuntan a que el pegamento para huir de la punta, evitando pegar las puntas de los electrodos. Insertar electrodo doblado solo barril en el porta electrodo del micromanipulador hecho a medida (Figura 2). Usando la guía visual primero y luego la orientación microscópico, baje el electrodo solo barril en el electrodo multibarrel. El único electrodo debería reducirse directamente en la ranura que está formada por la disposición de los 5 barriles, con su punta que sobresale de la punta de la punta multibarrel por aproximadamente 5-10 micrómetros. Al bajar el barril, supervisar de cerca al ángulo que se forma entre los dos electrodos. Para obtener el mejor resultado evitar cualquier ángulo en el que las puntas punto de diferencia el uno del otro, sino que intentan reducir el electrodo único en el multi perfectamente paralelo o incluso con su puntatocando el multibarrel primera, formando un arreglo muy leve "cuña". Desde la punta de cilindro único es muy flexible, se dobla cuando el único electrodo se baja un poco más después de que la punta ha alcanzado la superficie superior del electrodo de barril múltiples, formando una punta limpia compuesto que tiene una pequeña cantidad de la acción del muelle construido en que ayuda a la celebración de las puntas juntas. Sin embargo, si el ángulo entre el cañón y el electrodo único multibarrel es demasiado empinada (demasiado de una cuña), la acción de resorte será demasiado alta y doblar hacia abajo la disposición de electrodos.
- Pegue los electrodos ejes juntos. Pegue los ejes de los dos electrodos junto con cianocrilato (pegamento). Colocar una pequeña gota de pegamento en el lado pequeño de un palillo plano y montaje de electrodos contacto con la gota de pegamento. Comience en la posición más distal de las extremidades y mueva lentamente palillo con la gota de pegamento a lo largo de los ejes de los electrodos hacia las puntas de los electrodos. El uso de pegamento en exceso, o aplicar pegamento too para cerrar las puntas de los electrodos se traducirá en el pegado de las aberturas de los electrodos, haciendo que el electrodo al menos parcialmente no funcional.
- Estabilizar conjunta con cemento dental. Mezclar una pequeña cantidad de cemento dental y acrílico dental en un pequeño plato de plástico desechable o pesan barco, utilizando un palillo de dientes plana. Esperar hasta que el cemento se vuelve moldeable y aplicar una pequeña cantidad de la junta entre los dos electrodos para estabilizar la articulación (material de color rosa en la Figura 3). Deje aproximadamente 15 min para secar.
- Quite y guarde los electrodos. Retire con cuidado el terminado piggy-back primer electrodo del titular micromanipulador, y luego desprenderse del portaobjetos de vidrio, y guárdelo en un recipiente a prueba de polvo.
Preparar Soluciones Electrodos de relleno
Preparar soluciones electrodo de relleno. Desde iontoforesis requiere moléculas cargadas, la mayoría de los agentes tienen que ser disuelto ya sea en un ambiente ácido o alcalino (típicamente unta pH de aproximadamente 3-4, o un pH de aproximadamente 8-10, respectivamente). Un número de sustancias químicas que se utilizan a menudo en la iontoforesis se enumeran en la Tabla 1. Para los agentes que no figuran en la tabla, determinar a partir del valor de pKa, si sería más fácil de usar la molécula de un ácido o en un medio alcalino para mantener la molécula cargada, y se disuelven en consecuencia. Para obtener los mejores resultados, mezcle todas las soluciones frescas todos los días.Rellenar y preparar electrodos
Rellenar y preparar electrodos. Justo antes de utilizar el electrodo, de vuelta a llenar cada barril con su respectivo medicamento, el uso de fibra de carbono 28 a 34 agujas de calibre unidas a jeringas con filtros de jeringa. Rellene los 4 barriles exteriores de la configuración de 5 cañón con los fármacos de elección, y el barril centro con NaCl 3M como un barril de equilibrio. Llenar el electrodo barril sola grabación con NaCl 3M también. Adición de un colorante a la solución de NaCl, tal como rojo o verde rápido fenol hará que sea más fácil ver la punta del electrododurante la colocación del electrodo sobre la superficie del cerebro. Insertar el electrodo en el soporte del electrodo de la configuración de la grabación e insertar todos los cables en los barriles de vidrio apropiados. Use cable aislado de plata de la que alrededor de 1 cm de aislamiento se ha eliminado en la punta. No debe haber cables 5 para el electrodo de multibarrel (4 barriles de drogas y un barril de equilibrio), más el alambre amplificador que debe ser insertado en el electrodo de registro solo barril.Encienda módulos de bomba Iontoforesis
Encienda módulos de bomba iontoforesis y probar todos los barriles. La función de prueba de electrodo de cada módulo de la bomba le ayudará a determinar si el barril electrodo es funcional. Para impedir la fuga de los fármacos de los barriles cuando no está en uso, una tensión de retención en la polaridad opuesta, como la molécula de carga necesita ser aplicada.
Resultados
En este experimento, el antagonista de receptor de glicina clorhidrato de estricnina fue aplicada iontoforéticamente. El bloqueo de la inhibición glycinergic típicamente aumenta disparo de las neuronas. Figura 4 muestra datos de ejemplo de una neurona auditiva cuyas respuestas a estímulos sonoros sinusoidales de creciente intensidad entregada a las orejas del animal se registraron. Este tipo de experimento se conoce como la función de la neurona de descarga tasa de intensidad vs. Los sonidos más fuertes como resultado mayores tasas de pico de la curva (negro). La corriente de iontoforesis inicial utilizado en este experimento fue de 15 nA. Después de que la corriente se conecta y los cambios en la función de intensidad tasa se había estabilizado en su nuevo nivel (curva de color azul oscuro), la corriente de eyección se incrementó progresivamente a 30, 45, y 60 nA (naranja, verde y luz azul curvas, respectivamente). En cada caso, las respuestas de la neurona sobre el mismo intervalo de intensidades de sonido se registraron después de los cambios en la Alta trasrgimos intensidad tasa de funciones en respuesta a la corriente de eyección nuevo se había estabilizado. La eyección más corriente apropiada a utilizar en este ejemplo fue de 45 nA a 60 nA porque estos niveles de corriente ya no alterar de manera diferente las respuestas de las neuronas. Este resultado sugiere que en 45 nA de corriente, todos los receptores de glicina de neurona que ya había sido bloqueada por el hidrocloruro de estricnina. Cualquier incremento adicional de la estricnina eyección incluso más actual y la liberación no resultó en un cambio adicional de la descarga de la neurona tasa de nivel de función. Después de la finalización del protocolo, la corriente de eyección se apaga. La recuperación de las respuestas neuronales a la línea base se logró después de unos 25 min (línea roja). Esto puede llevar, en función del tipo y cantidad de medicamento expulsado, entre varios segundos y varias decenas de minutos.
| Droga | Concentración | pH de una solución | Solvente | Empresa | Cat. # | Retención de Corriente típica | Corrientes típicas de eyección |
| GABA | 500 mM | 3.5-4.0 | dH 2 O | Sigma | A-2129 | -15 NA | 5 nA a 100 nA |
| Glicina | 100 mM | 3.5-4.0 | dH 2 O | Sigma | G-7126 | -15 NA | 5 nA a 100 nA |
| Bicuculina metiodida | 10 mM | 3,0 | 0,165 M de NaCl en dH 2 O | Sigma | B-6889 | -15 NA | 5 nA a 60 nA |
| La estricnina clorhidrato | 10 mM | 3,0 | 0,165 M de NaCl en dH 2 O | Sigma | S-8753 | -15 NA | 5 nA a 80 nA |
| L-ácido glutámico | 500 mM | 8.0 | dH 2 O | Sigma | G-1251 | 30 nA | -10 A -150 nA nA |
| L-ácido aspártico | 500 mM | 8.0 | dH 2 O | Sigma | A-8949 | 30 nA | -10 A -150 nA nA |
| Ácido kaínico | 1 mM | 9.0 | dH 2 O | Sigma | K-0250 | 30 nA | -NA 10 nA a -100 |
Tabla 1. Fármacos comúnmente utilizados, con pH para la disolución y concentración. La tabla lista los agonistas más comúnmente utilizados sinápticas y antagonistas utilizados con iontoforesis. El entorno de pH indicado cuentas por la necesidad de polarizar t agentes stos, y las cuentas de concentración sugeridos para la variabilidad en la efectividad entre las diferentes drogas.
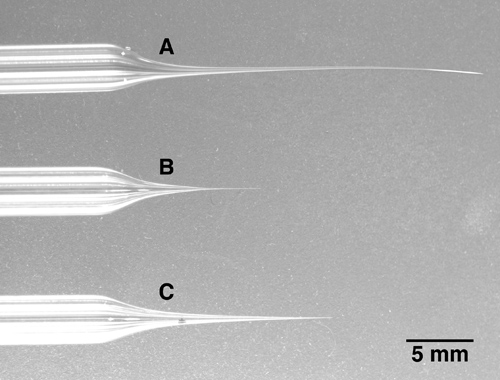
Figura 1. Tres multibarrel pipetas con puntas diferentes longitudes. A: La punta de este electrodo 5-barril se ha tirado demasiado largo y delgado. Tenga en cuenta que la punta esté doblada y muy suave. Este tipo de punta es muy difícil de romper para el diámetro deseado. B: La punta de este electrodo es demasiado corto y rechoncho. Cuando avanzado en áreas cerebrales más profundos, este electrodo puede causar daño cerebral innecesario debido al hecho de que el electrodo se vuelve relativamente gruesa sólo unos pocos milímetros después de la punta. C: Un ejemplo de un electrodo con una punta correctamente tira. Si bien es larga y delgada, la punta sigue siendo firme y se puede romper fácilmente al diámetro de la punta deseada.
gura 2 "src =" / files/ftp_upload/4358/4358fig2.jpg "/>
Figura 2. Dibujo de conjunto de electrodo manipulador. El conjunto manipulador se utiliza junto con un microscopio para montar los electrodos piggy-back. Los elementos marcados en gris son productos comercialmente disponibles y se enumeran en la Tabla 2. Los artículos marcados en azul fueron maquinados a medida en la tienda de máquina de nuestra institución. Ellos son: 1) 1/4 pulgadas de placa de acero de tamaño 43x26 cm con agujeros para la etapa Newport 423 perforado en él de acuerdo con el patrón de agujeros proporcionados por Newport, 2) una etapa de inclinación que permite la inclinación de la asamblea en ángulos arbitrarios, 3) un conector que se monta el soporte del electrodo a la etapa de traslación superior.
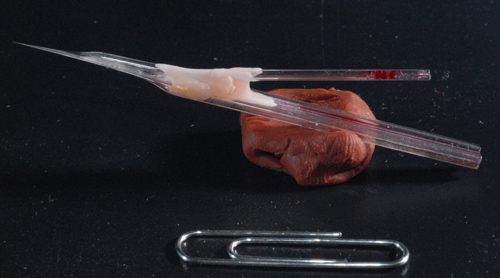
Figura 3. Foto de una muestra de piggy-back electrodo. Un acabado cinco barriles electrodo montado junto con una grabación en el de un solo cañónectrode. Nota eje largo de aproximadamente 7 mm lo que permite una grabación profundas del cerebro.
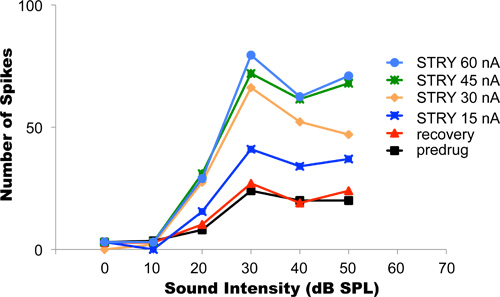
Figura 4. La titulación de las corrientes de expulsión. El gráfico muestra la intensidad de tasa funciones grabadas desde una neurona auditiva individual, mientras que las orejas del animal se estimularon con tonos de diferentes intensidades. Los sonidos más fuertes tienden a provocar mayor tasas de disparo. Antes de la aplicación del fármaco, la neurona La tasa de intensidad función mostraron las tasas más bajas puntas (curva en negro). Progresivamente más altas corrientes de eyección comandos progresivamente más receptores de glicina en la neurona, lo que resulta en tasas de disparo progresivamente más altas. La expulsión óptima actual en esta neurona era 45-60 nA. Con estas corrientes de eyección, el bloqueo completo de todos los receptores de las neuronas de glicina fue alcanzada. Después de la finalización del protocolo experimental, la iontoforesis se terminó y la neurona se dejórecuperar. La recuperación completa se logra cuando la tasa de recuperación de intensidad coincide con la función inicial antes del fármaco función de recuperación. Reproducido, con autorización de la American Physiological Society, de Klug et al, 1995.
Discusión
Se describe una técnica que permite la manipulación de un microcircuito de una sola neurona en vivo, mientras que al mismo tiempo que permite la grabación de las respuestas de las neuronas durante la manipulación experimental. Circuitos neuronales son manipuladas a través de la aplicación iontophoretical de agonistas y antagonistas sinápticas. La principal ventaja de la iontoforesis sobre presión de eyección es que la iontoforesis no requiere el movimiento físico de fluido desde el electrodo en el tejido neural, y por lo tanto no existe la preocupación de causar daños en los tejidos a través de la presión aplicada o el volumen de líquido. La principal limitación de esta técnica es la falta de información sobre la concentración de fármaco absoluta en el tejido, y el volumen de tejido afectado. Sin embargo, dado que las cantidades de los agentes farmacológicos eyectadas con iontoforesis son mucho más pequeño y mucho más controlable con precisión que con la presión de eyección, la recuperación de la aplicación del fármaco es típicamente mucho más rápido und mucho más completo. Microiontophoresis ha sido utilizado con éxito en un número de sistemas neuronales, sensoriales y otros, y se aplica con éxito en la mayoría de las áreas del cerebro con procesamiento intrínseca pequeña o nula. La razón es que algo del agente farmacológico expulsado puede difundirse desde el sitio de aplicación a una neurona vecina y también manipular las propiedades de respuesta de la neurona vecina.
La fabricación por separado de electrodos barril simples como múltiples permite la combinación de electrodos con propiedades arbitrarias y no relacionados. Tirando de barriles de electrodos juntos y utilizando algunos para la grabación y para algunos fines de iontoforesis se producen puntas de electrodo con propiedades muy similares, de tal manera que las puntas de los electrodos podría ser o bien demasiado grande para la grabación única célula, o demasiado pequeño para la aplicación del fármaco. Además, tener la punta del cañón único extienden más allá de las puntas de los electrodos multibarrel por unos 20 micrómetros reduce el ruido en las grabaciones, unad elimina los posibles efectos de confusión de las actuales corrientes de retención o expulsión de disparo de la neurona 3.
Piggy-back multibarrel electrodos hayan sido previamente descrito más de 30 años 4-6 y se han utilizado con mucho éxito para analizar circuitos neuronales 7-18 19-29. Así, el método en sí no es nuevo ni único. Sin embargo, los detalles particulares de la preparación del electrodo y el uso han sido modificados a través de los años, y el conjunto de instrucciones que se describen aquí ha demostrado ser especialmente fácil y con éxito, y no ha sido publicado en detalle en otra parte en la literatura. Particularmente, la flexión de la punta de cilindro único electrodo permite que la punta final del electrodo de lengüeta a ser relativamente delgada (Figura 3) y, por tanto, permite para grabaciones de núcleos profundos con el mínimo daño al cerebro, el saliente de la solo barril electrodo sobre el electrodo multi-cañón elimina prácticamente todo current efectos, que se citan a menudo como una desventaja de la técnica 3. Los nuevos detalles que aquí se presenta como tener la punta del electrodo apuntando hacia arriba durante el proceso de pegado y descansando el barril en la ranura del electrodo multibarrel asegurará una alta tasa de éxito cuando se produce piggy-back electrodos. La técnica es relativamente fácil y típicamente puede ser dominado por un principiante en unos pocos días.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
El trabajo fue apoyado por R01 DC 011582 (AK) y DC011555 SR1 (DJT).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del elemento | Fabricante | Comentario | Cat. # |
| Mechero Bunsen | Disponible en: VWR | 17928-027 | |
| Dos componentes del cemento dental: "cura Fría" material dental | Co-oral-ite Dental Mfg Co | Disponible en: Sistemas de AM, Inc | 525000 |
| Dos componentes del cemento dental: material de la dentadura reticulación compuesto líquido | Co-oral-ite Dental Mfg Co | Disponible en: Sistemas de AM, Inc | 525000 |
| Pegamento líquido | Henkel | Disponible en: Loctite Super Glue | 01-06849 |
| Micro-Iontoforesis Unes el siguiente: Neurophore BH-2 | Harvard Apparatus | Disponible en: Harvard Apparatus | 65-0200 65-0203 y |
| Plata aislado alambre | AM-Systems | Disponible desde: AM-Systems | 785500 |
| Extractor horizontal | Zeitz DMZ-Universal Extractor | Disponible en: AutoMate Scientific | NA |
| Manipulador de micro-piezas: porta electrodo | WPI | Disponible en: WPI | M3301EH |
| Manipulador de micro-piezas: fase lineal | Newport 423 Series | Disponible en: Newport | 423 |
| Manipulador de micro-piezas: rotación etapa | Newport RSP-2 | Disponible en:Newport | RSP-2 |
| Micromanipulador piezas: traducción z | Newport 433 Series | Disponible en: Newport | 433 |
| Micromanipulador piezas: soporte de ángulo de 90 ° para montar eje xy z y | Newport 360-90 | Disponible en: Newport | 360-90 |
| Micromanipulador piezas: traducción de x / lineal etapa | Newport 423 Series | Disponible en: Newport | 423 |
| Micromanipulador piezas: traducción y / lineal etapa | Newport 423 | Disponible en: Series Newport | 423 |
| Microscopio | Leitz Laborlux 11 | ||
| Microscopio: objetivo | Leitz Wetzlar 10x, NA 0,25 | 519760 | |
| Microscopio: eypieces | Leitz Wetzlar, Periplan 10x/18 | 519748 | |
| Microscopio: etapa | Leitz Wetzlar | 513544 | |
| Multibarrel capilar | N / A | Disponible en: sistemas de AM, Inc | 612000 |
| Sinlge barril capilar (GC 150F-10) | Harvard Apparatus | Disponible en: Harvard Apparatus | 30-0057 |
| Extractor vertical | Narishige modelo PE-2 | ||
| Elementos hechos de encargo del manipulador Micro-(marcado luz bLue en la Figura 1) | |||
| placa de acero | |||
| base de inclinación | |||
| fijación para soporte de electrodo | |||
Tabla 2. Los fabricantes y los números de puntos de todos los equipos y materiales utilizados en el procedimiento. |
Referencias
- Curtis, D. R. A method for assembly of "parallel" micro-pipettes. Electroencephalogr. Clin. Neurophysiol. 24, 587-589 (1968).
- Carette, B. A new method of manufacturing multi-barrelled micropipettes with projecting recording barrel. Electroencephalogr. Clin. Neurophysiol. 44, 248-250 (1978).
- Crossman, A. R., Walker, R. J., Woodruff, G. N. Problems associated with iontophoretic studies in the caudate nucleus and substantia nigra. Neuropharmacology. 13, 547-552 (1974).
- Havey, D. C., Caspary, D. M. A simple technique for constructing "piggy-back" multibarrel microelectrodes. Electroencephalogr. Clin. Neurophysiol. 48, 249-251 (1980).
- Verberne, A. J., Owens, N. C., Jackman, G. P. A simple and reliable method for construction of parallel multibarrel microelectrodes. Brain Res. Bull. 36, 107-108 (1995).
- Oliver, A. P. Technical contribution. A simple rapid method for preparing parallel micropipette electrodes. Electroencephalogr. Clin. Neurophysiol. 31, 284-286 (1971).
- Oswald, J. P., Klug, A., Park, T. J. Interaural intensity difference processing in auditory midbrain neurons: effects of a transient early inhibitory input. J. Neurosci. 19, 1149-1163 (1999).
- Park, T. J., Pollak, G. D. GABA shapes a topographic organization of response latency in the mustache bat's inferior colliculus. J. Neurosci. 13, 5172-5187 (1993).
- Park, T. J., Pollak, G. D. GABA shapes sensitivity to interaural intensity disparities in the mustache bat's inferior colliculus: implications for encoding sound location. J. Neurosci. 13, 2050-2067 (1993).
- Peterson, D. C., Nataraj, K., Wenstrup, J. Glycinergic inhibition creates a form of auditory spectral integration in nuclei of the lateral lemniscus. J. Neurophysiol. 102, 1004-1016 (2009).
- Ramsey, L. C. B., Sinha, S. R., Hurley, L. M. 5-HT1A and 5-HT1B receptors differentially modulate rate and timing of auditory responses in the mouse inferior colliculus. Eur. J. Neurosci. 32, 368-379 (2010).
- Wenstrup, J. J., Leroy, S. Spectral Integration in the Inferior Colliculus: Role of Glycinergic Inhibition in Response Facilitation. J. Neurosci. 21, RC124 (2001).
- Yang, L., Pollak, G. D. Features of ipsilaterally evoked inhibition in the dorsal nucleus of the lateral lemniscus. Hear. Res. 122, 125-141 (1998).
- Yang, L., Pollak, G. D. GABA and glycine have different effects on monaural response properties in the dorsal nucleus of the lateral lemniscus of the mustache bat. J. Neurophysiol. 71, 2014-2024 (1994).
- Yang, L., Pollak, G. D. The roles of GABAergic and glycinergic inhibition on binaural processing in the dorsal nucleus of the lateral lemniscus of the mustache bat. J. Neurophysiol. 71, 1999-2013 (1994).
- Yang, L., Pollak, G. D., Resler, C. GABAergic circuits sharpen tuning curves and modify response properties in the mustache bat inferior colliculus. J. Neurophysiol. 68, 1760-1774 (1992).
- Faingold, C. L., Gehlbach, G., Caspary, D. M. On the role of GABA as an inhibitory neurotransmitter in inferior colliculus neurons: iontophoretic studies. Brain Res. 500, 302-312 (1989).
- Faingold, C. L., Hoffmann, W. E., Caspary, D. M. Effects of excitant amino acids on acoustic responses of inferior colliculus neurons. Hear. Res. 40, 127-136 (1989).
- Hurley, L., Pollak, G. D. Serotonin shifts first-spike latencies of inferior colliculus neurons. J. Neurosci. 25, 7876-7886 (2005).
- Hurley, L., Pollak, G. D. Serotonin effects on frequency tuning of inferior colliculus neurons. J. Neurophysiol. 85, 828-842 (2001).
- Hurley, L. M., Pollak, G. D. Serotonin differentially modulates responses to tones and frequency-modulated sweeps in the inferior colliculus. J. Neurosci. 19, 8071-8082 (1999).
- Klug, A., Bauer, E. E., Pollak, G. D. Multiple components of ipsilaterally evoked inhibition in the inferior colliculus. J. Neurophysiol. 82, 593-610 (1999).
- Klug, A., Park, T. J., Pollak, G. D. Glycine and GABA influence binaural processing in the inferior colliculus of the mustache bat. J. Neurophysiol. 74, 1701-1713 (1995).
- Moore, M. J., Caspary, D. M. Strychnine blocks binaural inhibition in lateral superior olivary neurons. J. Neurosci. 3, 237-242 (1983).
- Nataraj, K., Wenstrup, J. J. Roles of inhibition in creating complex auditory responses in the inferior colliculus: facilitated combination-sensitive neurons. J. Neurophysiol. 93, 3294-3312 (2005).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. J. Neurosci. 30, 12075-12083 (2010).
- Burger, R., Pollak, G. D. Reversible inactivation of the dorsal nucleus of the lateral lemniscus reveals its role in the processing of multiple sound sources in the inferior colliculus of bats. J. Neurosci. 21, 4830-4843 (2001).
- Burger, R. M., Pollak, G. D. Analysis of the role of inhibition in shaping responses to sinusoidally amplitude-modulated signals in the inferior colliculus. J. Neurophysiol. 80, 1686-1701 (1998).
- Coleman, W. L., Fischl, M. J., Weimann, S. R., Burger, R. M. GABAergic and glycinergic inhibition modulate monaural auditory response properties in the avian superior olivary nucleus. J. Neurophysiol. 105, 2405-2420 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados