Method Article
Herstellung und Verwendung von Piggy-Back mehrgehäusigen Elektroden für
In diesem Artikel
Zusammenfassung
Iontophorese von neuronalen Agonisten und Antagonisten während der extrazellulären In vivo Aufnahmen ist eine leistungsfähige Methode zur eines Neurons Mikroumgebung zu manipulieren. Diese Manipulationen können am einfachsten über piggy-back mehrgehäusigen Elektroden durchgeführt werden. Hier beschreiben wir, wie man sie herstellen und verwenden Sie sie während der Tonaufnahmen.
Zusammenfassung
In-vivo-Aufnahmen von einzelnen Neuronen ein Ermittler ermöglichen, um die Eigenschaften von Neuronen feuern, beispielsweise in Reaktion auf sensorische Reize zu untersuchen. Neuronen empfangen typischerweise mehrere erregenden und hemmenden afferenten und / oder ableitenden Eingänge miteinander zu integrieren, und die ultimative gemessenen Antwort Eigenschaften des Neurons durch die neuronalen Integrationen dieser Eingänge angetrieben. Zur Informationsverarbeitung in neuronalen Systemen zu untersuchen, ist es notwendig, die verschiedenen Eingänge eines Neurons oder neuronale System zu verstehen, und die spezifischen Eigenschaften dieser Eingänge. Eine leistungsstarke und technisch relativ einfache Methode, um die funktionelle Rolle von bestimmten Eingaben, dass ein bestimmtes Neuron erhält beurteilen, dynamisch und reversibel unterdrücken oder zu eliminieren diese Eingänge, und messen Sie die Änderungen in das Neuron die Ausgabe durch diese Manipulation verursacht. Dies kann durch pharmakologisch Veränderung des Neurons unmittelbaren Umgebung mit Huckepack-mehrgehäusigen elektr erreicht werdenOden. Diese Elektroden bestehen aus einem einzigen Fass Messelektrode und einer mehrgehäusigen Drogen Elektrode, die tragen bis zu 4 verschiedenen synaptischen Agonisten oder Antagonisten. Die pharmakologischen Mittel können iontophoretisch zu gewünschten Zeiten angewendet werden während des Experiments, was eine zeit-gesteuerte Zufuhr und reversible Rekonfiguration der synaptischen Eingänge. Als solche pharmakologische Manipulation der Mikroumgebung stellt eine leistungsfähige und einzigartige Methode, um spezifische Hypothesen über neuronalen Schaltkreis Funktion zu testen.
Hier beschreiben wir, wie Huckepack-Elektroden hergestellt werden, und wie sie während der in-vivo-Experimenten verwendet. Die Huckepack-System ermöglicht ein Ermittler ein einziges Barrel Aufzeichnungselektrode jeder beliebigen Eigenschaft (Widerstand, Spitze Größe, Form usw.) mit einer mehrgehäusigen Drogen Elektrode zu verbinden. Dies ist ein wesentlicher Vorteil gegenüber Standard-Multi-Elektroden, wobei alle Fässer mehr oder weniger ähnliche Formen und Eigenschaften. Mehrgehäusigen electrodes wurden erstmals vor über 40 Jahren 1-3, eingeführt und erfahren haben eine Reihe von Design-Verbesserungen 2,3 bis das Huckepack-Art in den 1980er Jahren 4,5 eingeführt wurde. Hier präsentieren wir eine Reihe von wichtigen Verbesserungen im Labor Produktion von Huckepack-Elektroden, die für die tiefe Hirnstimulation Eindringen ermöglichen in intakten in vivo Tierpräparaten aufgrund einer relativ dünnen Elektrode Welle, die minimale Schäden verursacht. Weiterhin werden durch diese Elektroden rauscharme Aufnahmen charakterisiert und haben niedrige Widerstand Medikament Fässer für eine sehr effektive Iontophorese der gewünschten pharmakologischen Mitteln.
Protokoll
Ziehen Sie Glaselektroden
Ziehen Sie Glaselektroden- Ziehen einläufige Elektrode. Benutzen Barrel Glaskapillare mit Filament und Pull Spitze auf einen Durchmesser von etwa 1-2 Mikrometern Wellenlänge von 10-12 mm und entsprechend Elektrodenwiderstand von etwa 12 MOhm (Bereich 5-20 MOhm), gemessen in 0,9% NaCl-Lösung. Die untere Elektrode Widerstände würden in mehr Hintergrund-Aktivität führen und damit mehr Schwierigkeiten bei der Isolierung einheitlichen Aktivität von einzelnen Neuronen. Zum Ziehen diese Elektrode, verwenden Sie entweder eine horizontale oder eine vertikale Abzieher mit entweder Heizdrähte oder Heizschlangen.
- Ziehen Sie mehrgehäusigen Elektrode. Aufgrund der viel größeren Durchmesser mehrgehäusigen Glas und die Notwendigkeit der gleichmäßigen Wärmeverteilung über den gesamten mehrgehäusigen ist ein leistungsfähiges Abzieher mit einem größeren Durchmesser Heizwendel, nicht einer Heizwendel, benötigt. Ein mehrgehäusigen Pipette muss in der Mitte der Heizfaden mit n eingefügto der Heizwendel zu kontaktieren. Beachten Sie, dass neben den 5-Zylinder Pipetten hier beschrieben, sind 3-Barrel-oder 7-Barrel Pipetten kommerziell erhältlichen Alternativen. Ziehen Glas mit einer Pipettenspitze von etwa 10 Mikrometern Gesamtdurchmesser oder weniger. Die Spitze auf den richtigen Durchmesser in dem nächsten Schritt wird zerbrochen, so dass die genaue Größe der Spitze weniger kritisch ist während des Ziehvorgangs über die gesamte Form der Elektrodenspitze, die lang und relativ dünn sollte. Siehe das Bild in 1C für die gewünschte Elektrodenspitze Form. Kurze und stubby Elektrodenformen (1B) verursacht eine beträchtliche Menge von Gewebeschäden, wenn in das Gehirn vorgeschoben, während sehr langen und dünnen Elektrodenformen (1A) sich biegen und somit wird es schwierig, die Elektrodenspitze zum richtigen brechen Durchmesser (siehe Schritt 2).
Ändern Electrode Tipps
Ändern Elektrodenspitzen. Bevor die beiden Elektroden können miteinander verklebt werden, Sie müssen modifiziert werden. Die Welle des einzelnen Elektrode muss gebogen, bevor es dem mehrgehäusigen sicherstellen, dass die kombinierte Welle der fertigen Huckepack-Elektrode ist so dünn wie möglich angebracht werden kann. Zusätzlich hat die Spitze der Elektrode mehrgehäusigen abgebrochen werden, um mit geringem Widerstand für die Iontophorese gewährleisten.- Verbiegen Welle einer einzigen Trommel-Elektrode um etwa 20 Grad. Verwendung der kleinsten Bunsenbrennerflamme möglich. Typische "kleinen" Bunsenbrenner von Standard Labornetzteil Unternehmen schaffen Flamme Größen, die viel zu groß für diese Anwendung sind. Um dieses Problem zu umgehen verwenden kleinste Bunsenbrenner und sichern eine Spritzennadel (~ 18 Gauge) an die Oberseite des Brenners, und Abdichten der Verbindung unter Verwendung Dentalzement. Wenn betrieben, sollte die Flamme schwierig zu sehen sein, etwa 5 mm oder weniger im Durchmesser und etwa 8 mm hoch. Jede Luftbewegung im Raum, dass die Flamme zu löschen, so ist es eine gute Idee, um den Brenner in Betriebgeschlossenen Raum oder Windschutz verwenden. Bewegen des einzelnen Barrel-Elektrode durch die Flamme, um es um etwa 20 Grad biegt. Darauf abzielen, die Brennerflamme Schmelzen des Glases bei den Übergangsbereich bei etwa 10 Millimeter entfernt von der Elektrodenspitze. Um zu vermeiden, Schmelzen der Spitze der Elektrode wir vor, dass die Elektrode bei etwa 45 Grad statt, Spitze nach unten und bewegen die Elektrode durch die Flamme relativ schnell.
- Brechen Sie die Spitze des mehrgehäusigen Elektrode. Um visuelle Kontrolle zu gewährleisten und gleichzeitig bricht der Elektrodenspitze, ein Mikroskop mit einem Minimum Objektiv 10x und 10x Okulare. Ein Mess-Skala im Okular eingelegt wird auch benötigt, um Düsengrößen messen. Befestigen eines Stückes aus Plexiglas mit dem Mikroskop, dass das Ende des Plexiglas in etwa ein Drittel kann zu einer Hälfte des Sichtfeldes des Mikroskops gesehen werden. In unserem Fall ist das Plexiglas Stück ca. 25 x 70 mm und 5 mm dick und die angeschlossenen über eine Schraube, die in einem benutzerdefinierten gesichert werden kannmachte Thread im Mikroskoptisch. Es ist wichtig, ein Design, das für das Bewegen Plexiglas unabhängig von dem Schlitten ermöglicht haben. Legen Sie die mehrgehäusigen Elektrode in einem Bett aus Knetmasse auf einem Glasträger, und legen Sie die Folie mit der Elektrode in der Mikroskoptisch den Diahalter. Mit dem Mikroskoptisch der xy-Manipulatoren, sanft bewegen die Elektrodenspitze gegen den Plexiglas Stück, und beobachten Sie das Brechen der Spitze durch das Mikroskop Okulare. Versuchen Sie, sauber brechen die mehrgehäusigen Geheimtipp zu einer kumulativen Durchmesser von etwa 25-35 Mikrometer. Entsorgen Pipetten mit Spitzendurchmessern, die brach zu groß ist, oder Tipps mit ungleichen Pausen. Wir verwerfen etwa 30% unserer mehrgehäusigen Elektroden aufgrund unerwünschter Spitzenformen.
Montieren Piggy-Back-Elektrode
Montieren Huckepack-Elektrode.- Position Elektroden. Entfernen Plexiglas Stück in Schritt 2,2 aus dem Mikroskop Stufe eingesetzt. Sichern abgeschlossenmehrgehäusigen Elektrode in Knetmasse auf einem Glasträger, Spitze leicht nach oben zeigt. Aufwärts zeigt steht Schritt 3.2, das Kleben der beiden Elektroden wichtig. Tipps, die nach oben zeigen bewirken, dass der Kleber zu laufen weg von der Spitze, die Vermeidung Kleben Sie die Elektroden Tipps. Legen gebogene Single Barrel Elektrode in Elektrodenhalter der maßgeschneiderten Mikromanipulator (Abbildung 2). Mit visuellen Führung und dann mikroskopische Führung, senken Sie die Single Barrel Elektrode auf der mehrgehäusigen Elektrode. Die einzelne Elektrode sollte direkt in die Nut, die durch die Anordnung der 5 Fässer gebildet wird, mit seiner Spitze hervorstehenden die Spitze des mehrgehäusigen Spitze von ca. 5-10 Mikrometer verringert werden. Beim Absenken des einzigen Lauf, genau zu beobachten, die den Winkel zwischen den beiden Elektroden gebildet ist. Für beste Ergebnisse vermeiden Winkeln in der die Spitzen weisen voneinander, sondern versucht, die einzelne Elektrode auf der Multi abzusenken perfekt parallel oder sogar mit seiner SpitzeBerühren des mehrgehäusigen ersten bildet eine sehr geringe "Keil" Anordnung. Da die einzelnen Barrel Spitze sehr flexibel ist, wird er sich verbiegen, wenn die einzelne Elektrode etwas weiter ist, nachdem die Spitze die Oberfläche des Zylinders mit mehreren Elektroden erreicht hat abgesenkt, wodurch ein sauberes zusammengesetzter Spitze, die eine kleine Menge an Federwirkung gebaut hat das hilft halten die Spitzen zusammen. Wenn jedoch der Winkel zwischen den einzelnen Lauf und mehrgehäusigen Elektrode zu steil ist (zu viel von einem Keil), wird die Federwirkung zu hoch und biegen die Elektrodenanordnung nach unten.
- Kleber Elektrode Wellen zusammen. Kleben Sie die Wellen der beiden Elektroden zusammen mit Cyanacrylat (Sekundenkleber). Setzen Sie einen kleinen Tropfen Klebstoff auf die kleine Seite eines flachen Zahnstocher und Touch-Elektroden-Einheit mit dem Leim fallen. Beginnen Sie an der Position am weitesten distal der Tipps und langsam bewegen Zahnstocher mit Leim Tropfen entlang Elektrode Wellen in Richtung der Elektrode Tipps. Mit zu viel Leim oder Auftragen von Leim too nahe den Elektrodenspitzen wird Verkleben der Elektrode Öffnungen führen, wodurch die Elektrode zumindest teilweise nicht funktionsfähig.
- Stabilisieren Gelenk mit Zahnzement. Mischen einer kleinen Menge Dentalzement und zahnmedizinischen Acrylsäure in einem kleinen Einweg-Kunststoff-Schale oder Wiegeschiffchen, mit einem flachen Zahnstocher. Warten Sie, bis Zement wird formbar und eine kleine Menge auf die Verbindung zwischen den beiden Elektroden, die gemeinsame (pink Material in Abbildung 3) zu stabilisieren. Lassen Sie etwa 15 min zu trocknen.
- Entfernen und aufbewahren Elektrode. Entfernen Sie vorsichtig das ausgefüllte Huckepack-Elektrode zunächst aus dem Mikromanipulator Halter, und dann lösen sich von der Glasplatte, und an einem staub-Container.
Bereiten Electrode Fill-Lösungen
Planen Elektrode Füllung Lösungen. Da Iontophorese erfordert geladene Moleküle haben die meisten Wirkstoffe entweder im sauren oder alkalischen Milieu (typischerweise ein gelöst werdenta pH von etwa 3-4, oder einen pH von etwa 8-10, jeweils). Eine Anzahl von Chemikalien, die oft in Iontophorese verwendet werden, sind in Tabelle 1 aufgelistet. Für Wirkstoffe, die nicht in der Tabelle aufgelistet sind, aus der pKa-Wert zu bestimmen, ob es einfacher wäre, um das Molekül in einer sauren oder einer alkalischen Umgebung bei, um das Molekül eingebracht und dementsprechend aufzulösen. Für beste Ergebnisse, mischen alle Lösungen täglich frisch.Füllen und Vorbereiten Elektroden
Füllen Sie und bereiten Elektroden. Kurz vor Verwendung der Elektrode, Back-füllen jedes Fass mit ihren jeweiligen Droge, mit Kohlefaser 28 bis 34 Gauge-Nadeln an Spritzen mit Spritze Filter. Füllen Sie die 4 äußeren Barrel der 5-Zylinder-Konfiguration mit den Mittel der Wahl, und dem Zentrum Lauf mit 3M NaCl als Ausgleich Barrel. Füllen Sie den Single Barrel Aufnahme-Elektrode mit 3M NaCl als gut. Zugeben eines Farbstoffs zu der NaCl-Lösung, wie schneller grün oder Phenolrot wird es leichter, die Elektrodenspitze s.während der Platzierung der Elektrode auf der Oberfläche des Gehirns. Legen Sie die Elektrode in den Elektrodenhalter des Aufnahme-Setup und legen Sie alle Kabel in die entsprechenden Glas-Fässern. Verwenden Sie isolierte Silberdraht von denen etwa 1 cm der Isolierung an der Spitze entfernt wurde. Es sollte 5 Leitungen für die mehrgehäusigen Elektrode (4 Droge Fässer und ein Auswuchten Barrel), plus dem Verstärker Draht, der in die Aufnahme einläufige Elektrode eingesetzt werden muss.Schalten Sie Iontophorese Pump Module
Schalten Sie Iontophorese Pumpmodule und testen Sie alle Fässer. Die Elektrode Testfunktion jeder Pumpe Modul hilft festzustellen, ob die Elektrode Barrel funktionsfähig ist. Um ein Auslaufen der Medikamente aus den Fässern zu verhindern, wenn nicht in Gebrauch ist, muss eine Haltespannung in die entgegengesetzte Polarität wie die Ladung auf Molekül angewendet werden.
Ergebnisse
In diesem Experiment wurde die Glycin-Rezeptor-Antagonisten Strychnin Hydrochlorid iontophoretisch aufgebracht. Blocking glycinergen Hemmung erhöht typischerweise Brennen in Neuronen. Abbildung 4 zeigt Beispieldaten aus einer auditiven Neuron, dessen Antworten auf sinusförmigen Ton Reize zunehmender Intensität geliefert, um das Tier die Ohren aufgenommen wurden. Diese Art von Experiment wird als des Neurons Ausstoßrate vs Intensitätsfunktion bezeichnet. Lautere Töne in höheren Spike Preise (schwarze Kurve) geführt. Die anfängliche Iontophorese Strom während diesem Experiment verwendeten betrug 15 nA. Nachdem der Strom eingeschaltet wurde und die Änderungen in der Rate Intensitätsfunktion hatte am neuen Ebene (dunkelblaue Kurve) stabilisiert wurde das Ausstoßen aktuellen schrittweise auf 30, 45 erhöht wird, und 60 nA (orange, grünen und blauen Lichts Kurven, jeweils). In jedem Fall wurden die Reaktionen des Neurons über den gleichen Bereich des Schallintensitäten nach den Veränderungen der aufgezeichneten discharge geschwindigkeitsbestimmende Intensität Funktionen in Reaktion auf die neue aktuelle Ausstoßen stabilisiert hatte. Die am besten geeignete Ausstoßen Strom in diesem Beispiel zu verwenden war 45 nA bis 60 nA weil diese Strompegel nicht mehr unterschiedlich verändern des Neurons Reaktionen. Dieses Ergebnis legt nahe, dass bei 45 nA Strom, alle Glycin-Rezeptoren des Neurons bereits von Strychnin-Hydrochlorid blockiert worden. Jede weitere Erhöhung der Auswurf aktuellen und Loslassen noch Strychnin nicht in einer weiteren Änderung des Neurons Entladungsrate-Level-Funktion führen. Nach der Fertigstellung des Protokoll wurde das Ausstoßen aktuellen ausgeschaltet. Die Erholung der neuronalen Antworten zurück zum Ausgangswert wurde nach etwa 25 min (rote Linie) erreicht. Dieser Vorgang kann je nach Art und Menge des Arzneimittels ausgestoßen wird, zwischen einigen Sekunden und einigen zehn Minuten.
| Medikament | Konzentration | pH einer Lösung | Lösungsmittel | Firma | Cat. # | Typische Retention Aktuelle | Typische Ejection Currents |
| GABA | 500 mM | 3,5-4,0 | dH 2 O | Sigma | A-2129 | -15 NA | 5 nA bis +100 nA |
| Glycine | 100 mM | 3,5-4,0 | dH 2 O | Sigma | G-7126 | -15 NA | 5 nA bis +100 nA |
| Bicucullin methiodide | 10 mM | 3,0 | 0,165 M NaCl in dH 2 O | Sigma | B-6889 | -15 NA | 5 nA bis +60 nA |
| Strychnin-Hydrochlorid | 10 mM | 3,0 | 0,165 M NaCl in dH 2 O | Sigma | S-8753 | -15 NA | 5 nA bis 80 nA |
| L-Glutaminsäure | 500 mM | 8,0 | dH 2 O | Sigma | G-1251 | 30 nA | -10 NA bis -150 nA |
| L-Asparaginsäure | 500 mM | 8,0 | dH 2 O | Sigma | A-8949 | 30 nA | -10 NA bis -150 nA |
| Kainsäure | 1 mM | 9,0 | dH 2 O | Sigma | K-0250 | 30 nA | -10nA bis -100 nA |
Tabelle 1. Häufig verwendete Medikamente, mit pH zum Auflösen und Konzentration. Die Tabelle listet die am häufigsten verwendeten synaptischen Agonisten und Antagonisten mit Iontophorese verwendet. Der pH-Umgebung aufgeführt Konten für die Notwendigkeit t polarisieren iese Agenten, und die vorgeschlagenen Konzentration Konten für die Variabilität in der Wirksamkeit zwischen verschiedenen Drogen.
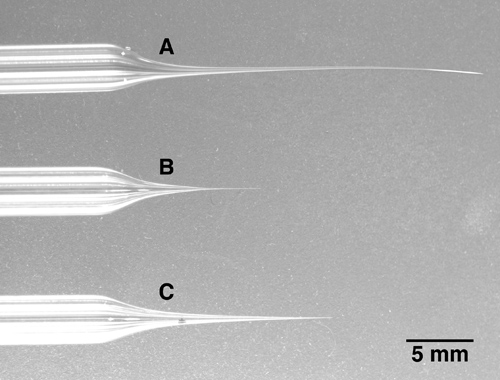
Abbildung 1. Drei mehrgehäusigen Pipetten mit unterschiedlichen Spitzenlängen A:. Die Spitze dieses 5-Zylinder-Elektrode gezogen worden zu lang und dünn. Beachten Sie, dass die Spitze gebogen und sehr weich ist. Diese Art der Spitze ist sehr schwierig, auf den gewünschten Durchmesser zu brechen. B: Die Spitze dieser Elektrode ist zu kurz und gedrungen. Wenn in tiefere Hirnarealen vorgeschoben wird diese Elektrode verursachen unnötige Hirnschäden aufgrund der Tatsache, dass die Elektrode relativ dicken nur wenige Millimeter nach dem Tip wird. C: Ein Beispiel für eine Elektrode mit einem vollständig herausgezogen Spitze. Während sie lang und dünn, ist die Spitze noch fest und kann leicht auf die gewünschte Durchmesser der Spitze gebrochen werden.
gure 2 "src =" / files/ftp_upload/4358/4358fig2.jpg "/>
Abbildung 2. Zeichnung der Elektrode Manipulator Montage. Manipulator Montage zusammen mit einem Mikroskop, um die Huckepack-Elektroden zusammenzustellen. Artikel in grau markiert sind handelsübliche Produkte und sind in Tabelle 2 aufgeführt. Artikel in blau markiert wurden benutzerdefinierte bearbeitet unsere Institution Werkstatt. Sie sind 1) 1/4 Zoll Stahlplatte bemessen 43x26 cm mit Löchern für Newport Stufe 423 in ihn entsprechend dem Lochmuster von Newport vorgesehen gebohrt, 2) eine Kippbühne die zum Kippen der Anordnung in beliebigen Winkeln ermöglicht, 3) ein Verbinder, der die Elektrodenhalter Halterungen nach oben translationale Bühne.
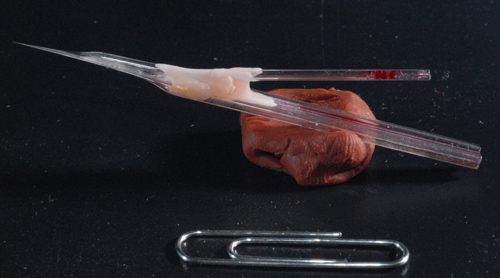
Abbildung 3. Foto von einer Probe Huckepack-Elektrode. Eine fertige 5-Zylinder-Elektrode zusammen mit einem einzigen Trommel-Aufnahme montiert electrode. Hinweis lange Welle von etwa 7mm so dass für eine Tiefenhirnstimulation Aufnahmen.
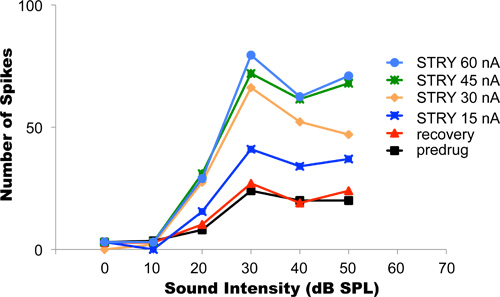
Abbildung 4. Titration des Ausstoßes Strömen. Die Grafik zeigt rate-Intensität Funktionen von einem einzigen auditorischen Neuronen aufgenommen, während das Tier die Ohren mit Tönen unterschiedlicher Intensität stimuliert wurden. Lautere Töne tendenziell höhere Feuerraten entlocken. Vor Drug Application, zeigte des Neurons Rate-intensity-Funktion die niedrigsten Spike Raten (schwarze Kurve). Progressiv höhere Ausstoß Ströme blockiert zunehmend Glycin-Rezeptoren an der Neuronen, was zu immer höheren Feuerraten. Die optimale Auswerfen Strom in diesem Neuron war 45-60 nA. Mit diesen Auswurf Ströme, wurde vollständige Blockade aller des Neurons Glycin-Rezeptoren erreicht. Nach Beendigung der experimentelle Protokoll wurde die Iontophorese beendet und das Neuron wurde erlaubterholen. Vollständige Genesung erreicht, wenn die Recovery Rate-intensity-Funktion abgestimmt die erste Pre-Drogen-Recovery-Funktion. Wiedergabe mit Genehmigung der American Physiological Society, von Klug et al, 1995.
Diskussion
Wir beschreiben ein Verfahren, das für die Manipulation eines einzelnen Neurons Mikroschaltung in vivo ermöglicht, während zur gleichen Zeit ermöglicht für die Aufzeichnung des Neurons Reaktionen während der experimentellen Manipulation. Neuronale Schaltungen werden über die iontophoretical Anwendung der synaptischen Agonisten und Antagonisten manipuliert. Der Hauptvorteil der Iontophorese Überdruck Auswerfen ist, dass Iontophorese erfordert nicht die physikalische Bewegung von Fluid von der Elektrode in Nervengewebe, und somit gibt es keine Bedenken verursachen Gewebeschädigungen durch den aufgebrachten Druck oder Fluidvolumen. Der größte Nachteil bei dieser Technik ist der Mangel an Informationen über den absoluten Wirkstoffkonzentration im Gewebe, und das Volumen des Gewebes beeinflusst. Da jedoch die Mengen von pharmakologischen Wirkstoffen mit Iontophorese ausgeworfen viel kleiner sind und viel genauer steuerbar als mit Druck Auswurf, ist die Erholung von der Zulassungsantrag in der Regel viel schneller eind viel mehr abgeschlossen. Microiontophoresis erfolgreich in einer Anzahl von neuronalen Systemen, sensorische und andere verwendet worden und ist am erfolgreichsten in Hirnarealen mit geringer oder keiner intrinsischer Verarbeitung angewendet. Der Grund dafür ist, dass einige der ausgestoßenen pharmakologischen Wirkstoff kann von der Applikationsstelle zu einem benachbarten Neuronen diffundieren und auch manipulieren die Antworteigenschaften des benachbarten Neurons.
Die getrennte Herstellung von Ein-und Mehr Barrel Elektroden ermöglicht die Kombination von Elektroden mit willkürlich und nicht verwandten Eigenschaften. Ziehen Elektrode Barrel zusammen und mit einigen für die Aufzeichnung und für einige Zwecke würde Iontophorese Elektrodenspitzen mit sehr ähnlichen Eigenschaften zu erzeugen, so daß die Elektrodenspitzen wäre entweder zu groß für einzelne Zelle Aufzeichnung oder zu klein für Medikamentenapplikation. Auch mit der Single Barrel Spitze über die mehrgehäusigen Elektrodenspitzen erweitern, indem etwa 20 Mikrometer reduziert Rauschen in den Aufnahmen eind eliminiert mögliche Störfaktoren aktuellen Effekte aus den Zurückbehaltung oder Auswerfen Ströme auf des Neurons Brennen 3.
Piggy-Back mehrgehäusigen Elektroden erste vor über 30 Jahren 4-6 beschrieben worden und wurden sehr erfolgreich neuronalen Schaltkreisen 7-18 19-29 sezieren verwendet. So kann das Verfahren per se nicht neu ist oder einzigartig. Jedoch haben die meisten Angaben Elektrode Herstellung und Verwendung in den letzten Jahren modifiziert wurde, und der Satz von Instruktionen hier beschrieben hat sich als besonders einfach und erfolgreich, und wurde nicht ausführlich an anderer Stelle in der Literatur veröffentlicht. Insbesondere ermöglicht die Biegung des Single Barrel Elektrodenspitze die letzte Spitze des Huckepack-Elektrode relativ schlank (Abb. 3) und ermöglicht so für Aufnahmen aus tiefen Kerne mit minimaler Schädigung des Gehirns, die hervorstehenden der Single Barrel Elektrode über dem mehrläufige Elektrode entfernt praktisch alle Währungent-Effekte, die häufig als Nachteil der Technik 3 wurden zitiert. Neue Details präsentiert hier wie mit der Elektrode Spitze nach oben während der Verklebung und Ruhe die einzigen Lauf in die Nut des mehrgehäusigen Elektrode wird eine hohe Erfolgsquote sicher bei der Herstellung von Huckepack-Elektroden. Die Technik ist relativ einfach und kann in der Regel von einem Anfänger innerhalb weniger Tage zu bewältigen.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Arbeit wurde durch R01 DC 011.582 (AK) und RO1 DC011555 (DJT) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Item name | Hersteller | Kommentar | Cat. # |
| Bunsenbrenner | Verfügbar ab: VWR | 17928-027 | |
| Zwei-Komponenten-Zahnzement: "Cold Heilung" Dentalmaterial | Co-oral-ite Dental Mfg Co | Verfügbar ab: AM Systems, Inc | 525000 |
| Zwei-Komponenten-Zahnzement: Denture Material Vernetzung flüssigen Verbindung | Co-oral-ite Dental Mfg Co | Verfügbar ab: AM Systems, Inc | 525000 |
| Flüssigkleber | Henkel | Verfügbar ab: Loctite Super Glue | 01-06849 |
| Micro-Iontophorese Unit: Neurophore BH-2 | Harvard Apparatus | Verfügbar ab: Harvard Apparatus | 65-0200 & 65-0203 |
| Isolierte Silberdraht | AM-Systems | Verfügbar ab: AM-Systems | 785500 |
| Horizontale puller | Zeitz DMZ-Universal Puller | Verfügbar ab: AutoMate Scientific | NA |
| Micro-Manipulator Stück: Elektrodenhalter | WPI | Verfügbar ab: WPI | M3301EH |
| Micro-Manipulator Stück: Lineartisch | Newport 423 Series | Verfügbar ab: Newport | 423 |
| Micro-Manipulator Stück: Drehtisch | Newport RSP-2 | Verfügbar ab:Newport | RSP-2 |
| Micro-Manipulator Stück: z-Übersetzung | Newport 433 Series | Verfügbar ab: Newport | 433 |
| Micro-Manipulator Stück: Winkel 90 ° bis z und xy Achse montieren | Newport 360-90 | Verfügbar ab: Newport | 360-90 |
| Micro-Manipulator Stück: x-Übersetzung / Lineartisch | Newport 423 Series | Verfügbar ab: Newport | 423 |
| Micro-Manipulator Stück: y Übersetzung / Lineartisch | Newport 423 | Verfügbar ab: Series Newport | 423 |
| Mikroskop | Leitz Laborlux 11 | ||
| Mikroskop: Ziel | Leitz Wetzlar 10x, NA 0,25 | 519760 | |
| Mikroskop: eypieces | Leitz Wetzlar, Periplan 10x/18 | 519748 | |
| Mikroskop: stage | Leitz Wetzlar | 513544 | |
| Mehrgehäusigen Kapillare | N / A | Verfügbar ab: AM-Systeme, Inc | 612000 |
| Sinlge Barrel Kapillare (GC 150F-10) | Harvard Apparatus | Verfügbar ab: Harvard Apparatus | 30-0057 |
| Vertical puller | Narishige Modell PE-2 | ||
| Custom made Elemente des Micro-Manipulator (markiert Licht blue in Abbildung 1) | |||
| Stahlplatte | |||
| Kipptische | |||
| Befestigung für Elektrodenhalter | |||
Tabelle 2. Hersteller-und Artikelnummern aller Ausrüstungen und Zubehör in dem Verfahren verwendet werden. |
Referenzen
- Curtis, D. R. A method for assembly of "parallel" micro-pipettes. Electroencephalogr. Clin. Neurophysiol. 24, 587-589 (1968).
- Carette, B. A new method of manufacturing multi-barrelled micropipettes with projecting recording barrel. Electroencephalogr. Clin. Neurophysiol. 44, 248-250 (1978).
- Crossman, A. R., Walker, R. J., Woodruff, G. N. Problems associated with iontophoretic studies in the caudate nucleus and substantia nigra. Neuropharmacology. 13, 547-552 (1974).
- Havey, D. C., Caspary, D. M. A simple technique for constructing "piggy-back" multibarrel microelectrodes. Electroencephalogr. Clin. Neurophysiol. 48, 249-251 (1980).
- Verberne, A. J., Owens, N. C., Jackman, G. P. A simple and reliable method for construction of parallel multibarrel microelectrodes. Brain Res. Bull. 36, 107-108 (1995).
- Oliver, A. P. Technical contribution. A simple rapid method for preparing parallel micropipette electrodes. Electroencephalogr. Clin. Neurophysiol. 31, 284-286 (1971).
- Oswald, J. P., Klug, A., Park, T. J. Interaural intensity difference processing in auditory midbrain neurons: effects of a transient early inhibitory input. J. Neurosci. 19, 1149-1163 (1999).
- Park, T. J., Pollak, G. D. GABA shapes a topographic organization of response latency in the mustache bat's inferior colliculus. J. Neurosci. 13, 5172-5187 (1993).
- Park, T. J., Pollak, G. D. GABA shapes sensitivity to interaural intensity disparities in the mustache bat's inferior colliculus: implications for encoding sound location. J. Neurosci. 13, 2050-2067 (1993).
- Peterson, D. C., Nataraj, K., Wenstrup, J. Glycinergic inhibition creates a form of auditory spectral integration in nuclei of the lateral lemniscus. J. Neurophysiol. 102, 1004-1016 (2009).
- Ramsey, L. C. B., Sinha, S. R., Hurley, L. M. 5-HT1A and 5-HT1B receptors differentially modulate rate and timing of auditory responses in the mouse inferior colliculus. Eur. J. Neurosci. 32, 368-379 (2010).
- Wenstrup, J. J., Leroy, S. Spectral Integration in the Inferior Colliculus: Role of Glycinergic Inhibition in Response Facilitation. J. Neurosci. 21, RC124 (2001).
- Yang, L., Pollak, G. D. Features of ipsilaterally evoked inhibition in the dorsal nucleus of the lateral lemniscus. Hear. Res. 122, 125-141 (1998).
- Yang, L., Pollak, G. D. GABA and glycine have different effects on monaural response properties in the dorsal nucleus of the lateral lemniscus of the mustache bat. J. Neurophysiol. 71, 2014-2024 (1994).
- Yang, L., Pollak, G. D. The roles of GABAergic and glycinergic inhibition on binaural processing in the dorsal nucleus of the lateral lemniscus of the mustache bat. J. Neurophysiol. 71, 1999-2013 (1994).
- Yang, L., Pollak, G. D., Resler, C. GABAergic circuits sharpen tuning curves and modify response properties in the mustache bat inferior colliculus. J. Neurophysiol. 68, 1760-1774 (1992).
- Faingold, C. L., Gehlbach, G., Caspary, D. M. On the role of GABA as an inhibitory neurotransmitter in inferior colliculus neurons: iontophoretic studies. Brain Res. 500, 302-312 (1989).
- Faingold, C. L., Hoffmann, W. E., Caspary, D. M. Effects of excitant amino acids on acoustic responses of inferior colliculus neurons. Hear. Res. 40, 127-136 (1989).
- Hurley, L., Pollak, G. D. Serotonin shifts first-spike latencies of inferior colliculus neurons. J. Neurosci. 25, 7876-7886 (2005).
- Hurley, L., Pollak, G. D. Serotonin effects on frequency tuning of inferior colliculus neurons. J. Neurophysiol. 85, 828-842 (2001).
- Hurley, L. M., Pollak, G. D. Serotonin differentially modulates responses to tones and frequency-modulated sweeps in the inferior colliculus. J. Neurosci. 19, 8071-8082 (1999).
- Klug, A., Bauer, E. E., Pollak, G. D. Multiple components of ipsilaterally evoked inhibition in the inferior colliculus. J. Neurophysiol. 82, 593-610 (1999).
- Klug, A., Park, T. J., Pollak, G. D. Glycine and GABA influence binaural processing in the inferior colliculus of the mustache bat. J. Neurophysiol. 74, 1701-1713 (1995).
- Moore, M. J., Caspary, D. M. Strychnine blocks binaural inhibition in lateral superior olivary neurons. J. Neurosci. 3, 237-242 (1983).
- Nataraj, K., Wenstrup, J. J. Roles of inhibition in creating complex auditory responses in the inferior colliculus: facilitated combination-sensitive neurons. J. Neurophysiol. 93, 3294-3312 (2005).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. J. Neurosci. 30, 12075-12083 (2010).
- Burger, R., Pollak, G. D. Reversible inactivation of the dorsal nucleus of the lateral lemniscus reveals its role in the processing of multiple sound sources in the inferior colliculus of bats. J. Neurosci. 21, 4830-4843 (2001).
- Burger, R. M., Pollak, G. D. Analysis of the role of inhibition in shaping responses to sinusoidally amplitude-modulated signals in the inferior colliculus. J. Neurophysiol. 80, 1686-1701 (1998).
- Coleman, W. L., Fischl, M. J., Weimann, S. R., Burger, R. M. GABAergic and glycinergic inhibition modulate monaural auditory response properties in the avian superior olivary nucleus. J. Neurophysiol. 105, 2405-2420 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten