Method Article
Fabrication et utilisation de ferroutage Multibarrel Électrodes pour
Dans cet article
Résumé
Iontophorèse d'agonistes et des antagonistes de neurones au cours extracellulaire In vivo Enregistrements est un moyen puissant pour manipuler des micro-environnement d'un neurone. Ces manipulations peuvent plus facilement se faire par ferroutage multibarrel électrodes. Nous décrivons ici la façon de les fabriquer et les utiliser pendant les enregistrements sonores.
Résumé
Enregistrements in vivo des neurones individuels permettent un enquêteur pour examiner les propriétés des neurones, par exemple en réponse à des stimuli sensoriels. Neurones reçoivent généralement plusieurs entrées excitatrices et inhibitrices afférents et / ou efférents qui intègrent les uns aux autres, et les propriétés finales de réponse mesurées du neurone sont entraînés par les intégrations de ces entrées de neurones. Pour étudier traitement de l'information dans les systèmes neuronaux, il est nécessaire de comprendre les différentes entrées d'un neurone ou d'un système nerveux, et les propriétés spécifiques de ces intrants. Une méthode puissante et techniquement relativement simple d'évaluer le rôle fonctionnel de certains intrants qu'un neurone donné reçoit est dynamique et réversible supprimer ou éliminer ces entrées, et de mesurer les variations de la production du neurone causés par cette manipulation. Ceci peut être accompli par pharmacologiquement modifier l'environnement immédiat du neurone avec piggy-back multibarrel électrodes. Ces électrodes sont constituées d'une électrode d'enregistrement à canon unique et une électrode de drogue multibarrel qui peut transporter jusqu'à 4 différents agonistes ou antagonistes synaptiques. Les agents pharmacologiques peut être appliqué par iontophorèse au moment souhaité lors de l'expérience, ce qui permet la livraison contrôlée dans le temps et réversible de reconfigurer les entrées synaptiques. En tant que tel, la manipulation pharmacologique du microenvironnement représente une méthode puissante et inégalée pour tester des hypothèses spécifiques sur le fonctionnement des circuits neuronaux.
Nous décrivons ici comment piggy-back électrodes sont fabriquées et comment elles sont utilisées pendant les expériences in vivo. Le système piggy-back permet à un chercheur de combiner une électrode à canon unique d'enregistrement des biens arbitraire (résistance, etc taille de la pointe forme) avec une électrode de drogue multibarrel. Ceci est un avantage majeur sur une norme multi-électrodes, où tous les canons ont plus ou moins des formes et des propriétés similaires. Multibarrel electrodes ont d'abord été introduit il ya 40 ans 1-3, et ont subi un certain nombre de 2,3 améliorations de conception ce que le type piggy-back a été introduit dans le 4,5 années 1980. Nous présentons ici un ensemble d'améliorations importantes dans la production en laboratoire de ferroutage électrodes qui permettent une pénétration profonde du cerveau dans intacts dans les préparations animales in vivo en raison d'une tige d'électrode relativement mince qui cause des dommages minimes. En outre, ces électrodes sont caractérisées par des enregistrements sonores faibles, et ont de faibles barils résistance aux médicaments pour ionophorèse très efficace des agents pharmacologiques souhaités.
Protocole
Tirez électrodes de verre
Tirez électrodes de verre- Tirer électrode seul barillet. Utilisation verre cylindre unique capillaire avec filament et retirer la pointe à un diamètre d'environ 1-2 micromètres, longueur d'arbre de 10-12 mm, et la résistance d'électrode correspondante d'environ 12 MOhm (gamme 5-20 MOhms) telle que mesurée dans une solution de NaCl 0,9%. Résistances électrode inférieure se traduirait par une plus grande activité de fond et de la difficulté à isoler donc plus l'activité unitaire des neurones individuels. Pour tirer cette électrode, utilisez horizontale ou verticale avec un extracteur de filaments de chauffage soit des serpentins de chauffage.
- Tirez électrode multibarrel. Grâce au diamètre beaucoup plus grand de verre multibarrel et la nécessité d'une répartition uniforme de la chaleur autour de la multibarrel ensemble, un extracteur puissant avec un serpentin de chauffage de plus grand diamètre, pas un filament de chauffage, est nécessaire. Une pipette multibarrel doit être inséré dans le centre du filament de chauffage avec no communiquer à la bobine de chauffage. Notez que, outre les pipettes 5-baril décrit ici, pipettes 3-7-tonneau ou fût existe des alternatives disponibles dans le commerce. Retirer le verre à une extrémité de la pipette d'environ 10 micromètres de diamètre total, ou moins. La pointe est cassée au diamètre correct dans l'étape suivante, de sorte que la taille de la seringue exacte est moins critique au cours de l'opération de traction de la forme globale de la pointe de l'électrode, qui doit être long et relativement mince. Reportez-vous à l'image de la figure 1C pour la forme de la pointe d'électrode souhaité. Formes d'électrodes courtes et trapues (figure 1B) provoquera une quantité importante de lésions des tissus lorsqu'elles sont avancées dans le cerveau, tandis que les formes d'électrodes très longues et minces (figure 1A) se plie et ainsi, il sera difficile de briser la pointe de l'électrode à la bonne diamètre (voir étape 2).
Modifier Conseils électrodes
Modifier pointes des électrodes. Avant que les deux électrodes peuvent être collées ensembleIls doivent être modifiées. La tige de l'électrode unique doit être plié avant d'être attaché à la multibarrel pour s'assurer que le combiné de l'arbre fini piggy-back électrode est aussi mince que possible. En outre, la pointe de l'électrode doit être multibarrel rompues afin d'assurer une faible résistance pour ionophorèse.- Plier l'arbre de barillet d'une électrode unique d'environ 20 degrés. Utilisation de la flamme du brûleur Bunsen plus petite possible. Typiques "petits" becs Bunsen de laboratoire standards sociétés d'approvisionnement créer des tailles de flamme qui sont bien trop grande pour cette application. Pour contourner ce problème, utilisez le brûleur Bunsen petit commerciale et d'assurer une aiguille de seringue (~ 18 gauge) sur le dessus du brûleur, et sceller la connexion en utilisant du ciment dentaire. Lorsqu'il est utilisé, la flamme devrait être difficile à voir, d'environ 5 mm de diamètre ou moins, et environ 8 mm de hauteur. Tout mouvement d'air dans la salle s'éteint la flamme, c'est donc une bonne idée pour faire fonctionner le brûleur dans unchambre fermée, ou à utiliser des boucliers de vent. Déplacer l'électrode unique canon à travers la flamme de le plier d'environ 20 degrés. Viser la flamme du brûleur de la fusion du verre dans la zone de transition à environ 10 millimètres de distance de l'extrémité de l'électrode. Pour éviter de faire fondre la pointe de l'électrode de nous suggérons que l'électrode se tiendra à environ 45 degrés, la pointe dirigée vers le bas et déplacer l'électrode à travers la flamme relativement rapidement.
- Casser la pointe de l'électrode multibarrel. Afin d'assurer un contrôle visuel tout en brisant la pointe de l'électrode, utiliser un microscope avec un objectif minimum de 10x et 10x oculaires. Une échelle de mesure inséré dans l'oculaire seront également nécessaires pour mesurer les tailles de buses. Fixer un morceau de plexiglas au microscope de telle sorte que l'extrémité de la plexiglas peut le voir sur environ un tiers à une moitié de champ de vision du microscope. Dans notre cas, la pièce de plexiglas est d'environ 25 x 70 mm et 5 mm d'épaisseur et joint par l'intermédiaire d'une vis qui peut être fixé dans une mesureles threads dans la platine du microscope. Il est important d'avoir un design qui permet de plexiglass se déplacer indépendamment de la diapositive. Placer l'électrode multibarrel dans un lit de pâte à modeler sur une lame de verre, et insérer la diapositive contenant l'électrode dans le support de diapositives étape microscope. Utilisation des manipulateurs xy le stade microscope, déplacez doucement le bout de l'électrode sur la pièce de plexiglas, et d'observer la rupture de la pointe à travers les oculaires du microscope. Tenter de briser proprement la pointe de la multibarrel à un diamètre cumulé de environ 25-35 micromètres. Jeter pipettes avec des diamètres de pointe, qui s'est détachée trop grande, ou des conseils avec des pauses inégales. Nous écartons environ 30% de nos électrodes multibarrel en raison de formes de pointe indésirables.
Assemblez Piggy-back électrode
Assemblez piggy-back de l'électrode.- Position des électrodes. Retirer la pièce de plexiglas utilisé à l'étape 2.2 de la platine du microscope. Fixez terminéemultibarrel électrode dans la pâte à modeler sur une lame de verre, pointe dirigée légèrement vers le haut. Pointant vers le haut sera important pour l'étape 3.2, le collage des deux électrodes. Conseils qui pointent jusqu'à provoquer la colle à s'enfuir de la pointe, en évitant le collage des pointes des électrodes. Insérez le baril électrode coudée unique en porte-électrode du micromanipulateur sur mesure (Figure 2). En utilisant un guidage visuel d'abord, puis d'orientation microscopique, abaisser l'électrode seul baril sur l'électrode multibarrel. L'électrode unique devrait être abaissé directement dans la rainure qui est formée par la disposition des canons 5, avec son extrémité faisant saillie de l'extrémité de la pointe multibarrel d'environ 5-10 micromètres. Lors de l'abaissement du cylindre unique, observer attentivement l'angle qui est formé entre les deux électrodes. Pour éviter les meilleurs résultats angles dans laquelle les pointes pointes en dehors de l'autre, mais plutôt tenter d'abaisser l'électrode unique sur le multi parfaitement parallèle ou même avec sa pointetoucher le multibarrel d'abord, la formation d'agencement, une très légère «écart». Depuis la pointe du cylindre unique est très flexible, il se plie lorsque l'électrode unique est descendu un peu plus loin après que la pointe a atteint la surface supérieure de l'électrode baril multiples, formant une pointe propre composite qui a une petite quantité de l'action du ressort intégré qui permet de tenir les pointes ensemble. Toutefois, si l'angle entre le canon unique et électrode multibarrel est trop raide (trop de coin), l'action du ressort sera trop élevé et plier vers le bas arrangement d'électrodes.
- Coller ensemble d'électrodes arbres. Collez les arbres des deux électrodes ainsi que l'aide de cyanoacrylate (superglue). Placer une petite goutte de colle sur le petit côté d'un cure-dent plat et assemblage d'électrodes contact avec la goutte de colle. Commencer à la position la plus distale des conseils et déplacer lentement cure-dent avec une chute de colle le long des arbres électrodes vers les pointes des électrodes. Avec de la colle trop, ou appliquer de la colle too à fermer les extrémités des électrodes se traduira par collage les ouvertures d'électrodes, ce qui rend l'électrode au moins partiellement non fonctionnel.
- Stabiliser joint avec du ciment dentaire. Mélangez une petite quantité de ciment dentaire et acrylique dentaire dans un petit plat en plastique jetable ou peser bateau, à l'aide d'un cure-dent plat. Attendez jusqu'à ce que le ciment devient malléable et appliquez une petite quantité de l'articulation entre les deux électrodes pour stabiliser l'articulation (matériau rose dans la figure 3). Prévoyez environ 15 minutes pour sécher.
- Retirez et rangez électrode. Retirez délicatement le achevée piggy-back première électrode du porte-micromanipulateur, puis détacher de la lame de verre, et conserver dans un récipient étanche à la poussière.
Préparer des solutions de remplissage pour électrodes
Préparer électrode solutions de remplissage. Depuis iontophorèse nécessite molécules chargées, la plupart des agents doivent être dissous soit dans un environnement acide ou alcalin (généralement unta pH d'environ 3-4, ou un pH d'environ 8-10, respectivement). Un certain nombre de produits chimiques qui sont souvent utilisés en ionophorèse sont énumérés dans le tableau 1. Pour les agents qui ne sont pas répertoriés dans le tableau, déterminer à partir de la valeur du pKa, que ce serait plus facile d'utiliser la molécule dans un milieu acide ou en milieu alcalin pour maintenir la molécule chargée, et se dissolvent en conséquence. Pour de meilleurs résultats, mélangez toutes les solutions frais tous les jours.Remplir et préparer des électrodes
Remplissage et préparation des électrodes. Juste avant d'utiliser l'électrode, remblais chaque baril avec son médicament concerné, à l'aide de fibre de carbone 28 - 34 aiguilles de calibre attachés à des seringues avec des filtres seringues. Remplir les 4 barils extérieures de la configuration 5-canon avec les médicaments de choix, et le canon central avec NaCl 3M comme un baril d'équilibrage. Remplir l'électrode à canon unique d'enregistrement avec NaCl 3M ainsi. Ajout d'un colorant à la solution de NaCl, comme le rouge de phénol vert ou rapide, il sera plus facile de voir la pointe de l'électrodelors de la pose de l'électrode sur la surface du cerveau. Insérer l'électrode dans le porte-électrode de la configuration de l'enregistrement et insérer les fils dans les fûts de verre appropriées. Utilisez un fil isolé d'argent, à environ 1 cm d'isolant a été retiré à la pointe. Il doit y avoir des fils 5 de l'électrode multibarrel (4 barils de médicaments et un baril d'équilibrage), ainsi que le fil de l'amplificateur qui doit être insérée dans le barillet électrode d'enregistrement unique.Allumez Modules pompe iontophorèse
Allumez modules de pompe iontophorèse et tester tous les fûts. La fonction de test d'électrode de chaque module de pompe aidera à déterminer si le canon électrode est fonctionnel. Pour empêcher la fuite des médicaments à partir des fûts lorsqu'il n'est pas utilisé, une tension de maintien de la polarité opposée à celle de la charge molécule doit être appliqué.
Résultats
Dans cette expérience, l'antagoniste du récepteur de la glycine chlorhydrate de strychnine a été appliquée par ionophorèse. Blocage de l'inhibition augmente généralement glycinergique tir dans les neurones. La figure 4 montre un exemple de données neurone auditif dont les réponses aux stimuli sonores sinusoïdales d'intensité croissante livré aux oreilles de l'animal ont été enregistrées. Ce type d'expérience est appelée fonction du neurone taux d'intensité de décharge vs. Sons plus forts entraîné une hausse des taux de spike (courbe noire). Le courant d'iontophorèse initial utilisé lors de cette expérience était de 15 nA. Après que le courant a été mis en marche et les changements dans la fonction d'intensité taux s'est stabilisé à leur nouveau niveau (courbe bleue foncée), le courant d'éjection a été progressivement porté à 30, 45 et 60 nA (orange, vert et bleu lumineux courbes, respectivement). Dans chaque cas, les réponses du neurone sur la même plage d'intensités sonores ont été enregistrés après les changements dans la discharge taux d'intensité en fonction de la réponse en cours d'éjection de nouveau se stabilise. L'éjection la plus appropriée en cours d'utilisation dans cet exemple est de 45 nA à 60 nA parce que ces niveaux de courant plus modifier différemment les réponses du neurone. Ce résultat suggère que à 45 nA de courant, tous les récepteurs de la glycine de ce neurone avait déjà été bloqué par le chlorhydrate de strychnine. Toute augmentation supplémentaire de l'éjection strychnine encore plus actuelle et la libération n'a pas abouti à un nouveau changement de décharge du neurone taux au niveau de la fonction. Après l'achèvement du protocole, le courant d'éjection a été mis hors tension. La reprise des réponses neuronales de retour à l'état initial a été atteint après environ 25 min (ligne rouge). Cela peut prendre, selon le type et la quantité de médicament éjecté, entre quelques secondes et plusieurs dizaines de minutes.
| Drogue | Concentration | pH d'une solution | Solvant | Entreprise | Cat. # | Rétention de courant typique | Courants typiques d'éjection |
| GABA | 500 mM | 3,5 à 4,0 | dH 2 O | Sigma | A-2129 | -15 NA | 5 nA nA à +100 |
| Glycine | 100 mM | 3,5 à 4,0 | dH 2 O | Sigma | G-7126 | -15 NA | 5 nA nA à +100 |
| Méthiodide bicuculline | 10 mM | 3,0 | 0,165 M de NaCl dans dH 2 O | Sigma | B-6889 | -15 NA | 5 nA nA à +60 |
| Chlorhydrate de strychnine | 10 mM | 3,0 | 0,165 M de NaCl dans dH 2 O | Sigma | S-8753 | -15 NA | 5 nA nA à +80 |
| Acide L-glutamique | 500 mM | 8.0 | dH 2 O | Sigma | G-1251 | 30 nA | -10 NA nA à -150 |
| Acide L-aspartique | 500 mM | 8.0 | dH 2 O | Sigma | A-8949 | 30 nA | -10 NA nA à -150 |
| Acide kaïnique | 1 mM | 9.0 | dH 2 O | Sigma | K-0250 | 30 nA | -10nA à -100 nA |
Tableau 1. Médicaments couramment utilisés, avec un pH de dissolution et de la concentration. Le tableau répertorie les agonistes les plus couramment utilisés synaptiques et les antagonistes utilisés avec l'iontophorèse. L'environnement pH liste des comptes de la nécessité de polariser t es agents, ainsi que les comptes de concentration suggérées pour la variabilité de l'efficacité entre les différents médicaments.
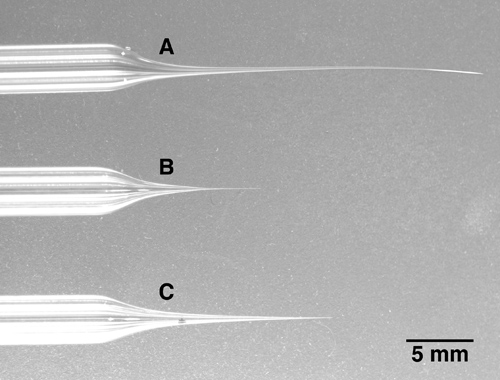
Figure 1. Trois multibarrel pipettes avec des longueurs de pointes différentes. A: La pointe de cette électrode 5-canon a été tiré trop long et mince. Notez que la pointe est tordue et très doux. Ce type de pointe est très difficile de percer au diamètre souhaité. B: La pointe de cette électrode est trop court et trapu. Lorsque avancé dans les zones les plus profondes du cerveau, cette électrode va causer des lésions cérébrales inutile en raison du fait que l'électrode devient relativement épaisse de quelques millimètres à la pointe. C: Un exemple d'une électrode avec une pointe correctement tiré. Tout en étant long et mince, la pointe est encore ferme et ne peut être rompu facilement au diamètre de la pointe souhaitée.
gure 2 "src =" / files/ftp_upload/4358/4358fig2.jpg "/>
Figure 2. L'élaboration d'ensemble manipulateur électrode. Ensemble manipulateur est utilisé avec un microscope à assembler les électrodes de ferroutage. Les champs marqués en gris sont des produits disponibles dans le commerce et qui sont énumérés dans le tableau 2. Articles marqués en bleu ont été usinés sur mesure à un atelier d'usinage de notre institution. Ils sont 1) 1/4 de pouce à plaques en acier de taille 43x26 cm avec des trous pour l'étape Newport 423 percés dans le selon le schéma de perçage fourni par Newport, 2) une étape d'inclinaison qui permet de basculement de l'ensemble des angles arbitraires, 3) une connecteur qui se monte le porte-électrode à l'étage supérieur de translation.
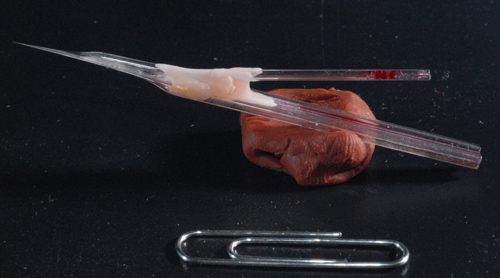
Figure 3. Photo d'un échantillon piggy-back de l'électrode. Un fini 5-baril électrode assemblés avec un enregistrement à canon unique electrode. Notez arbre long d'environ 7 mm permettant un enregistrement profondes du cerveau.
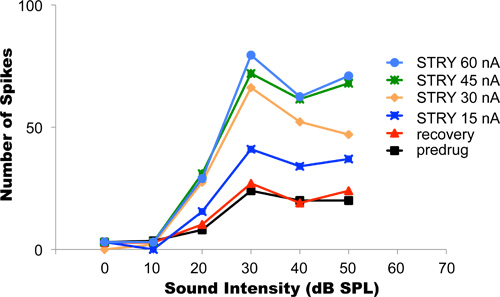
Figure 4. Titrage des courants d'éjection. Le graphique montre le taux d'intensité fonctions enregistrées à partir d'un neurone auditif unique, tout oreilles de l'animal ont été stimulées avec des tons de différentes intensités. Sons plus forts ont eu tendance à susciter des taux de combustion plus élevés. Avant l'application de drogue, le taux d'intensité du neurone fonction a montré les tarifs les plus bas spike (courbe noire). Courants d'éjection progressive des niveaux progressivement plus bloqué récepteurs de la glycine au neurone, des taux de combustion plus en plus élevés. L'éjection optimale actuelle dans ce neurone était nA 45-60. Avec ces courants d'éjection, un blocage complet de tous les récepteurs de la glycine du neurone a été atteint. Après l'achèvement du protocole expérimental, l'ionophorèse a été résilié et le neurone a été autorisé àrécupérer. Le rétablissement complet a été atteint lorsque le taux de recouvrement intensité fonction correspondait à la fonction de récupération initiale de pré-drogue. Reproduit avec la permission de l'American Physiological Society, de Klug et al, 1995.
Discussion
On décrit une technique qui permet la manipulation de micro-circuit d'un seul neurone in vivo, tout en permettant en même temps l'enregistrement de la réponse du neurone durant la manipulation expérimentale. Les circuits neuronaux sont manipulés par l'application iontophoretical des agonistes et des antagonistes synaptiques. Le principal avantage de la ionophorèse sur pression d'éjection est que iontophorèse ne nécessite pas le déplacement physique du fluide de l'électrode dans le tissu nerveux, et il n'y a donc aucun souci de causer des dommages aux tissus par la pression appliquée ou du volume de fluide. La principale limite de cette technique est le manque d'informations sur la concentration du médicament dans le tissu absolue, et le volume des tissus affectés. Toutefois, étant donné les quantités d'agents pharmacologiques éjectés avec ionophorèse sont beaucoup plus petits et beaucoup plus précisément contrôlable que par pression d'éjection, la reprise de la demande de drogue est généralement beaucoup plus rapide d'und beaucoup plus complet. Microiontophorèse a été utilisé avec succès dans un certain nombre de systèmes de neurones sensoriels, et d'autres, et il est appliqué avec succès dans la plupart des régions du cerveau avec le traitement intrinsèque faible ou nulle. La raison en est que certains de l'agent pharmacologique éjecté peut diffuser à partir du site d'application à un neurone voisin et aussi manipuler les propriétés de réponse du neurone voisin.
La fabrication séparée des électrodes uniques et multiples canon permet la combinaison d'électrodes ayant des propriétés arbitraires et non reliés. Tirer barils électrodes ensemble et avec d'autres pour l'enregistrement et certains à des fins d'ionophorèse produirait pointes des électrodes avec des propriétés très similaires, de sorte que les pointes des électrodes serait soit trop grand pour l'enregistrement unicellulaire, ou trop petit pour une demande de drogue. De plus, ayant au bout du canon unique au-delà des pointes des électrodes multibarrel d'environ 20 micromètres réduit considérablement le bruit dans les enregistrements, uned élimine de confusion possibles effets actuels à partir des courants de rétention ou d'éjection de tir du neurone 3.
Piggy-back multibarrel électrodes ont d'abord été décrite il ya 30 ans 4-6 et ont été utilisés avec succès pour disséquer les circuits neuronaux 7-18 19-29. Ainsi, la méthode en soi n'est pas nouveau ou unique. Toutefois, les détails particuliers de la préparation et de l'utilisation d'électrodes ont été modifiées au fil des ans, et l'ensemble des instructions décrites ici s'est avérée particulièrement facile et efficace, et n'a pas été publié ailleurs en détail dans la littérature. En particulier, la courbure de la pointe de l'électrode à canon unique permet à la pointe de l'électrode finale piggy-back pour être relativement mince (figure 3) et, par conséquent, permet des enregistrements de noyaux profonds avec un minimum de dommages au cerveau, la saillie du seul baril électrode sur l'électrode multi-corps élimine pratiquement toutes monnaiest effets, qui ont été souvent cité comme un inconvénient de la technique 3. De nouveaux détails ici présentée comme ayant l'extrémité d'électrode dirigée vers le haut pendant le processus de collage et de repos du cylindre unique dans la rainure de l'électrode multibarrel assurera un fort taux de réussite lors de la production de ferroutage électrodes. La technique est relativement simple et peut généralement être maîtrisé par un novice en quelques jours.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Le travail a été soutenu par R01 DC 011582 (AK) et RO1 DC011555 (DJT).
matériels
| Name | Company | Catalog Number | Comments |
| Nom de l'élément | Fabricant | Commenter | Cat. # |
| Bec Bunsen | Disponible à partir de: VWR | 17928-027 | |
| Deux composants du ciment dentaire: "Cold guérir" matériau dentaire | Co-oral-ite Dental Mfg Co | Disponible à partir de: Systèmes d'AM, Inc | 525000 |
| Deux composants du ciment dentaire: Prothèse matériau liquide composé de réticulation | Co-oral-ite Dental Mfg Co | Disponible à partir de: Systèmes d'AM, Inc | 525000 |
| La colle liquide | Henkel | Disponible à partir de: colle Loctite savoir | 01-06849 |
| Un micro-iontophorèseil: Neurophore BH-2 | Harvard Apparatus | Disponible à partir de: Harvard Apparatus | 65-0200 65-0203 & |
| Fil d'argent isolé | AM-Systems | Disponible à partir de: AM-Systems | 785500 |
| Extracteur horizontal | Zeitz DMZ-Universal Puller | Disponible à partir de: AutoMate scientifique | NA |
| Micro-manipulateur pièces: porte-électrode | WPI | Disponible à partir de: WPI | M3301EH |
| Micro-manipulateur pièces: stade linéaire | Newport 423 Series | Disponible à partir de: Newport | 423 |
| Micro-manipulateur pièces: platine de rotation | Newport RSP-2 | Disponible à partir de:Newport | RSP-2 |
| Micro-manipulateur pièces: traduction z | Newport 433 Series | Disponible à partir de: Newport | 433 |
| Micro-manipulateur pièces: équerre de 90 ° à assembler et z axe xy | Newport 360-90 | Disponible à partir de: Newport | 360-90 |
| Micro-manipulateur pièces: traduction x / linéaire stade | Newport 423 Series | Disponible à partir de: Newport | 423 |
| Micro-manipulateur pièces: traduction y / linéaire stade | Newport 423 | Disponible à partir du: Série Newport | 423 |
| Microscope | Leitz Laborlux 11 | ||
| Microscope: objectif | Leitz Wetzlar 10x, NA 0.25 | 519760 | |
| Microscope: eypieces | Leitz Wetzlar, PERIPLAN 10x/18 | 519748 | |
| Microscope: stade | Leitz Wetzlar | 513544 | |
| Multibarrel capillaire | N / A | Disponible à partir de: systèmes AM, Inc | 612000 |
| Sinlge baril capillaire (GC 150F-10) | Harvard Apparatus | Disponible à partir de: Harvard Apparatus | 30-0057 |
| Extracteur vertical | Narishige modèle PE-2 | ||
| Personnalisées éléments ou faits sur le manipulateur Micro-(b marquée lumièrelue dans la Figure 1) | |||
| plaque d'acier | |||
| fond basculant | |||
| fixation pour porte-électrode | |||
Fabricants Tableau 2. Numéros d'article et de tout l'équipement et les fournitures utilisés dans la procédure. |
Références
- Curtis, D. R. A method for assembly of "parallel" micro-pipettes. Electroencephalogr. Clin. Neurophysiol. 24, 587-589 (1968).
- Carette, B. A new method of manufacturing multi-barrelled micropipettes with projecting recording barrel. Electroencephalogr. Clin. Neurophysiol. 44, 248-250 (1978).
- Crossman, A. R., Walker, R. J., Woodruff, G. N. Problems associated with iontophoretic studies in the caudate nucleus and substantia nigra. Neuropharmacology. 13, 547-552 (1974).
- Havey, D. C., Caspary, D. M. A simple technique for constructing "piggy-back" multibarrel microelectrodes. Electroencephalogr. Clin. Neurophysiol. 48, 249-251 (1980).
- Verberne, A. J., Owens, N. C., Jackman, G. P. A simple and reliable method for construction of parallel multibarrel microelectrodes. Brain Res. Bull. 36, 107-108 (1995).
- Oliver, A. P. Technical contribution. A simple rapid method for preparing parallel micropipette electrodes. Electroencephalogr. Clin. Neurophysiol. 31, 284-286 (1971).
- Oswald, J. P., Klug, A., Park, T. J. Interaural intensity difference processing in auditory midbrain neurons: effects of a transient early inhibitory input. J. Neurosci. 19, 1149-1163 (1999).
- Park, T. J., Pollak, G. D. GABA shapes a topographic organization of response latency in the mustache bat's inferior colliculus. J. Neurosci. 13, 5172-5187 (1993).
- Park, T. J., Pollak, G. D. GABA shapes sensitivity to interaural intensity disparities in the mustache bat's inferior colliculus: implications for encoding sound location. J. Neurosci. 13, 2050-2067 (1993).
- Peterson, D. C., Nataraj, K., Wenstrup, J. Glycinergic inhibition creates a form of auditory spectral integration in nuclei of the lateral lemniscus. J. Neurophysiol. 102, 1004-1016 (2009).
- Ramsey, L. C. B., Sinha, S. R., Hurley, L. M. 5-HT1A and 5-HT1B receptors differentially modulate rate and timing of auditory responses in the mouse inferior colliculus. Eur. J. Neurosci. 32, 368-379 (2010).
- Wenstrup, J. J., Leroy, S. Spectral Integration in the Inferior Colliculus: Role of Glycinergic Inhibition in Response Facilitation. J. Neurosci. 21, RC124 (2001).
- Yang, L., Pollak, G. D. Features of ipsilaterally evoked inhibition in the dorsal nucleus of the lateral lemniscus. Hear. Res. 122, 125-141 (1998).
- Yang, L., Pollak, G. D. GABA and glycine have different effects on monaural response properties in the dorsal nucleus of the lateral lemniscus of the mustache bat. J. Neurophysiol. 71, 2014-2024 (1994).
- Yang, L., Pollak, G. D. The roles of GABAergic and glycinergic inhibition on binaural processing in the dorsal nucleus of the lateral lemniscus of the mustache bat. J. Neurophysiol. 71, 1999-2013 (1994).
- Yang, L., Pollak, G. D., Resler, C. GABAergic circuits sharpen tuning curves and modify response properties in the mustache bat inferior colliculus. J. Neurophysiol. 68, 1760-1774 (1992).
- Faingold, C. L., Gehlbach, G., Caspary, D. M. On the role of GABA as an inhibitory neurotransmitter in inferior colliculus neurons: iontophoretic studies. Brain Res. 500, 302-312 (1989).
- Faingold, C. L., Hoffmann, W. E., Caspary, D. M. Effects of excitant amino acids on acoustic responses of inferior colliculus neurons. Hear. Res. 40, 127-136 (1989).
- Hurley, L., Pollak, G. D. Serotonin shifts first-spike latencies of inferior colliculus neurons. J. Neurosci. 25, 7876-7886 (2005).
- Hurley, L., Pollak, G. D. Serotonin effects on frequency tuning of inferior colliculus neurons. J. Neurophysiol. 85, 828-842 (2001).
- Hurley, L. M., Pollak, G. D. Serotonin differentially modulates responses to tones and frequency-modulated sweeps in the inferior colliculus. J. Neurosci. 19, 8071-8082 (1999).
- Klug, A., Bauer, E. E., Pollak, G. D. Multiple components of ipsilaterally evoked inhibition in the inferior colliculus. J. Neurophysiol. 82, 593-610 (1999).
- Klug, A., Park, T. J., Pollak, G. D. Glycine and GABA influence binaural processing in the inferior colliculus of the mustache bat. J. Neurophysiol. 74, 1701-1713 (1995).
- Moore, M. J., Caspary, D. M. Strychnine blocks binaural inhibition in lateral superior olivary neurons. J. Neurosci. 3, 237-242 (1983).
- Nataraj, K., Wenstrup, J. J. Roles of inhibition in creating complex auditory responses in the inferior colliculus: facilitated combination-sensitive neurons. J. Neurophysiol. 93, 3294-3312 (2005).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. J. Neurosci. 30, 12075-12083 (2010).
- Burger, R., Pollak, G. D. Reversible inactivation of the dorsal nucleus of the lateral lemniscus reveals its role in the processing of multiple sound sources in the inferior colliculus of bats. J. Neurosci. 21, 4830-4843 (2001).
- Burger, R. M., Pollak, G. D. Analysis of the role of inhibition in shaping responses to sinusoidally amplitude-modulated signals in the inferior colliculus. J. Neurophysiol. 80, 1686-1701 (1998).
- Coleman, W. L., Fischl, M. J., Weimann, S. R., Burger, R. M. GABAergic and glycinergic inhibition modulate monaural auditory response properties in the avian superior olivary nucleus. J. Neurophysiol. 105, 2405-2420 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon