Method Article
Produzione e utilizzo di Piggy-back Multibarrel Elettrodi per
In questo articolo
Riepilogo
Ionoforesi di agonisti ed antagonisti neurali durante extracellulare In vivo Registrazioni è un potente mezzo per manipolare microambiente di un neurone. Queste manipolazioni possono più facilmente essere fatta tramite piggy-back multibarrel elettrodi. Qui si descrive come la loro fabbricazione e utilizzarli durante le registrazioni uditive.
Abstract
Nelle registrazioni di singoli neuroni in vivo permette un investigatore per esaminare le proprietà dei neuroni, per esempio in risposta a stimoli sensoriali. I neuroni in genere ricevono più ingressi eccitatori e inibitori afferenti e / o efferenti che si integrano tra di loro, e le proprietà finali di risposta misurati del neurone sono guidati dalle integrazioni neurali di questi ingressi. Per studiare l'elaborazione delle informazioni in sistemi neuronali, è necessario comprendere i vari ingressi di un neurone o sistema neurale, e le proprietà specifiche di tali ingressi. Un metodo efficace e tecnicamente relativamente semplice per valutare il ruolo funzionale di taluni fattori che un neurone dato sta ricevendo è quello di sopprimere in modo dinamico e reversibile o eliminare questi ingressi, e misurare le variazioni della produzione del neurone causati da questa manipolazione. Ciò può essere ottenuto alterando farmacologicamente ambiente circostante del neurone con piggy-back multibarrel elettrodi. Questi elettrodi sono costituiti da un singolo elettrodo di registrazione canna e un elettrodo multibarrel farmaco che può trasportare fino a quattro diversi agonisti o antagonisti sinaptici. Gli agenti farmacologici possono essere applicati iontophoretically momenti desiderati durante l'esperimento, consentendo temporizzata consegna e riconfigurazione reversibile di ingressi sinaptici. In quanto tale, la manipolazione farmacologica del microambiente rappresenta un metodo efficace e senza precedenti per testare specifiche ipotesi sulla funzione del circuito neurale.
Qui si descrive come piggy-back elettrodi sono realizzati, e in che modo vengono utilizzati durante gli esperimenti in vivo. Il piggy-back sistema consente un investigatore di combinare un singolo elettrodo di registrazione barile di qualsiasi proprietà arbitraria (resistenza, dimensioni della punta, ecc forma) con un elettrodo di droga multibarrel. Questo è un grande vantaggio rispetto ai normali multi-elettrodi, in cui tutte le canne hanno più o meno le forme e proprietà simili. Multibarrel electrodes sono stati introdotti più di 40 anni fa 1-3, e sono stati sottoposti a una serie di miglioramenti di progettazione 2,3 fino a quando il tipo piggy-back è stato introdotto nel 1980 4,5. Qui vi presentiamo una serie di importanti miglioramenti nella produzione laboratorio di piggy-back elettrodi che permettono la penetrazione cerebrale profonda in intatto in preparati animali in vivo a causa di un albero elettrodo relativamente sottile che provoca un danno minimo. Inoltre questi elettrodi sono caratterizzati da registrazioni a basso rumore, e hanno bassa resistenza ai farmaci botti per ionoforesi molto efficace di agenti farmacologici desiderati.
Protocollo
Tirare elettrodi di vetro
Tirare elettrodi di vetro- Tirare singolo elettrodo barile. Usa vetro singolo barile capillare con filamento e tirare punta ad un diametro di circa 1-2 micrometri, lunghezza albero di 10-12 mm, e la resistenza corrispondente elettrodo di circa 12 MOhm (range 5-20 MOhm), misurato in 0,9% di soluzione di NaCl. Resistenze elettrodo inferiore si tradurrebbe in attività di fondo più e quindi più difficoltà ad isolare l'attività unitaria di singoli neuroni. Per tirare questo elettrodo, utilizzare un estrattore orizzontale o verticale, sia con filamenti di riscaldamento o serpentine di riscaldamento.
- Tirare elettrodo multibarrel. Causa del diametro molto più grande di vetro multibarrel e la necessità di una distribuzione uniforme del calore attorno al multibarrel intero, un estrattore potente con una bobina di diametro maggiore riscaldamento, non un filamento di riscaldamento, è necessario. Una pipetta multibarrel deve essere inserito nel centro del filamento riscaldante con no contattare per la batteria di riscaldamento. Si noti che oltre alle 5 canna pipette qui descritto, a 3 o 7-barile barile pipette sono alternative disponibili in commercio. Tirare vetro per un puntale di circa 10 micrometri di diametro totale, o meno. La punta sarà rotto al giusto diametro nel passaggio successivo, quindi la dimensione esatta punta è meno critico durante il processo d'estrazione che la forma complessiva della punta dell'elettrodo, che dovrebbe essere lunga e relativamente sottile. Vedere l'immagine in figura 1C per la forma desiderata punta dell'elettrodo. Forme elettrodo corto e tozzo (Figura 1B) causerà una notevole quantità di danno tissutale quando avanzare nel cervello, mentre le forme di elettrodi molto lunghi e sottili (Figura 1A) si piega e quindi renderà difficile rompere la punta dell'elettrodo per la corretta diametro (vedi punto 2).
Modifica punte degli elettrodi
Modifica punte degli elettrodi. Prima che i due elettrodi possono essere incollati, Devono essere modificati. L'albero del singolo elettrodo deve essere piegata prima di essere attaccato al multibarrel per assicurarsi che l'albero combinato del finito piggy-back elettrodo è il più sottile possibile. Inoltre, la punta dell'elettrodo multibarrel deve essere interrotto per garantire bassa resistenza per ionoforesi.- Piegare albero di un elettrodo canna singola di circa 20 gradi. Utilizzare più piccolo possibile, la fiamma del bruciatore Bunsen. Tipici "piccoli" becchi Bunsen da società di fornitura standard di laboratorio creano dei formati di fiamma che sono di gran lunga troppo grande per questa applicazione. Per aggirare questo problema utilizzare il più piccolo bruciatore commerciale Bunsen e fissare un ago di siringa (~ 18 gauge) alla parte superiore del bruciatore, e sigillare la connessione con cemento dentale. Se utilizzato, la fiamma dovrebbe essere difficile da vedere, circa 5 mm o meno di diametro, e circa 8 mm di altezza. Qualsiasi movimento dell'aria nel locale si spegne la fiamma, quindi è una buona idea per azionare il bruciatore in unambiente chiuso, o di utilizzare scudi vento. Spostare l'elettrodo singolo canna attraverso la fiamma piegare di circa 20 gradi. Mirano ad avere la fiamma del bruciatore fondere il vetro nella zona di transizione a circa 10 millimetri di distanza dalla punta dell'elettrodo. Per evitare di fondere la punta dell'elettrodo suggeriamo che l'elettrodo si terrà a circa 45 gradi, punta rivolta verso il basso, e spostare l'elettrodo attraverso la fiamma in modo relativamente rapido.
- Rompere la punta dell'elettrodo multibarrel. Per garantire un controllo visivo, mentre rompere la punta dell'elettrodo, utilizzare un microscopio con un obiettivo minimo di 10x e oculari 10x. Una scala di misura inserito nel oculare saranno necessarie anche per misurare dimensioni di ugello. Attaccare un pezzo di plexiglass al microscopio tale che l'estremità del plexiglass può essere visto in circa un terzo a metà del campo di vista del microscopio. Nel nostro caso, il pezzo plexiglass è di circa 25 x 70 mm e spessore 5 mm e collegato tramite una vite che può essere fissato in un personalizzatoresi thread nella fase microscopio. È importante avere un design che permette l'plexiglass movimento indipendente della slitta. Posizionare l'elettrodo multibarrel in un letto di argilla da modellare su un vetrino, e inserire la diapositiva contenente l'elettrodo nel supporto diapositive palco microscopio. Utilizzando manipolatori xy la fase microscopio, spostare delicatamente la punta dell'elettrodo contro il pezzo in plexiglass, e osservare la rottura della punta attraverso gli oculari del microscopio. Tentativo di rompere in modo pulito la punta del multibarrel per un diametro complessivo di circa 25-35 micrometri. Scartare pipette con diametro punta che si è staccato troppo grande, o punte con interruzioni irregolari. Noi eliminare circa il 30% dei nostri elettrodi multibarrel a causa di forme punta indesiderati.
Montare Piggy-back Elettrodo
Montare piggy-back elettrodo.- Elettrodi di posizione. Togliere il cilindro di plexiglass utilizzato nel passaggio 2.2 dal palco microscopio. Fissare completatomultibarrel elettrodo nella plastilina su un vetrino, punta rivolta leggermente verso l'alto. Rivolta verso l'alto sarà importante per passo 3,2, l'incollaggio dei due elettrodi. Suggerimenti che puntano a causare la colla di fuggire dalla punta, evitando incollaggio delle punte degli elettrodi. Inserire elettrodo canna singola piegato in porta elettrodo del micromanipolatore misura (Figura 2). Utilizzo di guida visiva e poi la guida microscopica, abbassare l'elettrodo singolo barile sull'elettrodo multibarrel. Il singolo elettrodo deve essere abbassata direttamente nella scanalatura che è formata dalla disposizione delle canne 5, con la punta sporgente della punta della punta multibarrel di circa 5-10 micrometri. Quando si abbassa la canna singola, osservare attentamente l'angolo che si forma tra i due elettrodi. Per i migliori risultati evitare angoli in cui le punte puntano l'uno dall'altro, ma piuttosto il tentativo di abbassare il singolo elettrodo sulla multiplo perfettamente parallelo o anche con la sua puntatoccare il multibarrel primo formando disposizione un 'cuneo' MOLTO leggera. Poiché la punta canna singola è molto flessibile, si piega quando il singolo elettrodo si abbassa un po 'più dopo che la punta ha raggiunto la superficie superiore dell'elettrodo canna multi, formando una punta pulita composito che ha una piccola quantità di molla costruita in che aiuta a tenere le punte insieme. Tuttavia, se l'angolo tra canna singola e multibarrel elettrodo è troppo ripido (troppo di un cuneo), l'azione della molla sarà troppo alto e piegare verso il basso elettrodi disposizione.
- Alberi elettrodi Colla insieme. Incollare gli alberi dei due elettrodi insieme con cianoacrilato (colla). Mettere una goccia di colla sul lato piccolo di uno stuzzicadenti piatto e elettrodo assemblaggio contatto con la goccia di colla. Iniziare dalla posizione più distale delle punte e spostare lentamente stuzzicadenti con una caduta di colla lungo alberi elettrodi verso le punte degli elettrodi. Usando la colla troppo, o l'applicazione di colla too vicino alle punte degli elettrodi comporta incollaggio aperture elettrodi, rendendo l'elettrodo almeno parzialmente non funzionale.
- Stabilizzare congiunta con il cemento dentale. Miscelare una piccola quantità di cemento dentale e acrilico dentale in un piccolo piatto di plastica usa e getta o di peso in barca, con uno stuzzicadenti piatto. Attendere fino cemento diventa modellabile e applicare una piccola quantità al giunto tra i due elettrodi per stabilizzare l'articolazione (materiale rosa in Figura 3). Attendere circa 15 minuti ad asciugare.
- Rimuovere e conservare elettrodo. Rimuovere con cautela il termine piggy-back primo elettrodo dal supporto micromanipolatore, e quindi staccare dal vetrino, e conservare in un contenitore a prova di polvere.
Preparare le soluzioni di riempimento elettrodi
Preparare soluzioni di riempimento dell'elettrodo. Poiché ionoforesi richiede molecole cariche, la maggior parte agenti devono essere disciolto o in un ambiente acido o alcalino (tipicamente unta di circa pH 3-4, o un pH di circa 8-10, rispettivamente). Un certo numero di sostanze chimiche che vengono spesso utilizzati in ionoforesi sono elencati nella Tabella 1. Per gli agenti che non sono elencati nella tabella, determinare dal valore pKa, se sia più facile da usare la molecola in un acido o un ambiente alcalino per mantenere la molecola carica, e sciogliere conseguenza. Per ottenere i migliori risultati, mescolare tutte le soluzioni fresco tutti i giorni.Riempire e preparazione Elettrodi
Riempire e preparare elettrodi. Appena prima di usare l'elettrodo, back-riempire ogni botte con la sua rispettiva droga, utilizzando fibra di carbonio 28-34 aghi attaccato ad siringhe con filtri per siringa. Riempire le 4 canne esterne del 5 canna configurazione con i farmaci di scelta, e il barile centro con 3M NaCl come un barile di bilanciamento. Riempire il singolo elettrodo di registrazione botte con 3M NaCl pure. Aggiunta di un colorante per la soluzione di NaCl, come veloce verde o rosso fenolo renderà più facile vedere la punta dell'elettrododurante il posizionamento degli elettrodi sulla superficie del cervello. Inserire l'elettrodo nel portaelettrodo della configurazione della registrazione e inserire tutti i fili nelle botti di vetro appropriati. Utilizzare isolato filo d'argento, da cui circa 1 cm di isolamento è stato rimosso alla punta. Ci dovrebbero essere 5 fili per l'elettrodo multibarrel (4 barili droga e un barile di bilanciamento), più il filo amplificatore che deve essere inserito nel singolo elettrodo canna registrazione.Attivare moduli pompa Ionoforesi
Attivare moduli pompa ionoforesi e testare tutti i barili. La funzione di test elettrodo di ciascun modulo pompa sarà possibile stabilire se la canna elettrodo è funzionale. Per evitare perdite dei farmaci dalle canne quando non in uso, una tensione di ritenzione nella polarità opposta alla carica molecola deve essere applicato.
Risultati
In questo esperimento, il cloridrato di glicina recettore antagonista stricnina è stata iontophoretically applicata. Blocco inibizione glycinergic in genere aumenta la cottura nei neuroni. Figura 4 mostra i dati di esempio da un neurone uditivo cui risposte a stimoli sonori sinusoidali di intensità crescente consegnato alle orecchie dell'animale sono stati registrati. Questo tipo di esperimento è denominato neurone funzione rate a scarica vs. Suoni più forti, ha determinato un aumento dei tassi di spike (curva nera). L'attuale ionoforesi iniziale usato in questo esperimento era di 15 nA. Dopo che la corrente è stata accesa e le variazioni nella funzione dell'intensità tasso era stabilizzato al loro nuovo livello (curva blu scuro), la corrente di espulsione è stata progressivamente aumentata a 30, 45, e 60 nA (arancione, verde, blu e curve di luce, rispettivamente). In ogni caso, le risposte del neurone nello stesso intervallo di intensità acustica sono stati registrati dopo i cambiamenti nel dischaRGE tasso intensità funzioni in risposta alla corrente di eiezione nuova era stabilizzato. L'espulsione più appropriato corrente per utilizzare in questo esempio era di 45 nA a 60 nA perché questi livelli di corrente non alterare in modo diverso le risposte del neurone. Questo risultato suggerisce che a 45 nA di corrente, tutti i recettori della glicina del neurone che era già stato bloccato da stricnina cloridrato. Qualsiasi ulteriore aumento della stricnina espulsione corrente e rilasciando ancora più non ha dato luogo ad un ulteriore cambiamento del neurone tasso di scarico a livello di funzione. Dopo il completamento del protocollo, la corrente di espulsione è stato spento. Il recupero delle risposte neurali torna al basale è stato raggiunto dopo circa 25 min (linea rossa). Questo potrebbe richiedere, a seconda del tipo e della quantità di farmaco espulso, tra alcuni secondi e diverse decine di minuti.
| Droga | Concentrazione | pH di una soluzione | Solvente | Azienda | Cat. # | Ritenzione tipica corrente | Correnti di espulsione tipici |
| GABA | 500 mM | 3,5-4,0 | dH 2 O | Sigma | A-2129 | -15 NA | 5 nA a +100 nA |
| Glycine | 100 mM | 3,5-4,0 | dH 2 O | Sigma | G-7126 | -15 NA | 5 nA a +100 nA |
| Bicucullina Methiodide | 10 mM | 3,0 | 0,165 M NaCl in dH 2 O | Sigma | B-6889 | -15 NA | 5 nA a 60 nA |
| Strychnine cloridrato | 10 mM | 3,0 | 0,165 M NaCl in dH 2 O | Sigma | S-8753 | -15 NA | 5 nA a +80 nA |
| Acido L-glutammico | 500 mM | 8.0 | dH 2 O | Sigma | G-1251 | 30 nA | -10 A -150 nA nA |
| L-aspartico | 500 mM | 8.0 | dH 2 O | Sigma | A-8949 | 30 nA | -10 A -150 nA nA |
| Acid cainico | 1 mM | 9.0 | dH 2 O | Sigma | K-0250 | 30 nA | -10nA a -100 nA |
Tabella 1. Farmaci comunemente usati, con pH per la dissoluzione e la concentrazione. La tabella elenca i più comunemente utilizzati agonisti ed antagonisti dei recettori sinaptici utilizzati con ionoforesi. L'ambiente di pH indicato conti per la necessità di polarizzare t ueste agenti, e nei conti di concentrazione proposti per la variabilità di efficacia tra diversi farmaci.
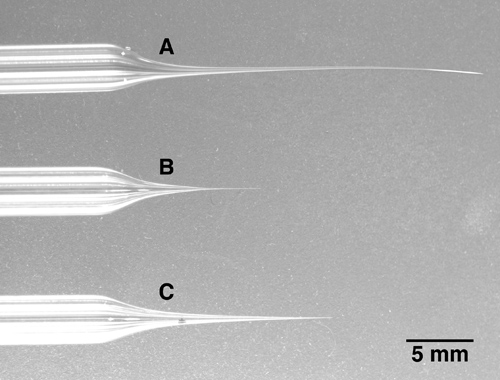
Figura 1. Tre multibarrel pipette con diverse lunghezze di punta A:. La punta di questo hotel a 5-barrel elettrodo è stato tirato troppo a lungo e sottile. Si noti che la punta è piegato e molto morbido. Questo tipo di punta è molto difficile rompere al diametro desiderato. B: La punta di questo elettrodo è troppo corto e tozzo. Quando avanzare in aree cerebrali profonde, questo elettrodo causerà inutili danni cerebrali a causa del fatto che l'elettrodo diventa relativamente spessa pochi millimetri dopo la punta. C: Un esempio di un elettrodo a punta correttamente tirato. Pur essendo lunga e sottile, la punta è ancora fermo e può essere rotto facilmente al diametro della punta desiderata.
gura 2 "src =" / files/ftp_upload/4358/4358fig2.jpg "/>
Figura 2. Disegno di gruppo di elettrodi manipolatore. L'assemblea manipolatore viene utilizzato insieme con un microscopio per assemblare i piggy-back elettrodi. Elementi contrassegnati in grigio sono prodotti disponibili in commercio e sono elencati nella Tabella 2. Gli elementi contrassegnati in blu sono stati lavorati su misura in officina della nostra Istituzione. Essi sono: 1) 1/4 di pollice a piastre in acciaio di dimensioni 43x26 centimetri con fori per la fase Newport 423 forato in esso secondo lo schema dei fori fornito da Newport, 2) una fase di inclinazione che permette di inclinazione del gruppo ad angoli arbitrari, 3) un connettore che monta il porta elettrodo alla fase superiore traslazionale.
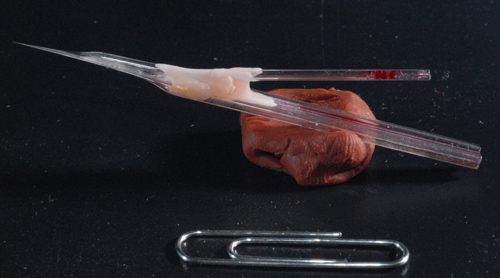
Figura 3. Foto di un elettrodo campione piggy-back. Un finito 5 barile elettrodo assemblato insieme ad una registrazione el singolo barileectrode. Nota albero lungo di circa 7 mm consentendo un registrazioni cerebrali profonde.
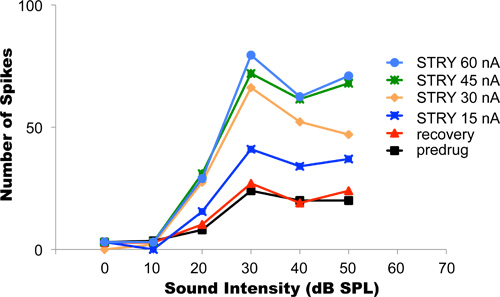
Figura 4. Titolazione delle correnti di espulsione. Il grafico mostra il tasso di intensità funzioni registrate da un neurone uditivo singolo mentre le orecchie dell'animale sono state stimolate con toni di varia intensità. Suoni più forti, tendeva ad indurre tassi più elevati di cottura. Prima dell'applicazione della droga, del neurone tasso di intensità funzione ha le tariffe più basse spike (curva nera). Correnti di espulsione progressivamente più elevati bloccati progressivamente più recettori glicina al neurone, con conseguente tasso di cottura progressivamente più elevati. L'espulsione ottimale corrente in questo neurone era 45-60 nA. Con queste correnti di espulsione, il blocco completo di tutti i recettori della glicina del neurone è stato raggiunto. Dopo il completamento del protocollo sperimentale, la ionoforesi è stato chiuso e il neurone è stato permesso direcuperare. Il recupero completo è stato raggiunto quando il tasso di intensità funzione di recupero abbinato il primo pre-farmaco funzione di recupero. Riprodotto, con il permesso della American Physiological Society, da Klug et al, 1995.
Discussione
Descriviamo una tecnica che permette la manipolazione di un microcircuito singolo neurone in vivo, mentre allo stesso tempo permette la registrazione delle risposte del neurone durante la manipolazione sperimentale. Circuiti neurali sono manipolati attraverso l'applicazione iontophoretical di agonisti e antagonisti sinaptici. Il vantaggio principale di ionoforesi oltre espulsione pressione è che ionoforesi non richiede il movimento fisico del fluido da elettrodo nel tessuto neurale, e quindi non vi è alcuna preoccupazione di causare danni tramite la pressione applicata o volume di fluido. Il limite principale di questa tecnica è la mancanza di informazioni sulla concentrazione del farmaco assoluta nel tessuto, e il volume del tessuto affetto. Tuttavia, poiché le quantità di agenti farmacologici espulse con ionoforesi sono molto più piccole e più precisamente con espulsione controllabile di pressione, il recupero dall'applicazione farmaco è in genere molto più veloce di und molto più completo. Microiontophoresis è stato utilizzato con successo in un certo numero di sistemi neuronali sensoriali, e altri, e viene applicato con successo in più aree cerebrali con poca o nessuna elaborazione intrinseca. La ragione è che alcuni dell'agente espulso farmacologico può diffondere dal sito di applicazione ad un neurone adiacente e manipolare le proprietà di risposta del neurone adiacente.
La produzione separata di elettrodi canna singola e multi consente la combinazione di elettrodi con proprietà arbitrarie e non correlati. Tirando botti elettrodi insieme e utilizzando alcuni per la registrazione e alcuni scopi ionoforesi produrrebbe punte degli elettrodi con proprietà molto simili, in modo tale che le punte degli elettrodi o sarebbe troppo grande per la registrazione singola cella, o troppo piccolo per applicazione droga. Inoltre, avere la punta della canna singola si estendono oltre le punte degli elettrodi multibarrel di circa 20 micrometri riduce notevolmente il rumore nelle registrazioni, und elimina possibili effetti confondenti di corrente dalle correnti di conservazione o di espulsione sulla cottura del neurone 3.
Piggy-back multibarrel elettrodi sono state preventivamente descritte più di 30 anni fa, 4-6 e sono stati utilizzati con successo per analizzare circuiti neurali 7-18 19-29. Pertanto, il metodo di per sé non è nuovo o unico. Tuttavia, i particolari di preparazione e uso di elettrodo sono stati modificati nel corso degli anni, e l'insieme delle istruzioni descritte qui ha dimostrato di essere particolarmente semplice e di successo, e non è stato pubblicato in dettaglio altrove nella letteratura. In particolare, la flessione della punta unico elettrodo canna consente la punta finale del piggy-back elettrodo relativamente sottile (Figura 3) e, quindi, permette di registrazioni da nuclei profondi con minimo danno al cervello, la sporgenza della canna singola elettrodo sopra il multi-elettrodo canna elimina virtualmente tutti valuteeffetti t, che sono stati spesso indicati come svantaggio della tecnica 3. Nuovi dettagli qui presentata come avente la punta dell'elettrodo rivolta verso l'alto durante il processo di incollaggio e di riposo della canna singola nella scanalatura dell'elettrodo multibarrel garantirà un alto tasso di successo nella produzione piggy-back elettrodi. La tecnica è relativamente semplice e in genere può essere masterizzato da un novizio nel giro di pochi giorni.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Il lavoro è stato sostenuto da R01 DC 011582 (AK) e RO1 DC011555 (DJT).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome della voce | Fabbricante | Commento | Cat. # |
| Becco Bunsen | Disponibile a partire dal: VWR | 17928-027 | |
| Bicomponente cemento dentale: "Cold cura" materiale dentale | Co-orale-ite Dental Mfg. Co | Disponibile a partire dal: Sistemi AM, Inc | 525000 |
| Due componenti del cemento dentale: protesi materiale liquido composto di reticolazione | Co-orale-ite Dental Mfg. Co | Disponibile a partire dal: Sistemi AM, Inc | 525000 |
| Colla liquida | Henkel | Disponibile a partire dal: Loctite Super Glue | 01-06849 |
| Micro-Ionoforesi Unesso: Neurophore BH-2 | Harvard Apparatus | Disponibile a partire dal: Harvard Apparatus | 65-0200 e 65-0203 |
| Argento filo isolato | AM-Systems | Disponibile da: AM-Systems | 785500 |
| Estrattore orizzontale | Zeitz DMZ-Universal Puller | Disponibile a partire dal: AutoMate Scientific | NA |
| Micro-manipolatore pezzi: porta elettrodo | WPI | Disponibile a partire dal: WPI | M3301EH |
| Micro-manipolatore pezzi: fase lineare | Newport 423 Series | Disponibile a partire dal: Newport | 423 |
| Micro-manipolatore pezzi: rotazione fase | Newport RSP-2 | Disponibile a partire dal:Newport | RSP-2 |
| Micro-manipolatore pezzi: traduzione z | Newport 433 Series | Disponibile a partire dal: Newport | 433 |
| Micro-manipolatore pezzi: parentesi angolare di 90 ° da montare xy z e l'asse | Newport 360-90 | Disponibile a partire dal: Newport | 360-90 |
| Micro-manipolatore pezzi: traduzione x / lineare fase | Newport 423 Series | Disponibile a partire dal: Newport | 423 |
| Micro-manipolatore pezzi: traduzione y / lineare fase | Newport 423 | Disponibile a partire dal: Serie Newport | 423 |
| Microscopio | Leitz Laborlux 11 | ||
| Microscopio: obiettivo | Leitz Wetzlar 10x, NA 0,25 | 519760 | |
| Microscopio: eypieces | Leitz Wetzlar, Periplan 10x/18 | 519748 | |
| Microscopio: stage | Leitz Wetzlar | 513544 | |
| Multibarrel capillare | N / A | Disponibile a partire dal: sistemi AM, Inc | 612000 |
| Sinlge barile capillare (GC 150F-10) | Harvard Apparatus | Disponibile a partire dal: Harvard Apparatus | 30-0057 |
| Estrattore verticale | Narishige modello PE-2 | ||
| Elementi realizzati su misura del micro-manipolatore (contrassegnato luce blue in Figura 1) | |||
| lamiera di acciaio | |||
| base orientabile | |||
| attacco per portaelettrodo | |||
Produttori Tabella 2. E numeri articolo di tutte le attrezzature e materiali di consumo utilizzati nella procedura. |
Riferimenti
- Curtis, D. R. A method for assembly of "parallel" micro-pipettes. Electroencephalogr. Clin. Neurophysiol. 24, 587-589 (1968).
- Carette, B. A new method of manufacturing multi-barrelled micropipettes with projecting recording barrel. Electroencephalogr. Clin. Neurophysiol. 44, 248-250 (1978).
- Crossman, A. R., Walker, R. J., Woodruff, G. N. Problems associated with iontophoretic studies in the caudate nucleus and substantia nigra. Neuropharmacology. 13, 547-552 (1974).
- Havey, D. C., Caspary, D. M. A simple technique for constructing "piggy-back" multibarrel microelectrodes. Electroencephalogr. Clin. Neurophysiol. 48, 249-251 (1980).
- Verberne, A. J., Owens, N. C., Jackman, G. P. A simple and reliable method for construction of parallel multibarrel microelectrodes. Brain Res. Bull. 36, 107-108 (1995).
- Oliver, A. P. Technical contribution. A simple rapid method for preparing parallel micropipette electrodes. Electroencephalogr. Clin. Neurophysiol. 31, 284-286 (1971).
- Oswald, J. P., Klug, A., Park, T. J. Interaural intensity difference processing in auditory midbrain neurons: effects of a transient early inhibitory input. J. Neurosci. 19, 1149-1163 (1999).
- Park, T. J., Pollak, G. D. GABA shapes a topographic organization of response latency in the mustache bat's inferior colliculus. J. Neurosci. 13, 5172-5187 (1993).
- Park, T. J., Pollak, G. D. GABA shapes sensitivity to interaural intensity disparities in the mustache bat's inferior colliculus: implications for encoding sound location. J. Neurosci. 13, 2050-2067 (1993).
- Peterson, D. C., Nataraj, K., Wenstrup, J. Glycinergic inhibition creates a form of auditory spectral integration in nuclei of the lateral lemniscus. J. Neurophysiol. 102, 1004-1016 (2009).
- Ramsey, L. C. B., Sinha, S. R., Hurley, L. M. 5-HT1A and 5-HT1B receptors differentially modulate rate and timing of auditory responses in the mouse inferior colliculus. Eur. J. Neurosci. 32, 368-379 (2010).
- Wenstrup, J. J., Leroy, S. Spectral Integration in the Inferior Colliculus: Role of Glycinergic Inhibition in Response Facilitation. J. Neurosci. 21, RC124 (2001).
- Yang, L., Pollak, G. D. Features of ipsilaterally evoked inhibition in the dorsal nucleus of the lateral lemniscus. Hear. Res. 122, 125-141 (1998).
- Yang, L., Pollak, G. D. GABA and glycine have different effects on monaural response properties in the dorsal nucleus of the lateral lemniscus of the mustache bat. J. Neurophysiol. 71, 2014-2024 (1994).
- Yang, L., Pollak, G. D. The roles of GABAergic and glycinergic inhibition on binaural processing in the dorsal nucleus of the lateral lemniscus of the mustache bat. J. Neurophysiol. 71, 1999-2013 (1994).
- Yang, L., Pollak, G. D., Resler, C. GABAergic circuits sharpen tuning curves and modify response properties in the mustache bat inferior colliculus. J. Neurophysiol. 68, 1760-1774 (1992).
- Faingold, C. L., Gehlbach, G., Caspary, D. M. On the role of GABA as an inhibitory neurotransmitter in inferior colliculus neurons: iontophoretic studies. Brain Res. 500, 302-312 (1989).
- Faingold, C. L., Hoffmann, W. E., Caspary, D. M. Effects of excitant amino acids on acoustic responses of inferior colliculus neurons. Hear. Res. 40, 127-136 (1989).
- Hurley, L., Pollak, G. D. Serotonin shifts first-spike latencies of inferior colliculus neurons. J. Neurosci. 25, 7876-7886 (2005).
- Hurley, L., Pollak, G. D. Serotonin effects on frequency tuning of inferior colliculus neurons. J. Neurophysiol. 85, 828-842 (2001).
- Hurley, L. M., Pollak, G. D. Serotonin differentially modulates responses to tones and frequency-modulated sweeps in the inferior colliculus. J. Neurosci. 19, 8071-8082 (1999).
- Klug, A., Bauer, E. E., Pollak, G. D. Multiple components of ipsilaterally evoked inhibition in the inferior colliculus. J. Neurophysiol. 82, 593-610 (1999).
- Klug, A., Park, T. J., Pollak, G. D. Glycine and GABA influence binaural processing in the inferior colliculus of the mustache bat. J. Neurophysiol. 74, 1701-1713 (1995).
- Moore, M. J., Caspary, D. M. Strychnine blocks binaural inhibition in lateral superior olivary neurons. J. Neurosci. 3, 237-242 (1983).
- Nataraj, K., Wenstrup, J. J. Roles of inhibition in creating complex auditory responses in the inferior colliculus: facilitated combination-sensitive neurons. J. Neurophysiol. 93, 3294-3312 (2005).
- Fukui, I., Burger, R. M., Ohmori, H., Rubel, E. W. GABAergic inhibition sharpens the frequency tuning and enhances phase locking in chicken nucleus magnocellularis neurons. J. Neurosci. 30, 12075-12083 (2010).
- Burger, R., Pollak, G. D. Reversible inactivation of the dorsal nucleus of the lateral lemniscus reveals its role in the processing of multiple sound sources in the inferior colliculus of bats. J. Neurosci. 21, 4830-4843 (2001).
- Burger, R. M., Pollak, G. D. Analysis of the role of inhibition in shaping responses to sinusoidally amplitude-modulated signals in the inferior colliculus. J. Neurophysiol. 80, 1686-1701 (1998).
- Coleman, W. L., Fischl, M. J., Weimann, S. R., Burger, R. M. GABAergic and glycinergic inhibition modulate monaural auditory response properties in the avian superior olivary nucleus. J. Neurophysiol. 105, 2405-2420 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon