Method Article
Preparación e inactivación de patógenos de Double Dose productos plaquetarios capa leucocitaria usando el sistema sanguíneo INTERCEPT
En este artículo
Resumen
En este artículo se describe el proceso utilizado por el Hospital Universitario de Örebro para producir dosis doble capa leucocitaria concentrados de plaquetas preparado a partir de donaciones de sangre entera y tratados con el sistema sanguíneo INTERCEPT para la inactivación de patógenos. La In vitro de las unidades de plaquetas finales se evaluó a lo largo de 7 días de almacenamiento.
Resumen
Los centros de sangre se enfrentan a muchos desafíos, incluyendo el rendimiento al máximo la producción de las donaciones de sangre de productos que reciben, así como garantizar el mayor nivel posible de seguridad para los pacientes de transfusión, incluyendo protección contra las enfermedades de transmisión transfusión. Esto debe llevarse a cabo de una manera fiscalmente responsable que reduce al mínimo los gastos de funcionamiento, incluidos los consumibles, equipos, residuos y costes de personal, entre otros.
Varios métodos están disponibles para producir concentrados de plaquetas para transfusión. Uno de los más comunes es el método de capa leucocitaria en el que se prepara una única unidad terapéutica de plaquetas (≥ 2,0 x10 11 plaquetas por unidad o por las normas locales) mediante la agrupación de la capa de leucocitos de hasta seis donaciones de sangre completa. Un procedimiento para la producción de "doble dosis" plaquetas de sangre entera derivados sólo recientemente ha sido desarrollado.
Se presenta aquí un nuevo método para preparardoble dosis de plaquetas en sangre total concentrados derivados de las piscinas de 7 buffy abrigos y posteriormente tratar las unidades de dosis dobles con el sistema sanguíneo INTERCEPT para la inactivación de patógenos. INTERCEPT fue desarrollado para inactivar virus, bacterias, parásitos y contaminación de las células donantes blancos que pueden estar presentes en la sangre donada. Vinculación intersección con el método de capa doble dosis buffy utilizando el procesamiento INTERCEPT Set con contenedores de almacenamiento dual (el "set DS"), permite a los bancos de sangre para el tratamiento de cada una de sus unidades de dosis dobles en un solo conjunto de procesamiento de inactivación de patógenos, lo que maximiza la seguridad del paciente minimizando los costos. La dosis doble capa leucocitaria método requiere menos capas leucocitarias y reduce el uso de consumibles hasta en un 50% (por ejemplo, conjuntos de puesta en común, sistema de filtros de solución aditiva de plaquetas, y obleas estériles de conexión) en comparación con la preparación y el tratamiento de unidades de dosis única capa leucocitaria de plaquetas . Otros ahorros de costos incluyen menos residuos, menos equipo mantenice, menores requisitos de energía, la reducción de tiempo de personal y un menor costo de recaudación en comparación con la técnica de aféresis.
Protocolo
1. Extracción de sangre total
- Recopilar toda la sangre de donantes voluntarios en 450 ml superior / inferior colección fija de acuerdo con las pautas locales de recogida de sangre.
- La sangre completa se almacena durante un mínimo de 2 h en una placa de refrigeración antes de la centrifugación y la separación.
2. Buffy Coat Preparación
- Centrifugar la sangre entera usando un giro difícil de separar la sangre en tres capas: los glóbulos rojos, la capa leucocitaria y el plasma. Centrifugar los parámetros utilizados fueron 4.880 RCF durante 11 minutos a 22 ± 2 ° C.
- El uso de un separador de sangre automatizado para expresar el plasma en la bolsa satélite y la parte superior de los glóbulos rojos (RBC) en la bolsa satélite fondo, dejando la capa leucocitaria en el recipiente de recogida. Meta significa rangos de volumen y hematocrito para buffy abrigos son de aproximadamente 48 ml y 37%, respectivamente.
- Los buffy-coats se almacenan durante la noche en un agitador de plaquetas a 22 ± 2 ° C.
3. Buffy Coat Pooling
- Estéril Connect 7 buffy abrigos y 300 ml de solución aditiva SSP + plaquetas (PAS) en una configuración de tren con las líneas paralelas para reducir la longitud de los trenes, el PAS deben estar en la parte superior del tren. Sujete la línea entre la PAS y la primera capa leucocitaria.
- Abra las conexiones estériles entre las unidades de la capa leucocitaria y permitir que el buffy abrigos para drenar en el último contenedor.
- Abrir la soldadura y la abrazadera entre el PAS y la primera capa leucocitaria. Permitir que un tercio de la solución de aditivo para enjuague a través de cada uno de los contenedores de la capa leucocitaria secuencialmente. Repetir 2 veces cada vez más utilizando la mitad de la restante PAS.
- La capa media buffy volumen de la piscina debe ser de aproximadamente 600 ml. Si el volumen de destino y el hematocrito de los individuales buffy abrigos se cumplen, la relación de plasma será de 32 - 47% como se requiere para el tratamiento de inactivación de patógenos INTERCEPT más tarde en el proceso.
- Deseche el vacío + SSP y buffycontenedores de abrigo.
- Para una óptima recuperación de las plaquetas, mantener la piscina en el agitador durante 1 hora antes de la centrifugación.
- Estéril conectar un recipiente de almacenamiento de plaquetas con filtro de leucorreducción integrado a la piscina capa leucocitaria.
- Realizar un "giro suave" de la piscina capa leucocitaria para separar los glóbulos rojos de las plaquetas en suspensión (462 RCF durante 9 min, 20 sec). Expresar la suspensión de plaquetas usando un separador de sangre automatizado a través del filtro de leucorreducción en el recipiente de almacenamiento de plaquetas.
- Los requisitos de procesamiento descritos anteriormente asegurar que la suspensión de plaquetas cumple con las especificaciones de procesamiento de intercepción de 300 ml - 420 ml de volumen, 2.5-7.0 x 10 11 dosis de plaquetas, y ≤ 4 x 10 6 células rojas / ml.
4. INTERCEPTAR Tratamiento
- Lleve a cabo el tratamiento de intercepción antes del final del día 1 después de la recolección (día 0 es el día de la recolección).
- Separar el equipo de procesamiento INTERCEPTcon contenedores de almacenamiento dual de la bolsa de plástico transparente.
- Estéril conectar el contenedor de suspensión de plaquetas a la tubería del recipiente amotosaleno en el equipo de procesamiento INTERCEPT.
- Etiquetar los recipientes de almacenamiento de procesamiento INTERCEPT conjunto con la identificación de productos sanguíneos apropiados según las exigencias locales.
- Colgar las plaquetas y romper primero la cánula parte inferior en el recipiente amotosaleno, permitiendo que la solución amotosaleno a entrar en el recipiente de iluminación. Romper la cánula de la parte superior en el recipiente amotosaleno permitiendo que las plaquetas fluya a través del recipiente amotosaleno en el recipiente de iluminación.
- Mezclar suavemente la mezcla de plaquetas y amotosaleno y expresar el aire desde el recipiente de iluminación en el recipiente amotosaleno.
- Expresar una pequeña cantidad de la mezcla de plaquetas en el tubo, relleno de aproximadamente 4 cm de la tubería. Esto asegura plaquetas en tanto el tubo y el recipiente iluminación someterse el patógeno inactivatien el tratamiento.
- Sellar la tubería entre el contenedor y el contenedor amotosaleno iluminación. Deja no más de aproximadamente 4 cm de tubería que se extienden desde el contenedor de iluminación. Retire y deseche la plaqueta y contenedores vacíos amotosaleno y cerrar las pinzas en las bolsas de muestreo.
- Coloque el equipo de procesamiento en el iluminador con el recipiente de iluminación en el compartimiento grande de la izquierda y el organizador en el compartimiento más pequeño en el lado derecho.
- Utilice el dispositivo de código de barras de mano para introducir el ID de donación, el código de producto y número de lote de procesamiento establecido en el iluminador. Cierre la tapa de metal y cuando se le indique en la interfaz gráfica de iluminación, cierre el cajón. Pulse el botón "Inicio" para iniciar la Iluminación.
- Después de la iluminación, retirar el equipo de procesamiento del iluminador. El iluminador imprime automáticamente el informe de tratamiento de la unidad tratada plaquetas (s).
- Separar los envases por parte del organizador y colgar la platelets y equipo de procesamiento, romper la cánula en la salida del recipiente de iluminación, y permitir que las plaquetas a fluir en el dispositivo compuesto de adsorción (CAD) de contenedores.
- Teniendo cuidado de no doblar la oblea de CAD, expresar el aire desde el recipiente de CAD en el recipiente de iluminación usando un extractor de plasma.
- Sellar la tubería cerca de la abertura de entrada del recipiente CAD. Retire y deseche el envase vacío iluminación.
- Coloque el recipiente de CAD con los contenedores de almacenamiento conectados en un agitador de plaquetas por lo menos durante 6 horas, pero no más de 16 horas. Esto resultará en una reducción de amotosaleno residual a una concentración de ≤ 2 m.
- Después del tratamiento de CAD, eliminar las unidades de plaquetas desde el agitador. Cuelgue las plaquetas. Romper la cánula y permitir plaquetas a fluir en los recipientes de almacenamiento.
- Expresar el aire de los contenedores de almacenamiento en el recipiente de CAD. Deja que el flujo residual de vuelta plaquetas concentrado en los recipientes de almacenamiento dela gravedad. Selle el tubo por encima de la Y-montaje y retire el recipiente vacío CAD.
- Redistribuir el volumen entre los contenedores de almacenamiento, según sea necesario. Los ajustes de volumen se hacen pesando los recipientes de almacenamiento. Sellar el tubo a cada recipiente de almacenamiento de unos pocos centímetros por encima de la entrada del recipiente de almacenamiento, lo que facilita la obtención de una muestra estéril del producto final como se describe en 5,2.
5. Muestreo de producto
- Para las pruebas de control de calidad de rutina, los recipientes de almacenamiento final se puede muestrear una vez mediante el uso de la bolsa de toma de muestras en los contenedores de almacenamiento. Para ello, asegúrese de que la unidad de plaquetas es bien mezclado, a continuación, abra la pinza en la bolsa y apretar varias veces. Sellar el tubo después de que la bolsa se ha llenado con las plaquetas. Transferir la muestra de plaquetas en un tubo de laboratorio adecuadas y realizar los ensayos de forma inmediata.
- Para obtener muestras en varios puntos de tiempo en el transcurso de almacenamiento, tal como para un estudio de validación, conectar estérilun recipiente de muestreo de nuevo a la tubería del recipiente de almacenamiento de plaquetas. Asegúrese de que las plaquetas están bien mezclados antes de la transferencia al recipiente de muestreo.
6. Función in vitro Evaluación
- Para este estudio de validación, la evaluación in vitro se llevó a cabo después del tratamiento CAD (Día 1 Día 2 o, dependiendo de la duración CAD) y de nuevo el Día 4 (o el día 5) y el Día 7. Mediciones in vitro fueron volumen, recuento de plaquetas, pH, gases en sangre (PO 2, PCO 2), glucosa, lactato y remolinos.
- El volumen se determina por el peso usando 1,01 g / ml como la gravedad específica de las plaquetas en solución de aditivos.
- Contaminación hemoglobina se evaluó visualmente mediante la comparación con una carta de colores.
- Swirling se determinó visualmente.
- Consulte "Tabla de equipamiento" para la metodología de otros ensayos.
7. Los resultados representativos
El proceso de producción de double dosis de capa leucocitaria plaquetas comienza con la producción de capas individuales buffy que cumplen con las especificaciones de destino para el volumen y el hematocrito. Dado que no es práctico medir el hematocrito de la persona buffy abrigos durante el proceso de validación final, comenzamos realizando un esfuerzo separado para optimizar nuestro buffy abrigos para asegurarnos de que siempre podía satisfacer volumen de destino y el hematocrito. Como se muestra en la Tabla 1, nuestros optimizados buffy abrigos compara favorablemente con los valores objetivo de volumen y el hematocrito a 46 ± 2 ml y 37 ± 3%, respectivamente.
Después de la agrupación, el volumen y el hematocrito de la capa leucocitaria de la piscina debe ser de aproximadamente 600 ml y 20%, respectivamente, antes de la centrifugación giro suave. Como se ilustra en la Tabla 2, las piscinas de la capa leucocitaria promedio de 615 ± 5 ml; el hematocrito promedio de 19 ± 1%.
Los resultados de giro suave con centrifugación en un concentrado de plaquetas dosis dobleentrate que cumpla con los requisitos de entrada para la inactivación de patógenos que utilizan el sistema INTERCEPT Blood DS procesamiento conjunto. Los parámetros clave de entrada para el tratamiento INTERCEPT incluyen recuento volumen, plaquetas, plasma relación, y el contenido de glóbulos rojos. Además, nuestro objetivo es recuperar ≥ 75% de las plaquetas en el concentrado de plaquetas en comparación con el pool de capa leucocitaria. Según los requisitos locales, la glóbulos blancos (WBC) la contaminación debe ser <1x10 6 / unidad. El concentrados de plaquetas en nuestra validación cumplieron los parámetros clave para tratamiento de intercepción, así como los objetivos de la contaminación del CMB y la recuperación de plaquetas, como se muestra en la Tabla 3.
El proceso INTERCEPT para la inactivación de patógenos se lleva a cabo en el concentrado doble dosis de plaquetas utilizando un conjunto único de procesamiento INTERCEPT. El conjunto de procesamiento contiene dos recipientes de almacenamiento integrales que permiten que la unidad de tratamiento que se divide en dos individuales dosis terapéutica de plaquetas en la terminación de la trayectoriaógeno proceso de inactivación. Directrices europeas establecen que el 75% de las unidades analizadas contienen ≥ 200x10 9 plaquetas por dose1 terapéutico, los requisitos locales en Suecia exigen que el 75% de las unidades analizadas contienen> 240x10 9 plaquetas por dosis. Después de tratamiento de intercepción, el contenido de plaquetas promedio fue de 265 ± 22 x10 9 (n = 24). Por otra parte, el 88% de las unidades cumplieron o excedieron 240x10 9 plaquetas por dosis terapéutica, lo que está dentro de las dos a las directrices europeas y normas suecas. Vea las figuras 1 y 2 para una ilustración de la preparación capa leucocitaria dosis doble y los procesos de tratamiento INTERCEPT respectivamente.
Para esta validación, se midió la características in vitro de los concentrados de plaquetas después de tratamiento de intercepción (es decir, después de la división en los recipientes de almacenamiento individuales); parámetros se midieron más de 7 días de almacenamiento. La media y la desviación estándar fueron recolectados paradosis de plaquetas, pH, PO 2, PCO 2, la producción de lactato y consumo de glucosa.
La Figura 3 muestra la media dosis inicial de plaquetas del concentrado de plaquetas de doble dosis antes del tratamiento de interceptación y la dosis promedio de plaquetas en cada uno de los productos de escisión tras tratamiento de intercepción de más de 7 días de almacenamiento. Pérdida de plaquetas durante el almacenamiento fue de aproximadamente el 9%. Esta reducción no es diferente de la pérdida esperada de las plaquetas durante el almacenamiento de plaquetas convencionales. 2
La Tabla 4 resume las características in vitro de las plaquetas INTERCEPT después del tratamiento y la división en unidades individuales.
Según los requisitos europeos, el pH de las plaquetas deben mantenerse por encima de 6,4 hasta el final de la vida útil. Durante el procesamiento, el pH de los concentrados de plaquetas cae ligeramente en función de la concentración de plaquetas, el volumen y la permeabilidad a los gases de la plaqueta storecipiente rabia. Figura 4 ilustra el pH de los productos plaquetarios divididas más de 7 días de almacenamiento. Durante el almacenamiento, el pH es estable y bien mantenido dentro de los requisitos de procesamiento.
Como se muestra en las Figuras 5A y 5B, el consumo de plaquetas O 2 y la producción de CO 2 indican la respiración continuada por las plaquetas intersección en el recipiente PL2410 durante 7 días de almacenamiento. Figuras 6A y 6B muestran los niveles de lactato y glucosa a lo largo de 7 días de almacenamiento . El consumo de glucosa y producción de lactato plaquetas son consistentes unos con otros durante los 7 días de almacenamiento. 5 unidades tenían un nivel de glucosa en menos de 1,11 mmol / l (el límite inferior para el ensayo de glucosa).
La preparación de la capa leucocitaria y plaquetas puesta en común de validación produce concentrados que cumplieron con los criterios de entrada para tratamiento de intercepción, en concreto, el volumen, recuento de plaquetas, plasma relación y rojo blood contaminación de células. Las unidades finales cumplieron con los criterios de validación de más de 7 días de almacenamiento, incluyendo dosis de plaquetas y pH.
| Parámetro | Target Range | Resultados La media ± DE |
| Volumen (ml) | ~ 48 | 46 ± 2 |
| Hematocrito (%) | ~ 37 | 37 ± 3 |
| Tiempo de espera antes de la puesta en común | Noche en el agitador | Noche en el agitador |
Tabla 1. Características de las Personas Coats Buffy (n = 19).
| Parámetro | Target Range | Resultados La media ± DE |
| Volumen (ml) | ~ 600 | 615 ± 5 |
| Hematocrit (%) | ~ 20 | 19 ± 1 |
| El tiempo de retención antes de la centrifugación | 1 hora en un agitador | 1 hora en un agitador |
Tabla 2. Características de las piscinas de capa leucocitaria (n = 12).
| Parámetro | Objetivo | Resultados La media ± DE |
| Volumen (ml) | 370 hasta 420 | 404 ± 8 |
| El recuento de plaquetas (x10 9 / unidad) | 250 hasta 700 | 577 ± 62 |
| La media de recuperación de plaquetas (%) | ≥ 75 | 75 ± 4 |
| Relación en plasma (%) | 32 a 47 | 38 ± 1 |
| RBC (x10 6 / ml) | ≤ 4 | 1,2 ± 0,4 |
| WBC (x10 6 / unidad) | ≤ 1 | 0,11 ± 0,1 |
| Tiempo de espera antes de la Interceptación (hr) | ≤ final del día 1 | ≤ final del día 1 |
Características de las tablas 3. De la plaqueta de doble dosis Concentrados (n = 12).
| Media ± SD | Min | Max | |
| Volumen (ml) | 199 ± 16 | 182 | 236 |
| El recuento de plaquetas (x10 9 / unidad) | 265 ± 22 | 225 | 292 |
| pH (22 º C) | 6,9 ± 0,1 | 6,8 | 7.0 |
| pO 2 (kPa) | 21,4 ± 4,8 | 12,8 | 27,3 |
| pCO 2 (kPa) | 4,3 y plusmn, 0,4 | 3,3 | 4,9 |
| Lactato (mmol / l) | 9,1 ± 1,7 | 6,8 | 12,4 |
| La glucosa (mmol / l) | 5,3 ± 0,9 | 3,7 | 6,5 |
Tabla 4. Características del Día plaquetas tratadas con INTERCEPT 1/2 (unidades individuales, n = 24).
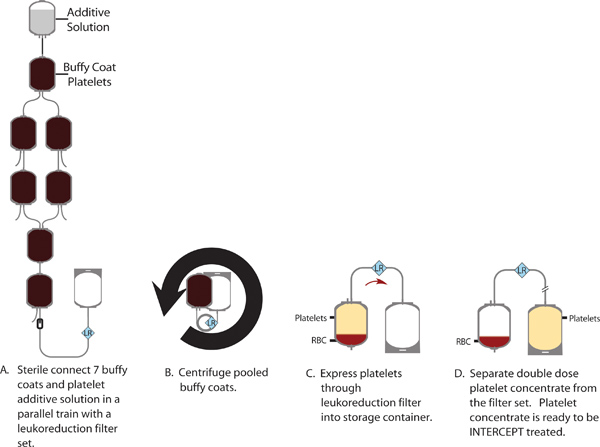
Figura 1. Producción de un concentrado de plaquetas dosis doble de un grupo de 7 capas leucocitarias.
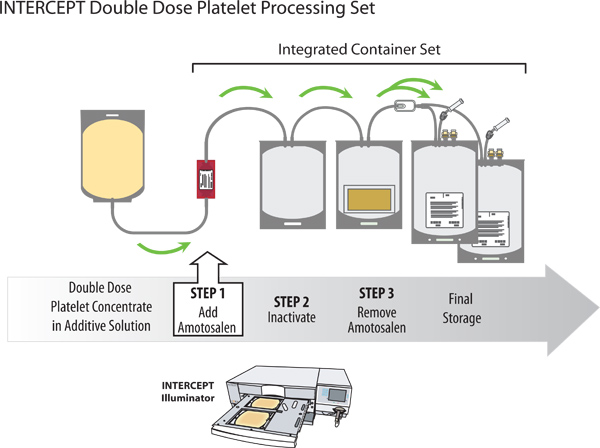
Figura 2. Inactivación de patógenos de un concentrado de plaquetas dosis doble con el sistema sanguíneo INTERCEPT.
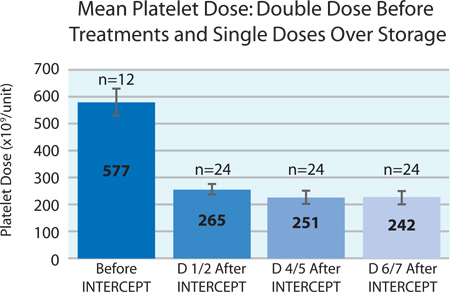
Figura 3. Dosis media de plaquetas antes y por7 días después del tratamiento de intercepción (n = 12 antes de intercepción, n = 24 después de intercepción).
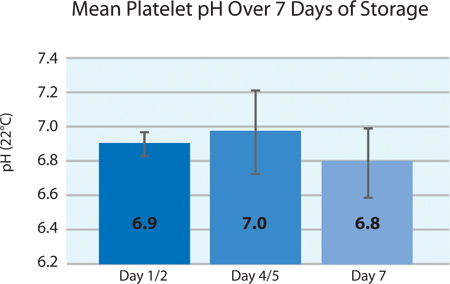
Figura 4. Media ± DE pH de plaquetas después del tratamiento INTERCEPT (n = 24).
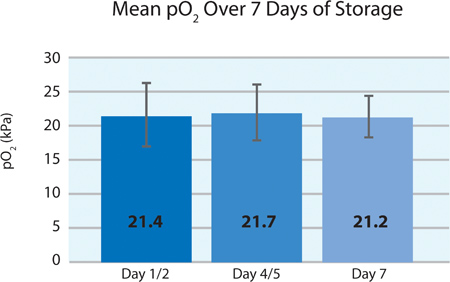
Figura 5A. Media ± DE PO 2 después del tratamiento INTERCEPT (n = 24).
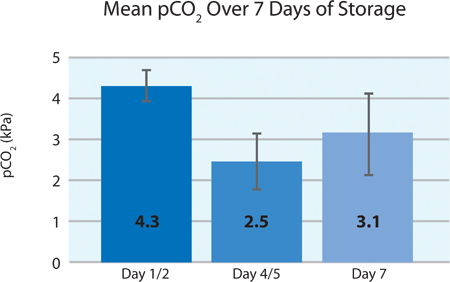
Figura 5B. Media ± DE PO 2 después del tratamiento INTERCEPT (n = 24).
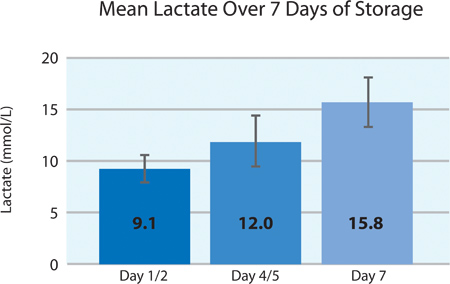
Figura 6a. Los niveles medios de lactato ± SD después del tratamiento INTERCEPT (n = 24).
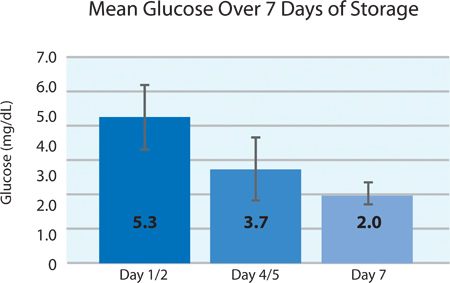
La Figura 6B. Media de los niveles de glucosa yplusmn; SD después del tratamiento INTERCEPT (n = 24).
Discusión
Plaquetas de capa leucocitaria requerir varios pasos de procesamiento que dan como resultado costes posteriores a la recolección, incluyendo el tiempo del personal, consumibles, equipo, y de los residuos, que debe tenerse en cuenta en el costo total de producción de las unidades de plaquetas. Mejora de la producción de plaquetas de cada capa leucocitaria (a través de la optimización del volumen de la capa leucocitaria y hematocrito) permite la producción de una unidad de capa leucocitaria dosis doble de plaquetas de un grupo de siete capas leucocitarias. Cuando esta optimización se lleva a cabo, el número de capas leucocitarias requerida para producir un número fijo de dosis de plaquetas se puede reducir, mejorando así la utilización general de capas leucocitarias y permitiendo la producción de plaquetas adicional concentrados (PCs). Tiempo de personal, así como los costes de consumibles y equipos tales como juegos de puesta en común, solución aditiva de plaquetas, obleas estériles de conexión, equipos de filtrado y procedimientos de centrifugación se reducen hasta en un 50%. Además de optimizar la producción de plaquetas y reducir los costos asociados, this método de mezcla puede generar un concentrado de plaquetas (PC) que cumpla con el requisito de entrada para uso con el sistema de procesamiento INTERCEPT dual de almacenamiento de contenedores, lo que nos permite proporcionar una mayor protección a los receptores de transfusiones nuestros también.
El sistema sanguíneo INTERCEPT para la inactivación de patógenos utiliza amotosaleno y luz ultravioleta A (UVA) para la reticulación covalente de ADN y ARN, evitando la replicación del ácido nucleico y patógenos de renderizado que no pueden causar la enfermedad. 3 Se inactiva eficazmente un amplio espectro de patógenos, incluyendo virus, bacterias , parásitos y contaminantes células blancas de la sangre de los donantes. 4-6 INTERCEPT proporciona una alternativa al paradigma actual de pruebas para patógenos emergentes, que históricamente implica un retraso sustancial, mientras que una nueva prueba se desarrolla y, finalmente, requiere una inversión financiera significativa para poner en práctica cuando una prueba esté disponible. 7,8 También puede proporcionar una alternativa a la seguridad redundante medires tales como la detección de bacterias y 9 irradiación gamma. 10-12 Además, INTERCEPT nos permite tratar a unidades de doble dosis de plaquetas que beneficia a nuestra eficiencia de producción y nos ayuda a cumplir nuestros presupuestos.
INTERCEPT y la dosis doble capa leucocitaria método se puede adaptar a una variedad de flujos de trabajo del centro de la sangre. Como ejemplos, las colecciones de sangre entera puede ser aumentado a 500 ml; colecciones también pueden ser almacenados durante una noche a 22 ° C antes de la separación. Además, a un sustituto de capa leucocitaria método de mezcla es posible (por ejemplo, un método de pulpo en lugar de un método de tren) y / o un dispositivo automatizado (por ejemplo Tacsi) puede ser utilizado para la segunda centrifugación y separación de la suspensión de plaquetas de los glóbulos rojos restantes .
Si el contenido de plaquetas se necesita mayor, se dispone de varias técnicas incluyendo la pre-selección de los donantes según el recuento de plaquetas, la incubación durante la noche de la sangre entera, adjustamento de ajustes de centrifugación, o la utilización de una piscina de 8 buffy abrigos en lugar de 7.
Debido a la limitación de la agrupación establece actualmente disponible y la capacidad de los cubos de centrífuga, el volumen total de la capa leucocitaria de la piscina debe ser de aproximadamente 600 ml. El proceso de centrifugación y ajustes descritos en este protocolo ha sido optimizado para obtener un producto que cumpla con los parámetros de intercepción para un grupo de 7 buffy abrigos. Los ajustes de centrifugación debe ser modificado si el número de capas leucocitarias en la piscina se modifica.
En algunos países, la dosis de plaquetas mínimo es más alto y los requisitos de control de calidad son más estrictos que en Suecia. Por lo tanto, nuestros resultados pueden no ser de aplicación universal. En estos países, el PC doble dosis antes del tratamiento INTERCEPT deberá contener un mayor número de plaquetas con el fin de satisfacer las necesidades locales después del tratamiento INTERCEPT y división. Debido a que el contenido máximo de plaquetas y el tratamiento volumen for INTERCEPT son 7x10 11 plaquetas y 420 ml, respectivamente, el porcentaje de unidades que excedan de los requisitos de procesamiento de interceptar o tener un contenido insuficiente de plaquetas a ser dividido en dos dosis terapéuticas, variará dependiendo de factores tales como los requisitos locales para la dosis de plaquetas, los criterios de control de calidad, buffy resultados capa de optimización, y la estabilidad de producción.
Si un PC dosis doble supera los requisitos de procesamiento de interceptar, se puede ajustar manualmente para cumplir con los requisitos y tratado posteriormente. En las pocas ocasiones en que la piscina capa 7-buffy rendimientos suficientes plaquetas de un producto de doble dosis después de intercepción, se opta por no realizar el tratamiento INTERCEPT. Alternativamente, otros centros de sangre puede decidir tratar el PC con un sistema de procesamiento INTERCEPT dosis única (es decir, el conjunto de gran volumen) y almacenar el PC como una sola dosis grande terapéutica, realizando de esta manera la inactivación de patógenos en todas las unidades. Con el fin de garantizar la satisfacción de nuestrosRequisitos de control de calidad y para inactivar patógenos como muchas de nuestras unidades de plaquetas como sea posible, seleccionamos buffy abrigos basadas en los recuentos de plaquetas de donantes, los cuales, cuando se agruparon, se traducirá en un contenido mínimo de plaquetas de 5.6x10 11 plaquetas en la piscina. Esto asegura que el contenido de plaquetas suficientes para producir dos dosis terapéuticas después del tratamiento INTERCEPT.
Nuestro validación demuestra que 7 unidades derivadas de sangre entera capa leucocitaria puede ser exitosamente agruparon y se trató con el proceso INTERCEPT para plaquetas, resultando en 2 productos plaquetarios patógenos inactivados que cumplen con los criterios de aceptación para la fabricación (requisitos suecas y las directrices europeas) y para el apoyo de los pacientes que requiere transfusiones de plaquetas de acuerdo con las guías de práctica clínica y los métodos estándar de infusión de plaquetas en Suecia.
Divulgaciones
La producción y el libre acceso a este artículo es patrocinado por Cerus.
Agradecimientos
La financiación de la publicación es proporcionada por Cerus Corp, fabricante del sistema sanguíneo INTERCEPT.
Materiales
| Name | Company | Catalog Number | Comments |
| Whole blood donation, primary separation, and platelet production | |||
| Blood collection pack | Fenwal | R6485 | Top/Bottom set |
| Automated component extractor | Fenwal | Optipress-II | |
| Blood mixer and balance system | Baxter | Easymix V3 | |
| Platelet leukocyte filtration set | Fenwal | K4R7042 | |
| Centrifuge | Hettich | Roto Silenta 63 RS | Version 5.5 |
| Platelet additive solution - SSP+ | MacoPharma | SSP2030U | 300 ml |
| Sterile tubing welder | Terumo | T-SCD | |
| INTERCEPT treatment & storage | |||
| INTERCEPT processing set |  Cerus Cerus | INT2503 | Dual Storage (DS) set |
| INTERCEPT Illuminator |  Cerus Cerus | INT100 | |
| PC sample pack | Fenwal | FTX 1122 | |
| Incubator | Helmer | PC2200/PC3200 | |
| Agitator | Helmer | PF48H/PF96H | |
| Evaluation of in vitro Platelet Function | |||
| Blood gas analyzer | Radiometer | ABL 735 | Used for pH, blood gases, and lactate measurement |
| Chemistry system | Ortho Clinical Diagnostic | Vitros 5.1 | Used for glucose measurement |
| Hematology analyzer | Boule Medical AB | Medonic CA620-Cellguard | Used for platelet count measurement |
| Flow cytometer | BD | FACSCanto | Used for white blood cell measurement |
Referencias
- . . Guide to the preparation, use and quality assurance of blood components. , (2010).
- Van Rhenen, D. J., Vermeij, J., Mayaudon, V., et al. Functional characteristics of S-59 photochemically treated platelet concentrates derived from buffy coats. Vox Sang. 79, 206-214 (2000).
- Wollowitz, S. Targeting DNA and RNA in pathogens: mode of action of amotosalen HCl. Transfus. Med. Rev. 31, 11-16 (2004).
- Irsch, J., Lin, L. Pathogen Inactivation of Platelet and Plasma Blood Components for Transfusion Using the INTERCEPT Blood SystemTM. Transfus. Med. Hemother. 38, (2011).
- Lin, L., Dikeman, R., Molini, B., et al. Photochemical treatment of platelet concentrates with amotosalen and long-wavelength ultraviolet light inactivates a broad spectrum of pathogenic bacteria. Transfusion. 44, 1496-1504 (2004).
- Lin, L., Hanson, C., Alter, H., et al. Inactivation of viruses in platelet concentrates by photochemical treatment with amotosalen and long-wavelength ultraviolet light. Transfusion. 45, 580-590 (2005).
- Allain, J. P., Cianco, C., Blajchman, A., et al. Protecting the blood supply from emerging pathogens: the role of pathogen inactivation. Transfus. Med. Rev. 19, 110-126 (2005).
- Stramer, S., Hollinger, F., Katz, L., et al. Emerging infectious disease agents and their potential threat to transfusion safety. Transfusion. 49, 1S-29S (2009).
- Nussbaumer, W., Allesdorfer, D., Grabmer, C., et al. Prevention of transfusion of platelet components contaminated with low levels of bacteria: a comparison of bacteria culture and pathogen inactivation methods. Transfusion. 47, 1125-1133 (2007).
- Schlenke, P. Protection against Transfusion-Associated Graft-versus-Host Disease in Blood transfusion: Is Gamma-Irradiation the Only Answer? Transfus. Med. Hemother. 31, 24-31 (2004).
- Lin, L., Corash, L., Osselear, J. C. Protection Against TA-GVHD Due to Platelet Transfusion By Using Pathogen Inactivation with the INTERCEPT Blood SystemTM - Gamma Irradiation is Not the Only Answer. Haematologica. 95 (Extra 1), 230-237 (2010).
- Corash, L., Lin, L. Novel processes for inactivation of leukocytes to prevent transfusion-associated graft-verus-host disease. Bone Marrow Transplant. 33, 1-7 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados