Method Article
Vorbereitung und Pathogeninaktivierung von Double Dose Buffy Coat Platelet Produkte, die INTERCEPT Blood System
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt den Prozess, durch Örebro University Hospital verwendet werden, um doppelte Dosis Leukozytenfilm Thrombozytenkonzentrate aus Vollblutspenden hergestellt und behandelt mit dem INTERCEPT Blood System für Pathogeninaktivierung produzieren. Die In vitro Qualität der endgültigen Thrombozyten Einheiten sind über 7 Tagen Lagerung ausgewertet.
Zusammenfassung
Blut-Zentren sind mit vielen Herausforderungen wie die Maximierung der Produktion Ertrag aus dem Blut und Sachspenden, die sie erhalten, sowie die Gewährleistung der höchstmöglichen Sicherheit für Transfusionsmedizin Patienten, einschließlich des Schutzes vor Transfusionen übertragbaren Krankheiten konfrontiert. Dies muss in einer verantwortungsvollen Haushaltspolitik Weise betrieblichen Aufwendungen einschließlich Verbrauchsmaterial, Ausrüstung, Abfall und Personalkosten, unter anderem minimiert erreicht werden.
Mehrere Methoden stehen zur Verfügung, um zu produzieren Thrombozytenkonzentrate zur Transfusion. Einer der häufigsten ist der Buffy-Coat, bei dem eine einzelne therapeutische Thrombozyten Einheit (≥ 2,0 x10 11 Plättchen pro Gerät oder pro örtlichen Vorschriften) durch die Bündelung der Buffy-Coat-Schicht von bis zu sechs Vollblutspenden vorbereitet wird. Ein Verfahren zur Herstellung von "doppelte Dosis" Vollblut gewonnen Blutplättchen hat erst vor kurzem entwickelt worden.
Hier ist dargestellt ein neues Verfahren zur Herstellungdoppelte Dosis Vollblut gewonnen Thrombozytenkonzentrate aus Pools von 7 buffy coats und anschließend die Behandlung der doppelte Dosis Einheiten mit dem INTERCEPT Blood System für Pathogeninaktivierung. INTERCEPT wurde entwickelt, um Viren, Bakterien, Parasiten und verunreinigen Spender weißen Blutkörperchen, die vorhanden sein in Blut kann zu inaktivieren. Pairing Schnittpunkt mit der doppelten Dosis Leukozytenfilm Verfahren unter Ausnutzung des INTERCEPT Verarbeitung mit Dual Storage Container (die "DS set") Set ermöglicht Blutspendezentren jedem ihrer doppelte Dosis Einheiten in einem einzigen Pathogeninaktivierung Verarbeitungssatzes zu behandeln, damit die Maximierung der Patientensicherheit bei gleichzeitiger Minimierung der Kosten. Die doppelte Dosis Leukozytenfilm Methode erfordert weniger buffy coats und reduziert die Verwendung von Verbrauchsmaterialien, die von bis zu 50% (z. B. Pooling-Sets, Filter-Sets, Plättchen-Additiv-Lösung, und sterile Verbindung Wafern) im Vergleich zu der Zubereitung und Behandlung von Einzeldosis Leukozytenfilm Thrombozyteneinheiten . Weitere Kosteneinsparungen sind weniger Abfall, weniger Geräte wartungsce, geringere Leistungsaufnahme, geringere Personal Zeit und geringere Kosten der Erhebung der Apherese-Technik verglichen.
Protokoll
Ein. Vollblutspende
- Vollblut von freiwilligen Spendern in 450 ml oben / unten Kollektion setzt nach den örtlichen Blutentnahme Richtlinien.
- Das Vollblut für mindestens 2 Stunden auf einer Kühlplatte vor der Zentrifugation und Abtrennung gespeichert.
2. Buffy Coat Vorbereitung
- Zentrifuge das Vollblut mit einem harten Spin um das Blut in drei Schichten trennt: rote Blutkörperchen, Leukozytenfilm und Plasma. Zentrifuge verwendeten Parameter waren 4880 RCF für 11 min bei 22 ± 2 ° C.
- Verwenden eines automatisierten Bluttrenneinheit um das Plasma in den oberen Satellitenbeutel und die roten Blutkörperchen (RBC) in den unteren Satellitenbeutel ausdrücken, so dass der Leukozytenmanschette in dem Sammelbehälter. Ziel bedeuten, Volumen und Hämatokrit Bereiche für buffy coats ca. 48 ml und 37%, bzw. sind.
- Die Buffy-Coats werden über Nacht auf einem Plättchen Rührwerk bei 22 ± 2 ° C gelagert
3. Buffy Coat Pooling
- Sterile connect 7 buffy coats und 300 ml SSP + Plättchen-Additiv-Lösung (PAS) in einem Zug Konfiguration mit parallelen Linien zur Verringerung der Zuglänge, die PAS sollte an der Spitze des Zuges. Klemmen Sie die Leitung zwischen dem PAS und der ersten Buffy-Coat.
- Öffnen die sterile Verbindung zwischen den Leukozytenfilm Einheiten und damit das buffy coats, in den letzten Behälter abzulassen.
- Öffnen Sie die Schweißnaht und die Klammer zwischen der PAS und der ersten Buffy-Coat. Erlauben einem Drittel des Additivs Lösung durch jedes der Leukozytenmanschette Behälter nacheinander zu spülen. 2 weitere Male wiederholen, wobei jedes Mal eine Hälfte des verbleibenden PAS.
- Die durchschnittliche Leukozytenfilm Pool Volumen sollte ca. 600 ml sein. Wenn das Zielvolumen und Hämatokrit der einzelnen buffy coats erfüllt sind, wird die Plasma-Verhältnis um 32 - 47% für die INTERCEPT Pathogeninaktivierung Behandlung später im Prozess erforderlich.
- Entsorgen Sie die leere SSP + und buffyMantel Behältern.
- Für eine optimale Plättchenregenerationsrate, halten den Pool auf dem Rührwerk für 1 Stunde vor dem Zentrifugieren.
- Sterile Verbindung ein Plättchen Vorratsbehälter mit integriertem Leukoreduktionsfilter der Buffy-Coat-Pool.
- Durchführen einer "soft spin" der Leukozytenmanschette-Pool, um die roten Blutkörperchen von den Plättchen in Suspension (462 RCF für 9 min, 20 sec) zu trennen. Hilfestellung Blutplättchensuspension Verwendung eines automatisierten Bluttrenneinheit durch die Leukoreduktionsfilter in die Blutplättchen Vorratsbehälter.
- Die zuvor beschriebenen Anforderungen an die Verarbeitung sicherzustellen, dass der Plättchensuspension dem Zwischenverarbeitungsuntersystem Spezifikationen von 300 ml entspricht - 420 ml Volumen, 2,5 bis 7,0 x 10 11 Blutplättchen Dosis und ≤ 4 x 10 6 / ml Erythrozyten.
4. INTERCEPT-Behandlung
- Führen Sie die INTERCEPT Behandlung vor dem Ende von Tag 1 nach der Entnahme (Tag 0 ist der Tag der Sammlung).
- Packen Sie das INTERCEPT Verarbeitung Setmit Dual Storage Containers aus dem klaren Plastikbeutel.
- Sterile verbinden Blutplättchensuspension Behälter zu dem Rohr des Behälters auf der Amotosalen INTERCEPT Verarbeitungssatzes.
- Beschriften Sie die INTERCEPT Verarbeitungssatzes Lagerbehälter mit dem entsprechenden Blutprodukt Identifizierung nach lokalen Anforderungen.
- Hängen Sie die Blutplättchen und brechen zuerst die unteren Kanüle auf dem Amotosalen Behälter, so dass die Amotosalen Lösung fließen in die Beleuchtung Behälter. Break the top Kanüle auf dem Amotosalen Behälter so dass die Blutplättchen durch die Amotosalen Behälter in der Beleuchtung Behälter fließen.
- Vorsichtig mischen und die Blutplättchen Amotosalen Gemischs und exprimieren die Luft aus dem Behälter in die Ausleuchtung Amotosalen Behälters.
- Ausdrücken eine kleine Menge der Blutplättchen Mischung in den Schlauch, Füllen etwa 4 cm von den Schläuchen. Dadurch wird sichergestellt, Thrombozyten sowohl in der Schlauch-und Beleuchtungs-Behälter durchlaufen den Erreger inactivatiauf die Behandlung.
- Verschließen Sie den Schlauch zwischen der Beleuchtung Behälter und Amotosalen Behälter. Hinterlegen nicht mehr als etwa 4 cm von Schläuchen, die sich von der Beleuchtungsvorrichtung Behälters. Entfernen und entsorgen Sie die leere Blutplättchen und Amotosalen Behälter und schließen Sie die Klemmen auf die Probenahme Beutel.
- Platzieren Sie die Verarbeitungssatz in den Illuminator mit dem Beleuchtungssystem Behälters in dem großen Fach auf der linken und der Organisator in der kleineren Kammer auf der rechten Seite.
- Mit dem Hand-held Barcode-Gerät, um die Spende ID, Produkt-Code und-verarbeitung Satz Losnummer in den Illuminator geben. Schließen Sie die Metallabdeckung und wenn sie auf dem Illuminator grafische Benutzeroberfläche aufgefordert, schließen Sie die Schublade. Drücken Sie auf "Start", um die Beleuchtung zu starten.
- Nach der Belichtung, entfernen Sie die Verarbeitung Satz von der Beleuchtungseinrichtung. Der Illuminator druckt automatisch die Behandlung Bericht für die behandelten Thrombozyten Einheit (en).
- Packen Sie die Behälter von dem Veranstalter und hängen Sie die platelets und Verarbeitungssatzes, brechen die Kanüle an dem Auslass des Beleuchtungssystems Behälters und damit die Thrombozyten in die Verbindung Adsorptionsvorrichtung (CAD) Behälter fließen.
- Dabei nicht um den CAD Wafer biegen, exprimieren die Luft aus dem Behälter in den CAD Ausleuchtung Behälter unter Verwendung eines Plasma-Extraktor.
- Abzudichten den Schlauch in der Nähe der Einlaßöffnung des Behälters CAD. Entfernen und entsorgen Sie die leere Beleuchtung Behälter.
- Legen Sie die CAD-Container mit den Attached Storage Container auf einem Plättchen Rührwerk für mindestens 6 h, aber nicht mehr als 16 Stunden. Dies wird im Abbau der Rest Amotosalen auf eine Konzentration von ≤ 2 uM führen.
- Nach CAD Behandlung, entfernen Sie die Thrombozyten-Einheiten aus dem Rührwerk. Hängen Sie die Blutplättchen. Brechen die Kanüle und damit Blutplättchen, um in die Lagerbehälter fließen kann.
- Exprimieren die Luft aus den Vorratsbehältern in den CAD-Container. Das verbliebene Plättchenkonzentrat fließen wieder in den Vorratsbehältern durchSchwerkraft. Verschließen Sie den Schlauch über dem Y-Stück und die leere CAD Behälter.
- Umzuverteilen das Volumen zwischen den Vorratsbehältern nach Bedarf. Lautstärkeeinstellungen werden durch Wägung der Vorratsbehälter gemacht. Dichten den Schlauch an jedem Vorratsbehälter wenige Zentimeter über dem Einlass des Vorratsbehälters, dies erleichtert den Erhalt einer sterilen Probe aus dem Endprodukt, wie in 5.2 beschrieben.
5. Produkt-Sampling
- Für Routine-QC-Tests können die Endlagerung Containern nach den Probenahme-Beutel auf den Vorratsbehältern abgetastet werden. Um dies zu tun, sicherzustellen, dass die Blutplättchen Gerät ist gut gemischt, dann öffnen Sie die Klemme an dem Beutel und drücken Sie mehrere Male. Verschließen Sie den Schlauch nach der Beutel mit Thrombozyten gefüllt. Übertragen Sie die Thrombozyten Probe in einem geeigneten Labor Rohr und führen Tests sofort.
- Um Proben zu verschiedenen Zeitpunkten erhalten im Laufe der Lagerung, wie etwa für eine Validierungsstudie, sterile Verbindungein neuer Probenbehälter auf das Rohr des Plättchens Vorratsbehälter. Sicherstellen, dass die Blutplättchen sind gut vor dem Probenbehälter übertragen gemischt.
6. In vitro Funktion Auswertung
- Aus diesem Validierungsstudie wurde in vitro Evaluierung nach CAD-Behandlung (Tag 1 oder Tag 2, je nach CAD Dauer) und erneut am Tag 4 durchgeführt (oder Tag 5) und Tag 7. In-vitro-Messungen enthalten Volumen, Thrombozytenzahl, pH, Blutgasanalyse (pO 2, pCO 2), Glukose, Laktat und Schwenken.
- Das Volumen wurde mit 1,01 Gew. g / ml auf der spezifischen Dichte von Blutplättchen in Additiv-Lösung bestimmt.
- Hämoglobin Kontamination wurde visuell mit Vergleich zu einer Farbkarte ausgewertet.
- Swirling wurde visuell bestimmt.
- Siehe "Tabelle der Ausrüstung" für Methodik der anderen Assays.
7. Repräsentative Ergebnisse
Das Verfahren zur Herstellung double Dosis Leukozytenfilm Plättchen beginnt mit der Produktion von individuellen Buffy Coats, die Zielvorgaben zu erfüllen für Volumen-und Hämatokrit. Da es nicht sinnvoll, den Hämatokrit des einzelnen Buffy Coats während der letzten Prozessvalidierung zu messen, haben wir begonnen, indem sie sich verpflichten eine separate bemüht, unsere Buffy Coats zu optimieren, um sicherzustellen, könnten wir konsequent erfüllen Zielvolumen und Hämatokrit. Wie in Tabelle 1 gezeigt, der optimierten buffy coats positiv auf die Zielwerte für die Menge und den Hämatokrit bei 46 ± 2 ml und 37 ± 3%, jeweils verglichen.
Nach Bündelung, sollte die Menge und Hämatokrit des Leukozytenmanschette Pool etwa 600 ml und 20% liegen, jeweils vor dem weichen Spin Zentrifugation. Wie in Tabelle 2 dargestellt, gemittelt unserer Leukozytenmanschette Pools 615 ± 5 ml; der Hämatokrit durchschnittlich 19 ± 1%.
Die weichen spin Ergebnisse in einer doppelten Dosis Thrombozyten concentrate, dass der Eingang für Pathogeninaktivierung Nutzung des INTERCEPT Blood System DS Verarbeitungssatzes gerecht wird. Key Eingabeparameter für INTERCEPT Behandlung gehören Lautstärke, Thrombozytenzahl, Plasma-Verhältnis und RBC Inhalt. Darüber hinaus streben wir an, ≥ 75% der Thrombozyten im Thrombozytenkonzentrat erholen, wie der Buffy-Coat-Pool verglichen. Per lokalen Anforderungen, muss der weißen Blutkörperchen (WBC) Verschmutzung <1x10 6 / Einheit. Die Thrombozytenkonzentrate in unserem Validierung erfüllt die wichtigsten Parameter für INTERCEPT Behandlung sowie die Ziele für WBC Verschmutzung und Plättchenregenerationsrate wie in Tabelle 3 dargestellt.
Das INTERCEPT Verfahren zur Pathogeninaktivierung basiert auf der doppelten Dosis Thrombozytenkonzentrat mit einer einzigen INTERCEPT Verarbeitungssatzes durchgeführt. Die Verarbeitung enthält zwei integralen Vorratsbehälter, die der behandelten Einheit in zwei einzelne therapeutische Dosen Blutplättchen bei Beendigung des Weges aufgeteilt werden könnenogen Inaktivierung. Europäische Richtlinien verlangen, dass 75% der getesteten Einheiten ≥ 200x10 9 Blutplättchen enthalten pro therapeutischen Dose1; lokalen Anforderungen in Schweden verlangen, dass 75% der Anteile geprüft> enthalten 240x10 9 Thrombozyten pro Dosis. Nach INTERCEPT Behandlung betrug die durchschnittliche Thrombozytengehalt 265 ± 22 x 10 9 (n = 24). Außerdem trafen 88% der Anteile oder überschritten 240x10 9 Thrombozyten pro therapeutischen Dosis, dies ist auch im Rahmen der beiden europäischen Richtlinien und schwedischen Vorschriften. Siehe Abb. 1 & 2 für eine Darstellung der doppelte Dosis Leukozytenfilm Vorbereitung und INTERCEPT Behandlungsverfahren sind.
Aus diesem Validierung, maßen wir die in vitro-Eigenschaften der Thrombozytenkonzentrate nach INTERCEPT Behandlung (dh nach der Trennung in die einzelnen Vorratsbehältern); Parameter wurden über 7 Tagen Lagerung gemessen. Mittelwert und Standardabweichung wurden gesammeltBlutplättchen-Dosis, pH, pO 2, pCO 2, Lactat und Glucose Produktion Verbrauch.
Abbildung 3 zeigt die mittlere beginnend Blutplättchen Dosis der doppelten Dosis Plättchenkonzentrat vor INTERCEPT Behandlung und dem mittleren Plättchen-Dosis in jeder der Spaltprodukte nach der Behandlung über INTERCEPT 7 Tagen Lagerung. Platelet Verlust während der Lagerung betrug etwa 9%. Diese Reduktion ist nicht verschieden von den erwarteten Verlust von Thrombozyten während der Lagerung von konventionellen Thrombozyten. 2
Tabelle 4 fasst die in vitro Eigenschaften der INTERCEPT Blutplättchen nach der Behandlung und Aufteilen in einzelne Einheiten.
Per europäischen Anforderungen, muss der pH-Wert der Blutplättchen über 6,4 bis zum Ende der Haltbarkeitsdauer bleiben. Während der Verarbeitung, Konzentrate der pH der Thrombozyten fällt leicht auf der Blutplättchenkonzentration, Volumen und die Gasdurchlässigkeit der Blutplättchen basiert stoWut Behälters. 4 stellt den pH-Wert der geteilten Thrombozytenprodukten über 7 Tagen Lagerung. Während der Lagerung, ist der pH-Wert stabil und gut innerhalb der Verarbeitungsanforderungen aufrechterhalten.
Wie in 5A und 5B, der Thrombozyten-O 2-Verbrauch und die CO 2-Produktion zeigen an, setzte die Atmung durch die INTERCEPT Blutplättchen im PL2410 Behälter während 7 Tagen Lagerung. 6A und 6B zeigen die Laktat und Glukose über 7 Tagen Lagerung . Blutplättchen-Glucose und Lactatproduktion stimmen miteinander während der 7-tägiger Lagerung. 5 Einheiten hatten Glukosespiegel weniger als 1,11 mmol / l (die Untergrenze für das Glucose-Assay).
Der Buffy-Coat-Zubereitung und Bündelung Validierung produziert Thrombozytenkonzentrate, dass trafen die Eingangs-Kriterien für INTERCEPT Behandlung; speziell, Volumen, Thrombozytenzahl, Plasma-Verhältnis und rot blood Zellkontamination. Die letzten Einheiten erfüllt die Prüfkriterien über 7 Tage der Lagerung einschließlich Thrombozyten Dosis und pH-Wert.
| Parameter | Target Range | Ergebnisse Mittelwert ± SD |
| Volumen (ml) | ~ 48 | 46 ± 2 |
| Hämatokrit (%) | ~ 37 | 37 ± 3 |
| Halten Sie Zeit vor Pooling | Übernachtung auf Rührwerk | Übernachtung auf Rührwerk |
Tabelle 1. Merkmale der einzelnen Buffy Coats (n = 19).
| Parameter | Target Range | Ergebnisse Mittelwert ± SD |
| Volumen (ml) | ~ 600 | 615 ± 5 |
| Hematocrit (%) | ~ 20 | 19 ± 1 |
| Haltezeit vor der Zentrifugation | 1 h auf Rührwerk | 1 h auf Rührwerk |
Tabelle 2. Merkmale der Buffy Coat Pools (n = 12).
| Parameter | Ziel | Ergebnisse Mittelwert ± SD |
| Volumen (ml) | 370 bis 420 | 404 ± 8 |
| Thrombozytenzahl (x10 9 / Einheit) | 250 bis 700 | 577 ± 62 |
| Mittlere Platelet Recovery (%) | ≥ 75 | 75 ± 4 |
| Plasma-Ratio (%) | 32 bis 47 | 38 ± 1 |
| RBC (x10 6 / ml) | ≤ 4 | 1,2 ± 0,4 |
| WBC (x10 6 / Einheit) | ≤ 1 | 0,11 ± 0,1 |
| Halten Sie Zeit vor INTERCEPT (hr) | ≤ Ende von Tag 1 | ≤ Ende von Tag 1 |
Tabelle 3. Merkmale des Double-Dose Thrombozytenkonzentraten (n = 12).
| Mittelwert ± Standardabweichung | Min | Max | |
| Volumen (ml) | 199 ± 16 | 182 | 236 |
| Thrombozytenzahl (x10 9 / Einheit) | 265 ± 22 | 225 | 292 |
| pH (22 ° C) | 6,9 ± 0,1 | 6,8 | 7,0 |
| pO 2 (kPa) | 21,4 ± 4,8 | 12,8 | 27,3 |
| pCO 2 (kPa) | 4,3 & plusmn; 0,4 | 3,3 | 4,9 |
| Lactat (mmol / l) | 9,1 ± 1,7 | 6,8 | 12,4 |
| Glucose (mmol / l) | 5,3 ± 0,9 | 3,7 | 6,5 |
Tabelle 4. Merkmale des INTERCEPT behandelte Thrombozyten Day 1/2 (Einzel-Units, n = 24).
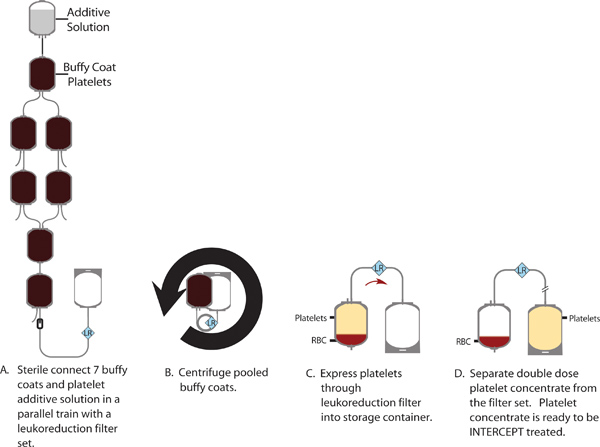
Abbildung 1. Herstellung einer doppelten Dosis Thrombozytenkonzentrat aus einem Pool von 7 buffy coats.
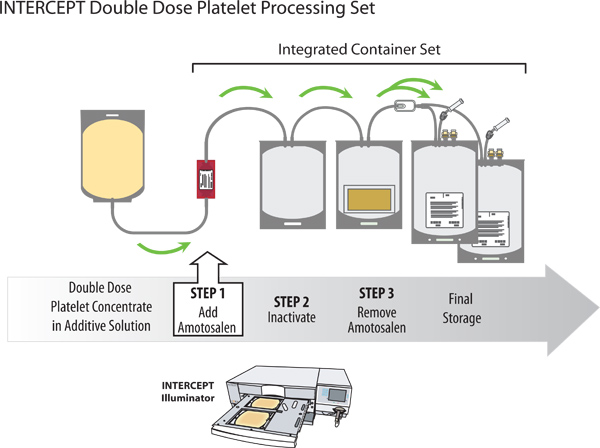
Abbildung 2. Pathogeninaktivierung einer doppelten Dosis Thrombozytenkonzentrat mit dem INTERCEPT Blood System.
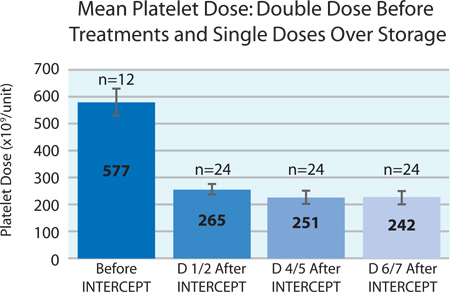
Abbildung 3. Mittlere Blutplättchen Dosis vor und für7 Tage nach INTERCEPT-Behandlung (n = 12 vor INTERCEPT; n = 24 nach INTERCEPT).
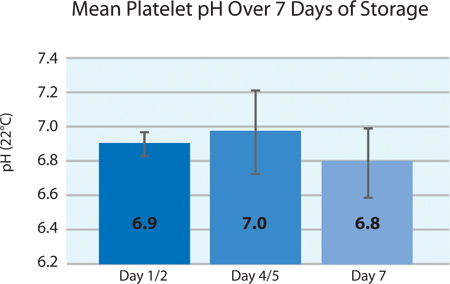
Abbildung 4. Mittelwert ± SD pH Blutplättchen nach INTERCEPT Behandlung (n = 24).
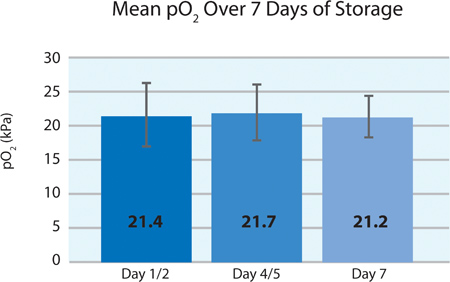
5A. Mittelwert ± SD pO 2 nach INTERCEPT Behandlung (n = 24).
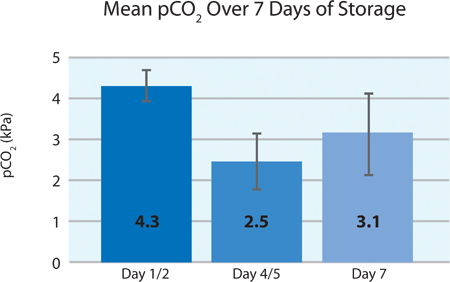
5B. Mittlere pO 2 ± SD nach INTERCEPT-Behandlung (n = 24).
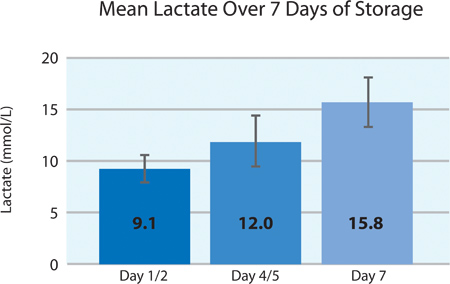
6A. Mittlere Laktatwerte ± SD nach INTERCEPT-Behandlung (n = 24).
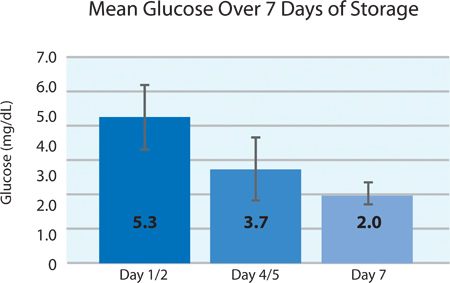
6B. Mittlere Blutzuckerwerte ± SD nach INTERCEPT-Behandlung (n = 24).
Diskussion
Buffy coat Thrombozyten erfordern mehrere Verarbeitungsschritte, die sich in der Post-Inkassokosten, einschliesslich Personal Zeit, Verbrauchsmaterialien, Geräten und Abfällen, die faktorisiert werden muss in die Gesamtkosten der Herstellung der Thrombozyten-Einheiten. Verbesserung der Plättchenausbeute voneinander Leukozytenmanschette (über die Optimierung der Leukozytenmanschette Volumen und Hämatokrit) erlaubt die Herstellung einer doppelten Dosis Leukozytenmanschette Blutplättchen Einheit aus einem Pool von sieben Buffy Coats. Wenn diese Optimierung durchgeführt wird, benötigt die Anzahl der Buffy Coats, um eine feste Anzahl von Blutplättchen Dosen produzieren kann reduziert werden, wodurch die Gesamtauslastung des Buffy Coats und ermöglicht die Produktion von zusätzlichen Thrombozytenkonzentrate (PCs). Personalzeiterfassung sowie Verbrauchsmaterialien und Geräte Kosten wie Bündelung Sets, Thrombozyten Additiv-Lösung, sterile Verbindung Wafer-, Filter-Sets, und Zentrifugation Verfahren um bis zu 50% reduziert. Neben der Optimierung Thrombozyten Produktion und die Reduzierung damit verbundenen Kosten, this Pooling Verfahren können ein Plättchenkonzentrat (PC), die die Eingabe Anforderung für die Verwendung mit dem Vorratsbehälter INTERCEPT dualen Verarbeitungssatz erfüllt, so dass wir in unseren verbesserten Schutz Transfusionsempfängern sowie bereitzustellen.
Das INTERCEPT Blood System für Pathogeninaktivierung verwendet Amotosalen und UV-A (UVA) Licht kovalent vernetzen DNA und RNA und verhindert Nucleinsäurereplikation und Rendering Krankheitserreger nicht eine Krankheit verursachen. 3 Es effektiv inaktiviert ein breites Spektrum von Krankheitserregern wie Viren, Bakterien , Parasiten und verunreinigen Spender weißen Blutkörperchen. 4-6 INTERCEPT bietet eine Alternative zu den aktuellen Tests Paradigma für auftauchende Krankheitserreger, die in der Vergangenheit eine wesentliche Verzögerung, während ein neuer Test entwickelt und letztendlich erfordert eine erhebliche finanzielle Investition zu realisieren, wenn ein Test zur Verfügung stehen. 7,8 Es kann auch eine Alternative redundante Sicherheitssysteme Messres wie bakterielle Detektion 9 und Gamma-Bestrahlung. 10-12 Darüber hinaus ermöglicht INTERCEPT uns doppelte Dosis Thrombozyteneinheiten behandeln welche Vorteile unsere Effizienz in der Produktion und hilft uns, unsere Budgets einzuhalten.
INTERCEPT und die doppelte Dosis Leukozytenmanschette Verfahren kann auf eine Vielzahl von Blut entfernt Workflows angepasst werden. Als Beispiele kann Vollblut Sammlungen auf 500 ml erhöht werden; Sammlungen könnte auch über Nacht bei 22 ° C gelagert werden, vor der Trennung. Darüber hinaus ist eine alternative Leukozytenmanschette Pooling Verfahren möglich (z. B. eine Krake Verfahren statt einer Zug-Methode) und / oder eine automatische Vorrichtung (zB TACSI) kann für die zweite Zentrifugation und Abtrennung der Blutplättchensuspension von den restlichen Erythrozyten verwendet werden .
Wenn erhöhte Thrombozytengehalt benötigt wird, sind mehrere Techniken verfügbar, einschließlich Vorauswahl von Spendern auf Thrombozytenzahl, Nacht-Inkubation des Vollblutes, einstellbar basierendtment Zentrifugation Einstellungen oder die Verwendung eines Pools von 8 buffy coats anstelle von 7.
Aufgrund der Beschränkung der gegenwärtig verfügbaren Pooling setzt und die Kapazität der Zentrifugenbehälter sollte das Gesamtvolumen der Leukozytenmanschette Pool etwa 600 ml betragen. Die Zentrifugation und Einstellungen in diesem Protokoll beschriebenen wurden optimiert, um Produkt, das INTERCEPT Parameter erfüllt für einen Pool von 7 buffy coats ergeben. Die Zentrifugation Einstellungen müssen geändert werden, wenn die Zahl der Buffy Coats im Pool wird geändert werden.
In einigen Ländern ist die minimale Thrombozyten höhere Dosis und die QC-Anforderungen sind strenger als in Schweden. Als solches kann unsere Ergebnisse nicht universell anwendbar. In diesen Ländern wird die doppelte Dosis PC vor INTERCEPT Behandlung benötigen, um eine größere Anzahl von Blutplättchen enthalten, um lokale Anforderungen nach INTERCEPT Behandlung und Split zu erfüllen. Da die maximale Thrombozytengehalt und Behandlung Volumen for INTERCEPT sind 7x10 11 Blutplättchen und 420 ml, wird der Anteil an Einheiten, die dem Zwischenverarbeitungsuntersystem zu übertreffen und bei zu geringer Gehalt an Blutplättchen in zwei therapeutischen Dosen aufgeteilt werden, abhängig von Faktoren wie der lokalen Voraussetzungen für die Blutplättchen-Dosis, QC Kriterien, Buffy-Coat-Optimierung Ergebnisse und Produktion Stabilität.
Wenn eine doppelte Dosis PC übertrifft die INTERCEPT Anforderungen an die Verarbeitung, kann es manuell eingestellt werden, um die Anforderungen zu erfüllen und anschließend behandelt. In den wenigen Gelegenheiten, bei denen die 7-Buffy-Coat-Pool liefert unzureichende Thrombozyten für eine doppelte Dosis Produkt nach INTERCEPT, wählen wir nicht die INTERCEPT Behandlung durchzuführen. Alternativ können andere Blutzentren entscheiden, den PC mit einer einzigen Dosis INTERCEPT Verarbeitungssatz (dh die großvolumige set) zu behandeln und Speichern des PC als einzelne therapeutische Dosis größer, wodurch eine Pathogeninaktivierung auf alle Einheiten. Um sicherzustellen, dass wir unserenQC Anforderungen und Pathogen zu inaktivieren, da viele unserer Thrombozyteneinheiten möglichst wir Buffy Coats auf den Donor Blutplättchen, die, wenn sie vereinigt, in einem minimalen Gehalt an Blutplättchen 5.6x10 11 Blutplättchen in dem Pool führt auszuwählen. Dies gewährleistet eine ausreichende Thrombozytengehalt zwei therapeutischen Dosen nach INTERCEPT Behandlung herzustellen.
Unsere Validierung zeigt, dass 7 Vollblut gewonnen Leukozytenfilm Einheiten erfolgreich gebündelt werden und mit dem INTERCEPT Verfahren für Blutplättchen, was in 2 Erregers inaktivierten Thrombozyten Produkte erfüllen die Aufnahmekriterien für die Herstellung von (Swedish Anforderungen und europäischen Richtlinien) und für die Unterstützung der Patienten erfordern Thrombozyten-Transfusionen nach klinischen Leitlinien und Standards Thrombozyten Infusionsverfahren in Schweden.
Offenlegungen
Produktion und den freien Zugang zu diesem Artikel durch Cerus gesponsert.
Danksagungen
Finanzierung für die Veröffentlichung von Cerus Corp, Hersteller des INTERCEPT Blood System zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Material / Equipment | Company | Catalogue Number | Comments |
| Whole blood donation, primary separation, and platelet production | |||
| Blood collection pack | Fenwal | R6485 | Top/Bottom set |
| Automated component extractor | Fenwal | Optipress-II | |
| Blood mixer and balance system | Baxter | Easymix V3 | |
| Platelet leukocyte filtration set | Fenwal | K4R7042 | |
| Centrifuge | Hettich | Roto Silenta 63 RS | Version 5.5 |
| Platelet additive solution - SSP+ | MacoPharma | SSP2030U | 300 ml |
| Sterile tubing welder | Terumo | T-SCD | |
| INTERCEPT treatment & storage | |||
| INTERCEPT processing set | Cerus | INT2503 | Dual Storage (DS) set |
| INTERCEPT Illuminator | Cerus | INT100 | |
| PC sample pack | Fenwal | FTX 1122 | |
| Incubator | Helmer | PC2200/PC3200 | |
| Agitator | Helmer | PF48H/PF96H | |
| Evaluation of in vitro Platelet Function | |||
| Blood gas analyzer | Radiometer | ABL 735 | Used for pH, blood gases, and lactate measurement |
| Chemistry system | Ortho Clinical Diagnostic | Vitros 5.1 | Used for glucose measurement |
| Hematology analyzer | Boule Medical AB | Medonic CA620-Cellguard | Used for platelet count measurement |
| Flow cytometer | BD | FACSCanto | Used for white blood cell measurement |
Referenzen
- . . Guide to the preparation, use and quality assurance of blood components. , (2010).
- Van Rhenen, D. J., Vermeij, J., Mayaudon, V., et al. Functional characteristics of S-59 photochemically treated platelet concentrates derived from buffy coats. Vox Sang. 79, 206-214 (2000).
- Wollowitz, S. Targeting DNA and RNA in pathogens: mode of action of amotosalen HCl. Transfus. Med. Rev. 31, 11-16 (2004).
- Irsch, J., Lin, L. Pathogen Inactivation of Platelet and Plasma Blood Components for Transfusion Using the INTERCEPT Blood SystemTM. Transfus. Med. Hemother. 38, (2011).
- Lin, L., Dikeman, R., Molini, B., et al. Photochemical treatment of platelet concentrates with amotosalen and long-wavelength ultraviolet light inactivates a broad spectrum of pathogenic bacteria. Transfusion. 44, 1496-1504 (2004).
- Lin, L., Hanson, C., Alter, H., et al. Inactivation of viruses in platelet concentrates by photochemical treatment with amotosalen and long-wavelength ultraviolet light. Transfusion. 45, 580-590 (2005).
- Allain, J. P., Cianco, C., Blajchman, A., et al. Protecting the blood supply from emerging pathogens: the role of pathogen inactivation. Transfus. Med. Rev. 19, 110-126 (2005).
- Stramer, S., Hollinger, F., Katz, L., et al. Emerging infectious disease agents and their potential threat to transfusion safety. Transfusion. 49, 1S-29S (2009).
- Nussbaumer, W., Allesdorfer, D., Grabmer, C., et al. Prevention of transfusion of platelet components contaminated with low levels of bacteria: a comparison of bacteria culture and pathogen inactivation methods. Transfusion. 47, 1125-1133 (2007).
- Schlenke, P. Protection against Transfusion-Associated Graft-versus-Host Disease in Blood transfusion: Is Gamma-Irradiation the Only Answer? Transfus. Med. Hemother. 31, 24-31 (2004).
- Lin, L., Corash, L., Osselear, J. C. Protection Against TA-GVHD Due to Platelet Transfusion By Using Pathogen Inactivation with the INTERCEPT Blood SystemTM - Gamma Irradiation is Not the Only Answer. Haematologica. 95 (Extra 1), 230-237 (2010).
- Corash, L., Lin, L. Novel processes for inactivation of leukocytes to prevent transfusion-associated graft-verus-host disease. Bone Marrow Transplant. 33, 1-7 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten