Method Article
הכנה ואיון פעולה של הפתוגן מוצרי Double מנת באפי Coat טסיות דם באמצעות מערכת הדם ליירט
In This Article
Summary
מאמר זה מתאר את התהליך שבו בית החולים של אוניברסיטת Örebro לייצר טסיות כפולות מנת אפי מעייל מתרכז הוכנו מתרומות דם שלמות וטופלו במערכת הדם ליירט לאיון הפתוגן. במבחנה איכות של יחידות טסיות הסופיות מוערכת על פני 7 ימים של אחסון.
Abstract
מרכזי דם מתמודדים עם אתגרים רבים, כולל תשואה למקסם הפקה מתרומות הדם שהם מקבלים המוצר כמו גם להבטיח רמת הבטיחות הגבוהה עבור חולי עירוי, כולל הגנה מפני מחלות המועברות במגע עירוי. זה חייבת להתבצע באופן אחראי מבחינה כספי אשר ממזער את ההוצאות תפעוליות, כולל חומרים מתכלה, ציוד, פסולת, ועלויות כוח אדם, בין שאר.
מספר שיטות זמינות כדי לייצר טסיות דם מתרכזת בעירוי. האחד הנפוץ ביותר הוא שיטת המעייל באפים שביחידת טסיות טיפולית יחידה (2.0 ≥ 11 טסיות X10 ליחידה או לתקנות מקומיות) הוא הוכן על ידי איגום שכבת המעייל באפים עד שש מתרומות דם שלמות. הליך להפקה "מנה כפולות" טסיות דם כל נגזרים רק לאחרונה פותח.
מוצגת כאן היא שיטה חדשנית להכנהכל טסיות דם מנה כפולות נגזרות מתרכזות מברכות של 7 מעיילי באפי ולאחר מכן טיפול ביחידות המנה הכפולות עם מערכת הדם ליירט לאיון הפתוגן. ליירט פותח כדי לנטרל וירוסים, חיידקים, טפילים ותאים לבנים תורמים מזהמים שעלולה להיות נוכח בדם שנתרם. שיוך ליירט בשיטת הפרווה הכפולה מנת האפים על ידי ניצול העיבוד ליירט גדר עם מכל אחסון כפול ("סט DS"), מאפשר למרכזי דם לטיפול בכל אחת מיחידות המנה הכפולות שלהם בסט עיבוד בודד פתוגן איון, ובכך למקסם את בטיחות מטופל תוך מזעור עלויות. שיטת הפרווה הכפולה מנת האפים דורשת מעיילי אפים פחות ומפחיתה את השימוש בחומרים מתכלה על ידי עד 50% (סטים כגון איגום, מערכות סינון, פתרון תוסף טסיות דם, וופלי חיבור סטריליים) בהשוואה להכנה וטיפול ביחידות בודדות במינון אפי מעייל טסיות . חיסכון בעלויות אחר כולל פחות פסולת, פחות הציוד maintenance, דרישות הספק נמוכות, הקטין זמן אנשים, ועלות גבייה נמוכה בהשוואה לטכניקת אפרזיס.
Protocol
1. איסוף דם שלם
- לאסוף את כל דם מתורמים מתנדבים בראש 450 מ"ל / אוסף תחתון קובע על פי הנחיות איסוף דם מקומיות.
- כל הדם מאוחסן למינימום של 2 שעות על פלטת קירור לפני צנטריפוגה והפרדה.
2. הכנת מעייל באפים
- צנטריפוגה כל הדם באמצעות ספין קשה להפריד בין הדם לשלוש שכבות: תאי דם אדומים, מעייל באפים, ופלזמה. פרמטרים בם השתמשו היו צנטריפוגות 4880 RCF עבור 11 דקות ב 22 ± 2 ° C.
- השתמש מפריד דם אוטומטי להביע את הפלזמה אל שקית הלווין העליונה ואת תאי הדם האדומים (RBC) לתוך שקית הלווין התחתונה, עוזב את המעייל באפים במכל האיסוף. מתכוון למקד טווחי נפח והמטוקריט למעיילי אפים הם כ 48 מ"ל ו 37%, בהתאמה.
- את מעיילי האפים מאוחסנים במשך הלילה על תועמלן טסיות דם בגיל 22 ± 2 ° C.
s = "jove_title"> 3. אפי פרוות איגום
- 7 חבר סטרילי אפי מעיילים ו300 מ"ל של פתרון + תוסף טסיות SSP (PAS) בתצורת רכבת עם קווים מקבילים לצמצם את אורך הרכבת; PAS צריך להיות בחלק העליון של הרכבת. מהדק את הקו בין PAS והמעייל באפים הראשון.
- פתח את החיבורים סטריליים בין יחידות מעייל באפים ולאפשר אפי מעיילים כדי לנקז לתוך המכל האחרון.
- פתח את הריתוך והמהדק בין PAS והמעייל באפים הראשון. אפשר שליש מפתרון התוסף לשטוף דרך כל אחד ממכלי המעייל באפים ברצף. חזור על 2 יותר פעמים בכל שעה באמצעות מחצית מPAS הנותר.
- נפח ברכת המעייל באפים הממוצע צריך להיות כ 600 מ"ל. אם נפח היעד והמטוקריט של מעיילי האפים הבודדים הם נפגשו, יחס הפלזמה של 32 - 47%, כנדרש לטיפול האיון הפתוגן ליירט מאוחר יותר בתהליך.
- השלך SSP + הריקים ואפיםמכולות מעייל.
- להתאוששות טסיות אופטימלית, לשמור על הברכה המסיתה ל1 שעה לפני צנטריפוגה.
- סטרילי להתחבר מכל אחסון טסיות עם מסנן leukoreduction משולב לברכת המעייל באפים.
- לבצע "ספין רך" של ברכת המעייל באפים להפריד את תאי הדם האדומים מטסיות השעיה (462 RCF ל9 דקות, 20 שניות). בטא השעית טסיות באמצעות מפריד דם אוטומטי דרך מסנן leukoreduction לתוך מכל אחסון טסיות הדם.
- דרישות העיבוד שתוארו לעיל להבטיח כי השעית הטסיות עומדת במפרטים ליירט עיבוד של 300 מ"ל - בנפח 420 מ"ל, מינון 2.5-7.0 x 10 11 טסיות ו≤ 4 x 10 6 תאים אדומים / מ"ל.
4. ליירט טיפול
- לבצע את הטיפול ליירט לפני סוף יום 1 לאחר איסוף (יום 0 הוא היום של אוסף).
- לגולל את סט העיבוד ליירטעם מכלי אחסון כפול משקית הפלסטיק השקופה.
- סטרילי להתחבר מכל השעית טסיות לצינור של מכל amotosalen על סט העיבוד ליירט.
- תייג את מכלי האחסון להגדיר עיבוד ליירט עם זיהוי המוצר המתאים הדם בעקבות דרישות מקומיות.
- לתלות את טסיות הדם וההפסקה הראשונה צינורית התחתונה על מכל amotosalen, המאפשר פתרון amotosalen לזרום לתוך מכל התאורה. לשבור את הצינורית העליונה על מכל amotosalen מאפשר לטסיות הדם לזרום דרך מכל amotosalen לתוך מכל התאורה.
- בעדינות מערבב את תערובת טסיות הדם וamotosalen ולהביע את האוויר ממכל התאורה לתוך מכל amotosalen.
- בטא את כמות קטנה של תערובת טסיות הדם לצנרת, מילוי כ 4 סנטימטר של הצינור. הדבר מבטיח טסיות גם הצינורות ומכל תאורה לעבור inactivati הפתוגןבטיפול.
- לאטום את הצינור בין מכל התאורה ומכל amotosalen. השאר לא יותר מכ 4 סנטימטר של צינורות המשתרעים מיכל התאורה. להסיר ולסלק טסיות הריקה ומכולות amotosalen ולסגור את התפסים בשקיות הדגימה.
- הנח את מערך העיבוד לנורה עם מכל התאורה בתא הגדול בצד השמאל והמארגן בתא הקטן בצד ימין.
- השתמש במכשיר המוחזק ביד ברקוד להזין את זיהוי התרומה, קוד מוצר, והמספר הרבה מערך עיבוד למקור האור. סגור את מכסה מתכת וכאשר יתבקשו לעשות זאת בממשק הגרפי המאייר, לסגור את המגירה. לחץ "התחל" כדי להתחיל בתאורה.
- אחרי הארה, להסיר את ערכת העיבוד ממקור האור. הפנס אוטומטית מדפיס את דוח הטיפול ליחידת טסיות טופלה (הים).
- לגולל את המכולות מהמארגן ולתלות עמlatelets וערכת עיבוד, לשבור את הצינורית ביציאה ממכל התאורה, ולאפשר את טסיות הדם לזרום אל תוך מכשיר ספיחת המתחם (CAD) מיכל.
- טיפול שלא לכופף את רקיק CAD, להביע את האוויר ממכל CAD לתוך המכל את התאורה בעזרת פלזמה חולץ.
- לאטום צינור קרוב לנמל הכניסה של מכל CAD. להסיר ולסלק את מכל התאורה הריקה.
- הנח את מכל CAD עם מכלי אחסון המצורף על תועמלן טסיות דם לפחות 6 שעות, אך לא יותר מ 16 שעות. זה יגרום להפחתה של amotosalen שייר לריכוז של ≤ 2 מיקרומטר.
- לאחר טיפול CAD, להסיר את יחידות טסיות מההסתה. לתלות את טסיות הדם. לשבור את הצינורית ולאפשר לטסיות דם זורמות למכלי האחסון.
- בטא את האוויר ממכלי האחסון למכל CAD. בואו נחזור שיורי טסיות להתרכז לזרום לתוך מכלי אחסון על ידיכוח משיכה. לאטום את הצינורות מעל Y-המתאים ולהסיר את מכל CAD הריק.
- להפיץ את הנפח בין מכלי האחסון לפי צורך. התאמות נפח נעשות על ידי שקילת מכלי האחסון. לאטום צינור לכל מכל אחסון של כמה סנטימטרים מעל לכניסה של מכל האחסון, זה מקל על קבלת דגימה סטרילית מהמוצר הסופי כפי שמתואר ב5.2.
5. דגימת מוצר
- לבדיקה שגרתית QC, מכולות האחסון הסופיות ניתן לדגום פעם אחת על ידי שימוש בשקיק הדגימה במכלי האחסון. לשם כך, ודא יחידת הטסיות היא גם מעורבת, לאחר מכן פתח את המהדק לשקית ולסחוט כמה פעמים. לאטום צינור לאחר הכיס מלא בטסיות. להעביר את מדגם טסיות הדם לתוך מבחנת מעבדה מתאימה ולבצע מבחנים באופן מיידי.
- כדי להשיג דגימות בנקודתי זמן שונים במהלך האחסון, כגון לתיקוף, להתחבר סטרילימכל דגימה חדשה לצינור של מכל אחסון טסיות הדם. ודא שטסיות דם מעורבבות היטב לפני העברה למכל הדגימה.
6. בדיקת תפקודים במבחנה
- לצורך מחקר אימות זו, בהערכת המבחנה בוצע לאחר טיפול CAD (יום 1 או יום 2, לפי משך CAD) ושוב ביום 4 (או יום 5) ומדידות במבחנת היום 7. כלל נפח, ספירת טסיות דם, רמת חומציות, גזים בדם (PO 2, PCO 2), גלוקוז, חומצת חלב, ומסתחרר.
- נפח נקבע לפי משקל באמצעות 1.01 גרם / מ"ל כמשקל הסגולי של טסיות פתרון תוסף.
- זיהום המוגלובין הוערך חזותי באמצעות השוואה לתרשים צבע.
- מתערבלים נקבע באופן חזותי.
- ראה "לוח של ציוד" להמתודולוגיה של מבחנים אחרים.
7. נציג תוצאות
התהליך של הפקת דאפי מינון ouble מעייל טסיות מתחילות בייצור של מעיילי אפים בודדים אשר עומדים מפרטי היעד עבור נפח והמטוקריט. היות שאין זה מעשי למדוד המטוקריט של אפי מעיילי הפרט במהלך אימות התהליך הסופית, התחיל בביצוע מאמץ נפרד כדי לייעל אפי המעיילים שלנו על מנת להבטיח שאנחנו יכולים לפגוש בעקביות נפח היעד והמטוקריט. כפי שניתן לראות בטבלה 1, מעיילי האפים אופטימיזציה שלנו לעומת לטובה לערכי היעד עבור נפח והמטוקריט ב46 ± 2 מ"ל ו 37 ± 3%, בהתאמה.
לאחר האיגום, הנפח והמטוקריט של ברכת המעייל באפים צריך להיות כ 600 מ"ל ו 20%, בהתאמה, לפני צנטריפוגה הספין הרכה. כפי שמתואר בטבלה, 2 ברכות המעייל באפינו בממוצע 615 ± 5 מ"ל; המטוקריט ממוצע 19 ± 1%.
תוצאות צנטריפוגה הספין הרכות בקונצרט כלשהו טסיות דם מנה כפולהentrate שיעמוד בדרישות הקלט לאיון הפתוגן ניצול הסט ליירט דם מערכת DS העיבוד. פרמטרי קלט עיקריים לטיפול ליירט כוללים ספירת נפח, טסיות דם, יחס פלזמה, ותוכן RBC. בנוסף, אנו שואפים לשחזר ≥ 75% מטסיות תרכיז טסיות בהשוואה לברכת המעייל באפים. לדרישות מקומיות, תאי הדם הלבן הזיהום (WBC) חייב להיות <1x10 6 יחידה /. טסיות הדם מתרכז באימות שלנו פגשו את הפרמטרים המרכזיים לטיפול ליירט, כמו גם את המטרות לזיהום WBC וטסיות התאוששות כפי שמוצג בטבלה 3.
תהליך היירוט לאיון הפתוגן מבוצע על תרכיז טסיות מנה הכפולה באמצעות מערך עיבוד ליירט אחת. סט העיבוד מכיל שני מכלי אחסון אינטגרלי המאפשרים למטופלי היחידה תפוצל לשתי מנות טסיות טיפוליות בודדות בסיום הדרךתהליך איון עוגן. הנחיות אירופיות דורשות כי 75% מיחידות שנבדקו מכילים ≥ 200x10 9 טסיות לטיפוליים dose1; דרישות מקומיות בשוודיה דורשות כי 75% מהיחידות שנבדקו מכילים> 240x10 9 טסיות למנה. לאחר הטיפול ליירט, תוכן טסיות הדם הממוצע היה 265 ± 22 x10 9 (n = 24). יתר על כן, 88% מיחידות נפגשו או החריגה 240x10 9 טסיות למינון טיפולי, וזאת גם בתוך שני ההנחיות האירופיות והתקנות שבדיות. ראה איורים 1 ו 2 לאיור של הכנת המנה הכפולה אפי המעייל ותהליכי טיפול ליירט בהתאמה.
לאימות זה, אנו נמדדים במאפייני מבחנה של טסיות הדם מתרכז לאחר טיפול יירוט (כלומר, לאחר פיצול לתוך מכל האחסון הנפרד); נבדק פרמטרים של מעל 7 ימים של אחסון. ממוצע והסטייה נאספה עבורמינון הטסיות, pH, ת.ד. 2, PCO 2, ייצור חומצת חלב וצריכת גלוקוז.
איור 3 מציג את הממוצע החל מינון הטסיות של תרכיז טסיות מנה הכפול לפני הטיפול ליירט ומנת טסיות הממוצעת בכל אחד מהמוצרים המפוצלים לאחר טיפול ליירט מעל 7 ימים של אחסון. אובדן טסיות במהלך האחסון היה כ 9%. הפחתה זו אינה שונה מההפסד הצפוי של טסיות דם במהלך האחסון של טסיות דם קונבנציונליות. 2
טבלה 4 מסכמת את מאפייני מבחנה בשל טסיות ליירט לאחר טיפול ופיצול ליחידות בודדות.
לדרישות אירופיות, ה-pH של טסיות חייבת להישאר מעל 6.4 ועד לסוף חיי מדף. במהלך עיבוד, ה-pH של טסיות הדם מתרכזת טיפין המבוססות על מעט ריכוז טסיות הדם, נפח וחדירות הגז של sto טסיותמכל זעם. איור 4 ממחיש את ה-pH של מוצרי טסיות המפוצלים על פני 7 ימים של אחסון. במהלך אחסון, pH הוא יציב ומטופח בדרישות העיבוד.
כפי שניתן לראות בתרשימים ו5A 5B, 2 צריכת O טסיות הדם וייצור CO 2 מצביעים נשימה המשיכה בלוחיות החיתוך בPL2410 המכל במהלך 7 ימים של אחסון. תרשימי 6A ו6B להראות את רמות חומצת החלב והסוכר מעל 7 ימים של אחסון . צריכת גלוקוז טסיות דם וייצור חומצת חלב עולות בקנה אחד עם השני במהלך 7 הימים של אחסון. 5 יחידות היו רמת הגלוקוז בפחות מ 1.11 mmol / l (הגבול התחתון לבדיקת גלוקוז).
הכנת המעייל באפים וטסיות דם איגום אימות מיוצרות תרכיזים שעמד בקריטריונים לטיפול בקלט ליירט; במיוחד, נפח, ספירת הטסיות, יחס פלזמה, ואדום blזיהום התא ood. היחידות הסופיות עמדו בקריטריוני האימות מעל 7 ימים של אחסון, כולל מינון וחומציות טסיות דם.
| פרמטר | יעד | תוצאות ממוצעות ± SD |
| נפח (מ"ל) | ~ 48 | 46 ± 2 |
| המטוקריט (%) | ~ 37 | 37 ± 3 |
| להחזיק זמן רב לפני האיגום | לינה במסית | לינה במסית |
לוח 1. מאפיינים של באפי מעיילי הפרט (n = 19).
| פרמטר | יעד | תוצאות ממוצעות ± SD |
| נפח (מ"ל) | ~ 600 | 615 ± 5 |
| Hematocrit (%) | ~ 20 | 19 ± 1 |
| להחזיק זמן רב לפני צנטריפוגה | 1 שעה במסית | 1 שעה במסית |
טבלה 2. מאפייני ברכות המעייל באפים (n = 12).
| פרמטר | יעד | תוצאות ממוצעות ± SD |
| נפח (מ"ל) | 370-420 | 404 ± 8 |
| ספירת הטסיות (9 / יחידת x10) | 250-700 | 577 ± 62 |
| משמעות החלמת טסיות דם (%) | ≥ 75 | 75 ± 4 |
| יחס פלזמה (%) | 32-47 | 38 ± 1 |
| RBC (6 x10 / מ"ל) | ≤ 4 | 1.2 ± 0.4 |
| WBC (6 x10 / יחידה) | ≤ 1 | 0.11 ± 0.1 |
| להחזיק זמן רב לפני ליירט (שעות) | ≤ הסוף של היום 1 | ≤ הסוף של היום 1 |
לוח 3. מאפיינים של טסיות הדם במינון כפול תרכיזים (n = 12).
| ממוצע ± SD | דקות | מקס | |
| נפח (מ"ל) | 199 ± 16 | 182 | 236 |
| ספירת הטסיות (9 / יחידת x10) | 265 ± 22 | 225 | 292 |
| pH (22 מעלות צלזיוס) | 6.9 ± 0.1 | 6.8 | 7.0 |
| ת.ד. 2 (kPa) | 21.4 ± 4.8 | 12.8 | 27.3 |
| PCO 2 (kPa) | 4.3 & plusmn; 0.4 | 3.3 | 4.9 |
| לקטט (mmol / L) | 9.1 ± 1.7 | 6.8 | 12.4 |
| גלוקוז (mmol / L) | 5.3 ± 0.9 | 3.7 | 6.5 |
טבלה 4. מאפיינים של היום ליירט מטפל בטסיות הדם 1/2 (יחידות בודדות, n = 24).
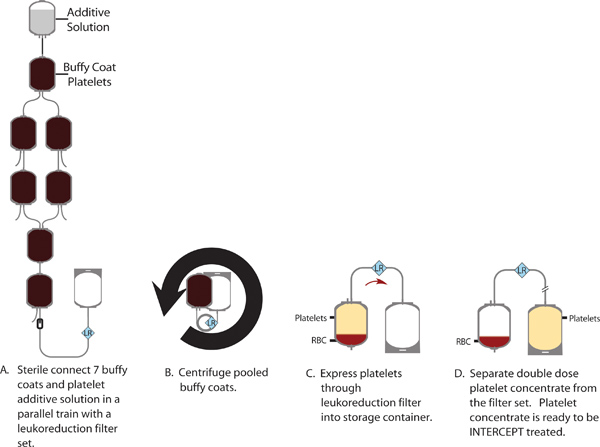
איור 1. ייצור של תרכיז טסיות מנה כפולה ממאגר של 7 אפי מעיילים.
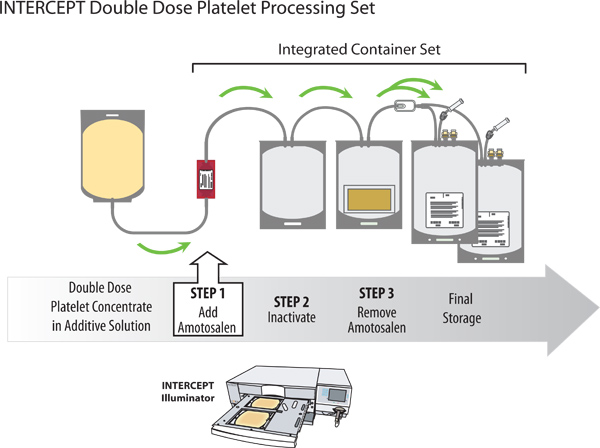
איור 2. איון פתוגן של תרכיז טסיות מנה כפולה עם מערכת הדם ליירט.
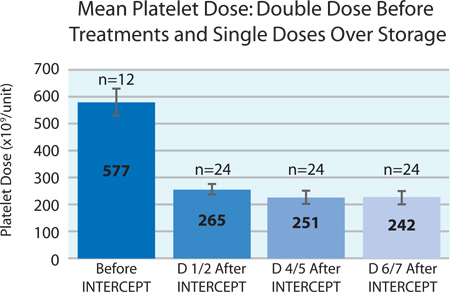
איור 3. מינון ממוצע של טסיות דם לפני ובמשך7 ימים לאחר טיפול ליירט (n = 12 לפני החיתוך; n = 24 לאחר יירוט).
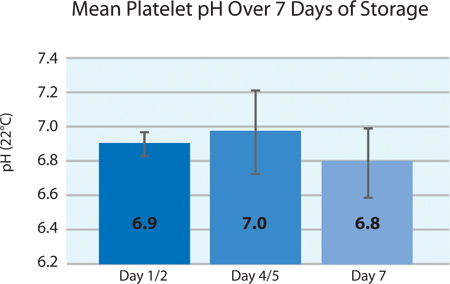
איור 4. Mean pH טסיות ± SD לאחר טיפול ליירט (n = 24).
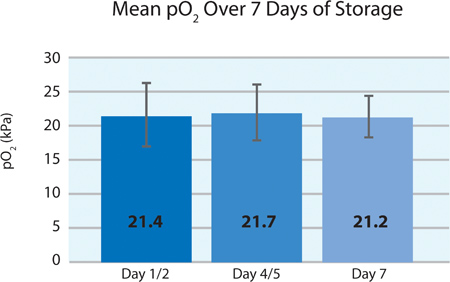
האיור 5 א. Mean PO 2 ± SD לאחר טיפול ליירט (n = 24).
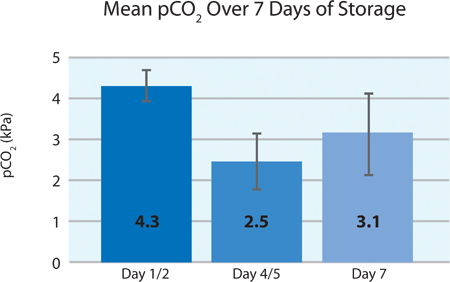
5B איור. Mean ת.ד. 2 ± SD לאחר טיפול ליירט (n = 24).
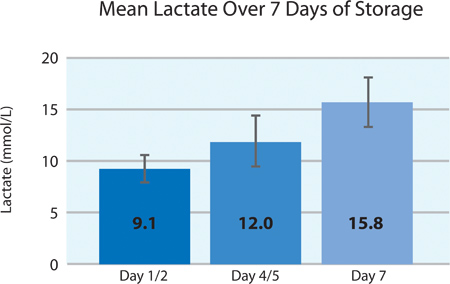
6A דמות. רמות ממוצעות של חומצת חלב ± SD לאחר טיפול ליירט (n = 24).
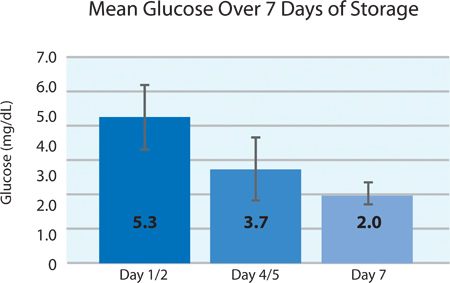
איור 6 ב. רמות ממוצעות של סוכר ± SD לאחר טיפול ליירט (n = 24).
Discussion
טסיות מעייל באפים דורשות מספר שלבי עיבוד שתוצאה בעלויות לאחר איסוף, כולל זמן כוח אדם, חומרים מתכלה, ציוד ופסולת, אשר חייבת להיות בחשבון את העלות הכוללת של הפקת יחידות טסיות הדם. שיפור תפוקת טסיות דם מכל מעייל באפים (באמצעות אופטימיזציה נפח מעייל באפים והמטוקריט) מאפשר ייצור של יחידה כפולה מנת אפי מעייל טסיות מברכה של שבעה מעיילים באפים. כאשר אופטימיזציה זו מתבצעת, מספר אפי המעיילים הנדרשים כדי לייצר מספר קבוע של מנות טסיות עשוי להיות מופחת, ובכך לשפר את הניצול הכולל של אפי מעיילים ומאפשר ייצור של טסיות דם נוספות מתרכז (מחשבים). זמן כוח אדם, כמו גם עלויות מתכלות וציוד כגון מקלטים נקווים, פתרון תוסף טסיות דם, ופלי חיבור סטריליים, ערכות מסננות, ונהלי צנטריפוגה מופחת בשיעור של עד 50%. בנוסף לייעול ייצור טסיות דם והפחתת עלויות נלוות, thiשיטה של האיגום יכול לייצר תרכיז טסיות (PC) שיעמוד בדרישת הקלט לשימוש עם הסט ליירט כפול אחסנת מכולות עיבוד, ומאפשרת לנו לספק הגנה משופרת למקבלי העירוי שלנו גם כן.
מערכת הדם ליירט לאיון הפתוגן משתמשת amotosalen וסגול בהירות (UVA) ל-DNA קוולנטית קישור לחצות ו-RNA, מניעת שכפול חומצות גרעין ופתוגנים טיוח שאינם מסוגל לגרום למחלה. 3 זה למעשה מנטרל קשת רחבה של פתוגנים, כולל וירוסים, חיידקים , טפילים, ותאי דם לבנים מזהמים תורם. 4-6 ליירט מספק חלופה לפרדיגמה הנוכחית הבדיקות לפתוגנים מתעוררים, שמבחין הסטורי כרוכה עיכוב משמעותי בזמן בדיקה חדשה שפותחה וסופו של דבר דורשת השקעה כספית משמעותית ליישום בעת מבחן הופך להיות זמין. 7,8 זה גם יכול לספק חלופה לבטיחות measu המיותרמיל כגון גילוי חיידקים 9 וקרינת גמא. 10-12 בנוסף, ליירט מאפשר לנו לטפל ביחידות טסיות מנה כפולות אשר יתרונות יעילות הייצור שלנו ומסייע לנו לדבוק בתקציבים שלנו.
ליירט ושיטת הפרווה הכפולה מנת האפים ניתן להתאים למגוון רחב של תהליכי עבודה במרכז בדם. כדוגמאות, אוספי דם מלאים ניתן להגדיל עד 500 מ"ל; אוספים גם יכולים להיות מאוחסנים בלילה 22 מעלות צלזיוס לפני ההפרדה. בנוסף, שיטה חלופית אפי מעייל וריכוז היא אפשרית (למשל שיטת תמנון במקום שיטת רכבת) ו / או מכשיר אוטומטי (למשל TACSI) יכול להיות מנוצל לצנטריפוגה השנייה וההפרדה של השעית טסיות הדם מהתאים האדומים שנותרו .
אם תוכן של טסיות דם מוגבר יש צורך, מספר טכניקות זמינות כוללות בחירה מראש של תורמים המבוססת על ספירת הטסיות, דגירת הלילה של הדם המלא, adjustment של הגדרות צנטריפוגה, או ניצול ברכה של 8 מעיילי אפים במקום 7.
בשל ההגבלה של איגום קובע זמין כרגע והקיבולת של דליי צנטריפוגות, הנפח הכולל של ברכת המעייל באפים צריך להיות כ 600 מ"ל. תהליך צנטריפוגה וההגדרות המתוארות בפרוטוקול זה המוטב להניב מוצר אשר עונו על הפרמטרים ליירט לברכה של 7 מעיילים באפים. הגדרות צנטריפוגה חייבות להיות שונות אם המספר באפי המעיילים בברכה הוא שונה.
במדינות מסוימות, במינון המינימאלי הוא טסיות הדם גבוה ודרישות QC הן קפדניות יותר מאשר בשוודיה. ככזה, התוצאות שלנו לא יכולות להיות אוניברסלי ישימות. במדינות אלו, מחשב המנה הכפולה לפני הטיפול ליירט יצטרך להכיל מספר גדול יותר של טסיות דם על מנת לעמוד בדרישות מקומיות לאחר טיפול ופיצול ליירט. בגלל תוכן הטסיות המרבי וטיפול הנפח for ליירט הם 7x10 11 טסיות ו420 מיליליטר בהתאמה, אחוז היחידות ומעבר לדרישות העיבוד ליירט או תוכן הטסיות מספיק כדי להיות מחולק לשני מינונים טיפוליים, ישתנה בהתאם לגורמים כגון דרישות מקומיות למנת טסיות, קריטריוני QC, תוצאות אפי מעייל לאופטימיזציה ויציבות ייצור.
אם מחשב של מנה כפולה עולה על דרישות העיבוד ליירט, זה יכול להיות מותאם באופן ידני כדי לעמוד בדרישות ובהמשך הטיפול. בפעמים המעטות שבו ברכת המעייל 7-האפים מניבה טסיות מספיקות למוצר מנה כפולה לאחר יירוט, אנו בוחרים שלא לבצע את הטיפול ליירט. לחלופין, מרכזי דם אחרים יכולים לבחור לטיפול במחשב עם סט אחד מינון ליירט עיבוד (כלומר סט הנפח הגדול) ולאחסן את המחשב כמינון טיפולי אחד גדול, ובזה עשה איון הפתוגן בכל היחידות. על מנת להבטיח שאנו פוגשיםדרישות QC ולפתוגן לנטרל כמה שיותר היחידות שלנו טסיות ככל האפשר, אנו בוחרים מעיילי אפים המבוססים על ספירת טסיות הדם התורם, שכאשר ראו נקווה, תוביל תוכן הטסיות מינימאלי של 11 5.6x10 טסיות בברכה. הדבר מבטיח תוכן הטסיות מספיק כדי לייצר שני מינונים טיפוליים לאחר טיפול ליירט.
האימות שלנו מוכיחה כי 7 יחידות שלמות דם שמקורם באפי מעייל ניתן נקוותה בהצלחה וטופלו בתהליך היירוט לטסיות דם, וכתוצאה מכך 2 מוצרי טסיות מומתים פתוגן שעומדות בקריטריונים לקבלה לייצור (דרישות שבדיות והנחיות אירופיות) ולתמיכה בחולים דורש עירויי טסיות בהתאם להנחיות קליניות ושיטות עירוי טסיות סטנדרטיות בשבדיה.
Disclosures
הייצור והגישה חופשיה למאמר זה הוא בחסות Cerus.
Acknowledgements
מימון לפרסום מסופק על ידי Cerus קורפ, יצרנית של מערכת הדם ליירט.
Materials
| Name | Company | Catalog Number | Comments |
| Whole blood donation, primary separation, and platelet production | |||
| Blood collection pack | Fenwal | R6485 | Top/Bottom set |
| Automated component extractor | Fenwal | Optipress-II | |
| Blood mixer and balance system | Baxter | Easymix V3 | |
| Platelet leukocyte filtration set | Fenwal | K4R7042 | |
| Centrifuge | Hettich | Roto Silenta 63 RS | Version 5.5 |
| Platelet additive solution - SSP+ | MacoPharma | SSP2030U | 300 ml |
| Sterile tubing welder | Terumo | T-SCD | |
| INTERCEPT treatment & storage | |||
| INTERCEPT processing set |  Cerus Cerus | INT2503 | Dual Storage (DS) set |
| INTERCEPT Illuminator |  Cerus Cerus | INT100 | |
| PC sample pack | Fenwal | FTX 1122 | |
| Incubator | Helmer | PC2200/PC3200 | |
| Agitator | Helmer | PF48H/PF96H | |
| Evaluation of in vitro Platelet Function | |||
| Blood gas analyzer | Radiometer | ABL 735 | Used for pH, blood gases, and lactate measurement |
| Chemistry system | Ortho Clinical Diagnostic | Vitros 5.1 | Used for glucose measurement |
| Hematology analyzer | Boule Medical AB | Medonic CA620-Cellguard | Used for platelet count measurement |
| Flow cytometer | BD | FACSCanto | Used for white blood cell measurement |
References
- . . Guide to the preparation, use and quality assurance of blood components. , (2010).
- Van Rhenen, D. J., Vermeij, J., Mayaudon, V., et al. Functional characteristics of S-59 photochemically treated platelet concentrates derived from buffy coats. Vox Sang. 79, 206-214 (2000).
- Wollowitz, S. Targeting DNA and RNA in pathogens: mode of action of amotosalen HCl. Transfus. Med. Rev. 31, 11-16 (2004).
- Irsch, J., Lin, L. Pathogen Inactivation of Platelet and Plasma Blood Components for Transfusion Using the INTERCEPT Blood SystemTM. Transfus. Med. Hemother. 38, (2011).
- Lin, L., Dikeman, R., Molini, B., et al. Photochemical treatment of platelet concentrates with amotosalen and long-wavelength ultraviolet light inactivates a broad spectrum of pathogenic bacteria. Transfusion. 44, 1496-1504 (2004).
- Lin, L., Hanson, C., Alter, H., et al. Inactivation of viruses in platelet concentrates by photochemical treatment with amotosalen and long-wavelength ultraviolet light. Transfusion. 45, 580-590 (2005).
- Allain, J. P., Cianco, C., Blajchman, A., et al. Protecting the blood supply from emerging pathogens: the role of pathogen inactivation. Transfus. Med. Rev. 19, 110-126 (2005).
- Stramer, S., Hollinger, F., Katz, L., et al. Emerging infectious disease agents and their potential threat to transfusion safety. Transfusion. 49, 1S-29S (2009).
- Nussbaumer, W., Allesdorfer, D., Grabmer, C., et al. Prevention of transfusion of platelet components contaminated with low levels of bacteria: a comparison of bacteria culture and pathogen inactivation methods. Transfusion. 47, 1125-1133 (2007).
- Schlenke, P. Protection against Transfusion-Associated Graft-versus-Host Disease in Blood transfusion: Is Gamma-Irradiation the Only Answer? Transfus. Med. Hemother. 31, 24-31 (2004).
- Lin, L., Corash, L., Osselear, J. C. Protection Against TA-GVHD Due to Platelet Transfusion By Using Pathogen Inactivation with the INTERCEPT Blood SystemTM - Gamma Irradiation is Not the Only Answer. Haematologica. 95 (Extra 1), 230-237 (2010).
- Corash, L., Lin, L. Novel processes for inactivation of leukocytes to prevent transfusion-associated graft-verus-host disease. Bone Marrow Transplant. 33, 1-7 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved