Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Pruebas de susceptibilidad a antibióticos inducidas por el estrés en un chip
En este artículo
Resumen
Hemos desarrollado una plataforma microfluídica para la prueba rápida de la susceptibilidad a los antibióticos. El líquido se pasa a altas velocidades sobre las bacterias inmovilizadas en el fondo de un canal microfluídico. En presencia de estrés y antibióticos, las cepas susceptibles de bacterias mueren rápidamente. Sin embargo, las bacterias resistentes pueden sobrevivir a estas condiciones estresantes.
Resumen
Hemos desarrollado un método microfluídico rápido para la prueba de la susceptibilidad a los antibióticos en un ambiente basado en el estrés. El líquido se pasa a altas velocidades sobre las bacterias inmovilizadas en el fondo de un canal microfluídico. En presencia de estrés y antibióticos, las cepas susceptibles de bacterias mueren rápidamente. Sin embargo, las bacterias resistentes sobreviven a estas condiciones estresantes. La hipótesis detrás de este método es nueva: la activación de la tensión de los caminos bioquímicos, que son blancos de antibióticos, puede acelerar la prueba de la susceptibilidad antibiótico. En comparación con los métodos estándar de prueba de susceptibilidad a los antibióticos, el paso limitador de la velocidad -el crecimiento bacteriano- se omite durante la aplicación del antibiótico. La implementación técnica del método se realiza en una combinación de técnicas estándar y enfoques innovadores. Las partes estándar del método incluyen protocolos de cultivo bacteriano, definición de canales microfluídicos en polidimetilsiloxano (PDMS), monitoreo de viabilidad celular con fluorescencia y procesamiento de imágenes por lotes para el conteo de bacterias. Las partes innovadoras del método están en el uso del flujo de los medios de cultivo para la aplicación mecánica de la tensión, el uso de enzimas para dañar pero no para matar a las bacterias, y el uso de los substratos del microarray para el accesorio bacteriano. La plataforma desarrollada se puede utilizar en el desarrollo y las pruebas de fármacos antibióticos y no antibióticos relacionados. En comparación con los experimentos de suspensión bacteriana estándar, el efecto de la droga se puede activar y desactivar repetidamente durante períodos de tiempo controlados. La observación repetitiva de la misma población bacteriana es posible en el transcurso del mismo experimento.
Introducción
El aumento de la resistencia bacteriana intensifica la necesidad de pruebas rápidas de susceptibilidad a los antibióticos basadas en fenotipos para salvaguardar nuestros medicamentos de último recurso. Las pruebas de susceptibilidad estándar se basan en la inhibición del crecimiento bacteriano en presencia de antibióticos que tardan varias (8-24) horas en completarse. Hemos desarrollado una nueva prueba de susceptibilidad a los antibióticos en una plataforma microfluídica que se basa en la activación del estrés de las vías biosintéticas para acelerar la acción de los antibióticos.
Las pruebas de susceptibilidad a los antibióticos a escala microfluídica tienen la ventaja de un uso eficaz de la muestra, ya que requieren un pequeño número de bacterias. Además, los dispositivos microfluídicos pueden ser multiplexados para probar múltiples muestras en múltiples condiciones1,2. Recientemente, se han reportado una serie de métodos microfluídicos para las pruebas de susceptibilidad a los antibióticos3-9. En estos métodos, las bacterias se cultivan dentro de las gotitas nano- y picolitro3,7,en el volumen completo del canal microfluídico4-6,8,o como bacterias individuales localizadas eléctricamente en la superficie inferior del canal9. Aunque estas pruebas se llevan a cabo en canales microfluídicos, todas ellas monitorizan el crecimiento microbiano en presencia y ausencia de antibióticos similares a los métodos tradicionales. Las mediciones de crecimiento se toman a través de densidad óptica, colorantes sensibles al pH o imágenes brillantes de contraste de campo /fase o fluorescencia. Aunque algunas de estas pruebas son más rápidas que los métodos tradicionales, cada una de ellas detecta pasivamente la resistencia a los antibióticos. En otras palabras, estos métodos todavía requieren que el usuario espere el crecimiento bacteriano como la lectura final.
Por el contrario, hemos desarrollado un método que utiliza una combinación de cizalladura y estrés enzimático para activar vías bioquímicas sensibles a los antibióticos10. Desafiar a las bacterias estresadas con esos antibióticos crea una prueba de susceptibilidad más rápida. Las bacterias que son resistentes al antibiótico son capaces de soportar las condiciones estresantes. Las bacterias susceptibles, por otro lado, son rápidamente asesinadas por las tensiones combinadas. El porcentaje de muerte celular después de una hora, medido por microscopía utilizando una mancha fluorescente de células muertas, define el fenotipo de las bacterias (resistentes frente a susceptibles).
Para la implementación exitosa de nuestro método, las bacterias deben ser inmovilizadas en la superficie inferior del canal microfluídico. De esta manera, las bacterias pueden ser sometidas a varias tensiones y simultáneamente fotovidas bajo un microscopio en un solo plano. Un portaobjetos de vidrio de microscopio recubierto se utiliza para la inmovilización de bacterias. El portaobjetos está precubierto por el fabricante con grupos epóxido para la unión a proteínas inespecíficas. La unión inespecífica de estos epóxidos a proteínas de superficie bacterianas une covalentemente las bacterias a la superficie del portaobjetos.
Las cepas se prueban en condiciones idénticas (cizalladura + estrés enzimático) en ausencia (control) y presencia (experimento) de antibiótico. Las imágenes del microscopio de contraste de fase y fluorescencia de cada canal se toman automáticamente cada dos minutos durante una hora. Las designaciones de resistencia se hacen comparando el porcentaje de bacterias muertas en el canal experimental con las presentes en el canal de control. Después de una hora, una muestra con un porcentaje de muerte celular superior al 1% se considera susceptible, mientras que menos del 0,5% de muerte es indicativa de resistencia. Los porcentajes que se encuentran entre estos dos puntos de corte se consideran indeterminados y la muestra debe ser analizada de nuevo.
Los canales microfluídicos se definen en pdms, que es un material de elección para dispositivos microfluídicos11. Pdms es ópticamente transparente en una amplia gama de longitudes de onda, biocompatible, inerte, permeable a los gases y tiene baja permeabilidad a los líquidos; por lo tanto, es muy adecuado para estos experimentos.
La tensión mecánica/de cizalladura es creada por el flujo de medios a temperatura ambiente sobre las bacterias inmovilizadas. (Nota: El calentamiento de los medios a 37 °C no tiene un efecto significativo en el resultado del ensayo). Las bombas de jeringa automatizadas fuerzan los medios (que contienen tinción de células muertas +/- antibiótico, así como estresores enzimáticos opcionales) a través de los canales microfluídicos (200 μm x 400 μm) a una velocidad de flujo de 1 ml/min para dar 6,25 kPa de fuerza de cizallamiento o una velocidad de cizallamiento de 6.000 seg-1. Esta tasa es igual o excede las tensiones de cizallamiento previamente estudiadas en los estafilococos.
La enzima, lysostaphin, fue seleccionada para experimentos preliminares porque causa daño directo a la pared celular del estafilococo. La concentración de lysostaphin (0,7 ng/ml) era suficiente causar daño bacteriano de la pared celular, pero no suficiente causar muerte celular bacteriana sin el antibiótico en el marco de tiempo del experimento. Lysostaphin no se requiere para la designación correcta de susceptibilidad bacteriana pero aumenta el resultado, llevando a la muerte celular creciente en tensiones susceptibles. Por el contrario, la tensión de cizalladura es crítica para la función del ensayo. Cuando las cepas de Staphylococcus aureus sensibles a la meticilina se tratan con lisoestaphin y oxacilina en ausencia de flujo, no se registra muerte celular en el transcurso del experimento.
La viabilidad celular se monitorea con una mancha fluorescente de células muertas12. La selección del tinte se basó en su capacidad para teñir selectivamente solo las células dañadas, su no toxicidad para las células vivas y su baja fluorescencia de fondo, lo que permitió su adición directa a los medios celulares sin pasos adicionales. La selección de una concentración de colorante fluorescente de 0,25 μM fue para lograr niveles aceptables de señal durante un tiempo de exposición de 1,6 segundos a la luz de excitación por fluorescencia.
El beta-lactámico, oxacilina, fue utilizado en nuestros estudios preliminares. Las especies de S. aureus resistentes a la meticilina (MRSA) son resistentes a la oxacilina y no mostrarán ninguna muerte celular apreciable en el marco de tiempo del experimento. La concentración de 50 μg/ml se determinó en los estudios preliminares. Las concentraciones más bajas de antibióticos dieron menos separación entre cepas resistentes y susceptibles, mientras que concentraciones más altas no causaron una diferencia apreciable en los resultados experimentales.
Hemos relatado previamente el desarrollo exitoso de una prueba que combina tensiones mecánicas y enzimáticas que afectan directamente a la pared celular bacteriana13 con un antibiótico que inhibe la biosíntesis de la pared celular14,15. Estos experimentos de prueba de principio se llevaron a cabo en un panel de SARM y S. aureus sensible a la meticilina (MSSA). Sin embargo, con la selección de parámetros experimentales adecuados, nuestro método debe ser aplicable a múltiples especies de bacterias y múltiples clases de antibióticos.
Protocolo
1. Hacer la capa PDMS (Figura 1)
- Mezcle vigorosamente pdms y agente de curado en una proporción de 10:1. Para eliminar burbujas, desgasificar la mezcla viscosa en una cámara de vacío durante 1 hora a temperatura ambiente.
- En una escala, vierta el PDMS lentamente sobre el molde de aluminio. Verter desde el centro y mantener el molde nivelado. Asegúrese de dejar los pines al descubierto. Deje de verter una vez que se alcance el peso objetivo.
Nuestro molde requiere 4 g de PDMS y 0,4 g de reactivo de curado. - Nivelar el molde dentro de un horno, y curar a 37 °C durante la noche.
Los tiempos de curado alternativos son 2 horas a 60 °C o 1 hora a 90 °C. - Diseccione la capa pdms curada a lo largo del borde del molde y éguela cuidadosamente de la superficie del molde con un par de pórceps. Limpie la superficie del molde con etanol al 70% y una punta Q.
2. Montar la celda de flujo de acuerdo con la figura 2
El montaje estándar de PDMS con portaobjetos de vidrio se realiza a través del tratamiento con plasma de oxígeno de ambas superficies, lo que garantiza una unión sin fugas entre el PDMS y el portaobjetos de vidrio del microscopio. En el protocolo presentado, el tratamiento con plasma destruiría el recubrimiento químico en el portaobjetos de vidrio. Por lo tanto, el portaobjetos está sellado a presión en lugar de tratarse con plasma.
- Coloque la ventana de vidrio en el bolsillo de la celda de flujo.
- Coloque una diapositiva de vidrio recubierta sobre la ventana de vidrio dentro del bolsillo de la celda de flujo con el lado activo hacia arriba, y coloque la capa PDMS con canales hacia abajo en la parte superior de ella. Coloque la corredera PDMS de tal manera que las entradas del canal se alineen con los orificios pasante en la placa metálica. Empuje suavemente el aire de entre las capas.
- Voltee el conjunto de diapositivas pdms/glass para que el PDMS se enfrente a la ventana de vidrio. Superponga las entradas del canal PDMS con los orificios pasante en la placa metálica.
- Coloque la placa de presión en la parte superior y apriete los tornillos.
- Coloque la celda de flujo ensamblada bajo el microscopio. Ajuste la ampliación del microscopio a 60X y prealinee las posiciones del canal.
3. Preparar bacterias de la fase de registro
- Día antes del experimento: Inocular 50 ml de caldo Mueller Hinton que contenga 2% de NaCl (MH2) con una colonia bacteriana. Agitar a 250 rpm durante la noche a 37 °C.
Una o dos cepas bacterianas se pueden estudiar en un experimento para la configuración descrita. - Antes del experimento: Mezcle 50 μl de cultivo de bacterias durante la noche en 50 ml de medios MH2. Agite a 250 rpm durante 3 horas a 37 °C para asegurarse de que las bacterias están en fase logarítmica.
4. Caliente los componentes de la solución experimental al menos 10 minutos antes de que se necesiten
- Descongelar el colorante fluorescente (5 mM) y la lisostaphin (10 μg/ml de stock) a temperatura ambiente.
- Caliente el polvo de oxacilina a temperatura ambiente.
5. Preparar y cargar la suspensión bacteriana
- Después del final del subcultivo de 3 horas: Tomar 10 ml de cultivo de bacterias y centrífuga a 1.650 x g durante 2 min.
- Retire las bacterias sobrenadantes y resuspentes en 1 ml de medios MH2 frescos.
- Coloque una longitud corta de tubo a una jeringa de bloqueo Luer de 1 ml. Enjuague el tubo de la jeringuilla con 1 ml de medios. Deje un poco de medios en el tubo para evitar burbujas de aire al dibujar en la suspensión bacteriana.
- Cargue 0,7 ml de bacterias tipo 1 en la jeringa. Llene dos canales de la célula de flujo con bacterias tipo 1. Esté atento a que el líquido aparezca al otro lado del canal después de ca. 150 μl.
La transparencia del canal cambia a medida que se llena de bacterias. - Si experimenta con varios tipos de bacterias, repita el procedimiento de carga para las bacterias tipo 2 en los dos canales restantes de la célula de flujo.
- Coloque la celda de flujo dentro de la incubadora a 37 °C durante 45 min para permitir la sedimentación bacteriana y la fijación a la superficie del deslizamiento.
6. Prepare y cargue las soluciones experimentales
- Preparar 140 μl de solución de colorante fluorescente de 0,5 mM mezclando 14 μl de colorante fluorescente (5 mM) y 126 μl de soporte MH2.
- Diluir 10 mg de oxacilina en 40 ml de medios MH2 para obtener una concentración final de 250 μg/ml de oxacilina.
- Preparar 130 ml de solución control con concentraciones finales de 0,25 μM de colorante fluorescente y 0,7 ng/ml de lisostaphin. Para ello, mezcle 65 μl de colorante fluorescente (0,5 mM), 9,12 μl de lysostaphin (10 μg/ml) y 130 ml de soporte MH2.
- Preparar 130 ml de solución antibiótica con concentraciones finales de 0,25 μM de colorante fluorescente, 0,7 ng/ml de lisostaprina y 50 μg/ml de oxacilina. Para ello, mezcle 65 μl de colorante fluorescente (0,5 mM), 9,12 μl de lysostaphin (10 μg/ml), 26 ml de oxacilina (250 μg/ml) y 104 ml de medios MH2.
- Llene dos jeringas de 60 ml con solución de control y dos jeringas de 60 ml con solución antibiótica. Mantenga las soluciones envueltas en papel de aluminio para evitar la degradación inducida por la luz de los reactivos.
Sobrellenar las jeringas para tener en cuenta la pérdida debido al enrojecimiento de la tubería. - Retire las burbujas de aire de las jeringas moviendo. Coloque y llene el tubo de entrada a la punta con la solución experimental.
- Monte jeringas en la bomba. Coloque primero la jeringa con el volumen más pequeño y, a continuación, bloquee la posición del émbolo. Coloque el resto de las jeringas en la bomba, exprimiendo sus émbolos según sea necesario.
- Ajuste la velocidad de la bomba a 1 ml/min y el volumen de la bomba a 60 ml. Haga un lavado con la bomba hasta que se vea un flujo constante de líquido de todas las jeringas.
7. Configurar la célula de flujo bajo el microscopio
- Retire la celda de flujo de la centrífuga y montarla en la etapa del microscopio (Figura 3).
- Conecte la tubería de entrada/salida a cada uno de los canales de celda de flujo (una entrada/una salida por canal).
La recolección de la salida en cuatro contenedores diferentes permite la medición de volúmenes de salida de canal individuales.
8. Ejecute el experimento de 60 minutos
- Compruebe las posiciones prealineadas del paso 2.5. Si el campo de visión del microscopio no está centrado en el canal y/o está descentrado, ajuste la configuración y guarde las nuevas posiciones.
El enfoque preciso puede no ser posible antes del inicio del flujo debido a la alta densidad de bacterias cargadas. - Establezca el tiempo de adquisición de contraste de fase en 10 milisegundos y el tiempo de adquisición de fluorescencia en 1.600 milisegundos.
- Obtenga imágenes de contraste de fase y fluorescencia para cada posición antes de iniciar el flujo.
Esto da una estimación cualitativa de la densidad bacteriana cargada. - Inicie el flujo de líquido y compruebe inmediatamente que el microscopio está enfocado en la parte inferior de los canales.
- Tome imágenes de contraste de fase y fluorescencia de las áreas objetivo dentro del primer minuto de flujo.
- Adquiera imágenes cada 2 minutos después del primer conjunto de imágenes hasta que se haya producido 60 minutos de flujo. Reenfoque según sea necesario.
9. Desinfectar la celda de flujo
- Hacer una solución de lejía al 10% en un casto (100 ml). Llene 4 x 20 ml de jeringas con 10 ml de la mezcla. Desburbuje las jeringas y conéctelas a la célula de flujo.
Tomará ~ 1-2 minutos para que los canales estén claros de bacterias. - Ajuste la velocidad de la bomba a 1 ml/min y el volumen de la bomba a 3 ml. Correr durante 3 min.
- Llene 4 x 60 ml de jeringas con 60 ml de agua DI. Desburbuje las jeringas y conéctelas a la célula de flujo.
- Ajuste la velocidad de la bomba a 1 ml/min y el volumen de la bomba a 30 ml. Correr durante 30 min.
- Monitoree la limpieza del canal bajo el microscopio.
- Desensamblar la celda de flujo. Deseche el portaobjetos epoxi usado. Remoje los componentes de la celda de flujo en agua DI durante 20 min. Seque al aire.
10. Analizar imágenes y generar datos
- Cuente el número de bacterias en cada imagen.
El software de acceso abierto, CellProfiler, se utiliza para realizar el procesamiento de imágenes por lotes16. Un esquema de alto nivel de la rutina CellProfiler se resume en la tabla 1. El número de bacterias presentes en la imagen de contraste de fase (Np) da el recuento total de bacterias. El número de bacterias visibles en la imagen de fluorescencia (Nf) da el número de bacterias muertas. - Calcular el porcentaje de muerte celular bacteriana normalizada en función del tiempo.
- Importe Nf y Np para imágenes individuales en el software de análisis de datos.
- Calcular la fracción de bacterias muertas en cada canal en un punto de tiempo específico dado por la fracción (Nf/N p)en t = T.
- Restar la fracción de bacterias muertas presentes al inicio del experimento (t = 1 min) tanto para el control como para los canales experimentales.
- Restar la fracción de bacterias muertas presentes en el canal de control de la presente en el canal experimental en cada punto de tiempo con la siguiente ecuación:
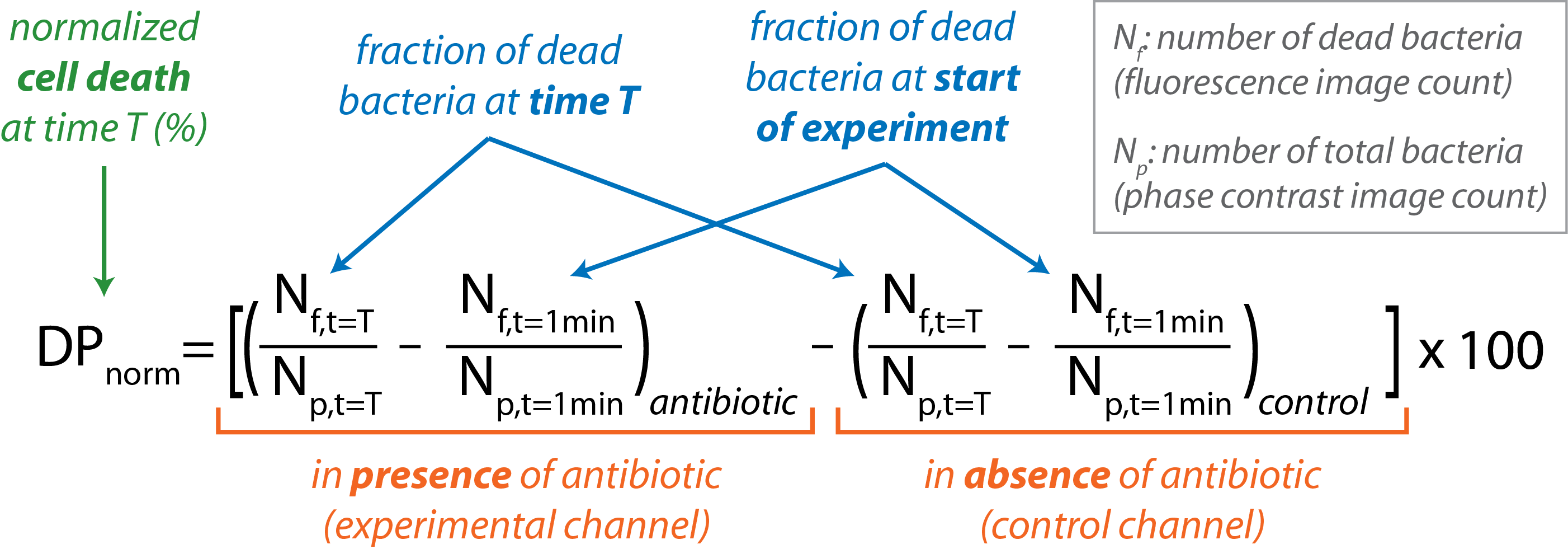
- Graficar la norma DP frente a t para el curso del experimento.
Tenga en cuenta que una muestra con un porcentaje de muerte celular superior al 1% se considera susceptible, mientras que menos del 0,5% de muerte es indicativo de resistencia. Los porcentajes que se encuentran entre estos dos puntos de corte se consideran indeterminados y la muestra debe ser analizada de nuevo. - Utilice una hoja de cálculo para resumir y analizar los resultados de diferentes experimentos.
Resultados
Los datos presentados en la Figura 4 muestran la respuesta de una cepa susceptible de Staphylococcus aureus a lo largo del tiempo en un canal microfluídico que contiene antibióticos. Las imágenes de contraste de fase adquiridas a 1 min y al final del experimento de 1 hora se muestran en las Figuras 4A y B. Los datos analizados de 1 hora se muestran en la Figura 4C con las bacterias resaltadas en rojo (5.828 en total). Las imágenes ...
Discusión
El protocolo presentado fue validado y optimizado en un conjunto de experimentos con cepas de Staphylococcus aureus sensibles a la meticilina y resistentes a la meticilina10. Por lo tanto, este protocolo sin modificación debe ser directamente aplicable a otras cepas de S. aureus y otros antibióticos con mecanismos de acción que afectan a la biosíntesis de la pared celular bacteriana. Los tipos de bacterias distintas de S. aureus pueden requerir variación en los parámetros de te...
Divulgaciones
El método microfluídico está pendiente de patente: Sauer-Budge A, Sharon A, Kalashnikov M, Wirz H, inventores; Método y dispositivo para la detección rápida de la resistencia a los antibióticos bacterianos / susceptibilidad patente PCT / US10/33523.
Agradecimientos
Agradecemos a los ingenieros y estudiantes del Centro Fraunhofer para la Innovación en Fabricación. Por ayudar en el diseño, mecanizado y automatización del sistema experimental, agradecemos a Andreas Prinzen, Holger Wirz, Doug Foss, David Chargin y el Dr. Sudong Shu. Agradecemos a Julia Kuckartz, Melanie Zimmermann, Niko Kraetzmar, Tim Gumbel, Josh Villanueva, Minori Shimizu y Katarzyna Kuliga por su ayuda con las pruebas de protocolos experimentales y la recopilación de datos. Reconocemos a los Doctores Anne E. Carpenter y Mark-Anthony Bray de la Plataforma de Imágenes en el Broad Institute de Harvard y el MIT por su ayuda con el desarrollo de la rutina de análisis de imágenes en CellProfiler. El proyecto descrito fue apoyado en parte por los Premios R21AI079474 y 1R01AI101446 del Instituto Nacional de Alergias y Enfermedades Infecciosas. El contenido es responsabilidad exclusiva de los autores y no representa necesariamente los puntos de vista oficiales del Instituto Nacional de Alergias y Enfermedades Infecciosas o de los Institutos Nacionales de Salud. El proyecto también contó con el apoyo de Fraunhofer USA.
Materiales
| Name | Company | Catalog Number | Comments |
| SYTOX Green | Invitrogen Corporation | S7020 | Dead cell fluorescence stain |
| Bovine Serum Albumin (BSA) | Sigma Aldrich, Inc | A9418-5G | Used for lysostaphin storage |
| Sodium Acetate | Sigma Aldrich, Inc | S8750-500G | Used for lysostaphin storage |
| Lysostaphin | Cell Sciences | CRL309A | Arrives as 1 mg solid. For storage: Dissolve in 20 mM sodium acetate. Mix with BSA solution to final concentration of 1% BSA and 100 µg/ml lysostaphin for storage |
| Oxacillin salt | Sigma Aldrich, Inc | 28221-1G | Antibiotic |
| Mueller Hinton Broth | Fisher Scientific | DF0757-17-6 | |
| Sodium chloride | Sigma Aldrixh | S3014-500G | 2% added to Mueller-Hilton broth prior to autoclaving |
| 1 ml, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 14-823-2F | |
| 2 oz, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 309653 - 60 mL | Overfill to ~65 ml |
| Microscope | |||
| Inverted Fluoresccence Microscope Olympus IX-70 | Cambridge Scientific | 9349 | |
| 60X, Fluorescence/Phase contrast objective | Olympus Corp. | LCPlan F1 60x/0.70 Ph2 | |
| Retiga 12-bit monochrome CCD camera | QImaging | RET-4000R-F-M-12-C | |
| Microscope automation | |||
| Shutters phase contrast/fluorescence | PRIOR Scientific | H204/H202 | |
| X/Y Stage | PRIOR Scientific | H107AENN | |
| Focus motor | PRIOR Scientific | H122 | |
| Joystick for XYZ control | PRIOR Scientific | CS152EF | |
| Proscan Controller | PRIOR Scientific | H3-XY2 | |
| Image Acquisition Software | Fraunhofer CMI | ||
| Flow Cell Assembly and PDMS | |||
| Flow Cell | BU Scientific Instruments Facility/Fraunhofer CMI | 3333-1044 | Engineering drawings were produced by Fraunhofer CMI |
| Glass window | Fraunhofer CMI | 3333-1054 | Glass window was cut to the proper size at Fraunhofer CMI |
| BOROFLOAT Window 50 mm x 50 mm | Edmund Optics Inc. | NT48-543 | |
| Sealing plate | BU Scientific Instruments Facility | 3333-1045 | |
| Epoxide glass slide | Arrayit Corporation | SuperEpoxy 2 | |
| PDMS master | Fraunhofer CMI | 3333-1053 | Master machined in aluminum or brass with UPM-0005 (ultrapresicion fly-cutting machine) |
| PDMS slide design | Fraunhofer CMI | 3333-1053 | |
| Tubing | |||
| Nut, Super flangeless Tinytight, headless, 1/16 in, PEEK, green | IDEX Health Science | M-644-03 | Flow cell inputs/outputs are tapped for this ferrule |
| Ferrule, Tinytight, 1/16 in, 6-40, .030 in TH, PEEK w/ SS lock ring, black | IDEX Health Science | M-657 | |
| Nut, Super flangeless Tinytight, headless, 1/16-1/32 in, 1/4-28, PEEK, natural | IDEX Health Science | P-255 | |
| Ferrule, Super Falngeless, 1/16 in, Tefzel (ETFE), yellow | IDEX Health Science | P-259 | Fits Luer-lock adapter |
| Tubing, Teflon FEP, .030 in x 1/16 in x 20 ft, green | IDEX Health Science | 1520G | |
| Adapter, quick connect female Luer to female 1/4-28, PEEK, red | IDEX Health Science | P-658 |
Referencias
- Mairhofer, J., Roppert, K., Ertl, P. Microfluidic systems for pathogen sensing: a review. Sensors. 9, 4804-4823 (2009).
- Yager, P., et al. Microfluidic diagnostic technologies for global public health. Nature. 442, 412-418 (2006).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab Chip. 8, 1265-1272 (2008).
- Cao, J., et al. Uncovering toxicological complexity by multi-dimensional screenings in microsegmented flow: modulation of antibiotic interference by nanoparticles. Lab Chip. 12, 474-484 (2012).
- Chen, C. H., et al. Antimicrobial susceptibility testing using high surface-to-volume ratio microchannels. Anal. Chem. 82, 1012-1019 (2010).
- Churski, K., et al. Rapid screening of antibiotic toxicity in an automated microdroplet system. Lab Chip. 12, 1629-1637 (2012).
- Eun, Y. J., Utada, A. S., Copeland, M. F., Takeuchi, S., Weibel, D. B. Encapsulating bacteria in agarose microparticles using microfluidics for high-throughput cell analysis and isolation. ACS Chem. Biol. 6, 260-266 (2011).
- Kim, K. P., et al. In situ monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device. Lab Chip. 10, 3296-3299 (2010).
- Peitz, I., van Leeuwen, R. Single-cell bacteria growth monitoring by automated DEP-facilitated image analysis. Lab Chip. 10, 2944-2951 (2010).
- Kalashnikov, M., Lee, J. C., Campbell, J., Sharon, A., Sauer-Budge, A. F. A microfluidic platform for rapid, stress-induced antibiotic susceptibility testing of Staphylococcus aureus. Lab Chip. 12, 4523-4532 (2012).
- McDonald, J. C., Whitesides, G. M. Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc. Chem. Res. 35, 491-499 (2002).
- Roth, B. L., Poot, M., Yue, S. T., Millard, P. J. Bacterial viability and antibiotic susceptibility testing with SYTOX green nucleic acid stain. Appl. Environ. Microbiol. 63, 2421-2431 (1997).
- Francius, G., Domenech, O., Mingeot-Leclercq, M. P., Dufrene, Y. F. Direct observation of Staphylococcus aureus cell wall digestion by lysostaphin. J. Bacteriol. 190, 7904-7909 (2008).
- Jordan, S., Hutchings, M. I., Mascher, T. Cell envelope stress response in Gram-positive bacteria. FEMS Microbiol. Rev. 32, 107-146 (2008).
- Koch, A. L. Bacterial wall as target for attack: past, present, and future research. Clin. Microbiol. Rev. 16, 673-687 (2003).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: from targets to networks. Nat. Rev. Microbiol. 8, 423-435 (2010).
- Kohanski, M. A., Dwyer, D. J., Hayete, B., Lawrence, C. A., Collins, J. J. A common mechanism of cellular death induced by bactericidal antibiotics. Cell. 130, 797-810 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados