Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Стресс-индуцированной антибиотиков Восприимчивость Тестирование на чип
В этой статье
Резюме
Мы разработали микрофлюидную платформу для быстрого тестирования на чувствительность к антибиотикам. На высоких скоростях жидкость передается бактериям, обездвиженным на дне микрофлюидного канала. При наличии стресса и антибиотиков, восприимчивые штаммы бактерий умирают быстро. Тем не менее, устойчивые бактерии могут выжить в этих стрессовых условиях.
Аннотация
Мы разработали быстрый микрофлюидный метод тестирования на чувствительность к антибиотикам в условиях стресса. На высоких скоростях жидкость передается бактериям, обездвиженным на дне микрофлюидного канала. При наличии стресса и антибиотиков, восприимчивые штаммы бактерий умирают быстро. Тем не менее, устойчивые бактерии выживают в этих стрессовых условиях. Гипотеза, стоящая за этим методом, новаяая: стресс-активация биохимических путей, которые являются объектами антибиотиков, может ускорить тестирование на восприимчивость к антибиотикам. По сравнению со стандартными методами тестирования на чувствительность к антибиотикам, ограничивающий скорость шаг - рост бактерий - опускается во время применения антибиотиков. Техническое внедрение метода заключается в сочетании стандартных методов и новаторских подходов. Стандартные части метода включают протоколы бактериальной культуры, определение микрофлюидных каналов в полидиметилсилоксане (PDMS), мониторинг жизнеспособности клеток с флуоресценцией и обработку пакетного изображения для подсчета бактерий. Инновационные части метода в использовании культуры потока средств массовой информации для механического применения стресса, использование ферментов для повреждения, но не убить бактерии, и использование микроаррей субстратов для бактериальной привязанности. Разработанная платформа может быть использована в разработке и тестировании антибиотиков и неантибиотических препаратов. По сравнению со стандартными экспериментами бактериальной суспензии, эффект препарата может быть включен и выключен неоднократно в течение контролируемых периодов времени. Повторяющиеся наблюдения одной и той же бактериальной популяции возможно в ходе того же эксперимента.
Введение
Рост бактериальной резистентности усиливает необходимость в быстрых тестах на восприимчивость к антибиотикам на основе фенотипа, чтобы защитить наши препараты последней инстанции. Стандартные тесты на восприимчивость основаны на ингибировании роста бактерий в присутствии антибиотиков, которые принимают несколько (8-24) часов для завершения. Мы разработали новый тест на восприимчивость к антибиотикам на микрофлюидной платформе, которая опирается на стресс-активацию биосинтетических путей для ускорения действия антибиотиков.
Тесты на восприимчивость к антибиотикам в микрофлюидной шкале имеют преимущество эффективного использования образца, поскольку они требуют небольшого количества бактерий. Кроме того, микрофлюидные устройства могут быть мультиплексированы для того, чтобы протестировать несколько образцов при несколькихусловиях 1,2. В последнее время, ряд микрофлюидных методов для тестирования на чувствительность к антибиотикам былизарегистрированы 3-9. В этих методах бактерии выращиваются внутри нано- и пиколитическихкапель 3,7,в полном объеме микрофлюидногоканала 4-6,8,или как одиночные бактерии, электрически локализованные на нижней поверхности канала9. Хотя эти тесты проводятся в микрофлюидных каналах, все они контролируют рост микробов в присутствии и отсутствии антибиотиков, аналогичных традиционным методам. Измерения роста проводятся с помощью оптических плотностей, чувствительных к рН красителей или яркого контраста поля/фазы или изображений флуоресценции. Хотя некоторые из этих тестов быстрее, чем традиционные методы, каждый из них пассивно обнаружить устойчивость к антибиотикам. Другими словами, эти методы по-прежнему требуют от пользователя ждать роста бактерий в качестве окончательного считыва.
В отличие от этого, мы разработали метод, который использует сочетание снятия снятия и энзиматический стресс для активации чувствительных к антибиотикам биохимическихпутей 10. Вызов подчеркнул бактерий с этими антибиотиками создает более быстрый тест восприимчивости. Бактерии, устойчивые к антибиотикам, способны выдерживать стрессовые условия. С другой стороны, восприимчивые бактерии быстро погибают от комбинированных стрессов. Процент клеточной смерти через час, измеряемый микроскопией с использованием флуоресцентного пятна мертвых клеток, определяет фенотип бактерий (резистентный против восприимчивых).
Для успешной реализации нашего метода бактерии должны быть обездвижены на нижней поверхности микрофлюидного канала. Таким образом, бактерии могут подвергаться различным стрессам и одновременно изображения под микроскопом в одной плоскости. Стеклянный слайд с покрытием микроскопа используется для иммобилизации бактерий. Слайд предварительно покрытием производителя с эпоксидными группами для неспецифического связывания белка. Неспецифическая привязка этих эпоксидов к бактериальным поверхностным белкам ковалентно прикрепляет бактерии к поверхности слайда.
Штаммы тестируются в одинаковых условиях (стрижка и энзиматический стресс) при отсутствии (контроле) и наличии (эксперименте) антибиотика. Фазовая контрастность и флуоресценция микроскопа фотографии каждого канала принимаются автоматически каждые две минуты в течение одного часа. Затем обозначения сопротивления сделаны путем сравнения процента мертвых бактерий в экспериментальном канале с теми, которые присутствуют в канале управления. После одного часа, образец с процентом смерти клетки больше чем 1% посчитан susceptible, пока меньш чем 0.5% смерть свидетельствует сопротивления. Проценты, которые падают между этими двумя отрезами, считаются неопределенными, и образец должен быть проверен еще раз.
Микрофлюидные каналы определяются в PDMS, который является материалом выбора для микрофлюидных устройств11. PDMS оптически прозрачна в широком диапазоне длин волн, биосовместима, инертна, проницаема для газов и имеет низкую проницаемость жидкостей; поэтому он хорошо подходит для этих экспериментов.
Механический/стрижка стресс создается потоком средств массовой информации комнатной температуры над обездвиженными бактериями. (Примечание: Потепление средств массовой информации до 37 градусов по Цельсию не имеет существенного влияния на результаты анализа.) Автоматизированные шприц насосы силу средств массовой информации (содержащий мертвые пятна клеток / - антибиотик, а также дополнительные энзиматические стрессоры) через микрофлюидные каналы (200 мкм х 400 мкм) при скорости потока 1 мл/мин, чтобы дать 6,25 кПа силы стрижки или скорость стрижки 6000сек -1. Этот показатель равен или превышает ранее изученные нагрузки с shear на Staphylococci.
Фермент, лизостафин, был выбран для предварительных экспериментов, потому что он вызывает прямое повреждение стенки клеток стафилококка. Концентрация лизостафина (0,7 нг/мл) была достаточной, чтобы вызвать повреждение стенок бактериальных клеток, но недостаточной, чтобы вызвать гибель бактериальных клеток без антибиотика в сроки эксперимента. Лизостафин не требуется для правильного обозначения бактериальной восприимчивости, но это увеличивает результат, что приводит к увеличению смертности клеток в восприимчивых штаммов. В отличие от этого, стресс стрижки имеет решающее значение для анализа функции. Когда метициллин чувствительных штаммов золотистого стафилококка лечатся лизостафином и оксациллином при отсутствии потока, клеточной смерти не регистрируется в течение эксперимента.
Жизнеспособность клеток контролируется с флуоресцентным пятном мертвыхклеток 12. Выбор красителя был основан на его способности избирательно окрашивать только поврежденные клетки, его нетоксичность для живых клеток, и его низкой фоновой флуоресценции, что позволило для его прямого добавления к клеточному смиреанию без дополнительных шагов. Выбор концентрации флуоресцентного красителя в 0,25 МКМ должен был достичь приемлемого уровня сигнала в течение 1,6 сек времени воздействия флуоресцентного возбуждения света.
Бета-лактам, оксациллин, был использован в наших предварительных исследованиях. Метициллин-устойчивые К. ауреус (MRSA) устойчивы к оксациллину и не покажут заметной гибели клеток в сроки эксперимента. В ходе предварительных исследований была определена концентрация 50 мкг/мл. Более низкие концентрации антибиотиков давали меньше разделения между устойчивыми и восприимчивыми штаммами, в то время как более высокие концентрации не вызывают заметной разницы в экспериментальных исходах.
Ранее мы сообщали об успешном разработке теста, который сочетает в себе механические и энзиматические стрессы, которые непосредственно влияют набактериальную клеточной стенки 13 с антибиотиком, который подавляет биосинтезклеточной стенки 14,15. Эти эксперименты были проведены на панели MRSA и метициллин чувствительных S. aureus (MSSA). Однако при выборе надлежащих экспериментальных параметров наш метод должен быть применим к нескольким видам бактерий и нескольким классам антибиотиков.
протокол
1. Сделать слой PDMS (рисунок 1)
- Энергично смешивать PDMS и лечебное средство в соотношении 10:1. Чтобы удалить пузырьки, дегазации вязкой смеси в вакуумной камере в течение 1 часа при комнатной температуре.
- В масштабе, залить PDMS медленно над алюминиевой формы. Налейте из центра и держать плесень выровняли. Убедитесь в том, чтобы оставить булавки обнаружили. Прекратите заливки, как только целевой вес достигается.
Наша плесень требует 4 г PDMS и 0,4 г реагента. - Уровень плесени внутри духовки, и вылечить при температуре 37 градусов по Цельсию на ночь.
Альтернативное время лечения 2 часа при 60 градусов по Цельсию или 1 час при 90 градусов по Цельсию. - Вскрыть вылеченный слой PDMS вдоль края прессформы и тщательно очистить его от поверхности прессформы с парой типсов. Очистите поверхность формы с 70% этанола и наконечником.
2. Соберите ячейку потока согласно рисунку 2
Стандартная сборка PDMS со стеклянными слайдами делается путем обработки плазмы кислорода обеих поверхностей, что обеспечивает без утечки связь между PDMS и микроскопом стеклянный слайд. В представленном протоколе плазменная обработка уничтожит химическое покрытие на стеклянной горке. Поэтому слайд запечатывается давлением, а не плазмой.
- Поместите стеклянное окно в карман ячейки потока.
- Положите покрытием стекла слайд над стеклянным окном внутри кармана потока ячейки с активной стороной вверх, и место PDMS слой с каналами, обращенными вниз на нем. Поместите слайд PDMS таким образом, чтобы входные данные канала выравниваются с сквозными отверстиями в металлической пластине. Аккуратно выталкивайте воздух между слоями.
- Переверните сборку слайдов PDMS/glass так, чтобы PDMS столкнулся со стеклянным окном. Перекрытие входов канала PDMS с помощью сквозных отверстий в металлической пластине.
- Поместите пластину давления сверху и затяните винты.
- Поместите собранную ячейку потока под микроскоп. Установите увеличение микроскопа до 60X и предварительно подготовьве позиций канала.
3. Подготовка бактерий фазы журнала
- За день до эксперимента: Привить 50 мл бульона Мюллера Хинтона, содержащего 2% NaCl (MH2) с бактериальной колонией. Встряхните при 250 об/мин ночь при 37 градусах по Цельсию.
Один или два бактериальных штамма могут быть изучены в одном эксперименте для описанной настройки. - До эксперимента: Смешайте 50 мкл культуры ночных бактерий в 50 мл MH2 СМИ. Встряхните при 250 об/мин в течение 3 часов при 37 градусах Цельсия, чтобы убедиться, что бактерии находятся в фазе журнала.
4. Разогреть компоненты экспериментального раствора по крайней мере за 10 минут до того, как они необходимы
- Оттепель флуоресцентного красителя (5 мМ бульона) и лизостафина (10 мкг/мл бульона) при комнатной температуре.
- Разогреть порошок оксациллина до комнатной температуры.
5. Подготовка и загрузка бактериальной подвески
- После окончания 3 часов субкультуры: Возьмите 10 мл бактерий культуры и центрифуги на 1650 х г в течение 2 мин.
- Удалите супернатант и повторное течение бактерий в 1 мл свежих MH2 средств массовой информации.
- Прикрепите короткую длину трубки к 1 мл шприца Luer lock. Промыть шприц трубки с 1 мл средств массовой информации. Оставьте немного средств массовой информации в трубках, чтобы избежать пузырьков воздуха при рисовании в бактериальной суспензии.
- Загрузите 0,7 мл бактерий типа 1 в шприц. Заполните два канала клетки потока бактериями типа 1. Следите за жидкостью, чтобы появиться на другой стороне канала после ca. 150 мкл.
Прозрачность канала меняется по мере того, как он наполнен бактериями. - При эксперименте с несколькими типами бактерий повторите процедуру загрузки бактерий типа 2 в два оставшихся канала клетки потока.
- Поместите ячейку потока внутри инкубатора при 37 градусов по Цельсию в течение 45 минут, чтобы бактериальное оседание и привязанность к поверхности слайда.
6. Подготовка и загрузка экспериментальных решений
- Приготовьте 140 мкл флуоресцентного раствора красителя 0,5 мм, смешивая 14 мкл флуоресцентного красителя (5 мМ) и 126 мкл средств массовой информации MH2.
- Разбавить 10 мг оксациллина в 40 мл MH2 сми, чтобы получить окончательную концентрацию 250 мкг/мл оксациллина.
- Приготовьте 130 мл контрольного раствора с конечной концентрацией 0,25 МКМ флуоресцентного красителя и 0,7 нг/мл лизостафина. Для этого смешайте 65 мкл флуоресцентного красителя (0,5 мМ), 9,12 мл лизостафинового запаса (10 мкг/мл) и 130 мл средств массовой информации MH2.
- Приготовьте 130 мл раствора антибиотика с конечной концентрацией 0,25 МКМ флуоресцентного красителя, 0,7 нг/мл лизостафина и 50 мкг/мл оксациллина. Для этого смешайте 65 мкл флуоресцентного красителя (0,5 мМ), 9,12 мкл лисостафинового бульона (10 мкг/мл), 26 мл оксациллина (250 мкг/мл) и 104 мл средств массовой информации MH2.
- Заполните два 60 мл шприцев раствором контроля и два 60 мл шприцев с раствором антибиотика. Храните растворы, завернутые в алюминиевую фольгу, чтобы избежать легкой деградации реагентов.
Переполнить шприцы для учета потерь из-за промывки труб. - Удалите пузырьки воздуха из шприцев, стряхивая. Прикрепите и заполните входной трубки к кончику экспериментальным раствором.
- Намонтировать шприцы на насосе. Поместите шприц с самым маленьким объемом, а затем заблокируй положение поршеня. Fit остальные шприцы на насос, сжимая их поршени по мере необходимости.
- Установите скорость насоса до 1 мл/мин и объем насоса до 60 мл. Сделай заподлицо с насосом, пока устойчивый поток жидкости не виден из всех шприцев.
7. Настройка ячейки потока под микроскопом
- Удалите ячейку потока из центрифуги и смонтировать ее на стадии микроскопа(рисунок 3).
- Подключите входные/выходные трубки к каждому из каналов ячейки потока (один вход/один выход на канал).
Сбор продукции в четыре различных контейнера позволяет измерять отдельные объемы вывода каналов.
8. Вы запустите 60-минутный эксперимент
- Проверьте предварительно выровненные позиции с шага 2.5. Если поле зрения микроскопа не сосредоточено на канале и/или находится вне фокуса, отрегулируйте настройки и сохраните новые позиции.
Точное фокусировка может быть невозможна до начала потока из-за высокой плотности загруженных бактерий. - Установите время приобретения контраста фазы до 10 мсек и время приобретения флуоресценции до 1600 мсек.
- Получить фазовую контрастность и флуоресценцию изображения для каждой позиции, прежде чем инициировать поток.
Это дает качественную оценку загруженной бактериальной плотности. - Запустите поток жидкости и немедленно убедитесь, что микроскоп ориентирован на дно каналов.
- Сделайте фазовую контрастность и флуоресценцию изображений целевых областей в течение первой минуты потока.
- Приобретайте изображения каждые 2 минуты после первого набора изображений до 60 минут потока. Переориентация по мере необходимости.
9. Дезинфекция потока ячейки
- Сделать 10% отбеливатель раствор в стакане (100 мл). Заполните 4 х 20 мл шприцев с 10 мл смеси. Откусить шприцы и прикрепить их к клетке потока.
Это займет 1-2 мин для каналов, чтобы быть подальше от бактерий. - Установите скорость насоса до 1 мл/мин и объем насоса до 3 мл. Бегите 3 мин.
- Заполните 4 х 60 мл шприцев с 60 мл воды DI. Откусить шприцы и прикрепить их к клетке потока.
- Установите скорость насоса до 1 мл/мин и объем насоса до 30 мл. Бегите 30 мин.
- Мониторинг очистки канала под микроскопом.
- Разоразить ячейку потока. Откажитесь от использованной эпоксидной горки. Замочите компоненты клеток потока в воде DI в течение 20 мин. Воздух сухой.
10. Анализ изображений и генерация данных
- Подсчитайте количество бактерий на каждом изображении.
Программное обеспечение открытого доступа, CellProfiler используется для выполнения обработки пакетныхизображений 16. В таблице 1обобщены наброски высокого уровня рутины CellProfiler. Количество бактерий, присутствующих на фазовом контрастном изображении (Np)дает общее количество бактерий. Количество бактерий, видимых на изображении флуоресценции (Nf) дает количество мертвых бактерий. - Рассчитайте нормализованный процент смерти бактериальных клеток в функции времени.
- Импорт Nf и N pдля отдельных изображений в программное обеспечение для анализа данных.
- Рассчитайте долю мертвых бактерий в каждом канале в определенной точке времени, данной фракцией (Nf / Np) при т. Т.
- Вычесть долю мертвых бактерий, присутствующих в начале эксперимента (т 1 мин) как для контроля и экспериментальных каналов.
- Вычесть долю мертвых бактерий, присутствующих в канале управления, из того, что присутствует в экспериментальном канале в каждый момент времени со следующим уравнением:
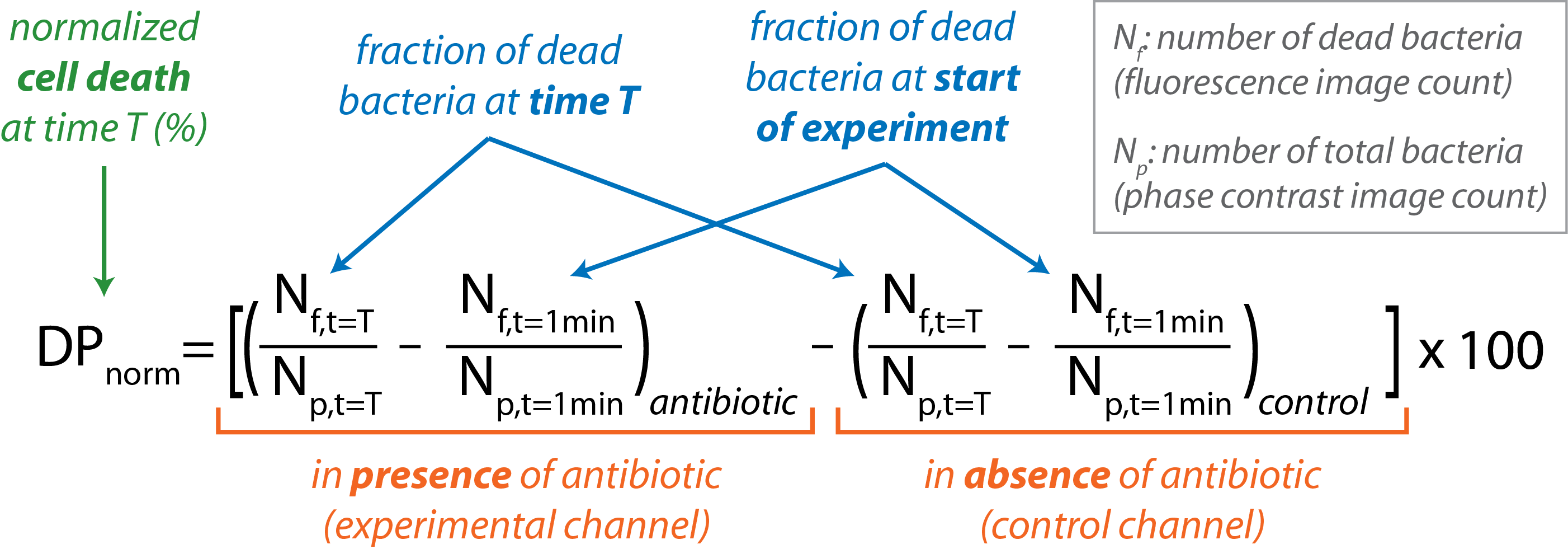
- Граф DPнорма против t для хода эксперимента.
Обратите внимание, что образец с процентом смертности клеток более 1% считается восприимчивым, в то время как менее 0,5% смерти свидетельствует о сопротивлении. Проценты, которые падают между этими двумя отрезами, считаются неопределенными, и образец должен быть проверен еще раз. - Используйте электронную таблицу для обобщения и анализа результатов различных экспериментов.
Результаты
Данные, представленные на рисунке 4, показывают реакцию восприимчивого штамма золотистого стафилококка с течением времени в антибиотикосодержащем микрофлюидном канале. Фазы контрастности изображения, приобретенные в 1 мин и в конце 1 час эксперимента показаны ?...
Обсуждение
Представленный протокол был проверен и оптимизирован в наборе экспериментов с метициллин-чувствительными и метициллин-устойчивыми штаммами золотистого стафилококка 10. Таким образом, этот протокол без изменений должен быть непосредственно применим к другим штаммам S. aureu...
Раскрытие информации
Микрофлюидный метод находится на рассмотрении патента: Sauer-Budge A, Шарон A, Калашников M, Wirz H, изобретатели; Метод и устройство для быстрого обнаружения бактериальной устойчивости к антибиотикам/ патента на восприимчивость PCT/US10/33523.
Благодарности
Мы благодарим инженеров и студентов Центра производственных инноваций Фраунгофера. За помощь в проектировании, обработке и автоматизации экспериментальной системы мы благодарим Андреаса Принцена, Хольгера Вирза, Дага Фосса, Дэвида Чаргина и доктора Судонг Шу. Мы благодарим Джулию Кукартц, Мелани Циммерманн, Нико Кракмар, Тима Гамбеля, Джоша Вильянуэва, Минори Симидзу и Катаржину Кулигу за помощь в тестировании экспериментальных протоколов и сбора данных. Мы признательны д-ру Энн Э. Карпентер и Марку-Энтони Брею (Mark-Anthony Bray) из платформы Imaging Platform в Институте Броуда Гарвардского университета и Массачусетского технологического института за помощь в разработке процедуры анализа изображений в CellProfiler. Описанный проект был частично поддержан наградами R21AI079474 и 1R01AI101446 от Национального института аллергии и инфекционных заболеваний. Содержание является исключительно ответственностью авторов и не обязательно отражает официальные взгляды Национального института аллергии и инфекционных заболеваний или Национальных институтов здравоохранения. Проект также был поддержан фраунгофером США.
Материалы
| Name | Company | Catalog Number | Comments |
| SYTOX Green | Invitrogen Corporation | S7020 | Dead cell fluorescence stain |
| Bovine Serum Albumin (BSA) | Sigma Aldrich, Inc | A9418-5G | Used for lysostaphin storage |
| Sodium Acetate | Sigma Aldrich, Inc | S8750-500G | Used for lysostaphin storage |
| Lysostaphin | Cell Sciences | CRL309A | Arrives as 1 mg solid. For storage: Dissolve in 20 mM sodium acetate. Mix with BSA solution to final concentration of 1% BSA and 100 µg/ml lysostaphin for storage |
| Oxacillin salt | Sigma Aldrich, Inc | 28221-1G | Antibiotic |
| Mueller Hinton Broth | Fisher Scientific | DF0757-17-6 | |
| Sodium chloride | Sigma Aldrixh | S3014-500G | 2% added to Mueller-Hilton broth prior to autoclaving |
| 1 ml, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 14-823-2F | |
| 2 oz, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 309653 - 60 mL | Overfill to ~65 ml |
| Microscope | |||
| Inverted Fluoresccence Microscope Olympus IX-70 | Cambridge Scientific | 9349 | |
| 60X, Fluorescence/Phase contrast objective | Olympus Corp. | LCPlan F1 60x/0.70 Ph2 | |
| Retiga 12-bit monochrome CCD camera | QImaging | RET-4000R-F-M-12-C | |
| Microscope automation | |||
| Shutters phase contrast/fluorescence | PRIOR Scientific | H204/H202 | |
| X/Y Stage | PRIOR Scientific | H107AENN | |
| Focus motor | PRIOR Scientific | H122 | |
| Joystick for XYZ control | PRIOR Scientific | CS152EF | |
| Proscan Controller | PRIOR Scientific | H3-XY2 | |
| Image Acquisition Software | Fraunhofer CMI | ||
| Flow Cell Assembly and PDMS | |||
| Flow Cell | BU Scientific Instruments Facility/Fraunhofer CMI | 3333-1044 | Engineering drawings were produced by Fraunhofer CMI |
| Glass window | Fraunhofer CMI | 3333-1054 | Glass window was cut to the proper size at Fraunhofer CMI |
| BOROFLOAT Window 50 mm x 50 mm | Edmund Optics Inc. | NT48-543 | |
| Sealing plate | BU Scientific Instruments Facility | 3333-1045 | |
| Epoxide glass slide | Arrayit Corporation | SuperEpoxy 2 | |
| PDMS master | Fraunhofer CMI | 3333-1053 | Master machined in aluminum or brass with UPM-0005 (ultrapresicion fly-cutting machine) |
| PDMS slide design | Fraunhofer CMI | 3333-1053 | |
| Tubing | |||
| Nut, Super flangeless Tinytight, headless, 1/16 in, PEEK, green | IDEX Health Science | M-644-03 | Flow cell inputs/outputs are tapped for this ferrule |
| Ferrule, Tinytight, 1/16 in, 6-40, .030 in TH, PEEK w/ SS lock ring, black | IDEX Health Science | M-657 | |
| Nut, Super flangeless Tinytight, headless, 1/16-1/32 in, 1/4-28, PEEK, natural | IDEX Health Science | P-255 | |
| Ferrule, Super Falngeless, 1/16 in, Tefzel (ETFE), yellow | IDEX Health Science | P-259 | Fits Luer-lock adapter |
| Tubing, Teflon FEP, .030 in x 1/16 in x 20 ft, green | IDEX Health Science | 1520G | |
| Adapter, quick connect female Luer to female 1/4-28, PEEK, red | IDEX Health Science | P-658 |
Ссылки
- Mairhofer, J., Roppert, K., Ertl, P. Microfluidic systems for pathogen sensing: a review. Sensors. 9, 4804-4823 (2009).
- Yager, P., et al. Microfluidic diagnostic technologies for global public health. Nature. 442, 412-418 (2006).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab Chip. 8, 1265-1272 (2008).
- Cao, J., et al. Uncovering toxicological complexity by multi-dimensional screenings in microsegmented flow: modulation of antibiotic interference by nanoparticles. Lab Chip. 12, 474-484 (2012).
- Chen, C. H., et al. Antimicrobial susceptibility testing using high surface-to-volume ratio microchannels. Anal. Chem. 82, 1012-1019 (2010).
- Churski, K., et al. Rapid screening of antibiotic toxicity in an automated microdroplet system. Lab Chip. 12, 1629-1637 (2012).
- Eun, Y. J., Utada, A. S., Copeland, M. F., Takeuchi, S., Weibel, D. B. Encapsulating bacteria in agarose microparticles using microfluidics for high-throughput cell analysis and isolation. ACS Chem. Biol. 6, 260-266 (2011).
- Kim, K. P., et al. In situ monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device. Lab Chip. 10, 3296-3299 (2010).
- Peitz, I., van Leeuwen, R. Single-cell bacteria growth monitoring by automated DEP-facilitated image analysis. Lab Chip. 10, 2944-2951 (2010).
- Kalashnikov, M., Lee, J. C., Campbell, J., Sharon, A., Sauer-Budge, A. F. A microfluidic platform for rapid, stress-induced antibiotic susceptibility testing of Staphylococcus aureus. Lab Chip. 12, 4523-4532 (2012).
- McDonald, J. C., Whitesides, G. M. Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc. Chem. Res. 35, 491-499 (2002).
- Roth, B. L., Poot, M., Yue, S. T., Millard, P. J. Bacterial viability and antibiotic susceptibility testing with SYTOX green nucleic acid stain. Appl. Environ. Microbiol. 63, 2421-2431 (1997).
- Francius, G., Domenech, O., Mingeot-Leclercq, M. P., Dufrene, Y. F. Direct observation of Staphylococcus aureus cell wall digestion by lysostaphin. J. Bacteriol. 190, 7904-7909 (2008).
- Jordan, S., Hutchings, M. I., Mascher, T. Cell envelope stress response in Gram-positive bacteria. FEMS Microbiol. Rev. 32, 107-146 (2008).
- Koch, A. L. Bacterial wall as target for attack: past, present, and future research. Clin. Microbiol. Rev. 16, 673-687 (2003).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: from targets to networks. Nat. Rev. Microbiol. 8, 423-435 (2010).
- Kohanski, M. A., Dwyer, D. J., Hayete, B., Lawrence, C. A., Collins, J. J. A common mechanism of cellular death induced by bactericidal antibiotics. Cell. 130, 797-810 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены