Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tests de sensibilité aux antibiotiques induits par le stress sur une puce
Dans cet article
Résumé
Nous avons développé une plateforme microfluidique pour des tests rapides de sensibilité aux antibiotiques. Le fluide est passé à grande vitesse sur les bactéries immobilisées au fond d’un canal microfluidique. En présence de stress et d’antibiotiques, les souches sensibles de bactéries meurent rapidement. Cependant, les bactéries résistantes peuvent survivre à ces conditions stressantes.
Résumé
Nous avons développé une méthode microfluidique rapide pour les tests de sensibilité aux antibiotiques dans un environnement basé sur le stress. Le fluide est passé à grande vitesse sur les bactéries immobilisées au fond d’un canal microfluidique. En présence de stress et d’antibiotiques, les souches sensibles de bactéries meurent rapidement. Cependant, les bactéries résistantes survivent à ces conditions stressantes. L’hypothèse derrière cette méthode est nouvelle : l’activation du stress des voies biochimiques, qui sont des cibles des antibiotiques, peut accélérer les tests de sensibilité aux antibiotiques. Par rapport aux méthodes standard d’essai de sensibilité aux antibiotiques, l’étape limitant le taux - la croissance bactérienne - est omise lors de l’application de l’antibiotique. La mise en œuvre technique de la méthode se fait dans une combinaison de techniques standard et d’approches innovantes. Les parties standard de la méthode comprennent des protocoles de culture bactérienne, la définition de canaux microfluidiques dans le polydiméthylsiloxane (PDMS), la surveillance de la viabilité cellulaire avec fluorescence et le traitement d’images par lots pour le comptage des bactéries. Les parties innovantes de la méthode sont l’utilisation du flux de milieux de culture pour l’application de contraintes mécaniques, l’utilisation d’enzymes pour endommager mais pas tuer les bactéries et l’utilisation de substrats de microréseaux pour la fixation bactérienne. La plate-forme développée peut être utilisée dans le développement et l’essai de médicaments antibiotiques et non antibiotiques. Par rapport aux expériences de suspension bactérienne standard, l’effet du médicament peut être activé et désactivé à plusieurs reprises sur des périodes de temps contrôlées. L’observation répétitive de la même population bactérienne est possible au cours de la même expérience.
Introduction
L’augmentation de la résistance bactérienne intensifie le besoin de tests de sensibilité aux antibiotiques rapides basés sur le phénotype afin de protéger nos médicaments de dernier recours. Les tests de sensibilité standard sont basés sur l’inhibition de la croissance bactérienne en présence d’antibiotiques qui prennent plusieurs (8-24) heures à compléter. Nous avons développé un nouveau test de sensibilité aux antibiotiques sur une plateforme microfluidique qui s’appuie sur l’activation du stress des voies biosynthétiques pour accélérer l’action des antibiotiques.
Les tests de sensibilité aux antibiotiques à l’échelle microfluidique ont l’avantage d’une utilisation efficace des échantillons, car ils nécessitent un petit nombre de bactéries. En outre, les dispositifs microfluidiques peuvent être multiplexés afin de tester plusieurs échantillons dans plusieurs conditions1,2. Récemment, un certain nombre de méthodes microfluidiques pour les tests de sensibilité aux antibiotiques ont été signalées3-9. Dans ces procédés, les bactéries sont cultivées à l’intérieur des gouttelettes nano- et picolitres3,7,dans le volume total du canal microfluidique4-6,8,ou sous forme de bactéries uniques localisées électriquement à la surface inférieure du canal9. Bien que ces tests soient effectués dans des canaux microfluidiques, ils surveillent tous la croissance microbienne en présence et en l’absence d’antibiotiques similaires aux méthodes traditionnelles. Les mesures de croissance sont prises via la densité optique, les colorants sensibles au pH ou le contraste de champ /phase lumineux ou des images de fluorescence. Bien que certains de ces tests soient plus rapides que les méthodes traditionnelles, ils détectent chacun passivement la résistance aux antibiotiques. En d’autres termes, ces méthodes nécessitent toujours que l’utilisateur attende la croissance bactérienne comme lecture finale.
En revanche, nous avons développé une méthode qui utilise une combinaison de cisaillement et de stress enzymatique pour activer les voies biochimiques sensibles aux antibiotiques10. La remise en question des bactéries stressées avec ces antibiotiques crée un test de susceptibilité plus rapide. Les bactéries résistantes à l’antibiotique sont capables de résister aux conditions stressantes. Les bactéries sensibles, d’autre part, sont rapidement tuées par les contraintes combinées. Le pourcentage de mort cellulaire après une heure, mesuré par microscopie à l’aide d’une coloration fluorescente des cellules mortes, définit le phénotype de la bactérie (résistante vs sensible).
Pour une mise en œuvre réussie de notre méthode, les bactéries doivent être immobilisées sur la surface inférieure du canal microfluidique. De cette façon, les bactéries peuvent être soumises à divers stress et simultanément esso repérées au microscope dans un seul plan. Une lame de verre de microscope revêtue est utilisée pour l’immobilisation des bactéries. La lame est pré-revêtue par le fabricant avec des groupes époxydes pour la liaison aux protéines non spécifiques. La liaison non spécifique de ces époxydes aux protéines de surface bactériennes fixe de manière covalente les bactéries à la surface de la lame.
Les souches sont testées dans des conditions identiques (cisaillement + stress enzymatique) en l’absence (contrôle) et en présence (expérience) d’antibiotique. Les photos de contraste de phase et de microscope à fluorescence de chaque canal sont prises automatiquement toutes les deux minutes pendant une heure. Les désignations de résistance sont ensuite faites en comparant le pourcentage de bactéries mortes dans le canal expérimental à celles présentes dans le canal témoin. Après une heure, un échantillon dont le pourcentage de mort cellulaire est supérieur à 1 % est considéré comme réceptif, tandis que moins de 0,5 % de décès indique une résistance. Les pourcentages qui se situent entre ces deux seuils sont considérés comme indéterminés et l’échantillon doit être testé de nouveau.
Les canaux microfluidiques sont définis dans PDMS, qui est un matériau de choix pour les dispositifs microfluidiques11. Pdms est optiquement transparent dans une large gamme de longueurs d’onde, biocompatible, inerte, perméable aux gaz et a une faible perméabilité aux liquides; par conséquent, il est bien adapté à ces expériences.
La contrainte mécanique/de cisaillement est créée par l’écoulement des milieux à température ambiante sur les bactéries immobilisées. (Remarque : Le réchauffement du support à 37 °C n’a pas d’effet significatif sur les résultats de l’essai.) Les pompes automatisées de seringue forcent les milieux (contenant une coloration des cellules mortes +/- antibiotique, ainsi que des facteurs de stress enzymatiques facultatifs) à travers les canaux microfluidiques (200 μm x 400 μm) à un débit de 1 ml/min pour donner 6,25 kPa de force de cisaillement ou un taux de cisaillement de 6 000 sec-1. Ce taux est égal ou supérieur aux contraintes de cisaillement précédemment étudiées sur les staphylocoques.
L’enzyme, la lysostaphine, a été choisie pour des expériences préliminaires parce qu’elle cause des dommages directs à la paroi cellulaire de Staphylococcus. La concentration de lysostaphin (0,7 ng/ml) était suffisante pour causer des dommages bactériens de paroi cellulaire, mais pas suffisante pour causer la mort cellulaire bactérienne sans antibiotique dans la période de l’expérience. La lysostaphine n’est pas requise pour la désignation correcte de la susceptibilité bactérienne, mais elle augmente le résultat, conduisant à une augmentation de la mort cellulaire chez les souches sensibles. En revanche, la contrainte de cisaillement est essentielle pour la fonction d’essai. Lorsque des souches de Staphylococcus aureus sensibles à la méthicilline sont traitées avec de la lysostaphine et de l’oxacilline en l’absence d’écoulement, aucune mort cellulaire n’est enregistrée au cours de l’expérience.
La viabilité cellulaire est surveillée avec une coloration fluorescente des cellules mortes12. Le choix du colorant était basé sur sa capacité à colorer sélectivement seulement les cellules endommagées, sa nontoxicité aux cellules vivantes, et sa faible fluorescence de fond, qui a permis son ajout direct au milieu cellulaire sans étapes supplémentaires. Le choix d’une concentration de colorant fluorescent de 0,25 μM visait à atteindre des niveaux de signal acceptables pendant un temps d’exposition de 1,6 s à la lumière d’excitation de fluorescence.
Le bêta-lactamine, oxacilline, a été employé dans nos études préliminaires. Les espèces de S. aureus résistant à la méthicilline (SARM) sont résistantes à l’oxacilline et ne présenteront aucune mort cellulaire appréciable au cours de l’expérience. La concentration de 50 μg/ml a été déterminée dans les études préliminaires. Des concentrations plus faibles d’antibiotiques ont donné moins de séparation entre les souches résistantes et sensibles, tandis que des concentrations plus élevées n’ont pas entraîné de différence appréciable dans les résultats expérimentaux.
Nous avons précédemment rendu compte du développement réussi d’un test qui combine des contraintes mécaniques et enzymatiques qui affectent directement la paroi cellulaire bactérienne13 avec un antibiotique qui inhibe la biosynthèse de la paroi cellulaire14,15. Ces expériences de démonstration de principe ont été réalisées sur un panel de SARM et de S. aureus (MSSA), sensible à la méthicilline. Cependant, avec la sélection des paramètres expérimentaux appropriés, notre méthode devrait être applicable à plusieurs espèces de bactéries et à plusieurs classes d’antibiotiques.
Protocole
1. Créer la couche PDMS (Figure 1)
- Mélanger vigoureusement le PDMS et l’agent de durcissement dans un rapport de 10:1. Pour éliminer les bulles, dégaz le mélange visqueux dans une chambre à vide pendant 1 heure à température ambiante.
- Sur une balance, versez le PDMS lentement sur le moule en aluminium. Versez du centre et maintenez le moule nivelé. Assurez-vous de laisser les broches à découvert. Arrêtez de verser une fois que le poids cible est atteint.
Notre moule nécessite 4 g de PDMS et 0,4 g de réactif de durcissement. - Niveler le moule à l’intérieur d’un four et durcir à 37 °C pendant la nuit.
Les temps de durcissement alternatifs sont de 2 h à 60 °C ou de 1 h à 90 °C. - Disséquer la couche PDMS durcie le long du bord du moule et la décoller soigneusement de la surface du moule avec une paire de pinces. Nettoyez la surface du moule avec 70% d’éthanol et une Q-tip.
2. Assemblez la cellule d’écoulement selon la figure 2
L’assemblage standard de PDMS avec des lames de verre se fait par traitement au plasma d’oxygène des deux surfaces, ce qui garantit une liaison sans fuite entre le PDMS et la lame de verre du microscope. Dans le protocole présenté, le traitement au plasma détruirait le revêtement chimique sur la lame de verre. Par conséquent, la lame est scellée sous pression plutôt que traitée au plasma.
- Placez la fenêtre en verre dans la poche de la cellule d’écoulement.
- Posez une lame de verre enduit sur la fenêtre en verre à l’intérieur de la poche de la cellule d’écoulement avec le côté actif vers le haut, et placez la couche PDMS avec des canaux orientés vers le bas sur le dessus. Placez la glissière PDMS de manière à ce que les entrées de canal s’alignent sur les trous traversants de la plaque métallique. Poussez doucement l’air entre les couches.
- Retournez l’assemblage PDMS/lame de verre afin que le PDMS fasse face à la fenêtre en verre. Superposez les entrées du canal PDMS avec les trous traversants de la plaque métallique.
- Placez la plaque de pression sur le dessus et serrez les vis.
- Placez la cellule d’écoulement assemblée sous le microscope. Réglez le grossissement du microscope sur 60X et préalignez les positions du canal.
3. Préparer les bactéries de la phase logarithmique
- Jour avant l’expérience : Inoculer 50 ml de bouillon Mueller Hinton contenant 2 % de NaCl (MH2) avec une colonie bactérienne. Agiter à 250 tr/min pendant la nuit à 37 °C.
Une ou deux souches bactériennes peuvent être étudiées dans une expérience pour la configuration décrite. - Avant l’expérience : Mélanger 50 μl de culture bactérienne pendant la nuit dans 50 ml de milieu MH2. Agiter à 250 tr/min pendant 3 h à 37 °C pour s’assurer que les bactéries sont en phase logarithmique.
4. Réchauffer les composants de la solution expérimentale au moins 10 minutes avant qu’ils ne soient nécessaires
- Décongeler le colorant fluorescent (5 mM de stock) et la lysostaphine (10 μg/ml de stock) à température ambiante.
- Réchauffer la poudre d’oxacilline à température ambiante.
5. Préparer et charger la suspension bactérienne
- Après la fin de la sous-culture de 3 heures: Prendre 10 ml de culture de bactéries et centrifuger à 1 650 x g pendant 2 min.
- Retirer le surnageant et la remise en suspension des bactéries dans 1 ml de milieux frais MH2.
- Fixez un tube de courte longueur à une seringue Luer lock de 1 ml. Rincer le tube de la seringue avec 1 ml de support. Laissez un peu de support dans le tube pour éviter les bulles d’air lors de l’étirage dans la suspension bactérienne.
- Chargez 0,7 ml de bactéries de type 1 dans la seringue. Remplissez deux canaux de la cellule d’écoulement avec des bactéries de type 1. Surveillez l’apparition du liquide de l’autre côté du canal après ca. 150 μl.
La transparence du canal change à mesure qu’il est rempli de bactéries. - Si vous expérimentez avec plusieurs types de bactéries, répétez la procédure de chargement pour les bactéries de type 2 dans les deux canaux restants de la cellule d’écoulement.
- Placez la cellule d’écoulement à l’intérieur de l’incubateur à 37 °C pendant 45 min pour permettre la décantation bactérienne et sa fixation à la surface de la glissière.
6. Préparer et charger les solutions expérimentales
- Préparer 140 μl de solution de colorant fluorescent à 0,5 mM en mélangeant 14 μl de colorant fluorescent (5 mM) et 126 μl de milieux MH2.
- Diluer 10 mg d’oxacilline dans 40 ml de MH2 pour obtenir une concentration finale de 250 μg/ml d’oxacilline.
- Préparer 130 ml de solution témoin avec des concentrations finales de colorant fluorescent de 0,25 μM et de 0,7 ng/ml de lysostaphine. Pour ce faire, mélanger 65 μl de colorant fluorescent (0,5 mM), 9,12 μl de stock de lysostaphine (10 μg/ml) et 130 ml de milieux MH2.
- Préparer 130 ml de solution antibiotique avec des concentrations finales de colorant fluorescent de 0,25 μM, de 0,7 ng/ml de lysostaphine et de 50 μg/ml d’oxacilline. Pour ce faire, mélanger 65 μl de colorant fluorescent (0,5 mM), 9,12 μl de stock de lysostaphine (10 μg/ml), 26 ml d’oxacilline (250 μg/ml) et 104 ml de milieux MH2.
- Remplissez deux seringues de 60 ml avec une solution de contrôle et deux seringues de 60 ml avec une solution antibiotique. Conservez les solutions enveloppées dans du papier d’aluminium pour éviter la dégradation des réactifs induite par la lumière.
Remplissez trop les seringues pour tenir compte de la perte due au rinçage du tube. - Retirez les bulles d’air des seringues en feuilletant. Fixez et remplissez le tube d’entrée à la pointe avec la solution expérimentale.
- Montez des seringues sur la pompe. Placez d’abord la seringue avec le plus petit volume, puis verrouillez la position du piston. Placez le reste des seringues sur la pompe, en serrant leurs pistons si nécessaire.
- Réglez la vitesse de la pompe à 1 ml/min et le volume de la pompe à 60 ml. Faites un flush avec la pompe jusqu’à ce qu’un flux constant de liquide soit vu de toutes les seringues.
7. Configurez la cellule d’écoulement au microscope
- Retirez la cellule d’écoulement de la centrifugeuse et montez-la sur l’étage du microscope(Figure 3).
- Connectez le tube d’entrée/sortie à chacun des canaux de cellule d’écoulement (une entrée/une sortie par canal).
La collecte de la sortie dans quatre conteneurs différents permet de mesurer des volumes de sortie de canal individuels.
8. Exécutez l’expérience de 60 minutes
- Vérifiez les positions préalignées de l’étape 2.5. Si le champ de vision du microscope n’est pas centré sur le canal et/ou n’est pas mis au point, ajustez les paramètres et enregistrez les nouvelles positions.
Une mise au point précise peut ne pas être possible avant le début de l’écoulement en raison de la forte densité de bactéries chargées. - Réglez le temps d’acquisition du contraste de phase à 10 ms et le temps d’acquisition de la fluorescence à 1 600 ms.
- Obtenir des images de contraste de phase et de fluorescence pour chaque position avant d’initier le flux.
Cela donne une estimation qualitative de la densité bactérienne chargée. - Démarrez le flux de liquide et vérifiez immédiatement que le microscope est focalisé sur le bas des canaux.
- Prenez des images de contraste de phase et de fluorescence des zones cibles dans la première minute d’écoulement.
- Acquérir des images toutes les 2 minutes après le premier ensemble d’images jusqu’à ce que 60 min de flux se soit produite. Recentrez-vous au besoin.
9. Désinfecter la cellule d’écoulement
- Faire une solution d’eau de Javel à 10% dans un bécher (100 ml). Remplissez 4 seringues de 20 ml avec 10 ml du mélange. Déblocez les seringues et fixez-les à la cellule d’écoulement.
Il faudra ~ 1-2 min pour que les canaux soient débraux des bactéries. - Réglez la vitesse de la pompe à 1 ml/min et le volume de la pompe à 3 ml. Courir pendant 3 min.
- Remplissez 4 seringues de 60 ml avec 60 ml d’eau DI. Déblocez les seringues et fixez-les à la cellule d’écoulement.
- Régler la vitesse de la pompe à 1 ml/min et le volume de la pompe à 30 ml. Courir pendant 30 min.
- Surveillez le nettoyage du canal au microscope.
- Désassemblez la cellule d’écoulement. Jetez la lame époxy utilisée. Faire tremper les composants de la cellule d’écoulement dans de l’eau DI pendant 20 min. Sécher à l’air.
10. Analyser les images et générer des données
- Comptez le nombre de bactéries dans chaque image.
Le logiciel en libre accès, CellProfiler est utilisé pour effectuer le traitement d’image par lots16. Un aperçu général de la routine CellProfiler est résumé dans le tableau 1. Le nombre de bactéries présentes dans l’image de contraste de phase (Np)donne le nombre total de bactéries. Le nombre de bactéries visibles dans l’image de fluorescence (Nf)donne le nombre de bactéries mortes. - Calculer le pourcentage normalisé de mort cellulaire bactérienne en fonction du temps.
- Importez Nf et Np pour des images individuelles dans le logiciel d’analyse de données.
- Calculer la fraction de bactéries mortes dans chaque canal à un point de temps spécifique donné par la fraction (Nf / Np) à t = T.
- Soustrayez la fraction de bactéries mortes présentes au début de l’expérience (t = 1 min) pour les canaux témoins et expérimentaux.
- Soustrayez la fraction de bactéries mortes présentes dans le canal témoin de celle présente dans le canal expérimental à chaque point temporel avec l’équation suivante :
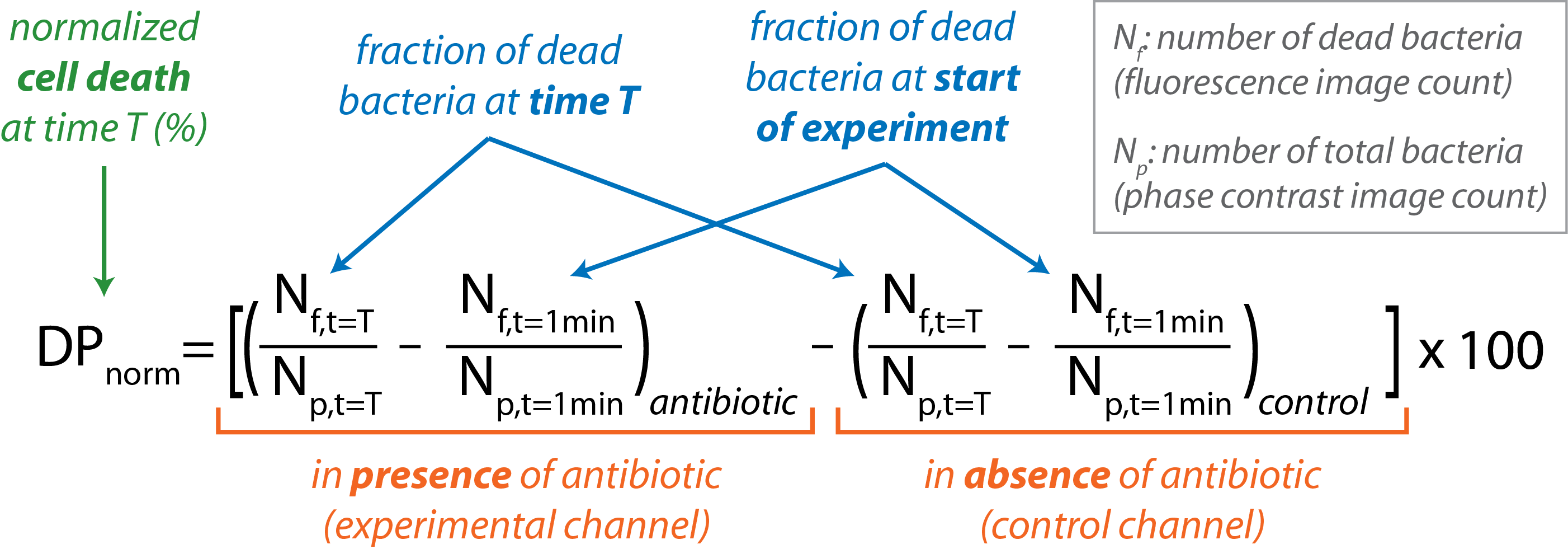
- Graphenorme DP vs t pour le cours de l’expérience.
Il est à noter qu’un échantillon dont le pourcentage de mort cellulaire est supérieur à 1 % est considéré comme réceptif, tandis que moins de 0,5 % de décès indique une résistance. Les pourcentages qui se situent entre ces deux seuils sont considérés comme indéterminés et l’échantillon doit être testé de nouveau. - Utilisez une feuille de calcul pour résumer et analyser les résultats de différentes expériences.
Résultats
Les données présentées à la figure 4 montrent la réponse d’une souche sensible de Staphylococcus aureus au fil du temps dans un canal microfluidique contenant des antibiotiques. Les images de contraste de phase acquises à 1 min et à la fin de l’expérience 1 heure sont représentées sur les figures 4A et B. Les données analysées sur 1 heure sont présentées à la figure 4C avec les bactéries surlignées en rouge (5 828 ...
Discussion
Le protocole présenté a été validé et optimisé dans un ensemble d’expériences avec des souches de Staphylococcus aureus sensibles à la méthicilline et résistantes à la méthicilline10. Par conséquent, ce protocole sans modification devrait être directement applicable à d’autres souches de S. aureus et à d’autres antibiotiques avec des mécanismes d’action affectant la biosynthèse bactérienne de paroi cellulaire. Les types de bactéries autres que S. aureus pe...
Déclarations de divulgation
La méthode microfluidique est en instance de brevet : Sauer-Budge A, Sharon A, Kalachnikov M, Wirz H, inventeurs ; Procédé et dispositif de détection rapide de la résistance bactérienne aux antibiotiques/sensibilité au brevet PCT/US10/33523.
Remerciements
Nous remercions les ingénieurs et les étudiants du Fraunhofer Center for Manufacturing Innovation. Pour avoir contribué à la conception, à l’usinage et à l’automatisation du système expérimental, nous remercions Andreas Prinzen, Holger Wirz, Doug Foss, David Chargin et le Dr Sudong Shu. Nous remercions Julia Kuckartz, Melanie Zimmermann, Niko Kraetzmar, Tim Gumbel, Josh Villanueva, Minori Shimizu et Katarzyna Kuliga pour leur aide dans la mise à l’essai des protocoles expérimentaux et la collecte de données. Nous remercions les Drs Anne E. Carpenter et Mark-Anthony Bray de la plateforme d’imagerie du Broad Institute de Harvard et du MIT pour leur aide dans le développement de la routine d’analyse d’images dans CellProfiler. Le projet décrit a été soutenu en partie par les prix R21AI079474 et 1R01AI101446 de l’Institut national des allergies et des maladies infectieuses. Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les opinions officielles de l’Institut national des allergies et des maladies infectieuses ou des Instituts nationaux de la santé. Le projet a également été soutenu par Fraunhofer USA.
matériels
| Name | Company | Catalog Number | Comments |
| SYTOX Green | Invitrogen Corporation | S7020 | Dead cell fluorescence stain |
| Bovine Serum Albumin (BSA) | Sigma Aldrich, Inc | A9418-5G | Used for lysostaphin storage |
| Sodium Acetate | Sigma Aldrich, Inc | S8750-500G | Used for lysostaphin storage |
| Lysostaphin | Cell Sciences | CRL309A | Arrives as 1 mg solid. For storage: Dissolve in 20 mM sodium acetate. Mix with BSA solution to final concentration of 1% BSA and 100 µg/ml lysostaphin for storage |
| Oxacillin salt | Sigma Aldrich, Inc | 28221-1G | Antibiotic |
| Mueller Hinton Broth | Fisher Scientific | DF0757-17-6 | |
| Sodium chloride | Sigma Aldrixh | S3014-500G | 2% added to Mueller-Hilton broth prior to autoclaving |
| 1 ml, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 14-823-2F | |
| 2 oz, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 309653 - 60 mL | Overfill to ~65 ml |
| Microscope | |||
| Inverted Fluoresccence Microscope Olympus IX-70 | Cambridge Scientific | 9349 | |
| 60X, Fluorescence/Phase contrast objective | Olympus Corp. | LCPlan F1 60x/0.70 Ph2 | |
| Retiga 12-bit monochrome CCD camera | QImaging | RET-4000R-F-M-12-C | |
| Microscope automation | |||
| Shutters phase contrast/fluorescence | PRIOR Scientific | H204/H202 | |
| X/Y Stage | PRIOR Scientific | H107AENN | |
| Focus motor | PRIOR Scientific | H122 | |
| Joystick for XYZ control | PRIOR Scientific | CS152EF | |
| Proscan Controller | PRIOR Scientific | H3-XY2 | |
| Image Acquisition Software | Fraunhofer CMI | ||
| Flow Cell Assembly and PDMS | |||
| Flow Cell | BU Scientific Instruments Facility/Fraunhofer CMI | 3333-1044 | Engineering drawings were produced by Fraunhofer CMI |
| Glass window | Fraunhofer CMI | 3333-1054 | Glass window was cut to the proper size at Fraunhofer CMI |
| BOROFLOAT Window 50 mm x 50 mm | Edmund Optics Inc. | NT48-543 | |
| Sealing plate | BU Scientific Instruments Facility | 3333-1045 | |
| Epoxide glass slide | Arrayit Corporation | SuperEpoxy 2 | |
| PDMS master | Fraunhofer CMI | 3333-1053 | Master machined in aluminum or brass with UPM-0005 (ultrapresicion fly-cutting machine) |
| PDMS slide design | Fraunhofer CMI | 3333-1053 | |
| Tubing | |||
| Nut, Super flangeless Tinytight, headless, 1/16 in, PEEK, green | IDEX Health Science | M-644-03 | Flow cell inputs/outputs are tapped for this ferrule |
| Ferrule, Tinytight, 1/16 in, 6-40, .030 in TH, PEEK w/ SS lock ring, black | IDEX Health Science | M-657 | |
| Nut, Super flangeless Tinytight, headless, 1/16-1/32 in, 1/4-28, PEEK, natural | IDEX Health Science | P-255 | |
| Ferrule, Super Falngeless, 1/16 in, Tefzel (ETFE), yellow | IDEX Health Science | P-259 | Fits Luer-lock adapter |
| Tubing, Teflon FEP, .030 in x 1/16 in x 20 ft, green | IDEX Health Science | 1520G | |
| Adapter, quick connect female Luer to female 1/4-28, PEEK, red | IDEX Health Science | P-658 |
Références
- Mairhofer, J., Roppert, K., Ertl, P. Microfluidic systems for pathogen sensing: a review. Sensors. 9, 4804-4823 (2009).
- Yager, P., et al. Microfluidic diagnostic technologies for global public health. Nature. 442, 412-418 (2006).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab Chip. 8, 1265-1272 (2008).
- Cao, J., et al. Uncovering toxicological complexity by multi-dimensional screenings in microsegmented flow: modulation of antibiotic interference by nanoparticles. Lab Chip. 12, 474-484 (2012).
- Chen, C. H., et al. Antimicrobial susceptibility testing using high surface-to-volume ratio microchannels. Anal. Chem. 82, 1012-1019 (2010).
- Churski, K., et al. Rapid screening of antibiotic toxicity in an automated microdroplet system. Lab Chip. 12, 1629-1637 (2012).
- Eun, Y. J., Utada, A. S., Copeland, M. F., Takeuchi, S., Weibel, D. B. Encapsulating bacteria in agarose microparticles using microfluidics for high-throughput cell analysis and isolation. ACS Chem. Biol. 6, 260-266 (2011).
- Kim, K. P., et al. In situ monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device. Lab Chip. 10, 3296-3299 (2010).
- Peitz, I., van Leeuwen, R. Single-cell bacteria growth monitoring by automated DEP-facilitated image analysis. Lab Chip. 10, 2944-2951 (2010).
- Kalashnikov, M., Lee, J. C., Campbell, J., Sharon, A., Sauer-Budge, A. F. A microfluidic platform for rapid, stress-induced antibiotic susceptibility testing of Staphylococcus aureus. Lab Chip. 12, 4523-4532 (2012).
- McDonald, J. C., Whitesides, G. M. Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc. Chem. Res. 35, 491-499 (2002).
- Roth, B. L., Poot, M., Yue, S. T., Millard, P. J. Bacterial viability and antibiotic susceptibility testing with SYTOX green nucleic acid stain. Appl. Environ. Microbiol. 63, 2421-2431 (1997).
- Francius, G., Domenech, O., Mingeot-Leclercq, M. P., Dufrene, Y. F. Direct observation of Staphylococcus aureus cell wall digestion by lysostaphin. J. Bacteriol. 190, 7904-7909 (2008).
- Jordan, S., Hutchings, M. I., Mascher, T. Cell envelope stress response in Gram-positive bacteria. FEMS Microbiol. Rev. 32, 107-146 (2008).
- Koch, A. L. Bacterial wall as target for attack: past, present, and future research. Clin. Microbiol. Rev. 16, 673-687 (2003).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: from targets to networks. Nat. Rev. Microbiol. 8, 423-435 (2010).
- Kohanski, M. A., Dwyer, D. J., Hayete, B., Lawrence, C. A., Collins, J. J. A common mechanism of cellular death induced by bactericidal antibiotics. Cell. 130, 797-810 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon