Method Article
Un modelo experimental para estudiar la tuberculosis-Malaria Coinfección sobre Transmisión Natural de Mycobacterium tuberculosis Y Plasmodium berghei
En este artículo
Resumen
La tuberculosis y la malaria son dos de las infecciones más prevalentes en los humanos y las principales causas de morbilidad y mortalidad en las poblaciones pobres de las zonas tropicales. Hemos establecido un sistema de modelo experimental para estudiar los resultados de la coinfección tuberculosis-la malaria en ratones tras la exposición a ambos patógenos a través de su vía natural de infección.
Resumen
Las coinfecciones ocurren de forma natural debido a la coincidencia geográfica de los distintos tipos de organismos patógenos. Infecciones concurrentes muy probablemente modulan la respectiva respuesta inmunitaria a cada solo patógeno y pueden afectar con ello la patogénesis y evolución de la enfermedad. Los pacientes coinfectados también pueden responder diferencialmente a las intervenciones anti-infecciosos. La coinfección entre la tuberculosis como causada por micobacterias y el parásito de la malaria Plasmodium, los cuales son coendemic en muchas partes del África subsahariana, no se ha estudiado en detalle. Con el fin de abordar el reto, pero científicamente y clínicamente pregunta muy relevante cómo modular la coinfección tuberculosis-malaria inmunidad del huésped y el curso de cada enfermedad, establecimos un modelo experimental de ratón que nos permite diseccionar las respuestas inmunitarias producidas a ambos patógenos en el huésped coinfectados . Es de destacar que el fin de la mayoría de las infecciones humanas imitan a la perfección adquiridos naturalmente, realizamos experimentalinfecciones de ratones con ambos patógenos por parte de sus rutas naturales de infección, es decir, aerosol y picadura de un mosquito, respectivamente.
Introducción
Las poblaciones humanas rara vez se exponen a un solo patógeno. Sobre todo en las regiones con alta incidencia de infecciones como el África subsahariana, las coinfecciones representan un problema de salud pública de primera, pero muy poco apreciada. La tuberculosis y la malaria son las infecciones bacterianas y parasitarias de mayor prevalencia en los seres humanos, respectivamente, y siguen siendo las causas principales de morbilidad y mortalidad en las poblaciones pobres de las zonas tropicales. A pesar de la amplia superposición geográfica entre la tuberculosis y la malaria y el gran número de personas en riesgo de coinfección, se sabe muy poco acerca de las interacciones entre los diversos y con frecuencia contrapuestos reguladores inmunes y efectores simultáneamente provocados contra los parásitos de la malaria y los bacilos de la tuberculosis en las personas coinfectadas.
Modelos de roedores de infecciones mixtas permiten caracterizar las reacciones inmunes diferenciales frente a patógenos distintos en un host, lo que enfatiza la influencia mutuariencias modulación de la patología y la evolución clínica de la enfermedad individual, lo que también ayudará a identificar nuevas recomendaciones para el tratamiento y la prevención. Hemos establecido un modelo experimental de ratón, que nos permite investigar las ramificaciones causadas por la infección concurrente con Mycobacterium tuberculosis (Mtb) y especies de Plasmodium de roedores dentro de la misma máquina 1. Es importante destacar que, para emular las infecciones humanas adquiridas naturalmente lo más estrechamente posible, nuestro modelo implementa las rutas naturales de infección utilizados por ambos patógenos. La tuberculosis es una infección por el aire, que por lo tanto se manifiesta principalmente en los pulmones. El agente causal, Mtb es transmitida por las personas con enfermedad activa a través de la ruta de aerosol cuando se expulsan gotitas de aerosol infecciosas durante la tos o el estornudo. Por lo tanto, la infección por aerosol es el método de elección para imitar la infección natural. Generación de partículas en el aire que contienen Mtb se puede lograr mediante el usode un sistema de exposición por inhalación. Esta cámara de exposición de todo el cuerpo permite la exposición de los animales experimentales para Mtb-que contiene gotitas de aerosol infecciosas (Figura 1) que se inhala en los alvéolos de los pulmones, donde se inicia la infección 2.
La malaria, por otro lado es una enfermedad transmitida por vectores causada por el protozoo parásito Plasmodium apicomplejo que se transmite de forma natural por la picadura de un mosquito anofeles hembra. Durante la harina de sangre, esporozoitos infecciosos se depositan bajo la piel de acogida y posteriormente alcanzan el hígado a través del torrente sanguíneo. Dentro de los hepatocitos se desarrollan y se multiplican rápidamente en esquizontes hígado etapa. Eventualmente, los esquizontes maduros se rompen y liberan miles de merozoitos de primera generación patógenos en el torrente sanguíneo donde inician un ciclo progresivo de la invasión de células rojas, la replicación, la ruptura de los glóbulos rojos, y la reinvasión 3. La contingencia del ciclo de vida del Plasmodiumues como algunos merozoitos se desarrollan en las etapas de parásitos sexuales, los gametocitos masculinos y femeninos, que pueden ser emprendidas por los mosquitos durante las comidas de sangre. En el mosquito, los esporozoitos de Plasmodium se desarrollan dentro de los ooquistes que residen en el intestino medio del mosquito y eventualmente migran a las glándulas salivales para su posterior transmisión a otro 3,4 anfitrión.
Aunque en modelos animales experimentales de la entrega de Mtb través del aerosol y la vía por lo tanto más relevante es muy común, muchos estudios de infección por Plasmodium roedores experimentales, incluyendo estudios sobre la malaria tuberculosis coinfección 5-7 se han llevado a cabo mediante la infección de ratones con eritrocitos parasitados, dando lugar a la infección de la malaria en fase de sangre mientras que excluye la fase hepática en fase clínicamente silenciosa. Sin embargo, la etapa de hígado es un paso obligatorio durante la infección y relevante para la inmunidad anti-plasmodial 8-11. Consideramos que es por lo tanto importante incluir el pH hepáticaase de transmisión de la malaria y el mantenimiento en los estudios tanto de la malaria y la coinfección por malaria tuberculosis, respectivamente. Además, se ha demostrado que los esporozoitos de transmisión de forma natural son más infecciosos que los transmitidos a través de las infecciones de aguja 12, que nos llevó a establecer la infección de la malaria por picadura de mosquito en lugar de inyectar aislado de las glándulas salivales esporozoitos derivados. La única manera de obtener mosquitos infecciosos de transmisión natural de parásitos de la malaria es mantener todo el ciclo de vida del parásito, tanto en el hospedador vertebrado (en este caso el ratón) y el mosquito vector. Por lo tanto, el acceso a un insectario para el mantenimiento parásito es inevitable con el fin de realizar transmisión natural por picadura.
Nuestro protocolo descrito en el presente documento ha sido desarrollado para investigar la forma en la coinfección por el Plasmodium esporozoitos impactos sobre la tuberculosis crónica 1. Para ello, los ratones son aerosoles infectados con M. tuberculosis y 40 días más tarde, cuando M. infección por tuberculosis ha alcanzado la fase crónica, los ratones son expuestos a los mosquitos malaria-infeccioso. El resultado de tanto la malaria y la tuberculosis en los animales coinfectados puede ser seguido por el seguimiento de la parasitemia en la sangre y la carga bacteriana en el tejido, respectivamente. En nuestro protocolo, vamos a describir en detalle cómo se infectan ratones con ambos patógenos a través de su ruta de infección natural y la forma de confirmar la transmisión de patógenos con éxito. En nuestras manos, la tasa de infección comúnmente alcanzada por ambas infecciones experimentales es del 100%. Estos protocolos se pueden aplicar para estudiar tanto las infecciones por separado o, como nosotros, para modelar y estudiar la coinfección entre dos de los más desafiantes enfermedades infecciosas humanas. Este modelo es aplicable a otras especies de Mycobacterium y Plasmodium roedor más allá de los descritos en este protocolo.
Protocolo
Medidas de seguridad y Declaración de Ética
Los estudios presentados en este documento implican el trabajo con el patógeno humano Mtb y el parásito de la malaria Plasmodium berghei roedor (P. berghei). Experimentos con Mtb (H37Rv cepa) y P. berghei debe llevarse a cabo bajo las condiciones de bioseguridad apropiadas. Nivel de bioseguridad (BSL) se requieren 2 laboratorios de parásitos de la malaria de roedores como P. berghei y BSL 3 de Mtb y por lo tanto, para todos los estudios de coinfección descritos en este documento. NOTA: Los ratones infectados con Mtb no transmiten la infección a otros ratones en las inmediaciones (de nuestra propia observación). Por lo tanto, Spread al experimentador puede excluirse; ropa de protección adecuada, sin embargo tiene que ser usado en el interior del laboratorio BSL 3 en todo momento. De acuerdo con nuestras normas, los experimentadores visten batas quirúrgicas, redes para el cabello, mascarillas desechables, y dos pares de guantes, de los cuales la exterior se descarta cualquier momento unarms son retirados del gabinete. Nuevo se ponen en antes de entrar en el gabinete de nuevo. Dos recipientes, uno con 2% Buraton (NOTA: otros desinfectantes aprobados para inactivar Mtb se pueden utilizar a la concentración aprobada) para residuos líquidos y contagiosa y una para la descontaminación de superficies, se preparan antes del experimento y se colocan en el interior del gabinete. Además, las bolsas de plástico se utilizan para que los residuos no infecciosa sólido. De acuerdo con las normas alemanas, todo el trabajo que implica el manejo y procesamiento de cultivos de btt o tejidos derivados de Mtb ratones infectados deben llevarse a cabo en un gabinete de seguridad biológica de clase 2 dentro de un laboratorio BSL3. Si bien el manejo de las micobacterias, las medidas tienen que ser tomadas para evitar la generación de aerosoles en todo momento.
Hembra C57BL / 6 ratones (Charles River) con edades comprendidas entre 6 a 8 semanas se utilizaron para todos los experimentos de coinfección y se mantiene en condiciones de barrera específicos en BSL 3 instalaciones. Cuidado de los animales y la experimentación eran performed de conformidad con los protocolos aprobados por el Comité Ético de Experimentación Animal del Ministerio de Agricultura, Medio Ambiente, y Medio Rural del Estado de Schleswig-Holstein
Para la obtención de las etapas del mosquito de la malaria, los ratones NMRI se compraron de Charles River Laboratory, Sulzfeld, Alemania y mantenidos bajo condiciones específicas libres de patógenos dentro de las instalaciones de animales de la Universidad de Heidelberg (FIB). Todos los experimentos con animales se realizaron de acuerdo con la normativa europea y aprobados por las autoridades del estado de Baden-Württemberg (Regierungspräsidium Karlsruhe).
1. Aerosol La infección de ratones con Mtb mediante una cámara de aerosol Glas-Col
La mejor manera de normalizar la infección por aerosol de animales de experimentación con Mtb es el uso de micobacterias de existencias congeladas con conocidos títulos de UFC. Para preparar cultivos madre, la cultura Mtb en caldo Middlebrook 7H9 suplementado con OADC (oleicoácido, albúmina, dextrosa, catalasa) medio y 0,05% de enriquecimiento de Tween 80, una fuente de carbono para micobacterias y medir a evitar la aglutinación bacteriana al mismo tiempo. Los cultivos deben tener un diámetro exterior ≤ 1 en el momento de la cosecha. A mayor OD, aumentos de agrupamiento bacterianas y la viabilidad se reduce. Tienda 1 ml alícuotas a -80 ° C. Determinar el número de colonias viables unidades (CFU) en material congelado por siembra de una serie de 10 diluciones de tres viales independientes sobre placas de agar 7H11 suplementado con 0,5% de glicerol, 1 g / L asparagina formación y OADC y enumerar las colonias después de 4 semanas de incubación a 37 ° C. Realizar la infección de aerosol como se describe a continuación.
- Descongelar las poblaciones de Mtb de conocida título de UFC y cuidadosamente la mezcla de la suspensión cinco veces para dispersar aglomeraciones bacterianas usando una jeringa de 1 ml, equipado con una aguja de calibre 27. Evitar la producción de aerosoles.
- Dependiendo de la dosis de infección deseado, transferir el volumen requerido de la población micobacteriana enun tubo de 50 ml que contenía PBS estéril. El volumen final es de 6 ml. NOTA: Al variar el número de microorganismos en esta suspensión, la proporción de bacterias que llevan gotitas de aerosol se varía. Por lo general, apuntamos a una absorción de 100 bacilos viables por pulmón (infección de dosis baja). En nuestra experiencia, esto requiere de alrededor de 1-2 x 10 6 Mtb / ml en un volumen total de 6 ml de los cuales 5,5 ml están nebulizadas (ver más abajo). Se recomienda hacer una serie de desafíos experimentales de aerosol con diferentes concentraciones de bacterias para encontrar las condiciones ideales para su infección. Mientras que las infecciones de dosis alta con hasta 5000 micobacterias se puede hacer para acelerar el proceso infeccioso, tan pocos como 5 bacterias se pueden utilizar para infectar con éxito ratones por aerosol. La tasa de infección es comúnmente 100%.
- Retire volumen suficiente (preparado en exceso de volumen final requerido) para el recubrimiento para determinar el título de inóculo; solemos eliminamos 500 l a la placa por triplicado técnicos.
- Coloque los animales enuna cesta de malla compartimentado (un ratón por cesta) dentro de la cámara de aerosol circular y cierre la tapa de la cámara de aerosol. NOTA: Otros modelos están equipados con una canasta en forma de pastel compuesto por cinco compartimentos individuales, cada una de ellas con capacidad de 20 ratones.
- Coloque la unidad Venturi-nebulizador para los tres rótulas de acero inoxidable.
- Retire la suspensión micobacteriana desde el tubo de 50 ml con una jeringa de 10 ml, equipado con una aguja roma 18 G y llevar a la jeringa a la cámara de aerosol en una caja de transporte cerrado.
- Retire el tapón de rosca de la unidad del nebulizador y cuidadosamente inyectar la suspensión de micobacterias en el nebulizador. Evitar la formación de aerosoles. Deseche la jeringa en un contenedor de objetos punzantes que contiene 2% Buraton. Selle el nebulizador con la tapa roscada.
- Encienda el interruptor de alimentación principal y la lámpara UV. La pantalla del panel de control muestra "Glas-Col Apparatus Co".
- Gire el selector de programas en. La pantalla mostraráShow "es el nebulizador listo?" "¿Se ha cargado la canasta?" Presione Enter cuando esté listo ". Pulsa enter.
- En la pantalla aparece "Enter Tiempo de precalentamiento 900", lo que significa que el tiempo de precalentamiento para la incineradora (que descontamina el aire de salida) es de 900 seg. Pulsa enter.
- La pantalla mostrará "Enter tiempo nebulizadora 1800", lo que significa que el tiempo de nebulización se establece en 1.800 segundos de forma predeterminada. Con el fin de extender el tiempo de nebulización, introduzca "2400" y pulse Enter. NOTA: Durante el ciclo de nebulización, aire a presión atomiza la suspensión, generando de esta manera pequeñas gotas de aerosol que contienen micobacterias. Con el flujo de aire principal, estas gotitas (aproximadamente 2-5 m de tamaño) se realizan en la cámara de aerosol.
- La pantalla mostrará "Enter Tiempo CD 1800", lo que significa que el ciclo de la decadencia lleva 1.800 sec. Establecer a "2400" y pulse Enter. NOTA: Durante este ciclo, la nube que se ha construido up en la cámara de aerosol durante el ciclo de nebulización puede decaer. Las pequeñas gotas son inhaladas por los animales de experimentación.
- La pantalla mostrará "Enter Tiempo diciembre 900", lo que significa que el ciclo de luz UV descontaminación tendrá 900 segundos. Pulsa enter. La máquina comenzará en bicicleta a través de precalentamiento, nebulización, la decadencia de nubes y descontaminación UV.
PRECAUCIÓN: El medidor de caudal de vacío debe indicar 60 pies cúbicos / hora (comprobar cuando se inicia el ciclo de precalentamiento, ajustar la válvula de control de vacío si es necesario) y el medidor de flujo de aire comprimido 10 metros cúbicos / hora (comprobar cuando se inicia el ciclo de nebulización, ajustar la válvula de control de aire de acuerdo ). - Cuando haya finalizado el ciclo, el teclado mostrará "Proceso completo - Retirar la pieza". Apague el programa, UV y el interruptor de alimentación principal.
- Compruebe si la suspensión micobacteriana ha sido nebulizado completamente y si no, registrar el volumen restante mediante la eliminación de la suspensión cuidadosamente con una jeringa apropiada equipado conuna aguja roma 18 G. El volumen restante no debe ser más de 1 ml.
- Retire el nebulizador de las articulaciones y colóquelo en un recipiente que contiene un 2% Buraton por un mínimo de 2 horas, por lo general se lleva a cabo la desinfección de O / N. Luego, transferir el nebulizador a una cacerola fresca y enjuague bien con agua. Deja nebulizador se seque al aire.
- Abra la cámara de aerosol y devolver los animales a sus jaulas. Bolso de los cestos en bolsas de autoclave y autoclave. Limpie las superficies del interior de la cámara de aerosol con un 2% Buraton NOTA:. Por razones de seguridad, un respirador purificador de aire forzado deben ser usados durante este procedimiento.
- Uso de los 500 l restantes de la suspensión micobacteriana (véase el paso 1.3) de la placa diluciones de 10 veces de una técnica por triplicado (3 x 100 l) en placas de agar 7H11.
2. Verifique Captación de CFU deseado en los pulmones
Un día después de la infección de aerosoles de animales de experimentación a determinar la he bacterianaanuncio en los pulmones de los animales de control designadas con el fin de verificar la absorción de la UFC deseada. NOTA: Por lo general, designamos un grupo extra de 3-5 ratones para el día 1 de determinación CFU.
Para supervisar el curso de la infección de Mtb con el tiempo, la carga micobacteriana tejido puede ser examinado mediante siembra de diluciones seriadas de homogeneizados de órganos enteros para la determinación de UFC. El pulmón es el sitio principal para la manifestación de la enfermedad de la tuberculosis, sin embargo bazo, el hígado y los ganglios se suelen analizar en consecuencia. Las diluciones para ser chapados dependen de la carga micobacteriana esperado en los órganos, que dependen de la inóculo inicial (dosis baja frente a dosis alta), que da lugar a diferentes cargas bacterianas en el tejido, así como en el órgano y el punto de tiempo para ser analizado. Tras la infección de dosis baja, la carga bacteriana de Mtb H37Rv en el pulmón por lo general llega a una meseta entre el día 25-30.
- Coloca los animales sacrificados (Eutanasia: CO 2 asfixia oanestesia terminal) sobre papel absorbente en un tablero de disección en una cabina de bioseguridad de clase II y desinfectar los ratones con etanol al 70%. NOTA: el 70% de alcohol es sólo para la descontaminación de la superficie y no matará Mtb.
- Hacer una pequeña incisión en el centro del abdomen y retraer la piel del ratón por encima de la cabeza.
- Abrir el abdomen y la caja torácica con tijeras quirúrgicas y quitar la pared torácica a fin de que los pulmones son accesibles.
- Eliminar los pulmones y transferir a un tubo de 15 ml con tampón de homogeneización (agua estéril / 1% v / v de Tween 80/1% w / v de albúmina).
- Usando el émbolo de un 5 pulmones ml de deformación jeringa a través de 100 micras tamices en una pequeña placa de Petri.
- Tamices descarga varias veces utilizando una pipeta de 1 ml, equipado con una punta de barrera y distribuir el homogeneizado de pulmón entre las 8 placas de agar (ca 250 l / placa;. Asegurarse de que tienen una superficie bien seca).
- Placa cuidadosamente las muestras utilizando esparcidores desechables que se eliminen en un 2%Buraton.
- Deja placas de agar para secar el interior del armario. Selle cada plato único con parafilm, envolver en papel de aluminio y se incuba en posición vertical a 37 ° C durante al menos 4 semanas.
3. Construcción de jaulas de mosquitos a prueba de fugas
Cepas de roedores Plasmodium no son perjudiciales para los seres humanos. Sin embargo, puesto que los ratones infectados con Mtb son los destinatarios del parásito y el trabajo se hace bajo condiciones BSL 3, es necesario tomar precauciones para evitar que los mosquitos se escapen de sus jaulas. Dependiendo del régimen de la infección planificada, autoclavable y jaulas de estructura metálica o jaulas desechables hechos a sí mismos reutilizables se pueden utilizar. Estos últimos se recomiendan si la infección por mordedura de animales de experimentación se requiere para ser llevado a cabo por un número definido de mosquitos por ratón. Si se requieren jaulas hecho a sí mismo, preparar las jaulas a las especificaciones exactas como la salud de los mosquitos y la seguridad del laboratorio depende de su sound construcción (Figura 2).
- Tome una caja de cartón, como un cuarto de litro de helado de cartón o una taza de café de papel (Figura 2).
- Cortar una pequeña abertura en el costado de la caja de cartón y la cubierta con una doble capa de látex con un corte de la abertura en cada pieza para crear una entrada segura para los mosquitos. NOTA: La apertura tiene un tamaño total de 2 cm x 2 cm, el tubo (dispositivo de aspiración) que utilizamos para traer y / o para llevar a cabo los mosquitos es un tubo de 15 ml Falcon modificada unida a una bomba de vacío y por lo tanto sirve como un aspirador con un diámetro de 1,5 cm.
- Pegue un pedazo de papel de filtro en la parte inferior en el interior de la caja de cartón para absorber los goteos.
- Cierre las copas de helado con red (doble capa de malla de nylon, tamaño de 1 mm x 1 mm) y fijarlo a la caja de cartón con cinta y la banda elástica.
- Para los experimentos de infección donde se requieren números definidos de mosquitos por ratón, preparar jaulas con 10-15 mosquitos infectados, cada uno de los cuales contiene idealmente un AVtura de 10.000 de tipo salvaje de la glándula salival P. esporozoitos berghei.
- Idealmente, los mosquitos morir de hambre durante 24 horas antes de realizar la harina de sangre.
4. Malaria La infección de ratones por picadura de mosquito
El parásito de la malaria de roedores se utiliza aquí es P. berghei sin embargo, cualquier otra cepa de Plasmodium roedor de interés se puede utilizar. Para obtener mosquitos infecciosos para la transmisión de esporozoitos se mantiene todo el ciclo de vida del parásito, tanto en el hospedador vertebrado (ratón) y el mosquito vector. Mantenimiento del parásito se lleva a cabo en un insectario. Para los experimentos de transmisión naturales, el número mínimo de esporozoitos por la glándula salival debe ser inferior a 10.000. Para los protocolos detallados en el mantenimiento del parásito nos referimos a los métodos de Investigación de Paludismo por Moll et al., 2013.
- Anestesiar ratones o animales preinfected durante 40 días con Mtb con ketamina ingenuos (100 mg / kg)y xilazina (7 mg / kg) por inyección intraperitoneal solución (200 l / ratón). NOTA: El tiempo entre la infección por Mtb y Plasmodium se puede ajustar en función de la pregunta de investigación subyacente. Del mismo modo, el orden de los retos de patógenos puede ser invertida, es decir, los ratones pueden ser expuestos a la picadura de un mosquito infeccioso antes de la infección de Mtb.
- Coloca los ratones anestesiados en la compensación de las jaulas de mosquitos (una de ratones por jaula de mosquitos para mosquitos definido al cociente del ratón) y permitir que los mosquitos se alimentan a través de la membrana durante 10-15 min. NOTA: La presencia de sangre en las entrañas de mosquitos implica la alimentación y, por tanto, la transmisión de esporozoitos.
- Transfiera los ratones de nuevo en sus jaulas y supervisar constantemente hasta que se despiertan de la anestesia. NOTA: Coloque los ratones en una toalla de papel y no en la ropa de cama (riesgo de asfixia) y mantener caliente (lugar en estrecha colaboración y cubrir el cuerpo con una toalla de papel).
- Matar a los mosquitos rociándolos con etanol al 70% u otro desinfectante a través del nettción de la jaula. Jaulas autoclave y descartan si se utilizaran los desechables.
5. Monitoreo Parasitemia
- Punción cola venas en el final con una aguja y recoger una gota de sangre en cada extremo de una diapositiva.
- Utilice otra diapositiva para tirar una gota de sangre más de la mitad de la longitud de la diapositiva. Dé la vuelta a la cruceta de usar el otro borde para el segundo frotis. Deja diapositivas se seque al aire.
- Tinción de Giemsa
- Coloque las diapositivas en cajas de portaobjetos y fijar los frotis de sangre mediante una breve inmersión en metanol absoluto. NOTA: Debido a que el uso del material de vidrio debe mantenerse como mínimo en el BSL 3 utilizamos cubetas de polipropileno para todas las soluciones.
- Sumerja los frotis en Giemsa (1:10 en agua desionizada). Después de 10 minutos, sumergir los portaobjetos dentro y fuera de las cubetas de tinción llenos de agua desionizada varias veces para enjuagar el exceso de colorante.
- Por último, los portaobjetos secos de aire en una posición vertical.
- MANCHA DE ALTERNATIVA: Wright & #180; s mancha
- Disolver la tinción de Wright a una concentración de 1 mg / ml en metanol.
- Filtrar a través de filtro plegado antes de su uso.
- Sumerja los frotis de sangre en solución de tinción y se incuba durante 4 min (NOTA: metanol fijación de los frotis no es necesario ya que la solución de tinción es metanol basada).
- Lave por deslizamientos de enjuague en agua desionizada como se describe más arriba y dejar secar al aire diapositivas.
- Una vez Giemsa / Wright 's se ha completado, transferir suavemente todos los reactivos utilizados en una disposición de la olla que contiene Buraton-.
- Análisis de frotis de sangre
- Analizar frotis de sangre teñidos con el microscopio óptico con un aumento de 100 veces con aceite de inmersión.
- Número de eritrocitos no infectados e infectados en una zona de la frotis de sangre donde los eritrocitos están dispuestas en una monocapa.
- Con el fin de lograr una parasitemia bien definida, contar al menos 10 campos de vista diferentes que muestran una monocapa de eritrocitos.
- Calculcomió la parasitemia relativa (en%) dividiendo el número de eritrocitos parasitados por el número de eritrocitos y multiplicando por 100.
Resultados
La infección de ratones con Mtb y P. berghei a través de la ruta natural, es decir, aerosol y picadura de un mosquito, respectivamente, los resultados en la infección coherente y reproducible de todos los animales (Tabla 1) 1. Podemos monitorear la infección exitosa y el curso de los dos la malaria y la tuberculosis mediante la determinación de la aparición inicial (prepatencia) y el número de parásitos en la sangre (P. berghei parasitemia) y la carga de Mtb en diferentes órganos, respectivamente. Un ejemplo de éxito de la transmisión del parásito de la malaria por la picadura de un mosquito infectado se muestra en la Tabla 1 y Figura 3. La alimentación de 10 mosquitos esporozoito infectados en cada ratón dio como resultado una tasa de infección del 100% según lo confirmado por la presencia de parásitos en el estadio en sangre 4-5 días después (Tabla 1 y Figura 3A). Es importante destacar que nos encontramos con el número de parásitos similares en la sangre de ratones individuales de la misma gr experimentaloup, lo que indica que la transmisión de esporozoito por los resultados de la mordedura de mosquito en una infección consistente y reproducible. Al comparar la prepatencia en los ratones control no tratados previamente con la de los animales Mtb coinfectados, podemos ver que prepatencia se retrasa ligeramente en ratones que habían sido preinfected con Mtb (Tabla 1, Figura 3B) 1. Como hemos informado anteriormente 1, podemos determinar el impacto de la coinfección Mtb en el curso de la malaria parasitemia seguimiento diario de Giemsa de frotis teñidos de sangre, como se muestra en la Figura 3B.
La infección de ratones con Mtb por el uso de un sistema de exposición a la inhalación resultados en la deposición con éxito de las bacterias en los pulmones con relativamente baja variabilidad entre ratones individuales (Figura 4A). Podemos seguir cargas de micobacterias en los pulmones y otros órganos de interés a través del tiempo por la determinación de UFC. Un ejemplo para la carga micobacteriana en los pulmones deMtb infectado ratones C57BL / 6 en la ausencia o presencia de P. berghei se muestra en la Figura 4B.
Tabla 1. Prepatencia después de la transmisión de esporozoito por picadura de mosquito. Todos los ratones desarrollaron infecciones del estadio en sangre después de la transmisión natural de P. berghei esporozoitos por picadura de mosquito. Adaptado de 1 PLoS ONE, 7 (10), e48110 con permiso.
| Grupo de ratones Experimental (C57BL / 6) | Desafíe por 10 picaduras de mosquitos infecciosos | Número de sangre-fase animales positivos / N º de animales por grupo | Mean prepatencia [d] |
| ingenuo | P. berghei | 7/7 | 4,4 |
| Mtb infectado | P. berghei | 7/7 | 5,5 d> |
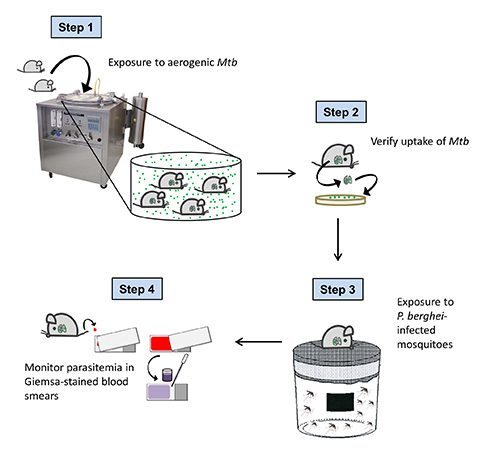
Figura 1. Esquema general del procedimiento experimental. C57BL / 6 ratones se expone a Mtb-que contienen gotitas de aerosol en una cámara de aerosol Glas-Col. Un día después de la infección de aerosol, la absorción de Mtb se verificó por análisis de UFC de pulmón. 40 días después del desafío Mtb (cuando la tuberculosis se ha convertido en crónica en ratones infectados), los animales están expuestos a P. berghei infectado mosquitos. Para confirmar la transmisión de esporozoito éxito y seguir el curso de la infección por Plasmodium, la parasitemia es monitoreada diariamente en Giemsa de frotis teñidos de sangre a partir de 3 días después picadura de mosquito.
/ Files/ftp_upload/50829/50829fig2highres.jpg "src =" / files/ftp_upload/50829/50829fig2.jpg "/>
Figura 2. Bosquejo de una jaula de mosquitos. Mosquitos infecciosos están contenidas dentro de un cartón, como un cuarto de litro de helado de cartón. Una pequeña abertura se corta en el lado de la caja de cartón y se cubre con una doble capa de látex con una hendidura cortada en cada pieza para crear una entrada segura para los mosquitos. Un trozo de papel de filtro se pega en la parte inferior en el interior de la caja de cartón para absorber los goteos. Copas de helado se cierran con una red (malla de nylon) que está fijado a la caja de cartón por la cinta y la banda elástica.

Figura 3. Parasitemia Sangre. A) Ejemplo de Wright `s frotis de sangre teñida mostrando eritrocitos parasitados (barra de escala, 20 & #181;. M) B) La parasitemia en sangre de ratón se controló mediante el análisis diarios frotis de sangre teñidos con Giemsa. Ratones coinfectados tienen una parasitemia reducido en comparación con los ratones de Plasmodium individuales infectados (n = 10), y los resultados se muestran como medias ± SD; *** p <0,001. Reproducido de 1 PLoS ONE, 7 (10), e48110 con permiso.
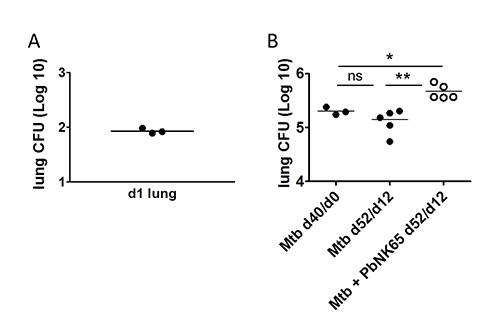
Figura 4. La detección de Mtb en el pulmón. C57BL / 6 ratones fueron retados con aerosol 100 UFC de Mtb y 40 días más tarde, coinfectados por el P. B) Las bacterias berghei por picadura de mosquito. A) Un día después de la infección aerosol la captación del número deseado de Mtb se verificó mediante siembra de homogeneizados de pulmón entero para la determinación de UFC.l cargas en el momento de la coinfección se determinaron en lisados de pulmón de 3 ratones a través de análisis de CFU (Mtb d40/d0). 12 días después de la coinfección, lisados de pulmón se sembraron para el análisis de CFU para determinar el impacto de la coinfección por Plasmodium en el control de Mtb. Tenga en cuenta, que los números de Mtb en los pulmones se incrementaron durante la coinfección con P. berghei NK65. Etiquetado del eje X: tiempo después de Mtb -infection/time después de la coinfección. Adaptado de 1 PLoS ONE, 7 (10), e48110 con permiso.
Discusión
Describimos cómo los ratones pueden ser productivamente infectadas por Mtb y P. berghei a través de sus rutas naturales de infección. Aplicamos establecido protocolos de infección experimental para estudiar la tuberculosis o la malaria 13 12 y, recientemente, los adoptó para estudiar la coinfección entre Mtb y Plasmodium en el modelo de ratón 1.
Los pasos más importantes para las infecciones de éxito son la transmisión de ambos patógenos en los números deseados. Stocks por micobacterias no deben ser mayores de 2 años, porque van a perder viabilidad en el tiempo, y la decidida originalmente el título de las acciones lo más probable es ya no ser exacta. Como resultado, las dosis de infección sería mucho menor de lo esperado. Por lo tanto, los títulos de UFC de cultivos madre deben determinarse cada pocos meses. Igualmente importante es el cultivo estandarizado y generación de reservas de Mtb en el primer lugar. Las condiciones de cultivo, tales comomedio, suplementos, tiempo, y el volumen deben ser normalizados con el fin de ser capaz de comparar los datos de diferentes experimentos utilizando poblaciones de Mtb. Micobacterias tienden a aglutinarse durante el cultivo, por lo que es importante mantener las condiciones de cultivo estandarizado, las bacterias de la cosecha en la misma fase de crecimiento y volver a suspender con frecuencia durante alícuotas. De lo contrario puede haber una amplia variación en los títulos de UFC y el resultado de la infección.
La generación de lotes de mosquitos infectados de forma homogénea es otro paso crítico. Desde diferentes mosquitos se alimentan de cada ratón individual, es importante que todos los mosquitos utilizados para un experimento de infección provienen del mismo lote y que se utilizan únicamente los lotes donde se infectó a más de 90% de los mosquitos.
El modelo actual se puede utilizar para diseccionar las respuestas inmunes y modulaciones inmune en un huésped coinfectados por comparación con las respuestas inmunes en hospedadores infectados individuales. Podemos aplicar vametodologías tales como la histología, inmunohistoquímica, citometría de análisis de poblaciones de células inmunes, o PCR y ELISA para la detección de citoquinas y quimioquinas a los tejidos o fluidos corporales de interés GRAVES bien establecidos. Cabe señalar, que tales modelos de ratón tienen ciertas limitaciones. Mientras que la mayoría de la gente infectada con Mtb desarrollar una infección latente, sin signos de los síntomas clínicos, los ratones desarrollan una enfermedad crónica con patología pulmonar progresiva. Sin embargo, ratones C57BL / 6 ratones son relativamente resistentes a la infección de Mtb y no desarrollan granulomas clásicos como se observa en los pacientes con tuberculosis humanos. Como resultado, las reacciones inmunopatológicas en el ratón no reflejan ni la enfermedad de la tuberculosis humana latente ni activa apropiadamente. A pesar de la discrepancia entre la enfermedad latente y crónica en el hombre y el ratón, los ratones se han utilizado ampliamente para identificar y estudiar los factores del huésped que controlan la infección por Mtb y son herramientas valiosas e indispensables para investigarla respuesta inmune en las enfermedades infecciosas. Es importante destacar que, la susceptibilidad a la infección de Mtb varía considerablemente entre las cepas de ratón endogámicas de uso común y las cepas más susceptibles tales como DBA o C3H se pueden incluir en los estudios de co-y-infección única. Por otra parte, además de las especies de patógenos descritos en este documento, se podrían utilizar cualquier otra especie de Mycobacterium de interés (por ejemplo, aislados clínicos). Del mismo modo, mientras que hay un único modelo de la malaria se replica todos los aspectos de la enfermedad humana diferentes modelos de ratones no se parecen mucho a los diferentes aspectos de la infección de la malaria humana adquirida de forma natural. Por ejemplo, P. berghei y P. ANKA Yoelii YM/17XL se estudian ampliamente los modelos de hombre (inducida por P. falciparum) paludismo grave, con P. berghei ANKA está considerado como un excelente modelo para el consumo humano Malari s cerebral 14,15. P. berghei NK65 es un excelente modelo para hiperparasitemia y malaria anemia aguda, y ha sido recientementedescrito como un modelo experimental para el síndrome de la malaria asociada a dificultad respiratoria aguda (SDRA MA-16). Utilizando el modelo de la coinfección descrito, recientemente hemos podido demostrar que P. concurrente infección berghei NK65 exacerba tuberculosis crónica 1.
Aparte de utilizar diferentes parásitos de la malaria de roedores, el orden y el calendario de eventos de infección pueden ser adaptados en función de la pregunta de investigación subyacente. En el campo, infecciones por Plasmodium concomitantes pueden estar presentes en el momento de la infección de Mtb o adquirida posteriormente. En ambos casos la respuesta inmune a Mtb y Plasmodium pueden verse afectados de forma diferente. Por lo tanto, los ratones pueden infectarse con esporozoitos de Plasmodium, ya sea antes o después de la infección de Mtb. Además, los ratones pueden ser impugnadas en diferentes momentos después de la infección de Mtb para evaluar el impacto de la respuesta inmune inducida por Plasmodium in aguda frente crónicala tuberculosis. Es importante destacar que, al elegir un parásito de la malaria para el estudio de la coinfección por malaria tuberculosis, uno debe ser consciente de que algunas cepas de Plasmodium roedores causan enfermedad grave en ciertas cepas de ratón y sucumben a la infección dentro de sólo unos días o semanas, mientras Mtb hace crónica y las infecciones de larga duración en inmunocompetentes ratones. Por lo tanto, el momento de la coinfección es crucial con el fin de evitar la muerte prematura de los animales experimentales.
La modulación de la inmunidad del huésped por la infección simultánea con múltiples especies de patógenos sigue siendo poco conocida. Nuestro modelo de coinfección experimental proporciona una herramienta poderosa para investigar Mycobacterium - interacción Plasmodium con el sistema inmune de un huésped coinfectados y contribuirá a nuestra comprensión de cómo las coinfecciones pueden afectar patogenia, evolución de la enfermedad, la vacunación, inmunodiagnóstico, y la terapia.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Miriam Ester para la reproducción de mosquitos. Este trabajo fue apoyado por el financiamiento interno del Centro de Investigación Borstel y se unió a la financiación por la infección Leibniz Center.
Materiales
| Name | Company | Catalog Number | Comments |
| Buraton | Schülke | active ingredients: aldehyds (formaldehyde, glutaraldehyde, oxalaldehyde, ethyl hexanal) | |
| Middlebrook 7H9 | Sigma | M0178 | For Mtb broth cultures |
| Middlebrook 7H11 | BD Biosciences | 283810 | Agar medium for Mtb culture |
| Middlebrook OADC enrichment medium | BD Biosciences | 212240 | Add to 7H9 and 7H11 for Mtb culture |
| Staining Dish | Science Services | E62542-12 | |
| 24-slide Holder w/Handle | Science Services | E62543-06 | |
| Giemsas Azur-Eosin-Methylene blue solution | Merck Millipore | 109204 | |
| Wright´s stain | Sigma | W0625 | |
| Inhalation Exposure System | Glas-Col | ||
| Nebulizer-Venturi | Glas-Col | ||
| Ice cream cups | Häagen-Dazs | Used as mosquito cages | |
| Metal-frame mosquito cages | BioQuip Products | 1450A |
Referencias
- Mueller, A. -. K., et al. Natural Transmission of Plasmodium berghei Exacerbates Chronic Tuberculosis in an Experimental Co-Infection Model. PLoS ONE. 7, e48110 (2012).
- Korbel, D. S., Schneider, B. E., Schaible, U. E. Innate immunity in tuberculosis: myths and truth. Microbes Infect. 10, 995-1004 (2008).
- Aly, A. S., Vaughan, A. M., Kappe, S. H. Malaria parasite development in the mosquito and infection of the mammalian host. Annu. Rev. Microbiol. 63, 195-221 (2009).
- Cirimotich, C. M., Dong, Y., Garver, L. S., Sim, S., Dimopoulos, G. Mosquito immune defenses against Plasmodium infection. Dev. Compar. Immuno. 34, 387-395 (2010).
- Page, K. R., et al. Mycobacterium-induced potentiation of type 1 immune responses and protection against malaria are host specific. Infect. Immun. 73, 8369-8380 (2005).
- Hawkes, M., et al. Malaria exacerbates experimental mycobacterial infection in vitro and in vivo. Microbes Infect. 12, 864-874 (2010).
- Scott, C. P., Kumar, N., Bishai, W. R., Manabe, Y. C. Short report: modulation of Mycobacterium tuberculosis infection by Plasmodium in the murine model. Am. J. Trop. Med. Hyg. 70, 144-148 (2004).
- Hoffman, S. L., Doolan, D. L. Malaria vaccines-targeting infected hepatocytes. Nat. Med. 6, 1218-1219 (2000).
- Mueller, A. K., et al. Genetically attenuated Plasmodium berghei liver stages persist and elicit sterile protection primarily via CD8 T cells. Am. J. Pathol. 171, 107-115 (2007).
- Mueller, A. K., Labaied, M., Kappe, S. H., Matuschewski, K. Genetically modified Plasmodium parasites as a protective experimental malaria vaccine. Nature. 433, 164-167 (2005).
- Nussenzweig, R. S., Vanderberg, J., Most, H., Orton, C. Protective immunity produced by the injection of x-irradiated sporozoites of plasmodium berghei. Nature. 216, 160-162 (1967).
- Vaughan, J. A., Scheller, L. F., Wirtz, R. A., Azad, A. F. Infectivity of Plasmodium berghei sporozoites delivered by intravenous inoculation versus mosquito bite: implications for sporozoite vaccine trials. Infect. Immun. 67, 4285-4289 (1999).
- Coleman, J., Juhn, J., James, A. A. Dissection of midgut and salivary glands from Ae. aegypti mosquitoes. J. Vis. Exp. , e228 (2007).
- Franke-Fayard, B., et al. A Plasmodium berghei reference line that constitutively expresses GFP at a high level throughout the complete life cycle. Mol. Biochem. Parasitol. 137, 23-33 (2004).
- Lin, J. W., et al. Loss-of-function analyses defines vital and redundant functions of the Plasmodium rhomboid protease family. Mol. Microbiol. 88, 318-338 (2013).
- Bancroft, J. D. G., M, . Theory and Practice of Histological Techniques. , (2007).
- Schneider, B. E., et al. A role for IL-18 in protective immunity against Mycobacterium tuberculosis. Eur. J. Immunol. 40, 396-405 (2010).
- Craig, A. G., et al. The role of animal models for research on severe malaria. PLoS Pathog. 8, e1002401 (2012).
- de Souza, J. B., Hafalla, J. C., Riley, E. M., Couper, K. N. Cerebral malaria: why experimental murine models are required to understand the pathogenesis of disease. Parasitology. 137, 755-772 (2010).
- Van den Steen, P. E., et al. Immunopathology and dexamethasone therapy in a new model for malaria-associated acute respiratory distress syndrome. Am. J. Respir. Crit. Care Med. 181, 957-968 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados