Method Article
Eine experimentelle Modell zum Studium Tuberkulose-Koinfektion auf Natur Malaria Übertragung von Mycobacterium tuberculosis Und Plasmodium berghei
In diesem Artikel
Zusammenfassung
Tuberkulose und Malaria sind zwei der häufigsten Infektionen bei Menschen und die Hauptursachen für Morbidität und Mortalität bei der verarmten Bevölkerung in den Tropen. Wir gründeten eine experimentelle Modellsystem, um Ergebnisse der Malaria-Tuberkulose-Koinfektion bei Mäusen nach der Infektion mit beiden Erregern über ihre natürlichen Infektionsweg zu studieren.
Zusammenfassung
Koinfektionen natürlich aufgrund der geografischen Überschneidungen von verschiedenen Arten von pathogenen Organismen vorkommen. Concurrent-Infektionen wahrscheinlich modulieren die Immunantwort auf jeweiligen einzelnen Erreger und kann dadurch Pathogenese und Krankheitsverlauf beeinflussen. Koinfektion Patienten können auch unterschiedlich reagieren auf anti-infektiöse Interventionen. Koinfektion von Tuberkulose durch Mykobakterien und dem Malaria-Parasiten Plasmodium, die beide coendemic sind in vielen Teilen Afrikas südlich der Sahara, verursacht hat, nicht im Detail untersucht. Um die Herausforderung, aber wissenschaftlich und klinisch sehr relevante Frage, wie Malaria-Tuberkulose-Koinfektion modulieren Wirtsimmunität und der Verlauf der jeweiligen Krankheit, ein experimentelles Mausmodell, dass wir die ausgelöste Immunantwort auf Krankheitserreger sowohl in der Host-Koinfektion sezieren ermöglicht haben wir nähern . Zu beachten ist, um die meisten genau Mimik natürlich erworbenen Infektionen beim Menschen führen wir experimentelleInfektionen von Mäusen mit beiden Krankheitserregern durch ihre natürlichen Infektionswege, dh Aerosol-und Mückenstich auf.
Einleitung
Bevölkerungs selten nur ein Pathogen ausgesetzt. Besonders in Regionen mit hoher Inzidenz von Infektionen wie Afrika südlich der Sahara, Co-Infektionen stellen eine erstklassige, aber sehr unterschätzte Problem der öffentlichen Gesundheit. Tuberkulose und Malaria sind die häufigsten bakteriellen und parasitären Infektionen beim Menschen bzw. und weiter auf die Hauptursachen für Morbidität und Mortalität bei der verarmten Bevölkerung in den Tropen zu sein. Trotz der großen geografischen Überschneidungen zwischen Tuberkulose und Malaria und der großen Anzahl von Personen in Gefahr Koinfektion wird sehr wenig über die Wechselwirkungen zwischen den verschiedenen und oft entgegenImmunRegulaToren und Effektoren gleichzeitig gegen Malaria-Parasiten und Tuberkelbazillen in coinfected Einzelpersonen ausgelöst bekannt.
Nagetier-Modelle von Mischinfektionen ermöglichen Charakterisierung Differenzimmunreaktionen gegen verschiedene Krankheitserreger in einem Wirt, damit Licht auf die gegenseitige Einflussflusst Modulation Pathologie und klinische Ergebnisse der einzelnen Krankheit, die auch helfen, neue Empfehlungen für die Therapie und Prävention identifizieren. Wir haben ein experimentelles Mausmodell, das es uns ermöglicht, die Auswirkungen durch die gleichzeitige Infektion mit Mycobacterium tuberculosis (Mtb) verursacht und Nagetier Plasmodium-Arten innerhalb der gleichen Host 1 zu untersuchen etabliert. Wichtig ist, die natürlicherweise erworbene Infektionen beim Menschen möglichst genau nachzubilden, unser Modell implementiert die natürlichen Infektionswege von beiden Erregern eingesetzt. Tuberkulose ist eine Tröpfcheninfektion, die somit offenbart in erster Linie in der Lunge. Der Erreger wird Mtb von Menschen mit aktiver Erkrankung über die Aerosol-Weg übertragen, wenn sie infektiöse Aerosol-Tröpfchen beim Husten oder Niesen zu vertreiben. So ist Aerosol-Infektion die Methode der Wahl, um die natürliche Infektion zu imitieren. Erzeugung von Schwebeteilchen Mtb enthalten, können durch die Verwendung erreicht werden,einer Inhalationsbelichtungssystem. Diese Ganzkörperexposition auszusetzen Kammer ermöglicht Versuchstieren zu Mtb-haltigen infektiösen Aerosol-Tröpfchen (Abbildung 1), die in die Alveolen der Lunge, wo Infektion eingeleitet 2 eingeatmet werden.
Malaria auf der anderen Seite ist eine Vektor-übertragene Krankheit, die durch Protozoen, apicomplexan Parasiten Plasmodium, die natürlich durch den Stich der Anopheles-Mücke eine weibliche übertragen wird. Während der Blutmahlzeit, sind infektiöse Sporozoiten unter dem Host Haut abgelagert und anschließend erreichen die Leber über die Blutbahn. Innerhalb Hepatozyten entwickeln sie sich rasch vermehren und in Leberstadium Schizonten. Schließlich reifen Schizonten Bruch und lassen Tausende von pathogenen ersten Generation Merozoiten in den Blutstrom, wo sie eine progressive Zyklus der roten Zellinvasion, Replikation, rote Zellbruch und Reinvasion 3 einzuleiten. Der Lebenszyklus von Plasmodium Continues wie einige Merozoiten entwickeln sich zu den sexuellen Parasitenstadien, die männlichen und weiblichen Gametozyten, die durch Mücken während der Blutmahlzeiten eingenommen werden kann. In der Mücke entwickeln Plasmodium Sporozoiten in Oozysten mit Wohnsitz in der Mückendarm und schließlich in die Speicheldrüsen zur Weiterleitung in ein anderes Wirts 3,4 migrieren.
Während in experimentellen Tiermodellen die Lieferung von Mtb über die Aerosol-und damit wichtigste Route ist sehr verbreitet, viele experimentelle Nagetier Plasmodium Infektionsstudien einschließlich Studien über Malaria-Tuberkulose-Koinfektion 5-7 wurden durch Infektion von Mäusen mit Parasiten befallenen Erythrozyten, wodurch geführt um Blut-Stufen-Malaria-Infektion unter Ausschluss der klinisch-silent Leberstadium-Phase. Die Leber ist jedoch eine obligatorische Etappe Schritt während der Infektion und relevant für Anti-Plasmodien Immunität 11.08. Wir halten es daher wichtig, die Leber enthalten phase der Malaria-Übertragung und Wartung in Studien sowohl Malaria und Malaria-Tuberkulose-Koinfektion auf. Darüber hinaus hat sich gezeigt, dass natürlich übertragen Sporozoiten sind ansteckender als diejenigen, die über 12 Nadel-Infektionen, die uns aufgefordert, die Malaria-Infektion durch Mücken anstelle der Injektion von isolierten Speicheldrüse abgeleitet Sporozoiten etablieren Biss übertragen. Der einzige Weg, um infektiöse Mücken für natürliche Übertragung von Malaria-Parasiten zu erhalten, ist der gesamte Lebenszyklus des Parasiten sowohl in der Wirbeltierwirt (hier Maus) und der Mücke zu erhalten. So ist der Zugang zu einem Insektarium für Parasiten Wartung, um natürlichen Übertragung durch Biss führen unvermeidlich.
Unsere hier beschriebenen Protokoll wurde entwickelt, um zu untersuchen, wie Plasmodium Sporozoiten Koinfektion mit Auswirkungen auf die chronische Tuberkulose ein. Um dies zu tun, werden die Mäuse infiziert Aerosol mit M. Tuberkulose und 40 Tage später, als M. Tuberkulose-Infektion der chronischen Phase erreicht hat, Mäuse, um Malaria-Infektions Mücken ausgesetzt. Das Ergebnis der beiden Malaria und Tuberkulose in den coinfected Tiere können durch die Überwachung des Blut Parasitämie und bakterielle Belastung im Gewebe, jeweils gefolgt werden. In unserem Protokoll, werden wir im Detail, wie Mäuse mit beiden Erregern infizieren, über ihre natürlichen Infektionsweg und wie man erfolgreiche Übertragung von Krankheitserregern bestätigen zu beschreiben. In unseren Händen, ist die allgemein erreicht Infektionsrate für beide experimentellen Infektionen 100%. Diese Protokolle können angewendet werden, um beide Infektionen getrennt oder, wie wir, zu modellieren und zu studieren Koinfektion zwischen zwei der schwierigsten menschlichen Infektionskrankheiten zu studieren. Dieses Modell ist auch auf andere Mycobacterium und Nagetier Plasmodium-Arten über die in diesem Protokoll beschriebenen.
Protokoll
Sicherheitsmaßnahmen und Ethikerklärung
Die vorgestellten Studien hier Arbeit einzubeziehen mit dem menschlichen Erreger Mtb und der Nagetier-Malaria-Parasiten Plasmodium berghei (P. berghei). Experimente mit Mtb (Stamm H37Rv) und P. berghei müssen unter den entsprechenden Bedingungen der biologischen Sicherheit durchgeführt werden. Biosicherheitsstufe (BSL) 2 Labors sind für Nager Malaria-Parasiten wie P. erforderlich berghei und BSL 3 für Mtb und damit für alle Koinfektion Studien hierin beschrieben. HINWEIS: Mäuse, die mit Mtb nicht infiziert, die Infektion auf andere Mäuse in unmittelbarer Nähe zu verbreiten (eigene Beobachtung). Verteilt auf den Experimentator kann daher nicht ausgeschlossen werden, aber entsprechende Schutzkleidung muss in der BSL 3 Labor jederzeit getragen werden. Nach unseren Regeln, Experimentatoren tragen chirurgische Peelings, Haarnetze, Einweg-Atemschutzmasken und zwei Paar Handschuhe, von denen der äußere verworfen wird jederzeit eineeff aus dem Schrank herausgezogen. Neue werden auf, bevor sie in den Schrank wieder setzen. Zwei Container, eines mit 2% Buraton (HINWEIS: genehmigt, um andere Mtb inaktivieren Desinfektionsmittel können in der zugelassenen Konzentration verwendet werden) für flüssige und infektiösen Abfällen und eine für Oberflächenkontamination, sind vor dem Experiment vorbereitet und in den Schrank gelegt. Darüber hinaus werden Kunststoffbeutel für feste Abfälle noninfectious verwendet werden. Nach deutschen Regeln, die alle Arbeiten, die den Umgang und die Verarbeitung von Mtb Kulturen oder Gewebe von infizierten Mäusen abgeleitet Mtb muss in einem Klasse-2-Biosicherheitswerkbank in einem BSL3 Labor durchgeführt werden. Beim Umgang mit Mycobakterien, müssen Maßnahmen ergriffen werden, um die Erzeugung von Aerosolen zu vermeiden.
Weibliche C57BL / 6 Mäuse (Charles River) zwischen 6-8 Wochen gealtert wurden für alle Experimente verwendet Koinfektion und unter bestimmten Bedingungen in Barriere BSL 3 Anlagen gehalten. Tierpflege und Experimente waren pein Übereinstimmung mit den Protokollen von der Ethikkommission für Tierversuche des Ministeriums für Landwirtschaft, Umwelt und ländliche Räume des Landes Schleswig-Holstein genehmigt rformed
Zur Gewinnung von Malaria-Mücke Stufen wurden NMRI-Mäuse von Charles River Laboratory, Sulzfeld, Deutschland gekauft und unter spezifischen Pathogen-freien Bedingungen innerhalb der Universität Heidelberg Tiereinrichtung (IBF) gehalten. Alle Tierversuche wurden entsprechend den europäischen Vorschriften durchgeführt und von den staatlichen Behörden des Landes Baden-Württemberg (Regierungspräsidium Karlsruhe) zugelassen.
1. Aerosol-Infektion von Mäusen mit Mtb mit einem Glas-Col Aerosolkammer
Der beste Weg, um die Aerosol-Infektion von Versuchstieren mit Mtb Standardisierung ist es, Mykobakterien aus gefrorenen Beständen mit bekannten CFU-Titer zu verwenden. Um Stammkulturen vorzubereiten, Kultur Mtb in Middlebrook 7H9-Bouillon mit OADC (Oleic ergänztSäure, Albumin, Dextrose, Catalase) Anreicherungsmedium und 0,05% Tween 80, eine Kohlenstoffquelle für Mykobakterien und messen, um bakterielle Verklumpung in der gleichen Zeit zu vermeiden. Kulturen sollte eine OD ≤ 1 haben zum Zeitpunkt der Ernte. Bei höheren OD, bakterielle Verklumpung Steigerungen und Rentabilität sinkt. Shop 1 ml Aliquots bei -80 ° C Bestimmung der Zahl der lebensfähigen koloniebildenden Einheiten (CFU) in gefrorenem Bestände durch Plattieren eine Reihe von 10-fachen Verdünnungen von drei unabhängigen Fläschchen auf 7H11-Agarplatten mit 0,5% Glycerin, 1 g / l Asparagin supplementiert, und OADC und aufzuzählen Kolonien nach 4 Wochen Inkubation bei 37 ° C. Führen Aerosol-Infektion, wie nachstehend beschrieben.
- Tauwetter Mtb Aktien von bekannten CFU-Titer und vorsichtig mischen die Suspension fünf Mal, um Bakterienklumpen zu zerstreuen mit einer 1-ml-Spritze mit einer 27 G-Nadel ausgestattet. Vermeiden Sie die Produktion von Aerosolen.
- Abhängig von der gewünschten Infektionsdosis, übertragen Sie die erforderliche Volumen des Aktien Mykobakterien inEin 50 ml-Röhrchen mit sterilem PBS. Das Endvolumen beträgt 6 ml. Hinweis: Durch Variieren der Anzahl der Mikroorganismen in dieser Suspension der Anteil der tragenden Bakterien Aerosoltröpfchen variiert. Wir streben in der Regel einer Aufnahme von 100 lebensfähigen Bazillen pro Lunge (Niedrigdosis-Infektion). Nach unserer Erfahrung erfordert dies etwa 1-2 x 10 6 MTB / ml in einem Gesamtvolumen von 6 ml davon 5,5 ml vernebelt werden (siehe unten). Es wird empfohlen, eine Reihe von Versuchsaerosol Herausforderungen mit verschiedenen Konzentrationen von Bakterien zu tun, um die idealen Bedingungen für Ihre Infektion zu finden. Während Hochdosis-Infektionen mit bis zu 5.000 Mykobakterien kann getan werden, um die Geschwindigkeit des Infektionsprozesses, so wenig wie 5 Bakterien verwendet, um Mäuse zu infizieren erfolgreich durch Aerosol werden. Die Infektionsrate ist in der Regel 100%.
- Entfernen einer ausreichenden Menge (über Endvolumen erforderlich hergestellt) für die Beschichtung um das Inokulum Titer zu bestimmen, haben wir normalerweise entfernen 500 ul technischer Triplikaten plattieren.
- Zeigen Tiere inein Fächergitterkorb (eine Maus pro Korb) innerhalb der kreisförmigen Aerosolkammer und schließen Sie den Deckel der Aerosolkammer. HINWEIS: Andere Modelle sind mit einem tortenförmigen Korb von fünf Einzelfächer, die jeweils 20 Mäusen zusammenzubringen ausgestattet.
- Befestigen Sie den Venturi-Vernebler Einheit zu den drei Edelstahl-Kugelgelenke.
- Entfernen der mykobakteriellen Suspension aus dem 50-ml-Röhrchen mit einer 10-ml-Spritze mit einer 18 G Nadel stumpf angebracht und tragen die Spritze in der Aerosolkammer in eine geschlossene Transportbox.
- Entfernen Sie den Schraubverschluss des Zerstäubers Einheit und sorgfältig spritzen die Mykobakterien Suspension in den Vernebler. Vermeiden Sie die Entstehung von Aerosolen. Entsorgen Sie die Spritze in einen Behälter für scharfe Gegenstände, die 2% Buraton. Verschließen Sie den Vernebler mit dem Schraubverschluss.
- Schalten Sie den Hauptnetzschalter und der UV-Lampe. Die Anzeige auf der Steuertafel zeigt "Glas-Col Apparat Co".
- Drehen Sie den Programmschalter auf. Das Display wirdShow "ist der Zerstäuber bereit?" "Ist der Korb eingelegt?" Drücken Sie die Eingabetaste, wenn Sie fertig. " Drücken Sie die Eingabetaste.
- Das Display zeigt "Enter rmen Zeit 900", das bedeutet, die Vorheizzeit für die Verbrennungsanlage (die die Abluft dekontaminiert) beträgt 900 Sekunden. Drücken Sie die Eingabetaste.
- Das Display zeigt "Enter Vernebelungszeit 1800", das heißt, die Zeit, Vernebeln 1.800 Sek. als Standard eingestellt ist. Um die Vernebelungszeit zu verlängern, geben Sie "2400", und drücken Sie die Eingabetaste. HINWEIS: Während der Vernebelungszyklus, Druckluft zerstäubt die Aufhängung, wodurch kleine Aerosoltröpfchen Mykobakterien enthalten. Mit dem Hauptluftstrom, werden diese Tröpfchen (etwa 2-5 um Grße) in die Aerosolkammer durchgeführt.
- Das Display zeigt "Enter CD-Zeit 1800", das bedeutet, dass der Zerfall Zyklus dauert 1,800 Sekunden. Auf "2400", und drücken Sie die Eingabetaste. HINWEIS: Während dieses Zyklus, Die Wolke, die gebaut wurde up in der Aerosolkammer während der Vernebelungszyklus kann zerfallen. Die kleinen Tröpfchen werden durch die Versuchstiere eingeatmet.
- Das Display zeigt "Enter Dezember Zeit 900", das bedeutet, dass das UV-Licht Dekontaminationszyklus 900 Sekunden dauern. Drücken Sie die Eingabetaste. Die Maschine startet Radfahren durch Vorwärmen, Vernebeln, Cloud-Zerfall und UV-Dekontamination.
ACHTUNG: Die Vakuum-Durchflussmesser sollte anzeigen, 60 Kubikmeter / h (zu überprüfen, wenn Vorheizzyklus beginnt; anzupassen Unterdrucksteuerventil, wenn nötig) und die Druckluft-Durchflussmesser 10 Kubikmeter / h (zu überprüfen, wenn Vernebelungszyklus beginnt, entsprechend anzupassen Luftsteuerventil ). - Wenn der Zyklus abgeschlossen ist, wird das Tastenfeld zeigen "Process Complete - entfernen Specimen". Schalten Sie das Programm, UV-und Hauptstromschalter.
- Prüfen Sie, ob die Mykobakterien Suspension wurde komplett vernebelt worden, und wenn nicht, notieren Sie die verbleibende Volumen durch vorsichtiges Entfernen der Suspension mit einer entsprechenden Spritze mit eingebauteine 18 G stumpfen Nadel. Das Restvolumen ist nicht mehr als 1 ml betragen.
- Nehmen Sie den Zerstäuber aus den Fugen und legen Sie sie in einer Pfanne mit 2% Buraton für mindestens 2 Stunden, ist in der Regel Desinfektions O / N. getan Anschließend übertragen Sie den Zerstäuber zu einem frischen Pfanne und gründlich mit Wasser abspülen. Lassen Vernebler an der Luft trocknen.
- Öffnen Sie die Aerosolkammer und Rück Tiere in ihre Käfige. Tasche die Körbe in Autoklaven Taschen und Autoklaven. Wischen Sie die Oberflächen der Innenseite der Aerosolkammer mit 2% Buraton. HINWEIS: Aus Sicherheitsgründen sollte ein Gebläsefiltergerät während dieser Prozedur getragen werden.
- Mit den verbleibenden 500 ul der Mykobakterien-Suspension (siehe Schritt 1.3) Platte 10-fach Verdünnungen eines technischen dreifacher Ausfertigung (3 x 100 ul) auf 7H11-Agar-Platten.
2. Stellen Sie sicher, Aufnahme von Wunsch CFU in Lunge
Einen Tag nach der Aerosol-Infektion von Versuchstieren festzustellen, die bakterielle loAnzeige in den Lungen der Kontrolltiere bezeichnet, um die Aufnahme des gewünschten CFU zu überprüfen. HINWEIS: Wir bezeichnen in der Regel eine zusätzliche Gruppe von 3-5 Mäusen für Tag 1 CFU Bestimmung.
Um den Verlauf der Mtb-Infektion im Laufe der Zeit zu überwachen, kann der Mykobakterien Gewebebelastung durch Plattierung serielle Verdünnungen der ganzen Organhomogenaten für CFU Bestimmung untersucht werden. Die Lunge ist der primäre Ort für Krankheitsmanifestation bei Tuberkulose jedoch Milz, der Leber und der Lymphknoten in der Regel entsprechend ausgewertet. Die Verdünnungen plattiert werden, hängt von der erwarteten mykobakteriellen Belastung in den Organen, die von der anfänglichen Inokulum (niedrige Dosis gegen hohe Dosis), die Erhöhung der Gewebe sowie auf das Organ und dem Zeitpunkt zu erhalten, um verschiedene bakterielle Belastungen hängen analysiert werden. Bei niedriger Dosierung Infektionen, die bakterielle Belastung von Mtb H37Rv in der Lunge der Regel erreicht ein Plateau zwischen Tag 25-30.
- Zeigen eingeschläfert Tiere (Euthanasie: CO 2-Erstickung oderTerminal Anästhesie) auf saugfähigem Papier auf einem Seziertisch Bord in einer Klasse II Biosicherheitswerkbank und desinfizieren Mäuse mit 70% Ethanol. HINWEIS: 70% Alkohol ist nur für Oberflächenkontamination und wird nicht Mtb töten.
- Machen Sie einen kleinen Schnitt in der Mitte des Bauches und Einfahren der Maus Haut über dem Kopf.
- Öffnen Sie den Bauch und den Brustkorb mit chirurgischer Schere und entfernen Sie die Brustwand, so dass die Lunge zugänglich sind.
- Entfernen Sie die Lungen und übertragen in einen 15-ml-Tube mit Homogenisationspuffer (steriles Wasser / 1% v / v Tween 80/1% w / v Albumin).
- Verwendung der Kolben einer 5 ml Spritze Stamm Lunge durch 100-um-Sieben in eine kleine Petrischale.
- Flush Sieben mehrmals mit einer 1 ml-Pipette mit einer Barriere ausgestattet Spitze und verteilen Sie die Lungenhomogenat unter 8-Agar-Platten (ca. 250 ul / Platte;. Sicherzustellen, dass sie eine gut getrocknete Oberfläche haben).
- Sorgfältig mit Einweg Treuer, die in 2% verworfen Platte der ProbenBuraton.
- Lassen Agar-Platten im Schrank, um zu trocknen. Verschließen Sie jede einzelne Platte mit Parafilm, in Alufolie wickeln und Inkubation aufrecht bei 37 ° C für mindestens 4 Wochen.
3. Bau von Escape-Beweis Moskitokäfige
Nager Plasmodium-Stämme sind nicht schädlich für den Menschen. Da jedoch Mtb-infizierten Mäusen sind die Empfänger des Parasiten und die Arbeit wird unter BSL 3 Bedingungen erfolgen, sind Maßnahmen erforderlich, um die Mücken aus ihren Käfigen entkommen zu verhindern. Abhängig von der geplanten Infektion Regime, autoklavierbar und wiederverwendbare Metallrahmen Käfigen oder selbstgemachte Einwegkäfige verwendet werden. Letztere sind zu empfehlen, wenn von Biss Infektion von Versuchstieren erforderlich ist, um durch eine definierte Anzahl von Mücken pro Maus durchgeführt werden. Wenn selbstgemachte Käfige benötigt werden, vorzubereiten Käfige genauen Spezifikationen wie die Gesundheit der Mücken und die Sicherheit des Labor hängt von ihrer sound Bau (Abbildung 2).
- Nehmen Sie einen Karton, wie eine halbe Portion Eis Karton oder Papier, Kaffeetasse (Abbildung 2).
- Schneiden Sie eine kleine Öffnung in die Seite des Kartons und decken mit einer Doppelschicht aus Latex mit einem Schlitz in jedem Stück geschnitten, um einen sicheren Eingang für die Moskitos zu schaffen. HINWEIS: Die Öffnung hat eine Gesamtgröße von 2 cm x 2 cm, ist der Schlauch (Saugvorrichtung), die wir nutzen, um in zu bringen und / oder Take-out Mücken eine modifizierte 15 ml Falcon-Röhrchen mit einer Vakuumpumpe angeschlossen und dient somit als eine Saugvorrichtung mit einem Durchmesser von 1,5 cm.
- Kleben Sie ein Stück Filterpapier auf der Innenseite Boden des Kartons zu tanken tropft.
- Verschließen Sie Eisbecher mit Netz (Doppelschicht aus Nylon-Mesh-Größe 1 mm x 1 mm) und zu beheben, um den Karton mit Klebeband und Gummiband.
- Für Infektionsversuche, bei denen definierte Anzahl von Mücken pro Maus erforderlich sind, bereiten Käfige mit 10-15 infizierten Mücken, enthält jede von denen idealerweise einen avschnittlich 10.000 Wildtyp-Speicheldrüse P. berghei Sporozoiten.
- Idealerweise verhungern Mücken für 24 Stunden vor der Durchführung der Blutmahlzeit.
4. Malaria-Infektion von Mäusen durch Mückenstich
Das Nagetier Malaria-Parasiten hier verwendet, ist P. berghei jedoch andere Nager Plasmodium-Stamm von Interesse verwendet werden. Um Infektions Mücken erhalten für Sporozoiten-Übertragung der gesamte Lebenszyklus des Parasiten ist in beiden Wirbeltierwirt (Maus) und der Mücke erhalten. Parasite Wartung wird in einem Insektarium durchgeführt. Für natürliche Übertragungsversuche, sollte die minimale Anzahl von Sporozoiten pro Speicheldrüse nicht weniger als 10.000 sein. Für detaillierte Protokolle über Parasiten Wartung verweisen wir auf Methoden in der Malaria-Forschung von Moll et al. 2013.
- Betäuben naiven Mäusen oder Tieren 40 Tage preinfected mit MTB mit Ketamin (100 mg / kg)und Xylazin (7 mg / kg)-Lösung durch intraperitoneale Injektion (200 &mgr; l / Maus). HINWEIS: Die Zeit zwischen Mtb und Plasmodium-Infektion kann in Abhängigkeit von der zugrunde liegenden Fragestellung angepasst werden. Ebenso kann die Reihenfolge der Erreger Herausforderungen umgekehrt werden kann, dh Mäuse, um Infektionsmückenstich vor Mtb-Infektion ausgesetzt werden.
- Zeigen betäubt Mäuse auf die Verrechnung der Moskitokäfige (eine Maus pro Käfig für Moskito definiert Moskito Maus-Verhältnis) und damit die Mücken durch die Membran für 10-15 min zu ernähren. HINWEIS: Die Anwesenheit von Blut in den Moskito Mut bedeutet, Fütterung und somit Sporozoiten-Übertragung.
- Übertragen Mäuse wieder in ihre Käfige und überwachen ständig, bis sie aus der Narkose aufwachen. HINWEIS: Platz Mäuse auf Papiertuch und nicht auf Einstreu (Erstickungsgefahr) und warm halten (Ort eng zusammen und decken Körper mit Papiertuch).
- Töte die Moskitos durch Besprühen mit 70% Ethanol oder andere Desinfektionsmittel durch die nettoten des Käfigs. Autoklav Käfige und verwerfen, wenn Einweg diejenigen eingesetzt wurden.
5. Überwachung Parasitämie
- Puncture Schwanzvenen ganz am Ende mit einer Nadel und sammeln ein Tropfen Blut an jedem Ende der Rutsche.
- Verwenden Sie eine andere Folie, um einen Tropfen Blut mehr als die Hälfte der Länge des Objektträgers zu ziehen. Flip über dem Spreizer, um die andere Kante zum zweiten Abstrich zu verwenden. Die Objektträger an der Luft trocknen.
- Giemsa-Färbung
- Legen Sie Folien in der Folienhalter und fixieren die Blutausstriche durch kurzes Eintauchen in absolutem Methanol. HINWEIS: Da die Verwendung von Glaswaren sollten mindestens in der BSL 3 gehalten wir Polypropylen Küvetten für alle Lösungen werden.
- Tauchen Sie die Abstriche in Giemsa (1:10 in VE-Wasser). Nach 10 Minuten tauchen die Folien in die und aus der Färbung Küvetten mit VE-Wasser ein paar Mal gefüllt zu spülen die überschüssige Fleck.
- Schließlich Luft trocknen Folien in einer senkrechten Position.
- ALTERNATIVE FLECK: Wright & #180; s Fleck
- Auflösen Wright-Färbung bei einer Konzentration von 1 mg / ml in Methanol.
- Filter durch Faltenfilter vor der Verwendung.
- Tauchen Sie die Blutausstriche in Farblösung und Inkubation für 4 min (HINWEIS: Methanol-Fixierung von Abstrichen ist nicht notwendig, da die Farblösung Methanol basiert).
- Durch Spülen Dias waschen in VE-Wasser, wie oben beschrieben und lassen gleitet an der Luft trocknen.
- Sobald Giemsa / Wright-Färbung abgeschlossen ist, übertragen Sie leicht alle in eine Buraton haltigen Verfügung Topf verwendeten Reagenzien.
- Blutausstrich-Analyse
- Analysieren gefärbten Blutausstrichen durch Lichtmikroskopie bei einer 100-fachen Vergrößerung mit Ölimmersion.
- Graf nicht infizierten und infizierten Erythrozyten in einem Bereich des Blutabstrich, wo Erythrozyten werden in einer Monoschicht angeordnet.
- Um eine gut definierte Parasitämie zu erreichen, zählen mindestens 10 verschiedene Sichtfelder Anzeige eines Erythrozyten-Monoschicht.
- Calculaß die relative Parasitämie (in%) durch Dividieren der Anzahl der parasitierten Erythrozyten durch die Anzahl der Erythrozyten und mit 100 multipliziert.
Ergebnisse
Infektion von Mäusen mit MTB und P. berghei über den natürlichen Weg, dh Aerosol-und Mückenstich bzw. Ergebnisse in konsistente und reproduzierbare Infektion aller Tiere (Tabelle 1) ein. Wir können erfolgreiche Infektion und den Verlauf der beiden Malaria und Tuberkulose durch die Bestimmung der anfänglichen Auftretens (Präpatenz) und Anzahl der Parasiten im Blut (P. berghei Parasitämie) und die Last der Mtb in verschiedenen Organen bzw. zu überwachen. Ein Beispiel für die erfolgreiche Übertragung von Malaria-Parasiten infektiösen Mückenstich ist in Tabelle 1 und Fig. 3 gezeigt. Fütterung von 10 Sporozoiten-infizierten Mücken auf jeder Maus führte zu einer 100%-Infektionsrate als durch die Anwesenheit von Blutstadium-Parasiten 4-5 Tage später (Tabelle 1 und Abbildung 3A) bestätigt. Wichtig ist, finden wir ähnliche Parasitenzahlen im Blut von einzelnen Mäusen des gleichen experimentellen group, was darauf hinweist, dass die Sporozoiten-Übertragung durch Mückenstich führt zu einer konsistenten und reproduzierbaren Infektion. Durch den Vergleich der Präpatenz in naiven Kontrollmäusen mit der in Mtb-Koinfektion Tieren, können wir sehen, dass Präpatenz leicht bei Mäusen, die mit Mtb (Tabelle 1, Abbildung 3B) preinfected worden war verzögert ein. Wie wir bereits berichtet 1, können wir den Einfluss von Mtb Koinfektion auf den Verlauf der Malaria durch tägliche Überwachung Parasitämie im Giemsa-gefärbten Blutausstrichen bestimmen, wie in Fig. 3B gezeigt.
Infektion von Mäusen mit Mtb durch die Verwendung eines Inhalationssystems führt erfolgreiche Abscheidung von Bakterien in den Lungen, die mit relativ geringen Schwankungen zwischen den einzelnen Mäusen (Fig. 4A). Wir können Mykobakterien Lasten in die Lunge und andere Organe von Interesse im Laufe der Zeit durch CFU Bestimmung zu folgen. Ein Beispiel für die mycobakterielle Last in LungenMtb-infizierten C57BL / 6 Mäusen in Abwesenheit oder Anwesenheit von P. berghei wird in 4B gezeigt.
Tabelle 1. Präpatenz nach Sporozoiten-Übertragung durch Mückenstich. Alle Mäuse nach Natur Übertragung von P. entwickelten Blut-Stufen-Infektionen berghei Sporozoiten durch Mückenstich. 1 PLoS ONE, 7 (10), e48110 mit Genehmigung angepasst.
| Experimentelle Mausgruppe (C57BL / 6) | Fordern Sie von 10 Infektionsmückenstiche | Anzahl der Blutstufigen positiven Tiere / Anzahl der Tiere pro Gruppe | Mittlere Präpatenz [d] |
| naiv | P. berghei | 7/7 | 4,4 |
| Mtb infiziert | P. berghei | 7/7 | 5,5 d> |
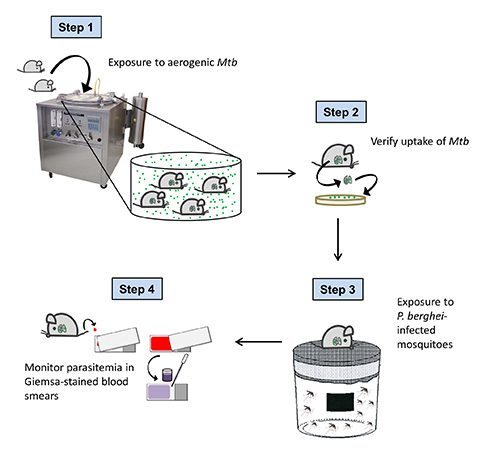
Fig. 1 ist. Insgesamt Schema der Versuchsdurchführung. C57BL / 6 Mäuse sind Mtb-haltigen Aerosoltröpfchen in einer Glas-Col Aerosolkammer ausgesetzt. Einen Tag nach Infektion des wird die Aufnahme von Mtb von CFU-Analyse der Lunge nachgewiesen. 40 Tage nach der MTB Challenge (bei Tuberkulose chronisch geworden in infizierten Mäuse) werden die Tiere ausgesetzt P. berghei infizierten Mücken. Um zu bestätigen, erfolgreiche Sporozoiten-Übertragung und den Kurs der Plasmodium-Infektion folgen, wird Parasitämie täglich in Giemsa-gefärbten Blutausstrichen ab 3 Tage nach dem Mückenstich überwacht.
/ Files/ftp_upload/50829/50829fig2highres.jpg "src =" / files/ftp_upload/50829/50829fig2.jpg "/>
2. Skizze einer Mücke Käfig. Infektions Mücken sind in einem Karton, wie eine halbe Portion Eis Karton enthalten sind. Eine kleine Öffnung in der Seite der Schachtel geschnitten und mit einer Doppelschicht aus Latex mit einem Schlitz in jedem Stück geschnitten, um einen sicheren Eingang für die Moskitos schaffen bedeckt. Ein Stück Filterpapier ist auf der Innenseite Boden des Kartons zu tanken tropft aufgezeichnet. Eiscremebecher mit Geflecht (Nylon-Netz), das an dem Karton durch ein Band und elastisches Band befestigt wird geschlossen.

3. Blut Parasitämie. A) Beispiel für ein Wright `s Bunt Blutausstrich zeigt parasitierten Erythrozyten (Maßstabsbalken, 20 & #181;. M) B) Parasitämie in Mäuseblut wurde durch die Analyse von Tages Giemsa-gefärbten Blutausstrichen überwacht. Koinfiziert Mäuse eine verringerte Parasitämie im Vergleich zu Plasmodium einzigen infizierten Mäusen (n = 10); Ergebnisse sind dargestellt als Mittelwerte ± SD, *** p <0,001. 1 PLoS ONE, 7 (10), e48110 Nachdruck mit freundlicher Genehmigung.
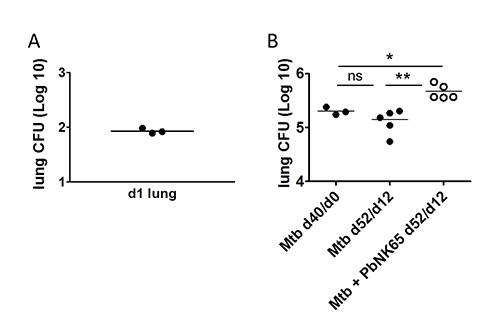
4. Nachweis von Mtb in der Lunge. C57BL / 6 Mäuse wurden mit 100 CFU Aerosol MTB herausgefordert bzw. 40 Tage später Koinfektion mit P. berghei durch Mückenstich. A) Einen Tag nach der Aerosol-Infektion die Aufnahme des gewünschten Anzahl von Mtb wurde durch Ausplattieren ganze Lungenhomogenaten für CFU Bestimmung verifiziert. B) Bakterienl Belastungen bei der Koinfektion wurden Lungen Lysaten von 3 Mäusen über KBE-Analyse (Mtb d40/d0) bestimmt. 12 Tage nach Koinfektion wurden Lungen Lysate für CFU-Analyse, um die Auswirkungen von Plasmodium-Koinfektion auf Mtb Steuer bestimmen plattiert. Beachten Sie, dass Mtb Zahlen in der Lunge erhöhte sich im Co-Infektion mit P. berghei NK65. X-Achsenbeschriftung: Zeit nach Mtb -infection/time nach Koinfektion. 1 PLoS ONE, 7 (10), e48110 mit Genehmigung angepasst.
Diskussion
Wir beschrieben, wie Mäuse können produktiv mit Mtb und P. infiziert werden berghei über ihre natürlichen Infektionswege. Wir gelten bestehenden Infektion Protokolle, experimentelle Tuberkulose oder Malaria 13 12 studieren und vor kurzem verabschiedete sie Koinfektion zwischen Mtb und Plasmodium im Mausmodell ein zu studieren.
Die wichtigsten Schritte für eine erfolgreiche Infektion ist die Übertragung von Krankheitserregern beiden an den gewünschten Zahlen. Mykobakterielle Aktien sollte nicht älter als 2 Jahre sein, weil sie im Laufe der Zeit verlieren die Lebensfähigkeit und die ursprünglich ermittelten Titer der Aktien wird wahrscheinlich nicht mehr genau. Als Ergebnis würde Infektion Dosen viel niedriger als erwartet. Daher sollte CFU Titer von Stammkulturen alle paar Monate bestimmt werden. Ebenso wichtig ist die standardisierte Anbau und die Erzeugung von Mtb-Aktien in den ersten Platz. Kulturbedingungen, wie z. B.mittel, Nahrungsergänzungsmittel, Zeit und Volumen sollte, um in der Lage, Daten aus Experimenten mit verschiedenen Aktien von Mtb vergleichen zu können standardisiert werden. Mykobakterien sind in der Regel während der Kultur verklumpen, daher ist es wichtig, den Kulturbedingungen halten standardisiert Ernte Bakterien in der gleichen Wachstumsphase und resuspendieren häufig während Aliquotieren. Sonst kann es eine große Variation in CFU-Titer und Infektions Ergebnis.
Die Erzeugung des homogen infizierten Moskito Chargen ist ein weiterer kritischer Schritt. Da verschiedene Mücken auf jeder einzelnen Maus zuzuführen, ist es wichtig, daß alle für eine Infektionsexperiment verwendet Moskitos aus derselben Charge stammen, und dass nur diejenigen Chargen, in denen mehr als 90% der infizierten Moskitos verwendet werden.
Das aktuelle Modell kann verwendet werden, um Immunreaktionen und Immunmodulation in einem Wirt Koinfektion durch Vergleich mit den Immunreaktionen in einzelnen infizierten Wirten zu sezieren werden. Wir können va geltenschiedenen etablierten Methoden wie Histologie, Immunhistochemie, Durchflusszytometrie-Analyse von Immunzellpopulationen oder PCR und ELISA zur Zytokin-und Chemokin-Erkennung, um die Gewebe oder Körperflüssigkeiten von Interesse. Es sollte beachtet werden, dass solche Mausmodelle weisen bestimmte Einschränkungen auf. Während die Mehrheit der Menschen mit Mtb infiziert entwickeln eine latente Infektion ohne Anzeichen klinischer Symptome entwickeln Mäuse eine chronische Erkrankung mit progressiven Lungenpathologie. Dennoch sind C57BL / 6 Mäusen relativ resistent gegen Mtb-Infektion und entwickeln sich nicht wie in der klassischen Granulome menschliche Tuberkulose-Patienten beobachtet. Als Ergebnis immunpathologische Reaktionen in der Maus nicht spiegeln weder latent noch aktive menschliche Tuberkulose-Krankheit entsprechend. Trotz der Diskrepanz zwischen latenten und chronischen Krankheiten bei Mensch und Maus haben Mäuse ausgiebig zu identifizieren und zu untersuchen Wirtsfaktoren, die Mtb-Infektion zu kontrollieren und sind wertvolle und unverzichtbare Werkzeuge zu untersuchen,Immunantwort bei Infektionskrankheiten. Wichtig ist, dass die Anfälligkeit für Mtb-Infektion variiert beträchtlich zwischen den üblicherweise verwendeten Inzuchtmausstämmen und anfälliger Stämme wie DBA oder C3H in Co-und Single-Infektionsstudien enthalten sein. Darüber hinaus, abgesehen von den hierin beschriebenen Erregerspezies, irgendwelche anderen Mycobacterium-Spezies von Interesse (zB klinische Isolate) verwendet werden. Ebenso, während keine einzige Malaria-Modell repliziert alle Aspekte der menschlichen Krankheit verschiedene Mausmodelle nicht ähneln die verschiedenen Aspekte der natürlich erworbenen menschlichen Malaria-Infektion. Zum Beispiel P. berghei ANKA und P. yoelii YM/17XL sind weitgehend untersucht Modelle der menschlichen (P. falciparum-induziert) schwerer Malaria, mit P. berghei ANKA ist als hervorragendes Modell für menschliche Gehirn Malari s 14,15 angesehen. P. berghei NK65 ist ein hervorragendes Modell für hyperparasitaemia und akuten Malaria-Anämie, und hat vor kurzemals ein experimentelles Modell für die Malaria-assoziierten akutem Atemnotsyndrom (ARDS MA-16) beschrieben. Mit dem beschriebenen Modell-Koinfektion, die wir vor kurzem zeigen konnte, dass die gleichzeitige P. berghei NK65 Infektion verschlimmert chronischen Tuberkulose ein.
Neben der Verwendung von verschiedenen Nagetieren Malaria-Parasiten, kann die Reihenfolge und der Zeitpunkt der Infektion Ereignisse in Abhängigkeit von der zugrunde liegenden Fragestellung angepasst werden. In dem Gebiet, kann die gleichzeitige Plasmodium-Infektionen bei der MTB-Infektion vorliegt oder nachträglich erworben sein. In beiden Szenarien können die Immunantwort auf Mtb und Plasmodium unterschiedlich betroffen sein. Daher können Mäuse mit Plasmodium-Sporozoiten entweder vor oder nach Mtb-Infektion infiziert werden. Darüber hinaus können Mäuse zu verschiedenen Zeiten herausgefordert werden verfassen Mtb-Infektion, um die Auswirkungen des Plasmodium-induzierten Immunantwort auf akute gegen chronische bewertenTuberkulose. Wichtig ist, bei der Auswahl eines Malaria-Parasiten für die Untersuchung Malaria-Tuberkulose-Koinfektion, sollte man sich bewusst sein, dass einige Nager Plasmodium-Stämme verursachen akute Krankheit in bestimmten Mausstämmen und erliegen Infektion innerhalb weniger Tage oder Wochen, während Mtb verursacht chronische und lang anhaltende Infektionen bei immunkompetenten Mäusen. Daher ist das Timing der Koinfektion, um eine vorzeitige Tod der Versuchstiere vermieden entscheidend.
Die Modulation der Wirtsimmunität durch gleichzeitige Infektion mit mehreren Erregerspezies bleibt kaum verstanden. Unsere experimentellen Koinfektion Modell bietet ein leistungsstarkes Werkzeug, um Mycobacterium untersuchen - Plasmodium Interaktion mit dem Immunsystem eines Host-Koinfektion und wird zu unserem Verständnis, wie Koinfektionen können Pathogenese, Krankheitsverlauf, Impfungen, Immundiagnostik und Therapie beeinflussen beitragen.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren bedanken sich bei Miriam Ester für Mückenbrut danken. Diese Arbeit wurde durch in-house Finanzierung aus dem Forschungszentrum Borstel unterstützt und trat Förderung durch die Leibniz-Zentrum Infektion.
Materialien
| Name | Company | Catalog Number | Comments |
| Buraton | Schülke | active ingredients: aldehyds (formaldehyde, glutaraldehyde, oxalaldehyde, ethyl hexanal) | |
| Middlebrook 7H9 | Sigma | M0178 | For Mtb broth cultures |
| Middlebrook 7H11 | BD Biosciences | 283810 | Agar medium for Mtb culture |
| Middlebrook OADC enrichment medium | BD Biosciences | 212240 | Add to 7H9 and 7H11 for Mtb culture |
| Staining Dish | Science Services | E62542-12 | |
| 24-slide Holder w/Handle | Science Services | E62543-06 | |
| Giemsas Azur-Eosin-Methylene blue solution | Merck Millipore | 109204 | |
| Wright´s stain | Sigma | W0625 | |
| Inhalation Exposure System | Glas-Col | ||
| Nebulizer-Venturi | Glas-Col | ||
| Ice cream cups | Häagen-Dazs | Used as mosquito cages | |
| Metal-frame mosquito cages | BioQuip Products | 1450A |
Referenzen
- Mueller, A. -. K., et al. Natural Transmission of Plasmodium berghei Exacerbates Chronic Tuberculosis in an Experimental Co-Infection Model. PLoS ONE. 7, e48110 (2012).
- Korbel, D. S., Schneider, B. E., Schaible, U. E. Innate immunity in tuberculosis: myths and truth. Microbes Infect. 10, 995-1004 (2008).
- Aly, A. S., Vaughan, A. M., Kappe, S. H. Malaria parasite development in the mosquito and infection of the mammalian host. Annu. Rev. Microbiol. 63, 195-221 (2009).
- Cirimotich, C. M., Dong, Y., Garver, L. S., Sim, S., Dimopoulos, G. Mosquito immune defenses against Plasmodium infection. Dev. Compar. Immuno. 34, 387-395 (2010).
- Page, K. R., et al. Mycobacterium-induced potentiation of type 1 immune responses and protection against malaria are host specific. Infect. Immun. 73, 8369-8380 (2005).
- Hawkes, M., et al. Malaria exacerbates experimental mycobacterial infection in vitro and in vivo. Microbes Infect. 12, 864-874 (2010).
- Scott, C. P., Kumar, N., Bishai, W. R., Manabe, Y. C. Short report: modulation of Mycobacterium tuberculosis infection by Plasmodium in the murine model. Am. J. Trop. Med. Hyg. 70, 144-148 (2004).
- Hoffman, S. L., Doolan, D. L. Malaria vaccines-targeting infected hepatocytes. Nat. Med. 6, 1218-1219 (2000).
- Mueller, A. K., et al. Genetically attenuated Plasmodium berghei liver stages persist and elicit sterile protection primarily via CD8 T cells. Am. J. Pathol. 171, 107-115 (2007).
- Mueller, A. K., Labaied, M., Kappe, S. H., Matuschewski, K. Genetically modified Plasmodium parasites as a protective experimental malaria vaccine. Nature. 433, 164-167 (2005).
- Nussenzweig, R. S., Vanderberg, J., Most, H., Orton, C. Protective immunity produced by the injection of x-irradiated sporozoites of plasmodium berghei. Nature. 216, 160-162 (1967).
- Vaughan, J. A., Scheller, L. F., Wirtz, R. A., Azad, A. F. Infectivity of Plasmodium berghei sporozoites delivered by intravenous inoculation versus mosquito bite: implications for sporozoite vaccine trials. Infect. Immun. 67, 4285-4289 (1999).
- Coleman, J., Juhn, J., James, A. A. Dissection of midgut and salivary glands from Ae. aegypti mosquitoes. J. Vis. Exp. , e228 (2007).
- Franke-Fayard, B., et al. A Plasmodium berghei reference line that constitutively expresses GFP at a high level throughout the complete life cycle. Mol. Biochem. Parasitol. 137, 23-33 (2004).
- Lin, J. W., et al. Loss-of-function analyses defines vital and redundant functions of the Plasmodium rhomboid protease family. Mol. Microbiol. 88, 318-338 (2013).
- Bancroft, J. D. G., M, . Theory and Practice of Histological Techniques. , (2007).
- Schneider, B. E., et al. A role for IL-18 in protective immunity against Mycobacterium tuberculosis. Eur. J. Immunol. 40, 396-405 (2010).
- Craig, A. G., et al. The role of animal models for research on severe malaria. PLoS Pathog. 8, e1002401 (2012).
- de Souza, J. B., Hafalla, J. C., Riley, E. M., Couper, K. N. Cerebral malaria: why experimental murine models are required to understand the pathogenesis of disease. Parasitology. 137, 755-772 (2010).
- Van den Steen, P. E., et al. Immunopathology and dexamethasone therapy in a new model for malaria-associated acute respiratory distress syndrome. Am. J. Respir. Crit. Care Med. 181, 957-968 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten