Method Article
Antinuclear Anticuerpo de detección sistemática mediante células Hep-2
En este artículo
Resumen
Ensayos de inmunofluorescencia indirecta (IFI) se han utilizado tradicionalmente para la detección de anticuerpos antinucleares (ANA) en el suero humano. La presencia de estos anticuerpos puede ayudar en el diagnóstico de enfermedades reumáticas autoinmunes sistémicas (ADRS). Este protocolo se muestra cómo realizar efectivamente la técnica de IFI para detectar con precisión estos autoanticuerpos.
Resumen
El Colegio Americano de Reumatología declaración de posición sobre las pruebas de ANA estipula el uso de la IFI como el método estándar de oro para ANA proyección 1. Aunque IIF es una excelente prueba de detección en manos expertas, las dificultades técnicas de procesamiento y lectura IIF diapositivas - tales como el procesamiento de mano de obra intensiva de diapositivas, la lectura manual, la necesidad de experiencia, los técnicos capacitados y el uso de la cámara oscura - hacer que el método IIF difícil de encajar en el flujo de trabajo de, laboratorios automatizados modernos.
El primer y crucial paso para la detección de ANA es de alta calidad de procesamiento de diapositivas cuidado. Este procedimiento es laborioso y requiere una comprensión completa del proceso, así como la atención a los detalles y la experiencia.
Slide lectura se realiza mediante microscopía de fluorescencia en habitaciones oscuras, y se lleva a cabo por técnicos capacitados que están familiarizados con los diversos patrones, en el contexto del ciclo celulary la morfología de la interfase y las células en división. Siempre que IIF es la primera herramienta de líneas para la ADRS, la comprensión de los pasos para realizar correctamente esta técnica es fundamental.
Recientemente, los sistemas de imágenes digitales se han desarrollado para la lectura automatizada de diapositivas IIF. Estos sistemas, como el NOVA Ver automatizada fluorescente Microscopio, están diseñados para agilizar el flujo de trabajo de rutina IIF. NOVA Ver adquiere y almacena de alta resolución las imágenes digitales de los pozos, separando de este modo la adquisición de imágenes de la interpretación; imágenes se ven un interpretados en los monitores de ordenador de alta resolución. Almacena imágenes para futuras referencias y apoyan la interpretación del operador, proporcionando datos de intensidad de luz fluorescentes en las imágenes. También clasifica preliminarmente resultados como positivos o negativos, y proporciona el reconocimiento de patrones para las muestras positivas. En resumen, se elimina la necesidad de cuarto oscuro, y automatiza y agiliza el readi IIFng / flujo de trabajo de interpretación. Lo más importante, aumenta la coherencia entre los lectores y las lecturas. Por otra parte, con el uso de diapositivas con códigos de barras, los errores de transcripción se eliminan, proporcionando trazabilidad de las muestras y la identificación positiva del paciente. Esto se traduce en una mayor integridad de los datos y seguridad del paciente.
El objetivo general de este video es para demostrar el procedimiento IIF, incluyendo el procesamiento de diapositivas, la identificación de patrones comunes IIF, y la introducción de nuevos avances para simplificar y armonizar esta técnica.
Introducción
El término anticuerpos antinucleares (ANA) describe una variedad de autoanticuerpos que reaccionan con constituyentes de los núcleos de células incluyendo ADN, proteínas y ribonucleoproteínas 1, 2. La célula HEp-2, una matriz de proteína nativa con cientos de antígenos, proporciona un sustrato ideal para la detección de ANA 1. La detección de anticuerpos antinucleares en el suero humano es una herramienta de detección importante para enfermedades del tejido conectivo, y IIF es el método de referencia para la prueba ANA 1. Recientemente, IIF en células HEp-2 ha sido sustituido en algunos laboratorios con inmunoensayos específicos de antígenos y métodos múltiplex. Debido a la preocupación por los resultados negativos falsos y la falta de transparencia de los médicos, el Colegio Americano de Reumatología formó un Grupo de Trabajo que concluyó que IIF utilizando células HEp-2 debe ser el "estándar de oro" para la detección de ANA 1.
Debido a la naturaleza subjetiva de la detección de ANA, la calidad de células HEp-2 se encuentra engral de informes precisos y confiado de los resultados. La presencia de un alto número de células mitóticas, la morfología óptima de células, suficiente confluencia, y la expresión de antígenos relevantes son particularmente importantes. IIF reconocimiento de patrones sirve como una herramienta importante para ayudar en el diagnóstico del paciente. Comprender el significado de varios patrones permite a los médicos y personal de laboratorio para llevar a cabo la adecuada prueba de seguimiento para confirmar el diagnóstico. Por ejemplo, el patrón de ANA homogéneo puede ocurrir en la presencia de anticuerpos anti-ADN de doble cadena de la cromatina o, y puede ser asociado con el lupus eritematoso sistémico (LES) 3. Desde el otro lado, recientemente se ha descrito que el llamado patrón denso fino moteado (DFS) que se ve comúnmente en hasta el 12% de las muestras de rutina, sobre todo se ha asociado con anticuerpos anti-DFS70. Estos autoanticuerpos, cuando se encuentran en forma aislada (sin otra ANA específica de la enfermedad) no están asociados con enfermedades reumáticas autoinmunes sistémicas 4-9. De esta manera la prueba confirmatoria de anticuerpos anti-DFS70 puede ayudar a reducir el reflejo de las pruebas innecesarias, ofrecen un considerable ahorro de costes, y calmar la ansiedad del paciente.
Dado que el IIF es la primera metodología de selección de línea para detectar autoanticuerpos, es primordial que el usuario entiende cómo la selección de los reactivos y sustratos de tejidos puede afectar los resultados. Dado que la técnica IIF es inherentemente subjetiva, es importante que los reactivos utilizados proporcionan los resultados más altos de calidad.
Este objetivo de este protocolo de vídeo es familiarizar al usuario con los pasos correctos necesarios para llevar a cabo el método de IFI, los patrones comunes asociados con ANA, e introducir los nuevos avances que pueden agilizar el flujo de trabajo de laboratorio y estandarizar los resultados.
Protocolo
1. Preparación de la muestra y la selección del sustrato
- Extraiga los reactivos del paquete y permitir que cada elemento a la temperatura ambiente. Preparar los reactivos y diluir el suero del paciente de acuerdo con la dirección de inserción. Nota: Las diapositivas NOVA Lite se un código de barras y se puede integrar fácilmente en los sistemas automatizados en conjunto con el Sistema de Información de Laboratorio LIS. Este procedimiento ilustra el procesamiento manual de diapositivas; laboratorios de alto rendimiento, sin embargo, pueden optar por un equipo automático de procesamiento de diapositivas.
2. Adición de controles y muestras
- Dispensar 1 gota de control positivo y 1 gota de control negativo a los pocillos apropiados de diapositivas. Pipeta 20-25 l de suero diluido de paciente a los pocillos restantes. Procesar una diapositiva a la vez.
- Coloque la diapositiva (s) en un recipiente de tinción con una toalla de papel húmeda en la parte inferior. Cubrir el recipiente y incubar el portaobjetos (s) durante 30 min. Nota: Las condiciones de humedad seevitar que el sustrato se seque. El secado de los pozos podría resultar en artefactos de tinción. Durante este período de incubación, los anticuerpos anti-nucleares en el suero del paciente se unirán a los antígenos de las células que se fijan en cada pocillo.
- Después del periodo de incubación, enjuague el suero utilizando un chorro suave de tampón de lavado. Con el fin de evitar daños en el sustrato y evitar cruzado de las muestras entre los pozos, ángulo de la corredera ligeramente para evitar dirigir la corriente directamente sobre los pocillos. Elimine el exceso de tampón de lavado y colocar la placa en una jarra Coplin con tampón de lavado durante aproximadamente 5 min.
3. Adición de conjugado fluorescente
- Uno por uno, retire las diapositivas de la solución de lavado y golpear suavemente para eliminar el exceso de tampón de lavado. Aplicar 1 gota de conjugado fluorescente (marcado con FITC anti-IgG humana) a cada pocillo. Incubar los portaobjetos durante 30 minutos en el recipiente humidificado, y asegúrese de reemplazar la tincióntapa del recipiente. Nota: Para la prueba de ANA, se recomienda el uso de un conjugado de IgG específica de Fc. El conjugado es sensible a la luz, y la cubierta protegerá las diapositivas de la exposición a la luz, además de mantener el medio ambiente humidificado. Durante este periodo de incubación, el conjugado se unirá a los anticuerpos anti-nucleares del paciente que se han unido a los antígenos de las células. Este conjugado de unión resultados en la presencia de fluorescencia en los pocillos.
- Enjuagar y lavar el portaobjetos como se describe anteriormente.
- Coloque un cubreobjetos sobre una toalla de papel y aplicar el medio de montaje en línea continua hasta el borde inferior del cubreobjetos.
- Retire cada diapositiva de la solución de lavado y golpee suavemente el portaobjetos para retirar el exceso de tampón de lavado. Toque el borde inferior de la diapositiva en el borde del cubreobjetos.
- Bajar suavemente el portaobjetos sobre el cubreobjetos de tal manera que el medio de montaje sobre el cubreobjetos fluye hacia el borde superior de la corredera y sin la formación de burbujas de aire. Nota: Coverslipping, incluyendo el uso de la cantidad óptima de medio de montaje, es una técnica que requiere de práctica para perfeccionar.
4. Identificación de los resultados positivos y negativos
Interpretación Manual
- Ver desliza con un microscopio de fluorescencia, que se encuentra en un cuarto oscuro. Realizar el análisis de todo el pozo con un objetivo 20X o 25X para evaluar la distribución de células y la uniformidad de la fluorescencia
- Cambiar a un objetivo de 40X para hacer la interpretación final con respecto a la positividad y el patrón.
- Mira los controles positivos y negativos. Positividad Grado usando una escala de clasificación reactividad de 1 + a 4 +. Nota: El control negativo no puede aparecer completamente a oscuras, pero a menudo mostrará fluorescencia inespecífica de bajo nivel. El control positivo se mostrará manzana brillante fluorescencia verde en el núcleo (Figura 1).
Interpretación automatizada
Nota: En additien la interpretación manual, carga y diapositivas de escaneo por NOVA Ver Automatizado microscopio de fluorescencia o de otro instrumento de imagen digital automatizado; sin cuarto oscuro es necesario. Después de crear un proyecto mediante la selección del tipo de deslizamiento adecuado, el instrumento adquiere y almacena imágenes digitales de alta resolución de las células en cada pocillo. Además, NOVA Ver mide la intensidad de la luz fluorescente, y clasifica los resultados como positivos o negativos, y proporciona el reconocimiento de patrones para las muestras positivas. Las imágenes se visualizan por el operador en un monitor de ordenador de alta resolución, lo que permite la interpretación final, revisión y confirmación de NOVA Ver resultado. Se pueden generar informes sobre los resultados confirmados. Microscopía digital debe ser usado en conjunción con un técnico de laboratorio experimentado, ya que está destinado a ayudar en la interpretación de los resultados.
Resultados
Al evaluar los resultados de la tinción de células de HEp-2, cinco grandes patrones nucleares son más comúnmente reportados: homogénea, pintados centrómero, nucleolar, y los puntos nucleares. Estos patrones son el resultado de la unión de autoanticuerpos con constituyentes específicos del núcleo. Aunque la detección de ANA es específica a las estructuras nucleares, también se pueden observar los patrones citoplasmáticas asociadas con autoanticuerpos contra estructuras citoplasmáticas. En algunos casos, varios autoanticuerpos pueden estar presentes en una muestra, y la imagen pueden aparecer como un patrón mixto.
Hay otra, observado con menos frecuencia y, a menudo patrones específicos del ciclo celular que pueden ser detectados por el método IIF; más recientemente, una llamada densa patrón moteado fino con significado clínico especial ha sido descrita en algunos sueros ANA positiva.
Homogénea Patrón
Para identificar un patrón homogéneo, escanee el bien e identificar mitótico o divisoriacélulas. La cromatina condensada de las células mitóticas (Figura 2, flecha naranja) exhibe fluorescencia sólido, uniforme que a menudo es más pronunciada que en la célula en reposo nuclei.In el patrón homogéneo, la exposición uniforme de las células en reposo, la fluorescencia difusa de todo el núcleo (Figura 2, flecha blanca). Este patrón característico es a menudo el resultado de los anticuerpos anti-dsDNA 10.
Patrón moteado
En el patrón moteado grueso, las células mitóticas muestran ninguna tinción de las regiones cromosómicas condensadas (Figura 3, flecha naranja). Las células en reposo exhiben fluorescencia granular a través de todo el núcleo. El moteado nuclear puede ser definido como grueso o fino. El patrón moteado grueso es a menudo el resultado de anti-Sm y anti-RNP 11.
En el patrón moteado fino, las células en reposo muestran un moteado fino o difusa a través de los núcleos, por lo general en uniforme dISTRIBUCIÓN (Figura 4, flecha blanca). El patrón moteado fino es a menudo el resultado de la lucha contra SSAand anti-SSB 12.
Dense Pattern Fine manchada
Ahora se reconoce que el denso patrón moteado fino (DFS) es común en las pruebas de rutina, y hasta un 12% de las muestras son positivas para autoanticuerpos anti-DFS70. Sin embargo, estos autoanticuerpos, cuando se encuentran en forma aislada, no se asocian con enfermedades reumáticas autoinmunes sistémicas 4 -6. Estos anticuerpos son frecuentes en las personas y los pacientes portadores de enfermedades no relacionadas con la ADRS 6 sanas. Las pruebas de confirmación para los anticuerpos anti-DFS70 puede ayudar a reducir el reflejo de las pruebas innecesarias, ofrecen un considerable ahorro de costes, y calmar la ansiedad del paciente.
Dado el patrón de DFS es difícil de identificar y la positividad de ANA puede causar ansiedad a los pacientes y médicos, es muy recomendable realizar una prueba de confirmación al cabo de identificación ficar un patrón sugestivo de anticuerpos anti-DFS70 para aclarar el significado clínico de ANA positivty 5,6.
En este modelo, las células mitóticas (Figura 5, naranja de flecha) muestran tinción positiva moteada de la cromatina metafase, mientras descansa núcleos de las células (Figura 5, flecha blanca) exhiben manchas finas uniformemente distribuidas por todo el núcleo.
Patrón Centrómero
Para identificar el patrón centrómero, mira los pozos e identificar mitótico o células en división. En células mitóticas (Figura 6, naranja de flecha), estos se convierten en manchas aisladas estrechamente asociados en lo que a menudo se describe como un "bar metafase". En el patrón de centrómero, células en reposo (Figura 6, flecha blanca) muestran aproximadamente 40-60 manchas discretas distribuidas a lo largo de los núcleos. El patrón centrómero es el resultado de anti-CENP A, B, C anticuerpos 13.
paso "> Nucleolar PatrónAlgunos patrones nucleolar se asocian con la tinción citoplásmica difusa en las células mitóticas (Figura 7, flecha naranja) y la región cromosómica negativo, mientras que otros patrones nucleolear muestran tinción positiva de la región cromosómica. El patrón nucleolar se asocia con la tinción homogénea o moteado de los nucleolos (figura 7, flecha blanca), junto con moteado débil o tinción homogénea de la nucleoplasma. Estos patrones están asociados con anti-ARN polimerasa III, anti-fibrilarina, anti-Th/To y anti-PM/Scl anticuerpos 14,15.
Modelo de punto Nuclear
El modelo de punto nuclear se asocia con células mitóticas en metafase negativos (Figura 8, naranja de flecha) y con pocas manchas discretas en los núcleos de las células en reposo (Figura 8, flecha blanca). Este patrón característico es a menudo el resultado de la sp-100, PML, o p80 autoanticuerpos colin. Estos anticuerpos son como asociadas con la cirrosis biliar primaria y la hepatitis autoinmune 16.
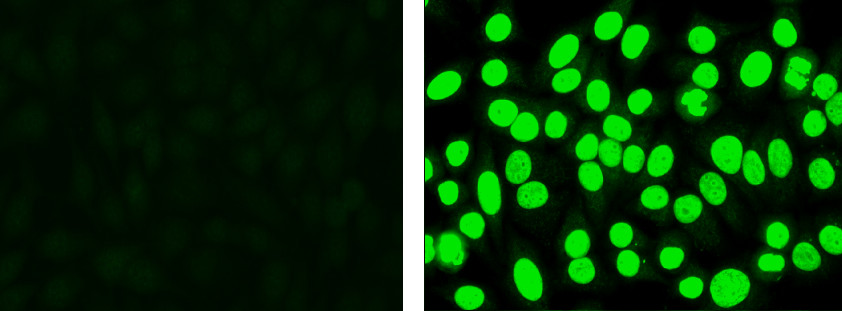
. Figura 1 Control negativo (izquierda): Las células muestran bajo nivel de fluorescencia no específica, pero sin tinción nuclear específico de control positivo (derecha):. Las células muestran fluorescencia nuclear de manzana verde.
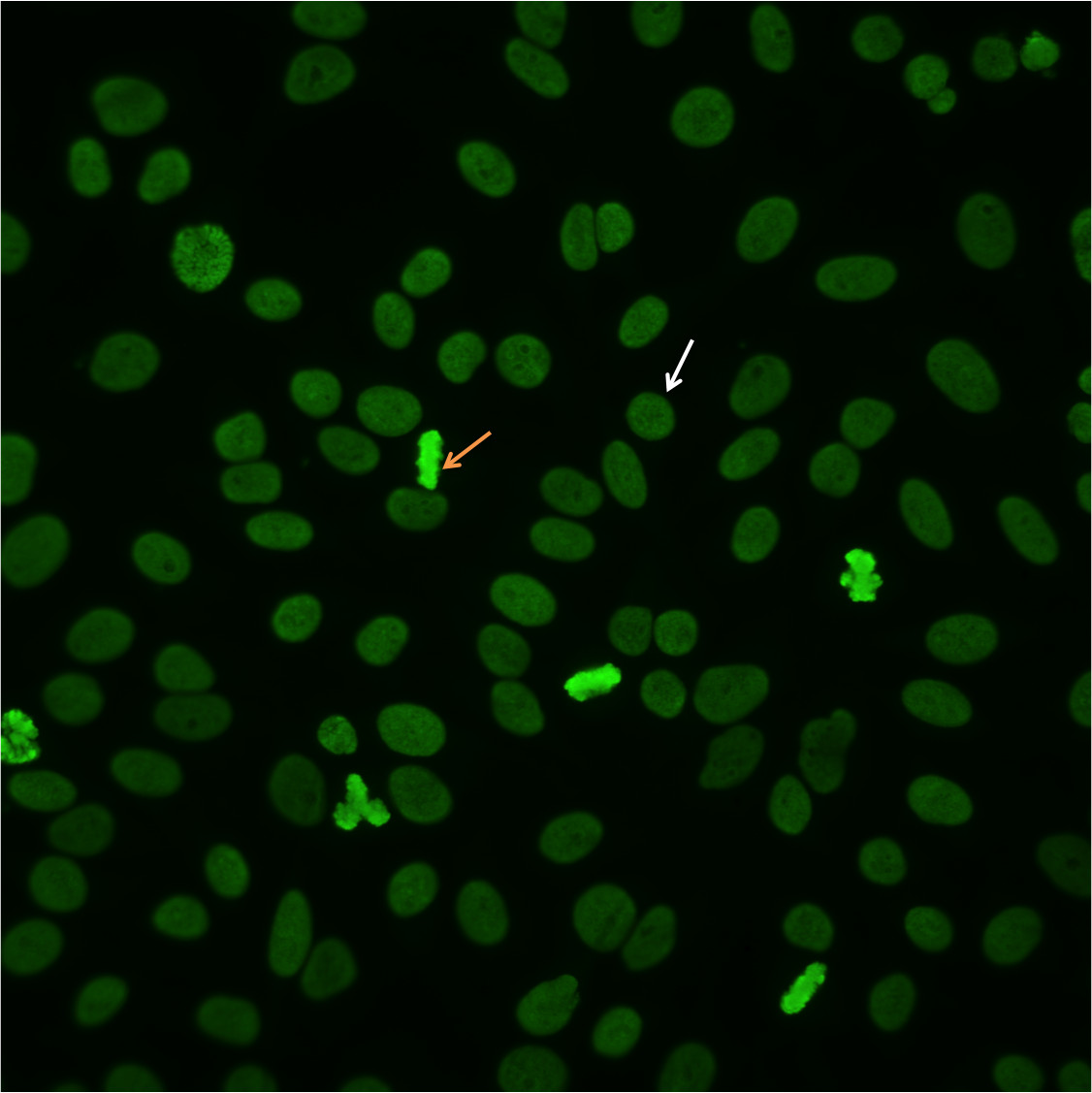
Figura 2. Patrón homogéneo. Células mitóticas (orangearrow) muestran fluorescencia sólido. Las células en reposo muestran incluso, la tinción difusa (whitearrow).
"Width =" 500 "/>
Figura 3. Gruesa moteado patrón. Células mitóticas (flecha naranja) muestran tinción negativa. Las células en reposo muestran una mancha moteado distinta (flecha blanca).

Figura 4. Patrón moteado fino. Células mitóticas (flecha naranja) muestran tinción negativa. Las células en reposo muestran una tinción moteada fina distinta (flecha blanca).

Figura 5. Patrón denso fino moteado. Células mitóticas (flecha naranja) muestran una tinción sólida granular fino. Las células en reposo muestran un muy fino, mancha moteado difuso (whitearrow).

Figura 6. Patrón centrómero. Células mitóticas (orangearrow) Mostrar uniforme, manchas aisladas. Descansar células (whitearrow) muestra 40-60 manchas aisladas por núcleo celular.
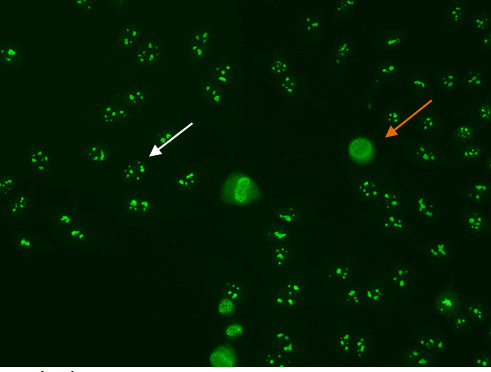
Figura 7. Patrón nucleolar. Células mitóticas (orangearrow) aparecen como grandes grupos de tinción granular. Descansar celular nucleishows fluorescencia en los nucleolos (whitearrow).
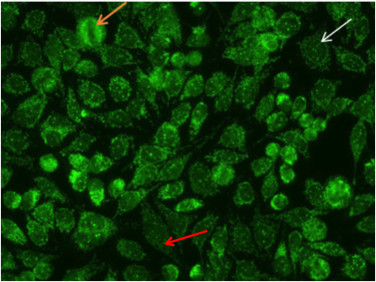
Figura 8. Patrón de puntos Nuclear. Células mitóticas (orangearrow) parece negativo. Las células en reposo muestran algunos DISCRmotas ete en el núcleo (whitearrow). Además, el patrón de puntos nucelar pueden coexistir con tinción citoplásmica asociada con autoanticuerpos a antígenos mitocondriales (flecha roja).
Discusión
Screening by HEp-2 cells is a critical first step in the diagnosis of patients with SARD. However, IIF methods lack harmonization. Sources of variability include preparation of slides, conjugate specificity, and efficiency of the fluorescent microscope and experience of the reader. Despite these concerns, IIF remains the “gold standard” for ANA testing. HEp-2 cells contain a large variety of autoantigens, and provide the ideal substrate for the detection of these autoantibodies. In some laboratories, IIF has been replaced with solid phase screening methods such as multiplex assay or ELISA. The shortcoming of such tests is that they do not display the full range of antigens to be sufficiently sensitive. As a consequence, true positive patients may be missed which can have deleterious consequences In addition to the issues of treatment delay and wrong diagnosis, additional healthcare costs may occur due to the repetition of confirmatory tests or unnecessary diagnostic investigations. Given the inherent challenges to IIF, it is paramount to perform this technique properly to avoid subjectivity in results.
To ensure accurate interpretation and reporting of results for ANA screening, it is vital to use the highest quality substrate. When selecting a HEp-2 substrate, it is critical that the cells be optimized to express clinically relevant epitopes in their native protein state. Transfected or otherwise modified HEp-2 cell lines may not allow proper antibody-antigen binding. In addition, when several different autoantibodies are present simultaneously, recombinant cells may mask one or more patterns. High number of mitotic cells should also be present in the substrate. Adequate number of mitotic cells allows quick and accurate identification of patterns.
In addition to the attributes of the substrate, the objective of this video protocol is to describe the IIF technique by showing critical steps such as the addition of sample, slide washing, addition of conjugate, cover slipping, and determination of positive and negative results. Results can be compromised if proper technique is not used for each of these steps. Proper washing is important to remove all unbound antibody. Some patients display very high amounts of autoantibodies and in these cases it is important to wash the serum from the wells such that it does not contaminate other wells.
Although IIF has traditionally been a very labor intensive and subjective laboratory method, new technologies such as slide processors, barcoded slides and automated digital microscopy can greatly simplify the workflow, increase the consistency and reduce the sources of variability of interpretation.
Divulgaciones
Los autores Gabriella Lakos, Cassandra Bryant, Carol Buchner, y Anna Eslami son empleados de INOVA Diagnostics.
Agradecimientos
Damos las gracias a Cassandra Bryant para realizar el experimento IIF y Carol Buchner por su revisión técnica de expertos.
Materiales
| Name | Company | Catalog Number | Comments |
| NOVA Lite HEp-2 IgG (DAPI conjugate) | INOVA Diagnostics | 708102 | |
| NOVA View Instrument | INOVA Diagnostics | NV2000 | |
| QUANTA Link Workstation | INOVA Diagnostics | LINK010 | |
| QUANTA Link Workstation License | INOVA Diagnostics | LINK001 | |
| Barcode Scanner | INOVA Diagnostics | LINK019 |
Referencias
- Meroni, P. L., Schur, P. H. ANA screening: an old test with new recommendations. Ann Rheum Dis. 69 (8), 1420-1422 (2010).
- Tan, E. M. Autoantibodies to nuclear antigens (ANA): Their immunobiology and medicine. Advances in immunology. 33, 167-240 (1982).
- Sack, U., et al. Autoantibody detection using indirect immunofluorescence on HEp-2 cells. Ann NY Acad Sci. 1173, 166-173 (2009).
- Watanabe, A., et al. Anti-DFS70 antibodies in 597 healthy hospital workers. Arthritis Rheum. 50 (3), 892-900 (2004).
- Mahler, M., et al. Importance of the dense fine speckled pattern on HEp-2 cells and anti-DFS70 antibodies for the diagnosis of systemic autoimmune diseases. Autoimmun Revi. 11 (9), 642-645 (2012).
- Mahler, M., Fritzler, M. J. The clinical significance of the dense fine speckled immunofluorescence pattern on HEp-2 cells for the diagnosis of systemic autoimmune diseases. Clin Dev Immunol. , (2012).
- Miyara, M., et al. Clinical phenotypes of patients with anti-DFS70/LEDGF antibodies in a routine ANA referral cohort. Clin Dev Immunol. , (2013).
- Mariz, H., et al. Pattern on the antinuclear antibody-HEp-2 test is a critical parameter for discriminating antinuclear antibody positive healthy individuals and patients with autoimmune rheumatic diseases. Arthritis Rheum. 63 (1), 191-200 (2011).
- Muro, Y., et al. High concomitance of disease marker autoantibodies in anti-DFS70/LEDGF autoantibody-positive patients with autoimmune rheumatic disease. Lupus. 17 (3), 171-176 (2008).
- Agmon-Levin, N., et al. International recommendations for the assessment of autoantibodies to cellular antigens referred to as anti-nuclear antibodies. Ann Rheum Dis. 73 (1), 17-23 (2014).
- Craft, J., et al. The U2 small nuclear ribonucleoprotein particle as an autoantigen. J Clin Invest. 81 (6), 1716-1724 (1998).
- Salomonsson, S., et al. A serologic marker for fetal risk of congenital heart block. Arthritis Rheum. 46 (5), 1233-1241 (2002).
- Miyawaki, S., et al. Clinical and serological heterogeneity in patients with anticentromere antibodies. J Rheumatology. 32 (8), 1488-1494 (2005).
- Raijamkers, R., et al. PM-Scl-75 is the main autoantigen in patients with the polymyositis/scleroderma overlap syndrome. Arthritis Rheum. 50 (2), 565-569 (2004).
- Yang, J. M., et al. Human scleroderma sera contain autoantibodies to protein components specific to the UC small nucleolar RNP complex. Arthritis Rheum. 48 (1), 210-217 (2003).
- Granito, A., et al. Antinuclear antibodies as ancillary markers in primary biliary cirrhosis. Expert Rev Mol Diagn. 12 (1), 65-74 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados