Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Utilizando diseño personalizado galvanotaxia Cámaras para Estudiar direccional migración de las células de la próstata
En este artículo
Resumen
We present a method to apply a physiological electric field to migrating, immortalized prostate cells in a custom-made galvanotaxis chamber. Using this method, we demonstrate that 2 lines of non-tumorigenic prostate cells demonstrate different degrees of migration directionality in the field.
Resumen
El campo eléctrico fisiológica sirve funciones biológicas específicas, tales como la dirección de la migración celular en el desarrollo del embrión, consecuencia neuronal y la curación de la herida epitelial. La aplicación de un campo eléctrico de corriente directa a las células cultivadas in vitro induce la migración celular direccional, o galvanotaxia. El método galvanotaxia 2-dimensional se demuestra aquí se modifica con cámaras de poli por encargo (cloruro de vinilo) (PVC), superficie de vidrio, electrodos de platino y el uso de una etapa motorizada en la que se crean imágenes de las células. Las cámaras de PVC y electrodos de platino presentan baja citotoxicidad y son asequibles y re-usable. La superficie de vidrio y la platina del microscopio motorizado mejorar la calidad de las imágenes y permiten posibles modificaciones a la superficie de vidrio y tratamientos para las células. Filmamos la galvanotaxia de dos líneas de células no tumorigénicas SV40 inmortalizado próstata, PRN-1-1 y PNT2. Estas dos líneas celulares muestran velocidades de migración similares y ambos migran haciael cátodo, pero muestran un grado diferente de direccionalidad en galvanotaxia. Los resultados obtenidos a través de este protocolo sugerir que los PRN-1.1 y las líneas celulares PNT2 pueden tener diferentes características intrínsecas que gobiernan sus respuestas migratorias direccionales.
Introducción
Campos eléctricos endógenos se detectan en varios tejidos, como la piel 1, 32, 33 y el cerebro 2. El campo eléctrico fisiológica sirve funciones biológicas específicas, incluyendo la dirección de desarrollo del embrión 3, 4, guiando la consecuencia de los procesos neuronales 5, 6 y la promoción de cierre de la herida epitelial corneal y 1, 7. In vitro, la aplicación de un campo eléctrico de corriente directa a las células cultivadas imita el campo eléctrico fisiológica e induce la migración celular direccional, o galvanotaxia. Galvanotaxis se ha estudiado en fibroblastos, queratinocitos 8 de pescado 9, epitelial humano y queratinocitos corneales 10-12, linfocitos 13, neuroblastos 2, y células progenitoras neuronales 14. Cuando se expone al campo aplicado, la mayoría de las células estudiadas migran direccionalmente hacia el catódica polo (-). Sin embargo, varias células cancerosas, incluyendo altamente metastásicocélulas de cáncer de mama humano y la próstata humana línea celular de cáncer PC-3M, se mueven a la anódica polo (+) 15, 16. Se proponen varios mecanismos para mediar galvanotaxia o para explicar la capacidad de las células para detectar el campo eléctrico, incluyendo la activación de los receptores de EGF 12, el canal de sodio epitelial 17, PI3K y PTEN 18, y la liberación de iones de calcio 15, 19. El mecanismo no es todavía plenamente comprendida y es posible que múltiples vías de señalización están implicadas en galvanotaxia.
El método galvanotaxia 2-dimensional se demuestra aquí es útil para caracterizar la migración direccional de adherente, células móviles, ya sea para controlar la migración de células individuales 10, 12, 17 o la migración de una hoja de células confluentes 18, 20. Esta técnica se modifica desde Peng y Jaffe 21 y Nishimura et al. 10 con, cámaras de PVC claras a medida, con coversl extraíbleips permitiendo la recuperación de células fácil después galvanotaxia para el análisis secundario, como las imágenes de inmunofluorescencia. La superficie de vidrio de las cámaras galvanotaxia es compatible con óptica, que permite la grabación a alta magnificación y con células marcadas con fluorescencia. También permite que el diseño experimental con la modificación de la superficie de vidrio, tales como cambiar el revestimiento de la superficie o cargos. Los espaciadores hechos de No. 1 cubreobjetos se utilizan en las cámaras para minimizar el flujo de corriente a través de las células; por lo tanto el calentamiento por efecto Joule, que es proporcional al cuadrado del flujo de corriente, no sobrecalentar las células durante el experimento. Los puentes de conexión de agar evitar el contacto directo de los electrodos con las células y prevenir el cambio del pH del medio o la concentración de iones durante galvanotaxia.
Dos no tumorigénicas líneas celulares de próstata humano se examinaron por su respuesta galvanotaxia en este estudio. Los PRN-1-1 22 y PNT2 23 son ambos SV40 inmortalizadas, dependientes de factor de crecimiento de líneas celulares que expresan los marcadores epiteliales citoqueratina 5, 8, 18 y 19 con baja o ninguna expresión de la específica de antígeno de la próstata (PSA). Ambas líneas celulares mantienen la morfología poligonal de las células epiteliales normales, pero anomalía cromosómica se observó en el cariotipo 22, 24. Aunque PRN-1-1 y PNT2 comparten comportamientos similares en la mayoría de los experimentos, muestran diferencias en la formación de la estructura acinar y en galvanotaxia. En una matriz de 3-D, Matrigel, los PRN-1-1 células acinares formar estructuras huecas con lúmenes se asemejan a la tejido de la glándula próstata normal 25. Sin embargo, las células PNT2 formar esferoides sólidos sin un lumen o epitelio polarizado 26. Las células PRN-1-1 también demuestran una respuesta galvanotactic más alta que la PNT2 en el estudio actual. La correlación entre la formación de la estructura acinar y galvanotaxia en PRN-1-1 sugiere que las señales galvanotactic pueden jugar un papel en la organización de la prmovimientos de tejido de la glándula ostate en respuesta a campos eléctricos endógenos, y ofrece características adicionales para discriminar entre estas 2 líneas celulares.
Protocolo
1. cultivar células de la próstata
- Cultura los PRN-1-1 y PNT2 próstata células en 100 mm cultura platos en medio RPMI 1640 suplementado con 10% de SFB y antibióticos Antimycotic a 37 ° C con 5% de CO 2. Actualizar el medio de cultivo cada día hasta que las células alcanzan 80% de confluencia para los experimentos galvanotaxia.
2. Composición galvanotaxia Cámaras
- Montaje de cámaras inferiores
- Limpie una cámara galvanotaxia plástico con 2-propanol. Aplicar el sellador de silicona de grado marino alrededor de las aberturas circulares en la parte inferior de una cámara con una jeringa y adjuntar una gran cubreobjetos (Figura 1). Use la parte de atrás de un aplicador de algodón para empujar hacia abajo el cubreobjetos y limpie el exceso de pegamento con hisopos de algodón. Las aberturas circulares permiten el medio y la corriente eléctrica fluya sobre las células situadas entre los dos depósitos medianas interiores.
- Corte un pequeño cubreobjetos para hacer 6 mm x 25 espaciadores mm con un marcador de punta de diamante.
- Voltear la cámara. Aplicar 2 rayas de la cola de silicio con una jeringa y / o una espátula de metal para crear un x 25 mm superficie del canal 10 mm para la fijación celular entre las 2 aberturas circulares en el cristal inferior. Pegue 2 piezas de vidrio separador entre las 2 aberturas circulares. Use la parte de atrás de los aplicadores de algodón para empujar hacia abajo los espaciadores y limpie el exceso de pegamento con hisopos y / o palillos de algodón.
- Seque la cámara durante 24 horas hasta que se cure el pegamento de silicona. Remojar la cámara durante la noche en agua destilada para eliminar el residuo de ácido acético a partir de la cola. Seque la cámara para su uso inmediato, o almacenar la cámara para su uso posterior en un recipiente limpio.
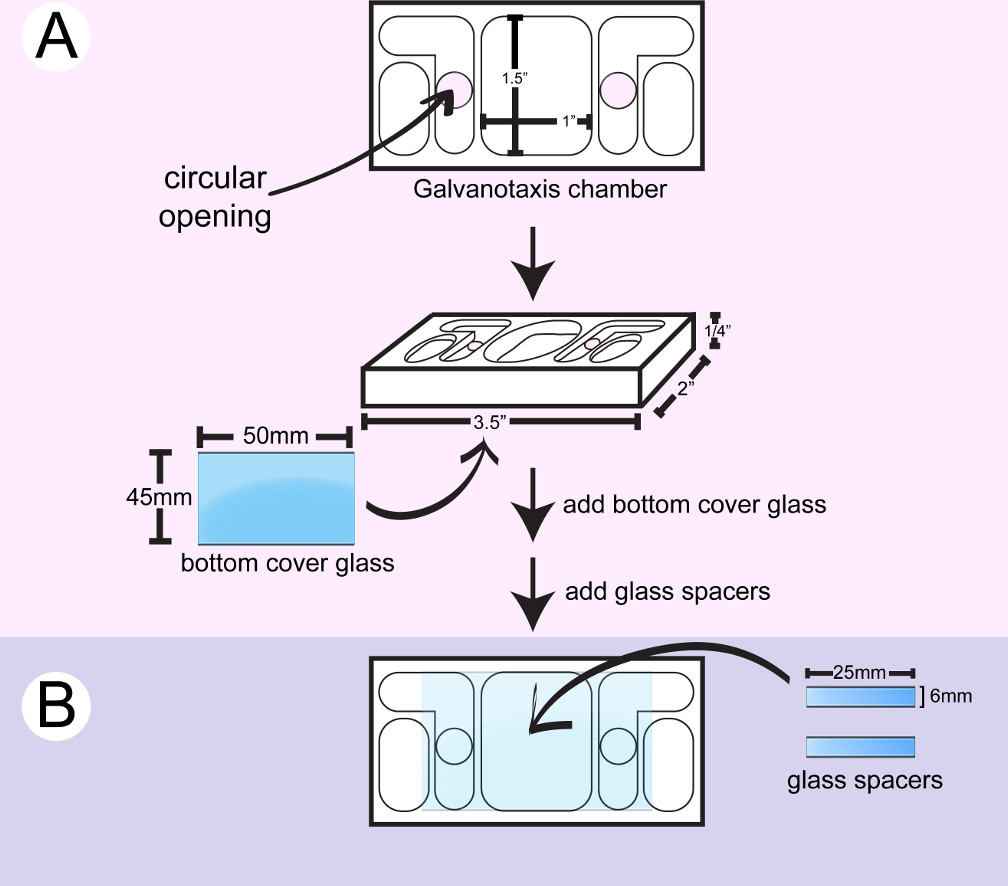
Figura 1: Montaje de la cámara de la parte inferior galvanotaxia. A) Un gran cubreobjetos está unido a la parte inferior de una cámara limpia. B) Two piezas de separadores de cristal se pegan entre las 2 aberturas circulares para crear una 10 mm x 25 mm para el canal de las células se unan.
- Siembra de las células en las cámaras galvanotaxia
- Preparar el número requerir de cámaras galvanotaxia necesarios para el experimento. Cada línea o el tratamiento de células requiere una única cámara galvanotaxia. Limpie las cámaras galvanotaxia con 2-propanol. Lave las cámaras con estériles PBS 3 veces y compruebe el flujo de líquido entre las 2 aberturas circulares en las cámaras.
- Incluya las cámaras en placas de cultivo de células estériles y dejar que se equilibren a 37 ° C durante 15 minutos. Separar las células de la próstata a partir de su plato de cultivo utilizando 5 ml 0,25% de tripsina-EDTA a 37 ° C durante 5 min. Neutralizar la tripsina-EDTA con 5 ml 10% de FBS en PBS.
- Transferir las células a tubos de 15 ml y centrifugar las células durante 5 min a 200 xg, 37 ° C. Aspirar el sobrenadante y volver a suspender las células en 1 ml de medio de cultivo.
- Tome 20 μl de solución de células para cargar a una cámara de recuento y calcular el número de células. Ajustar la concentración de células a 8 x 10 4 células / ml con medio de cultivo.
- Tome las cámaras galvanotaxia de los 37 ° C incubadora. Semillas 350 l de la suspensión celular sobre cada cámara.
- Se incuban las células en las cámaras durante la noche en la placa de cultivo con Kimwipe mojado o en una cámara de humedad en la incubadora a 37 ° C con 5% de CO 2.
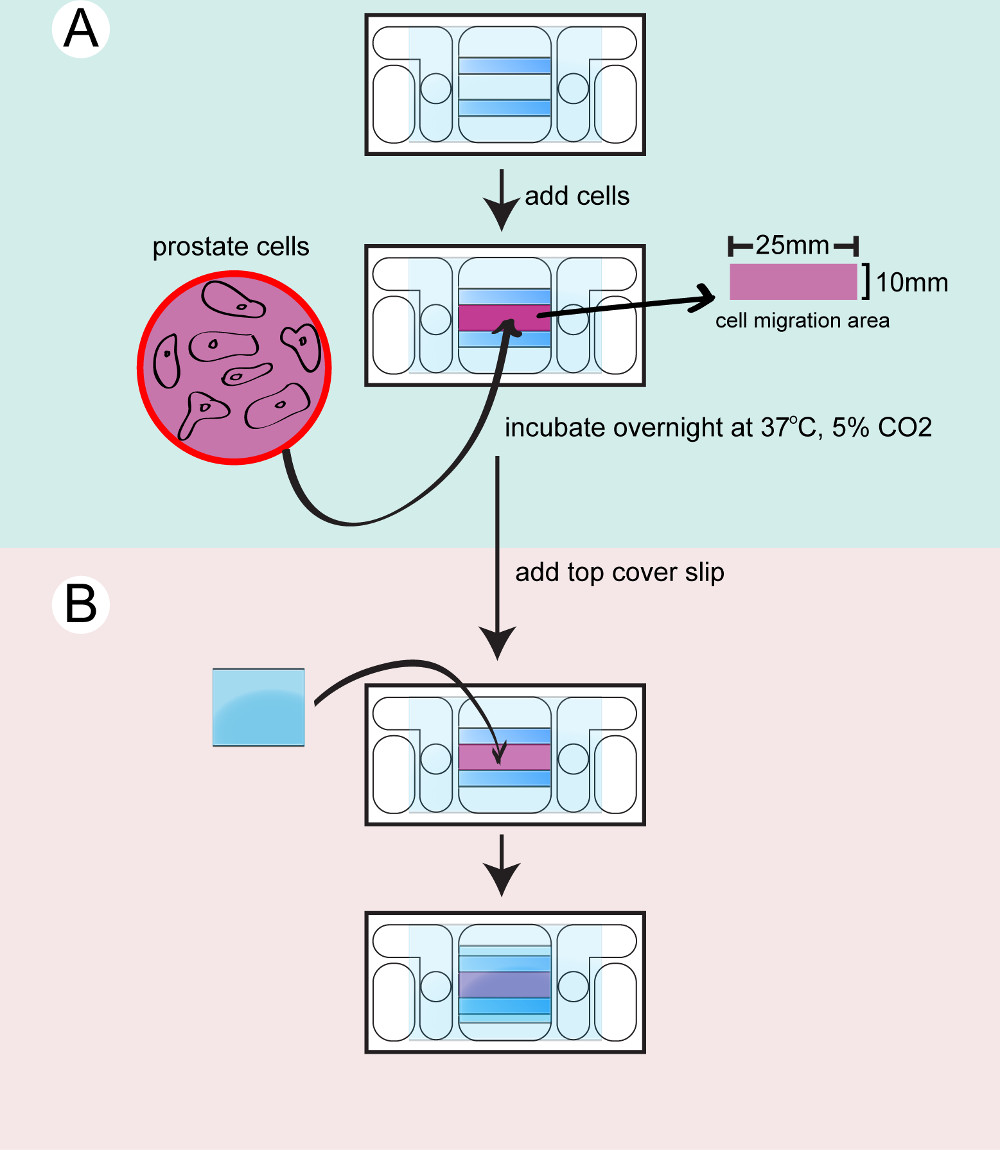
Figura 2:. Siembra de las células a la cámara de la cámara inferior se seca y limpia las células A) de próstata se tripsinizaron, se contaron y se transfirieron a la cámara y se incubaron durante la noche B) un cubreobjetos superior está unido a sellar la cámara antes de la filmación...
- Lassembling las cámaras superiores
- Montar la cámara superior antes de la filmación. El microscopio sólo puede acomodar imágenes de una sola cámara galvanotaxia al mismo tiempo. Calentar 10 ml de medio de cultivo a 37 ° C para cada cámara galvanotaxia. Transferir una cámara galvanotaxia de las incubadoras a una placa de calentamiento 37 ° C.
- Enjuagar las células con medio de cultivo para eliminar las células no unidas. Deja 400 l de medio en la cámara. Utilice una jeringa para aplicar grasa de alto vacío en la parte superior de ambos separadores de vidrio.
- Añadir una pequeña cubreobjetos para sellar la cámara. Presione suavemente el cubreobjetos con el lado posterior de un aplicador de algodón. Limpie el medio exceso con hisopos de algodón.
- Seque la superficie del vidrio y aplicar grasa de alto vacío para sellar la brecha entre el cubreobjetos y la cámara. Use una espátula de metal para extender la grasa. Añadir 4 ml de medio de cultivo para los depósitos internos y comprobar el flujo de líquido entre los embalses.
- Haga agarpuentes
- Corte un par de tubos de PVC de 2 pulgadas de largo (503/16 ID x 5.16 OD x 1/16 Wall), dar la vuelta e insertarlos en un vaso de 100 ml.
- Mide 200 mg Bacto-Agar y agregarlo en un matraz de 50 ml con medio de cultivo de 10 ml de hacer 2% en gel de agar. Microondas durante 30 segundos. Cargue el gel de agar para el tubo de plástico con una pipeta de transferencia. Deje los puentes de agar a temperatura ambiente durante 10 min para solidificar el agar.
- Añadir 2 ml de medio de cultivo a los depósitos exteriores de la cámara galvanotaxia. Inserte los puentes de agar a los embalses medianas interior y exterior para conducir la corriente.
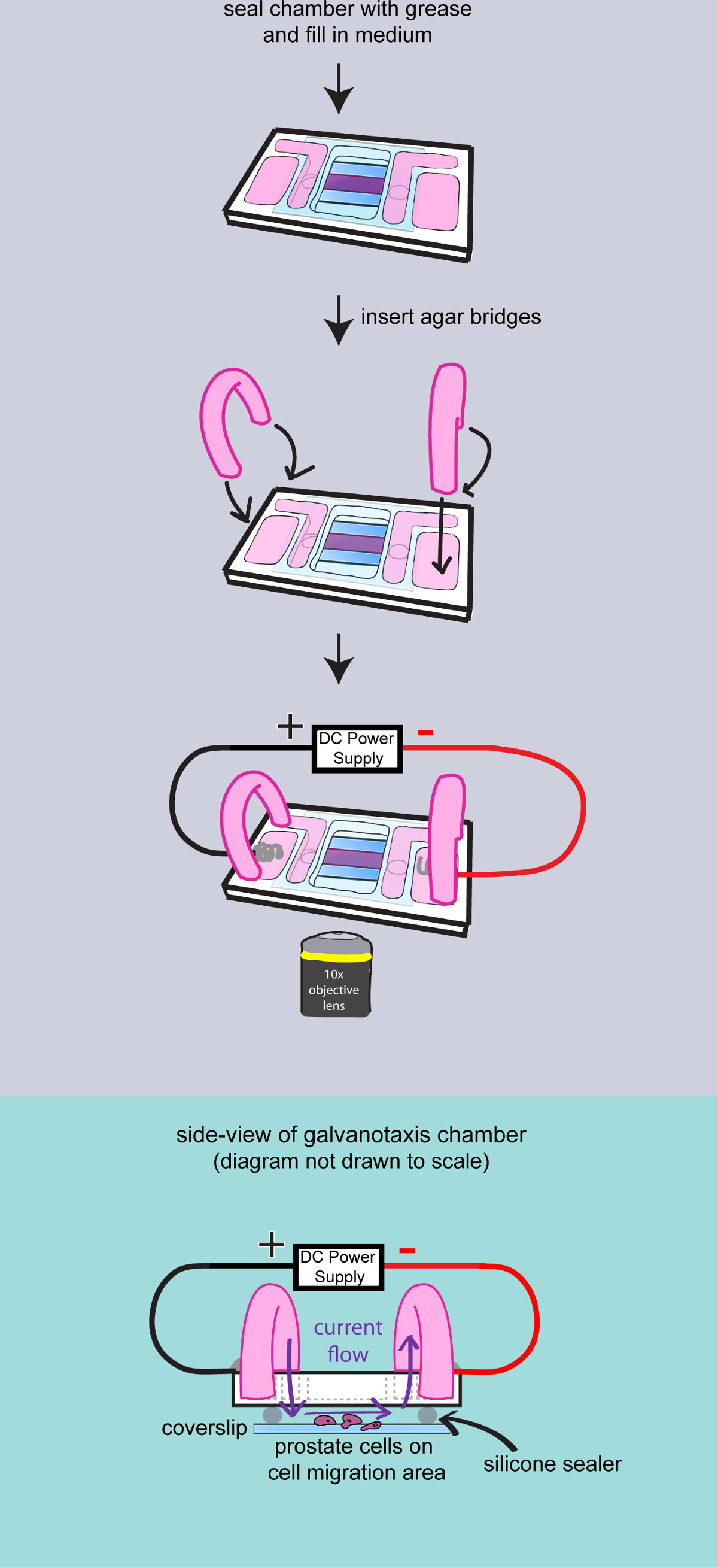
Figura 3:. El rodaje de las células en la cámara de un diagrama para demostrar el montaje final de la cámara de galvanotaxia. La cámara está completamente sellado con grasa de alto vacío. El medio se añadió to llenar los depósitos, y dos puentes de agar se insertan en la cámara. A continuación, la cámara de galvanotaxia se transfiere a la platina del microscopio y los electrodos están unidos a aplicar el campo eléctrico. Vista lateral de la cámara de galvanotaxia ensamblado se muestra para demostrar que la corriente eléctrica fluye sobre las células a través de los puentes de agar y el espacio entre el vidrio de cubierta.
Imaging 3. Time-lapse
- Encender la cámara ambiental a 37 ° C con 5% de CO2 en el aire que circula 2 hr antes de la imagen.
- Encienda el microscopio e iniciar el software de adquisición de imagen. Calibrar la platina del microscopio y seleccione el objetivo de 10X.
- Transferir las cámaras galvanotaxia a la platina del microscopio, asegure la cámara con cinta y se centran en las células. Introducir los electrodos galvanotaxia a los depósitos exteriores con cátodo en el lado derecho. Fije el cable y los electrodos con cinta.
- Encienda el bo poderx para aplicar un campo eléctrico a la cámara. Mida el voltaje de salida con el voltímetro a través de la cámara de alcanzar 2,5 voltios para la cámara de 25 mm de largo (100 mV / mm). Mantener la intensidad de campo durante el experimento mediante el ajuste de la corriente de salida.
- Seleccione 10 puntos a través de la cámara para filmar en el software para generar diez películas a intervalos. Configurar las condiciones de adquisición a intervalos de 10 minutos durante 2 horas.
- Iniciar el rodaje y ajustar la corriente de salida, según sea necesario.
- Al final del experimento, retire la cámara desde el escenario y fijar las células con 95% de alcohol. Rompa la cámara con una hoja de afeitar para limpiar y volver a usarlo.
4. Cuantificación de Galvanotaxis
- Gire las películas a intervalos y reorientar el cátodo a la parte superior de las imágenes. Exportar las películas para el software de seguimiento de la célula.
- Rastrear manualmente el (x, y), la posición de 10 a 20 células en cada punto de tiempo de cada película (Figura 4 A, B).Las distancias de migración y los ángulos relativos a la dirección norte-sur, la misma orientación del campo eléctrico, se calcularán en el software de seguimiento de la célula (Figura 4C).
NOTA: La velocidad media de migración se convierte de la distancia de migración total y el tiempo total de rodaje. La direccionalidad se convierte de los ángulos en el valor del coseno. Si las células migran con direccionalidad al azar, el promedio de coseno neto será cercano a cero. Si las células migran directamente hacia el cátodo, el valor del coseno será 1. Si las células migran directamente hacia el ánodo, el valor del coseno será -1.
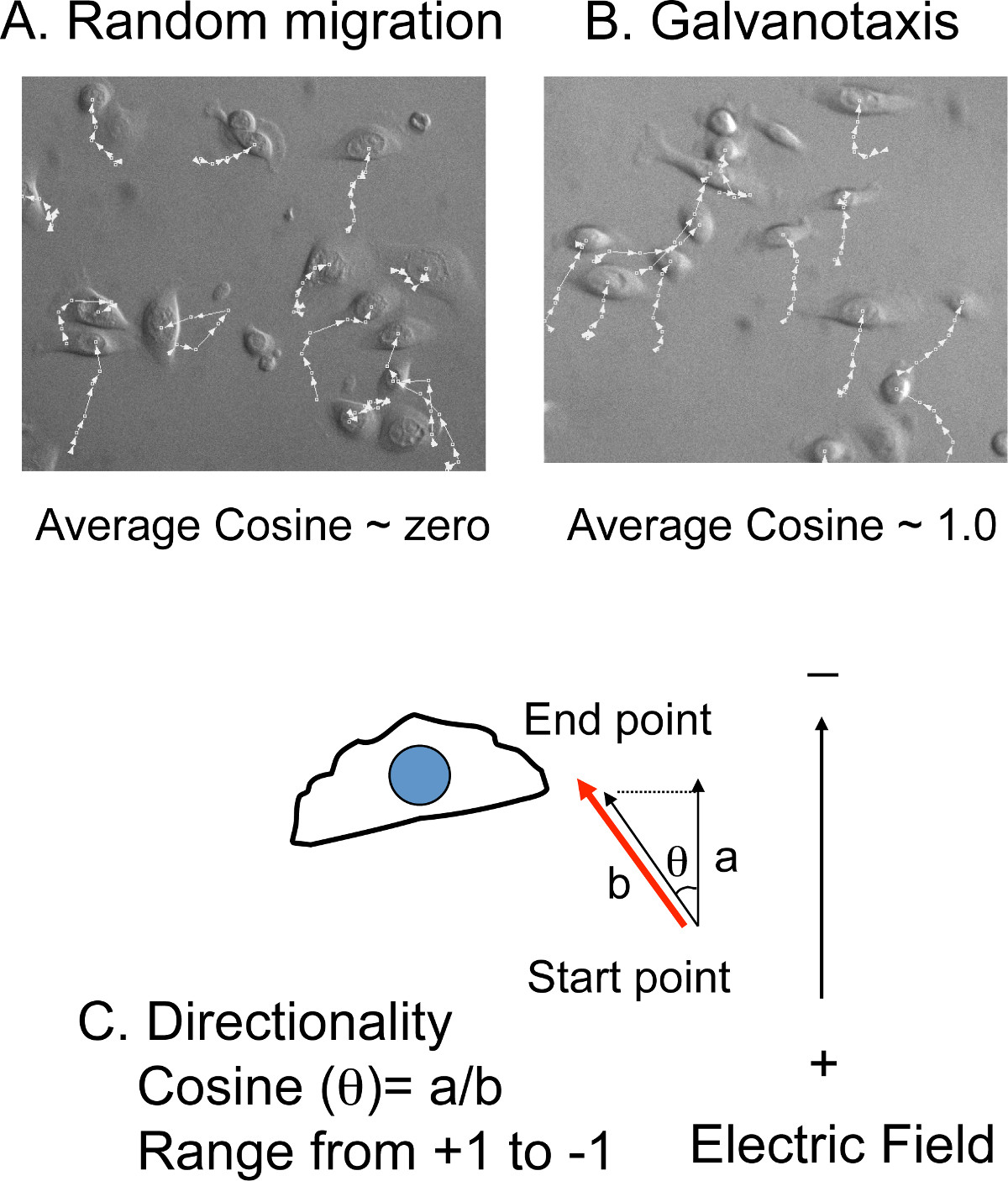
Figura 4: seguimiento de la célula para medir la direccionalidad A) Superposición de las líneas de seguimiento con imágenes de células.. Los (x, y) posiciones de las células son manually rastreado en las películas a intervalos. . Si las células migran al azar, el coseno promedio es cercano a cero B) Sin embargo, si las células migran hacia el cátodo o el ánodo, el valor del coseno media es de cerca de + (cátodo) o -. (Ánodo) 1,0 C ) La direccionalidad es presentado por el valor del coseno, que se convierte a partir de los ángulos de migración (θ). El coseno (θ) es igual a la relación de la distancia a (la distancia de migración) la distancia b (la distancia proyectada a la dirección del campo eléctrico).
- Guarde las mediciones. Importe los datos a una aplicación de base de datos para el cálculo de los resultados combinados.
- Exportar los datos combinados de la velocidad media de migración y el valor promedio del coseno de una hoja de cálculo para trazar los gráficos de barras (Figura 5).
Resultados
Dos líneas de células de la próstata (PRN-1-1 y PNT2) se investigaron con este método. Las células en ambas líneas migran a velocidades similares de 1,0 +/- 0,3 micras / min durante el transcurso de 2 horas (figura 5A). Sin embargo, la direccionalidad al campo eléctrico es 0,7 +/- 0,3-PRN para la línea 1-1, y 0,2 +/- 0,8 para la línea PNT2 (Figura 5B). Los resultados muestran una diferencia significativa en la galvanotaxia de estas dos líneas celulares (p <0,01, 100 célula...
Discusión
El análisis de la respuesta galvanotaxia de una célula ha sido un indicador funcional importante para muchos migratoria o crecimiento celular procesa 27, 28. Aquí se utiliza una cámara de medida con la superficie de vidrio a la película dos líneas celulares de próstata. Estas líneas celulares demostraron diferentes grados de galvanotaxia, y especulan que la localización intracelular o la activación de las proteínas galvanotaxia-mediación pueden ser interferidas durante el proceso de generación de...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Las líneas celulares de próstata se amablemente proporcionados por el Dr. Ling-Yu Wang y Dr. Hsing-Jien Kung en el Centro de Cáncer, la Universidad de California Davis. Este proyecto es apoyado por el NIH subvención galvanotaxia 4R33AI080604.
Materiales
| Name | Company | Catalog Number | Comments |
| Cells | |||
| pRNS-1-1 prostate cells | Lee, et al. (1994) | ||
| PNT2 prostate cells | Sigma-Aldrich | 95012613-1VL | Berthon, et al. (1995) |
| Medium and solutions | |||
| RPMI 1640 medium | Invitrogen | 11875-093 | warm up to 37 °C before use |
| Fetal Bovine Serum - Premium | Atlanta Biologicals | S11150 | 10% in PBS, warm up to 37 °C before use |
| Antibiotic-Antimycotic (100x) | Life Technologies | 15240 | add 5 ml to 500 ml medium |
| 2-propanol | VWR | BDH1133-5GL | |
| PBS | - | - | 137 mM NaCl, 2.7 mM KCl, 4.3 mM Na2HPO4 and 1.5 mM KH2PO4 in 1,000 ml of H2O, pH to 7.4 and autoclaved, warm up to 37 °C before use |
| 0.25% Trypsin-EDTA | Invitrogen | 25200-056 | warm up to 37 °C before use, treat cells for 3-5 min at 37 °C |
| Galvanotaxis device | |||
| Galvanotaxis chambers | Precision Plastics Inc, CA | Custom-designed (1/4" x 2" x 3.5"), non-toxic, clear PVC chambers. Please contact the authors for the design specs. | |
| Galvanotaxis electrodes | UCD electric shop | platinum coiled electrodes with flexable cords | |
| Galvanotaxis power box | Substrate Engineering, CA | custom-designed DC power output with voltmeter | |
| Microscope Cover Glass, Large, 45 x 50 mm, No. 1.5 | Fisher | 12-544-F | |
| Microscope Cover Glass, small, 25 x 25 mm, No. 1 | ThermoScientific | 3307 | |
| Diamond point marker | ThermoScientific | 750 | |
| Marine grade silicon sealer, clear | 3M | 051135-08019 | |
| High vacuum grease | Dow Corning | 2021846-0807 | |
| 6 ml syringe | Fisher Scientific | 05-561-64 | |
| Nichiryo Syringe, 1.5 ml | Nichiryo | SG-M | |
| Cotton applicators | Purtian Medical Products | 806-WC | |
| Qtips | Johnson & Johnson | 729389 | |
| Nalgene 180 PVC tubing | Nalgene | 8000-9030 | 503/16 ID x 5/16 OD x 1/16 Wall |
| Bacto-Agar | Difco | 0140-01 | make 2% agar solution |
| Razor Blade | Personna | 74-0001 | |
| Equipments and Software | |||
| Benchtop Centrifuge | Eppendorf | 5810R | operated with an A-4-62 rotor |
| Cellometer Auto T4 | Nexcelom | Auto T4 | |
| Cellometer counting chambers | Nexcelom | CHT4-SD100-002 | load 20 μl cell solutions to count |
| Culture Temp Warming plate | Bel-Art Scienceware | 370150000 | to keep the galvanotaxis chambers at 37 °C |
| Eclipse TE-2000 microscope with motorized stage and environmental chamber | Nikon | ||
| Plan Fluor 10X/0.30 objective len | Nikon | ||
| Retiga EX CCD camera | Qimaging | Cooled CCD camara, mono-color, 12-bit | |
| Compressed air with 5% CO2 | Airgas | special order | |
| Volocity 6.3 | PerkinElmer | Image acquiring software | |
| Improvision OpenLab 5.5.2 | PerkinElmer | Cell tracking software and customized to measure migration angles | |
| FileMaker Pro Advanced, 8.0 | FileMaker | ||
| Microsoft Excel 2008 for Mac | Microsoft | ||
Referencias
- Reid, B., Nuccitelli, R., Zhao, M. Non-invasive measurement of bioelectric currents with a vibrating probe. Nat Protoc. 2 (3), 661-669 (2007).
- Cao, L., et al. Endogenous electric currents might guide rostral migration of neuroblasts. EMBO Rep. 14 (2), 184-190 (2013).
- Hotary, K. B., Robinson, K. R. Endogenous electrical currents and voltage gradients in Xenopus embryos and the consequences of their disruption. Dev Biol. 166 (2), 789-800 (1994).
- Hotary, K. B., Robinson, K. R. Evidence of a role for endogenous electrical fields in chick embryo development. Development. 114 (4), 985-996 (1992).
- Yamashita, M. Electric axon guidance in embryonic retina: galvanotropism revisited. Biochem Biophys Res Commun. 431 (2), 280-283 (2013).
- Wood, M. D., Willits, R. K. Applied electric field enhances DRG neurite growth: influence of stimulation media, surface coating and growth supplements. J Neural Eng. 6 (4), 046003 (2009).
- Kucerova, R., et al. The role of electrical signals in murine corneal wound re-epithelialization. J Cell Physiol. 226 (6), 1544-1553 (2011).
- Sillman, A. L., Quang, D. M., Farboud, B., Fang, K. S., Nuccitelli, R., Isseroff, R. R. Human Dermal fibroblasts do not exhibit directional migration on collagen I in direct-current electric fields of physiological strength. Exp Dermatol. 12 (4), 396-402 (2003).
- Allen, G. M., Mogilner, A., Theriot, J. A. Electrophoresis of cellular membrane components creates the directional cue guiding keratocyte galvanotaxis. Curr Biol. 23 (7), 560-568 (2013).
- Nishimura, K. Y., Isseroff, R. R., Nuccitelli, R. Human keratinocytes migrate to the negative pole in direct current electric fields comparable to those measured in mammalian wounds. J Cell Sci. 109 (1), 199-207 (1996).
- Farboud, B., Nuccitelli, R., Schwab, I. R., Isseroff, R. R. DC electric fields induce rapid directional migration in cultured human corneal epithelial cells. Exp Eye Res. 70 (5), 667-673 (2000).
- Fang, K. S., Ionides, E., Oster, G., Nuccitelli, R., Isseroff, R. R. Epidermal growth factor receptor relocalization and kinase activity are necessary for directional migration of keratinocytes in DC electric fields. J Cell Sci. 112 (12), 1967-1978 (1999).
- Li, J., et al. Activated T lymphocytes migrate toward the cathode of DC electric fields in microfluidic devices. Lab Chip. 11 (7), 1298-1304 (2011).
- Meng, X., Arocena, M., Penninger, J., Gage, F. H., Zhao, M., Song, B. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp Neurol. 227 (1), 210-217 (2011).
- Wu, D., Ma, X., Lin, F. DC Electric Fields Direct Breast Cancer Cell Migration, Induce EGFR Polarization, and Increase the Intracellular Level of Calcium Ions. . Cell Biochem Biophys. 67 (3), 1115-1125 (2013).
- Martin-Granados, C., et al. A role for PP1/NIPP1 in steering migration of human cancer cells. PLoS One. 7 (7), 40769 (2012).
- Yang, H. Y., Charles, R. P., Hummler, E., Baines, D. L., Isseroff, R. R. The epithelial sodium channel mediates the directionality of galvanotaxis in human keratinocytes. J Cell Sci. 126 (9), 1942-1951 (2013).
- Zhao, M., et al. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442 (7101), 457-460 (2006).
- Shanley, L. J., Walczysko, P., Bain, M., MacEwan, D. J., Zhao, M. Influx of extracellular Ca2+ is necessary for electrotaxis in Dictyostelium. J Cell Sci. 119 (22), 4741-4748 (2006).
- Zhao, M., Agius-Fernandez, A., Forrester, J. V., McCaig, C. D. Directed migration of corneal epithelial sheets in physiological electric fields. Invest Ophthalmol Vis Sci. 37 (13), 2548-2558 (1996).
- Peng, H. B., Jaffe, L. F. Polarization of fucoid eggs by steady electrical fields. Dev Biol. 53 (2), 277-284 (1976).
- Lee, M., et al. Characterization of adult human prostatic epithelial-cells immortalized by polybrene-induced DNA transfection with a plasmid containing an origin-defective sv40-genome. Int J Oncol. 4 (4), 821-830 (1994).
- Berthon, P., Cussenot, O., Hopwood, L., Leduc, A., Maitland, N. Functional expression of sv40 in normal human prostatic epithelial and fibroblastic cells - differentiation pattern of non-tumorigenic cell-lines. Int J Oncol. 6 (2), 333-343 (1995).
- Aurich-Costa, J., Vannier, A., Grégoire, E., Nowak, F., Cherif, D. IPM-FISH, a new M-FISH approach using IRS-PCR painting probes: application to the analysis of seven human prostate cell lines. Genes Chromosomes Cancer. 30 (2), 143-160 (2001).
- Tyson, D. R., Inokuchi, J., Tsunoda, T., Lau, A., Ornstein, D. K. Culture requirements of prostatic epithelial cell lines for acinar morphogenesis and lumen formation in vitro: role of extracellular calcium. Prostate. 67 (15), 1601-1613 (2007).
- Lang, S. H., Sharrard, R. M., Stark, M., Villette, J. M., Maitland, N. J. Prostate epithelial cell lines form spheroids with evidence of glandular differentiation in three-dimensional Matrigel cultures. Br J Cancer. 85 (4), 590-599 (2001).
- Babona-Pilipos, R., Popovic, M. R., Morshead, C. M. A galvanotaxis assay for analysis of neural precursor cell migration kinetics in an externally applied direct current electric field. J Vis Exp. (68), (2012).
- Meng, X., et al. Electric field-controlled directed migration of neural progenitor cells in 2D and 3D environments. J Vis Exp. (60), (2012).
- Pullar, C. E., Isseroff, R. R. Cyclic AMP mediates keratinocyte directional migration in an electric field. J Cell Sci. 118 (9), 2023-2034 (2005).
- Sheridan, D. M., Isseroff, R. R., Nuccitelli, R. Imposition of a physiologic DC electric field alters the migratory response of human keratinocytes on extracellular matrix molecules. J Invest Dermatol. 106 (4), 642-646 (1996).
- Feng, J. F., et al. Guided migration of neural stem cells derived from human embryonic stem cells by an electric field. Stem Cells. 30 (2), 349-355 (2012).
- Mukerjee, E. V., Isseroff, R. R., Nuccitelli, R., Collins, S. D., Smith, R. L. Microneedle array for measuring wound generated electric fields. Conf Proc IEEE Eng Med Biol Soc. 1, 4326-4328 (2006).
- Nuccitelli, R., Nuccitelli, P., Li, C., Narsing, S., Pariser, D. M., Lui, K. The electric field near human skin wounds declines with age and provides a noninvasive indicator of wound healing. Wound Rep. and Reg. 19, 645-655 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados