Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verwendung Maßgeschneiderte Galvanotaxis Chambers zu Directional Migration Studie von Prostatazellen
In diesem Artikel
Zusammenfassung
We present a method to apply a physiological electric field to migrating, immortalized prostate cells in a custom-made galvanotaxis chamber. Using this method, we demonstrate that 2 lines of non-tumorigenic prostate cells demonstrate different degrees of migration directionality in the field.
Zusammenfassung
Die physiologische elektrische Feld dient spezifische biologische Funktionen, wie zB die Leitung der Zellmigration in der Embryonalentwicklung, neuronale Auswachsen und epithelialen Wundheilung. Anlegen eines Gleichstromfeldes, um kultivierte Zellen in vitro induziert gerichteten Zellmigration oder Galvanotaxis. Die 2-dimensionalen Galvanotaxis Verfahren wir hier zeigen, wird mit maßgeschneiderten Poly (vinylchlorid) (PVC) Kammern, Glasoberfläche, Platin-Elektroden und der Verwendung eines motorisierten Tisch, auf dem die Zellen abgebildet werden modifiziert. Die PVC-Kammern und Platinelektroden eine geringe Zytotoxizität und sind erschwinglich und wiederverwendbare. Die Glasoberfläche und der motorisierten Mikroskoptisch zur Verbesserung der Qualität der Bilder und lassen mögliche Änderungen an der Glasoberfläche und Anwendungen zu den Zellen. Wir filmten die Galvanotaxis von zwei nicht-tumor, SV40-immortalisierten Prostata-Zelllinien, PRNs-1-1 und PNT2. Diese beiden Zelllinien zeigen ähnliche Migrationsgeschwindigkeiten und beide wandern zudie Kathode, aber sie zeigen ein unterschiedliches Maß an Richtwirkung in Galvanotaxis. Die über dieses Protokoll erhaltenen Ergebnisse deuten darauf hin, dass die PRN-1-1 und die PNT2 Zelllinien können unterschiedliche intrinsische Eigenschaften, die ihren Richtungsmigrations Antworten zu regieren.
Einleitung
Endogene elektrische Felder in verschiedenen Geweben, wie der Haut 1, 32, 33 und Gehirn 2 detektiert. Die physiologischen elektrischen Feldes dient spezifische biologische Funktionen, einschließlich Leiten Embryonalentwicklung 3, 4, Führen des Auswachsen von neuronalen Prozessen 5, 6 und Förderung Epithel- und Hornhautwundverschluss 1, 7. In vitro-Anwendung eines elektrischen Gleichstromfeldes an kultivierte Zellen ahmt die physiologischen elektrischen Feld und induziert Richtungszellmigration oder Galvanotaxis. Galvanotaxis in Fibroblasten 8, Fisch Keratinozyten 9, humanen epithelialen und Hornhaut Keratinozyten 10-12 untersucht worden, Lymphozyten 13, Neuroblasten 2 und neuronale Vorläuferzellen 14. Wenn zu dem angelegten Feld ausgesetzt sind, die Mehrzahl der untersuchten Zellen wandern gerichtet in Richtung der kathodenseitigen Pol (-). Dennoch verschiedenen Krebszellen, einschließlich hochmetastatischmenschliche Brustkrebszellen, und der menschliche Prostatakrebs-Zelllinie PC-3M, zu bewegen, um die anodenseitige Pol (+) 15, 16. Verschiedene Mechanismen sind vorgeschlagen Galvanotaxis vermitteln oder die Fähigkeit der Zellen, um das elektrische Feld zu erfassen, einschließlich der Aktivierung erklären der EGF-Rezeptoren 12, die epithelialen Natriumkanals 17, PI3K und PTEN 18, und die Freisetzung von Calciumionen 15, 19. Der Mechanismus ist noch nicht vollständig verstanden, und es ist möglich, dass mehrere Signalwege in Galvanotaxis beteiligt.
Die 2-dimensionalen Galvanotaxis Verfahren wir hier zeigen, ist nützlich, um die gerichtete Migration von adhärenten, bewegliche Zellen zu charakterisieren, auf einzelne Zellmigration 10, 12, 17 oder Migration einer Lage von zusammenhängenden Zellen 18, 20. Diese Technik ist aus modifizierten überwachen Peng und Jaffe 21 und Nishimura et al. 10 mit maßgeschneiderten, klarem PVC Kammern mit herausnehmbaren coverslips erlaubt eine einfache Zellentnahme nach Galvanotaxis für die Sekundäranalyse, wie zum Beispiel Immunfluoreszenz-Bildgebung. Die Glasoberfläche der Galvanotaxis Kammern optischen kompatibel, was die Filmbildung bei hoher Vergrößerung und mit fluoreszenzmarkierten Zellen erlaubt. Es ermöglicht auch das experimentelle Design mit Modifizierung der Glasoberfläche, wie die Änderung der Oberflächenbeschichtung oder Ladungen. Spacer aus No. 1 Abdeckglas gebildet in den Kammern verwendet, um den Stromfluss in den Zellen zu minimieren; damit die Joulesche Erwärmung, die proportional zu dem Quadrat des Stromflusses ist, würden die Zellen nicht während des Experimentes hitzen. Die Verbindungs Agar Brücken verhindern einen direkten Kontakt der Elektroden mit den Zellen und Änderung des Mediums pH oder Ionenkonzentration während Galvanotaxis verhindern.
Zwei nicht-tumorigene menschliche Prostata-Zelllinien wurden hinsichtlich ihrer Galvanotaxis Reaktion in dieser Studie untersucht. Die PRNs-1-1 22 und 23 sind beide PNT2 SV40 immortalisierte, Wachstumsfaktor-abhängigen Zelllinien, welche die epithelialen Marker Cytokeratin 5, 8, 18 und 19 mit geringer oder keiner Expression des Prostata-spezifisches Antigen (PSA). Beide Zelllinien halten die polygonale Morphologie von normalen Epithelzellen, aber Chromosomenanomalie in Karyotypisierung 22, 24 festgestellt. Obwohl PRN-1-1 und PNT2 teilen ähnliche Verhaltensweisen in den meisten Experimenten zeigen sie Unterschiede bei der Bildung der Struktur und in azinösen Galvanotaxis. In einem 3-D-Matrix, Matrigel, die PRN-1-1 Zellen bilden Hohl acinar Strukturen mit Lumen ähnlich der normalen Prostatagewebe 25. Allerdings sind die PNT2 Zellen bilden feste Kügelchen ohne Lumen oder polarisierten Epithel 26. Die PRNs-1-1-Zellen eine höhere galvanotactic Antwort als die PNT2 in der aktuellen Studie zeigen auch. Die Korrelation zwischen der Bildung von acinar Struktur und Galvanotaxis in PRNs-1-1 schlägt vor, dass die galvanotactic Signale können eine Rolle bei der Organisation der pr spielenostate Drüsengewebe Bewegungen als Reaktion auf endogene elektrische Felder, und stellt weitere Merkmale, um zwischen diesen 2 Zelllinien unterscheiden.
Protokoll
1. Die Kultivierung Prostatazellen
- Kultur die PRNs-1-1 und PNT2 Prostata-Zellen auf 100 mm Kulturschalen in RPMI 1640 Medium mit 10% FBS und Antibiotika-Antimykotische ergänzt bei 37 ° C mit 5% CO 2. Aktualisieren Sie das Kulturmedium täglich, bis die Zellen bis zu 80% Konfluenz für die Galvanotaxis Experimente.
2. Montage Galvanotaxis Chambers
- Montage Unterkammern
- Wischen eines Kunststoff Galvanotaxis Kammer mit 2-Propanol. Übernehmen Sie die Meeressilizium Versiegelung rund um die kreisförmigen Öffnungen an der Unterseite einer Kammer mit einer Spritze und legen einen großen Deckglas (Abbildung 1). Verwenden Sie die Rückseite eines Baumwoll-Applikator, um das Deckglas nach unten drücken, und wischen Sie das überschüssige Kleber mit Wattestäbchen. Die kreisförmigen Öffnungen kann das Medium und elektrischer Strom über die Zellen zwischen den beiden inneren Medienspeicher zu fließen.
- Schneiden Sie ein kleines Deckglas 6 mm x 2 machen5 mm Abstandshalter mit einer Diamantspitze Marker.
- Drehen Sie die Kammer. Auftragen von 2 Streifen aus dem Silikonkleber mit einer Spritze und / oder einem Metallspatel um eine 10 mm x 25 mm Kanaloberfläche für die Zellanheftung zwischen den kreisförmigen Öffnungen 2 an der unteren Glas erstellen. Kleben Sie zwei Stücke aus Glas Abstandhalter zwischen den zwei kreisförmigen Öffnungen. Benutzen Sie die Rückseite der Watte sich die Abstandshalter zu schieben und wischen Sie das überschüssige Kleber mit Wattestäbchen und / oder Zahnstocher.
- Trocknen Sie die Kammer für 24 Stunden, bis die Silikonkleber ausgehärtet wird. Weichen Sie die Kammer mit destilliertem Wasser über Nacht, um die Essigsäure Rückstand aus der Kleber zu entfernen. Trocknen Sie die Kammer für den sofortigen Einsatz, oder die Kammer für eine spätere Verwendung gespeichert werden in einem sauberen Behälter.
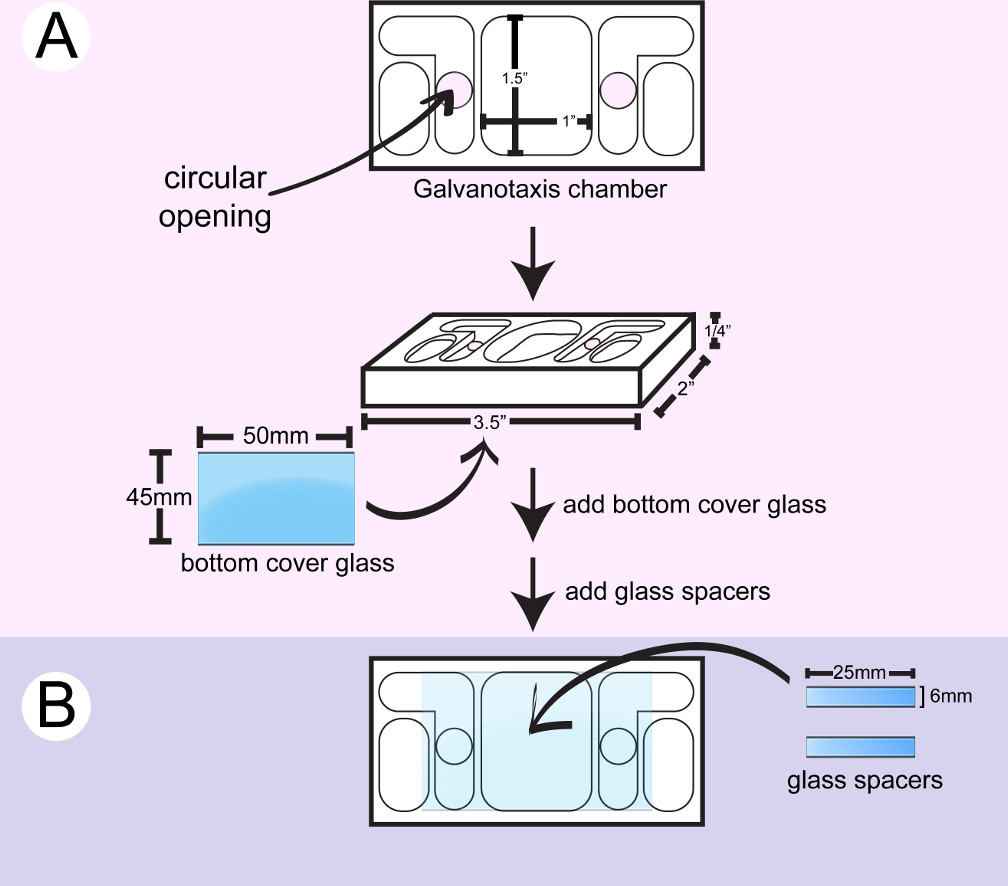
Abbildung 1: Montage des unteren Galvanotaxis Kammer. A) Eine große Deckglas wird auf den Boden eines Reinraums. B beigefügt) TWO Glasstücke Abstandshalter werden zwischen den kreisförmigen Öffnungen 2 verklebt, um eine 10 mm x 25 mm Kanal für Zellen zu befestigen erstellen.
- Seeding Zellen auf den Galvanotaxis Kammern
- Bereiten Sie die Anzahl der benötigen Galvanotaxis Kammern für das Experiment benötigt. Jede Zelllinie oder Behandlung erfordert einen einzelnen Galvanotaxis Kammer. Wischen Sie die Galvanotaxis Kammern mit 2-Propanol. Waschen Sie die Kammern mit sterilem PBS 3 mal und überprüfen Sie den Flüssigkeitsstrom zwischen den zwei kreisförmigen Öffnungen in den Kammern.
- Umschließen die Kammern in sterile Zellkulturschalen, und es ihnen ermöglichen, bei 37 ° C für 15 Minuten äquilibrieren. Trennen der mit Prostatazellen aus ihrem Kulturschale mit 5 ml 0,25% Trypsin-EDTA bei 37 ° C für 5 min. Neutralisieren die Trypsin-EDTA mit 5 ml 10% FBS in PBS.
- Übertragen der Zellen auf 15 ml-Röhrchen und Zentrifugieren der Zellen 5 min bei 200 × g, 37 ° C. Saugt den Überstand und resuspendiere die Zellen in 1 ml Kulturmedium.
- Nehmen Sie 20 μl der Zell-Lösung auf eine Zählkammer laden und berechnen Sie die Anzahl der Zellen. Stellen Sie die Zellkonzentration bis 8 × 10 4 Zellen / ml mit Kulturmedium.
- Nehmen Sie die Galvanotaxis Kammern aus dem 37 ° C-Inkubator. Seed 350 ul der Zellsuspension auf jeder Kammer.
- Die Zellen in der Kulturschale mit nassen Kimwipe oder in einer feuchten Kammer in den Inkubator bei 37 ° C mit 5% CO 2 inkubieren in den Kammern über Nacht.
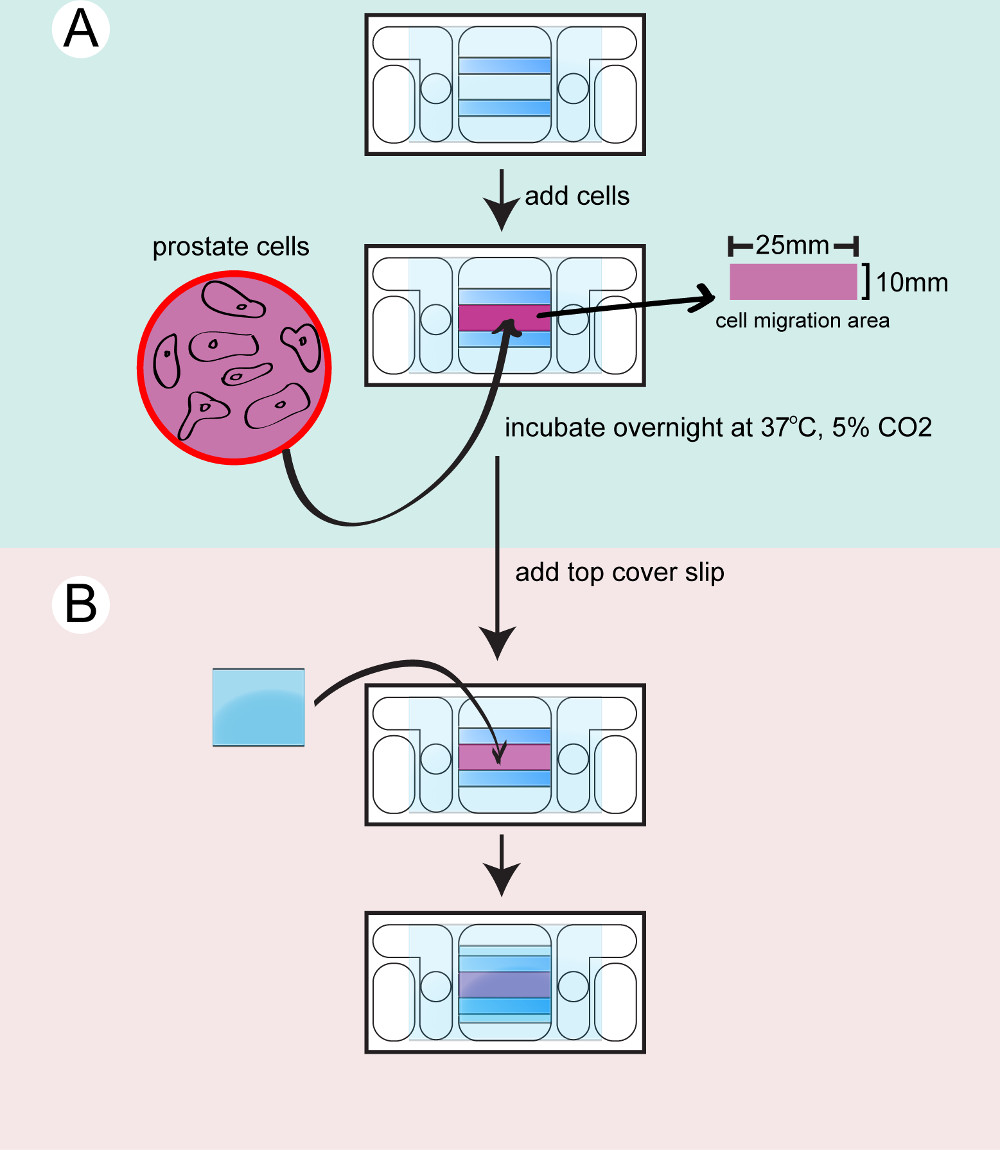
Abb. 2: Aussaat der Zellen in die Kammer der unteren Kammer wird getrocknet und gereinigt A) Prostata-Zellen trypsiniert, gezählt und in die Kammer überführt und über Nacht inkubiert B) Ein Top Deckglas angebracht ist, um die Kammer bevor die Dreharbeiten zu versiegeln...
- Assembling die oberen Kammern
- Montieren Sie die obere Kammer vor den Dreharbeiten. Das Mikroskop ist nur Platz Abbilden eines einzigen Galvanotaxis Kammer zu einer Zeit. Warm up 10 ml Kulturmedium bei 37 ° C für jeden Galvanotaxis Kammer. Übertragen einer Galvanotaxis Kammer aus den Brutkästen zu einer 37 ° C Warmhalteplatte.
- Spülen Sie die Zellen mit Kulturmedium, um die ungebundene Zellen zu entfernen. Leave 400 ul Medium in der Kammer. Mit einer Spritze Hochvakuumfett auf der Oberseite der beiden Glasabstandshalter anwenden.
- Fügen Sie eine kleine Deckglas, um die Kammer zu versiegeln. Drücken Sie vorsichtig das Deckglas mit der Rückseite eines Baumwoll-Applikator. Wischen Sie das überschüssige Medium mit Wattestäbchen.
- Trocknen Sie die Glasoberfläche und gelten Hochvakuumfett, um die Lücke zwischen dem Deckglas und der Kammer zu versiegeln. Verwenden Sie eine Metallspachtel, um das Fett zu verbreiten. 4 ml des Kulturmediums zu den inneren Behälter und überprüfen Sie den Flüssigkeitsstrom zwischen den Stauseen.
- Stellen AgarBrücken
- Schneiden Sie ein Paar 2-Zoll-langen PVC-Schlauch (ID 503/16 x 16.5 mm x 16.1 Wand), Flip und fügen Sie sie in einen 100-ml-Becher.
- Messung 200 mg Bacto-Agar und fügen in einem 50 ml-Kolben mit 10 ml Kulturmedium zu 2% Agargel machen. Mikrowelle für 30 Sekunden. Laden Sie die Agar-Gel auf den Kunststoffschlauch mit einer Transferpipette. Lassen Sie die Agar-Brücken bei Raumtemperatur für 10 Minuten, um den Agar verfestigt.
- 2 ml Kulturmedium zu den Außenbehälter des Galvanotaxis Kammer. Legen Sie die Agar-Brücken zu den inneren und äußeren Medienspeicher, um den Strom zu leiten.
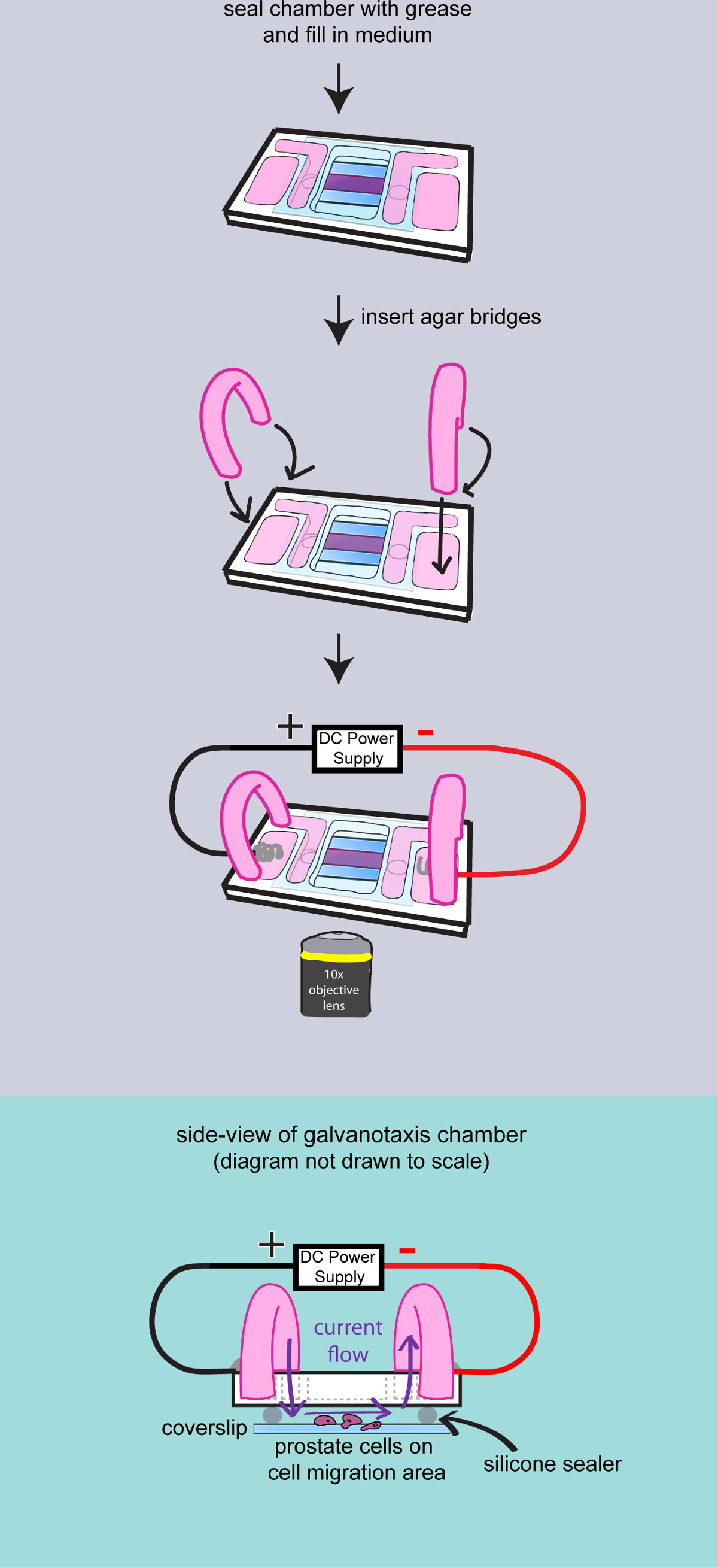
Fig. 3: Dreh die Zellen an der Kammer ein Diagramm, um die Endmontage des Galvanotaxis Kammer demonstrieren. Die Kammer ist komplett mit Hochvakuumfett abgedichtet. Medium hinzugefügt to füllen die Stauseen und zwei Agar Brücken in die Kammer eingeführt wird. Dann wird die Galvanotaxis Kammer auf den Mikroskoptisch übertragen, und die Elektroden angebracht sind, um das elektrische Feld anzulegen. Seitenansicht des zusammengebauten Galvanotaxis Kammer gezeigt, um zu zeigen, dass der elektrische Strom in den Zellen durch die Agar-Brücken und der Raum zwischen dem Deckglas.
3. Zeitraffer-Imaging
- Einschalten der Klimakammer auf 37 ° C mit 5% CO 2 in der zirkulierenden Luft 2 h vor der Bilderzeugung.
- Schalten Sie das Mikroskop und starten Sie die Bilderfassungssoftware. Kalibrieren Sie den Mikroskoptisch und wählen Sie die 10X-Objektiv.
- Übertragen Sie die Galvanotaxis Kammern mit dem Mikroskoptisch, sichern Sie die Kammer mit Klebeband und konzentrieren sich auf den Zellen. Setzen Sie die Galvanotaxis Elektroden an den Außenbehälter mit Kathode auf der rechten Seite. Sichern Sie die Kabel und die Elektroden mit Klebeband.
- Schalten Sie die Strom box, ein elektrisches Feld an die Kammer anzuwenden. Die Ausgangsspannung mit dem Spannungsmesser über die Kammer auf 2,5 Volt für die 25 mm lange Kammer (100 mV / mm) erreichen. Pflegen Sie die Feldstärke während des Experiments durch Anpassung des Ausgangsstroms.
- Wählen Sie 10 Punkte über die Kammer in der Software zu filmen zu zehn Zeitraffer-Filme erstellen. Richten Sie die Aufnahmebedingungen im 10-Minuten-Intervallen für 2 Stunden.
- Starten Dreharbeiten und stellen Sie den Ausgangsstrom je nach Bedarf.
- Am Ende des Experiments, entfernen Sie die Kammer von der Bühne aus und fixieren Sie die Zellen mit 95% Alkohol. Brechen Sie den offenen Kammer mit einer Rasierklinge zu reinigen und wieder verwenden.
4. Quantifizierung Galvanotaxis
- Drehen Sie die Zeitraffer-Filme und neu orientieren die Kathode an die Spitze der Bilder. Exportieren Sie die Filme auf die Zelle-Tracking-Software.
- Manuell verfolgen die (x, y) Position 10-20 Zellen bei jedem Zeitpunkt von jedem Film (Abbildung 4 A, B).Die Migrationsabstände und die Winkel in Bezug auf die Nord-Süd-Richtung, die gleiche Ausrichtung des elektrischen Feldes in der Zelle Verfolgungssoftware (4C) berechnet werden.
HINWEIS: Die durchschnittliche Wanderungsgeschwindigkeit wird von der Gesamtlaufstrecke und Gesamtdreharbeiten Zeit konvertiert. Die Laufrichtung wird von den quer zu dem Kosinus Wert umgewandelt. Wenn Zellen wandern mit zufälliger Ausrichtung, wird der Durchschnitt der Umlauf Cosinus nahe Null sein. Wenn die Zellen wandern direkt zu der Kathode, wird die Kosinuswert +1 sein. Wenn die Zellen wandern direkt zu der Anode wird der Cosinus-Wert -1 ist.
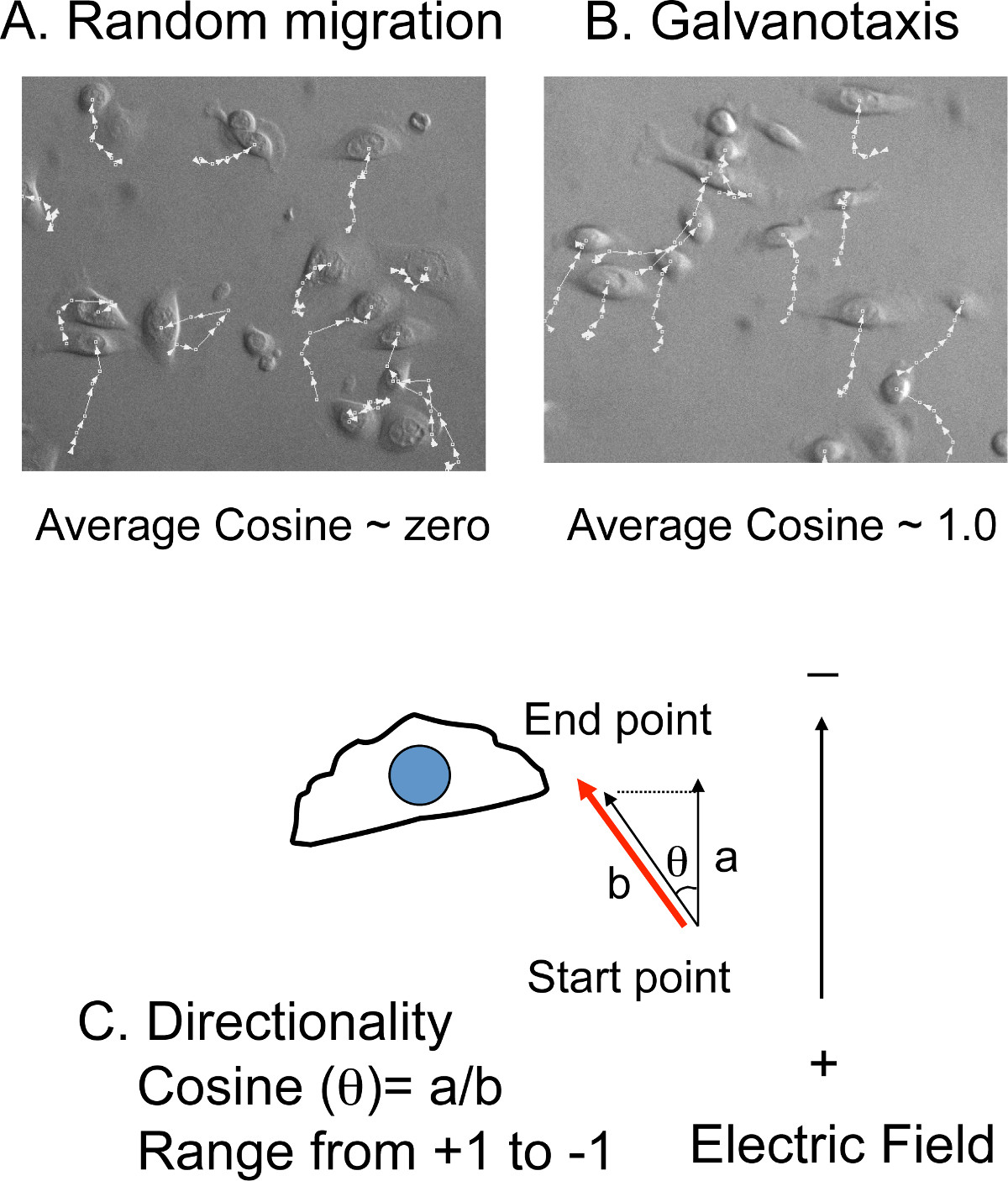
Abbildung 4: Zellverfolgung zu Direktionalität messen A) Überlagerung der Spurlinien mit Zellbildern.. Die (x, y) -Positionen der Zellen manually im Zeitraffer-Filmen verfolgt. . Wenn die Zellen wandern zufällig ist die mittlere Kosinus nahe Null B) Wenn jedoch die Zellen wandern in Richtung der Kathode oder der Anode, ist der Wert des durchschnittlichen Cosinus nahe + (Kathode) - oder. (Anode) 1.0 C ) Die Laufrichtung wird durch den Kosinus-Wert, der aus den Migrationswinkel (θ) umgewandelt wird, dargestellt. Der Kosinus (θ) gleich dem Verhältnis des Abstandes a (die Migrationsdistanz) auf Abstand b (der Abstand zu der Richtung des elektrischen Feldes projiziert).
- Speichern Sie die Messungen. Importieren der Daten in eine Datenbankanwendung, die kombinierten Ergebnisse zu berechnen.
- Exportieren Sie die kombinierten Daten der durchschnittlichen Wanderungsgeschwindigkeit und Durchschnitts Kosinuswert in eine Tabellenkalkulation, um die Balkendiagramme (Abbildung 5) zu zeichnen.
Ergebnisse
Zwei Linien der Prostatazellen (PRNs-1-1 und PNT2) wurden mit dieser Methode untersucht. Zellen in beiden Leitungen wandern bei ähnlichen Geschwindigkeiten von 1,0 +/- 0,3 um / min im Verlauf von 2-Stunden (5A). , Die Direktionalität zu dem elektrischen Feld ist jedoch 0,7 +/- 0,3 für das PRN-1-1 Linie und 0,2 +/- 0,8 für die PNT2 Leitung (5B). Die Ergebnisse zeigen einen signifikanten Unterschied in der Galvanotaxis dieser beiden Zelllinien (p <0,01, 100-Zellen wurden verfolgt),...
Diskussion
Die Analyse der Galvanotaxis Reaktion einer Zelle ist ein wichtiger Funktionsanzeige für viele zelluläre Migrations oder Wachstumsprozesse 27, 28. Hier nutzen wir eine maßgeschneiderte Kammer mit Glasoberfläche, um zwei Prostata-Zelllinien zu filmen. Diese Zellinien zeigten unterschiedliche Grade der Galvanotaxis, und wir vermuten, dass die intrazelluläre Lokalisierung oder die Aktivierung der Galvanotaxis vermittelnde Proteine könnte während des Prozesses der Erzeugung der unsterblichen Zelllini...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Die Prostata-Zelllinien werden freundlicherweise von Dr. Ling-Yu Wang und Dr. Hsing-Jien Kung bei Cancer Center, UC Davis zur Verfügung gestellt. Dieses Projekt wird von NIH Galvanotaxis Zuschuss 4R33AI080604 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Cells | |||
| pRNS-1-1 prostate cells | Lee, et al. (1994) | ||
| PNT2 prostate cells | Sigma-Aldrich | 95012613-1VL | Berthon, et al. (1995) |
| Medium and solutions | |||
| RPMI 1640 medium | Invitrogen | 11875-093 | warm up to 37 °C before use |
| Fetal Bovine Serum - Premium | Atlanta Biologicals | S11150 | 10% in PBS, warm up to 37 °C before use |
| Antibiotic-Antimycotic (100x) | Life Technologies | 15240 | add 5 ml to 500 ml medium |
| 2-propanol | VWR | BDH1133-5GL | |
| PBS | - | - | 137 mM NaCl, 2.7 mM KCl, 4.3 mM Na2HPO4 and 1.5 mM KH2PO4 in 1,000 ml of H2O, pH to 7.4 and autoclaved, warm up to 37 °C before use |
| 0.25% Trypsin-EDTA | Invitrogen | 25200-056 | warm up to 37 °C before use, treat cells for 3-5 min at 37 °C |
| Galvanotaxis device | |||
| Galvanotaxis chambers | Precision Plastics Inc, CA | Custom-designed (1/4" x 2" x 3.5"), non-toxic, clear PVC chambers. Please contact the authors for the design specs. | |
| Galvanotaxis electrodes | UCD electric shop | platinum coiled electrodes with flexable cords | |
| Galvanotaxis power box | Substrate Engineering, CA | custom-designed DC power output with voltmeter | |
| Microscope Cover Glass, Large, 45 x 50 mm, No. 1.5 | Fisher | 12-544-F | |
| Microscope Cover Glass, small, 25 x 25 mm, No. 1 | ThermoScientific | 3307 | |
| Diamond point marker | ThermoScientific | 750 | |
| Marine grade silicon sealer, clear | 3M | 051135-08019 | |
| High vacuum grease | Dow Corning | 2021846-0807 | |
| 6 ml syringe | Fisher Scientific | 05-561-64 | |
| Nichiryo Syringe, 1.5 ml | Nichiryo | SG-M | |
| Cotton applicators | Purtian Medical Products | 806-WC | |
| Qtips | Johnson & Johnson | 729389 | |
| Nalgene 180 PVC tubing | Nalgene | 8000-9030 | 503/16 ID x 5/16 OD x 1/16 Wall |
| Bacto-Agar | Difco | 0140-01 | make 2% agar solution |
| Razor Blade | Personna | 74-0001 | |
| Equipments and Software | |||
| Benchtop Centrifuge | Eppendorf | 5810R | operated with an A-4-62 rotor |
| Cellometer Auto T4 | Nexcelom | Auto T4 | |
| Cellometer counting chambers | Nexcelom | CHT4-SD100-002 | load 20 μl cell solutions to count |
| Culture Temp Warming plate | Bel-Art Scienceware | 370150000 | to keep the galvanotaxis chambers at 37 °C |
| Eclipse TE-2000 microscope with motorized stage and environmental chamber | Nikon | ||
| Plan Fluor 10X/0.30 objective len | Nikon | ||
| Retiga EX CCD camera | Qimaging | Cooled CCD camara, mono-color, 12-bit | |
| Compressed air with 5% CO2 | Airgas | special order | |
| Volocity 6.3 | PerkinElmer | Image acquiring software | |
| Improvision OpenLab 5.5.2 | PerkinElmer | Cell tracking software and customized to measure migration angles | |
| FileMaker Pro Advanced, 8.0 | FileMaker | ||
| Microsoft Excel 2008 for Mac | Microsoft | ||
Referenzen
- Reid, B., Nuccitelli, R., Zhao, M. Non-invasive measurement of bioelectric currents with a vibrating probe. Nat Protoc. 2 (3), 661-669 (2007).
- Cao, L., et al. Endogenous electric currents might guide rostral migration of neuroblasts. EMBO Rep. 14 (2), 184-190 (2013).
- Hotary, K. B., Robinson, K. R. Endogenous electrical currents and voltage gradients in Xenopus embryos and the consequences of their disruption. Dev Biol. 166 (2), 789-800 (1994).
- Hotary, K. B., Robinson, K. R. Evidence of a role for endogenous electrical fields in chick embryo development. Development. 114 (4), 985-996 (1992).
- Yamashita, M. Electric axon guidance in embryonic retina: galvanotropism revisited. Biochem Biophys Res Commun. 431 (2), 280-283 (2013).
- Wood, M. D., Willits, R. K. Applied electric field enhances DRG neurite growth: influence of stimulation media, surface coating and growth supplements. J Neural Eng. 6 (4), 046003 (2009).
- Kucerova, R., et al. The role of electrical signals in murine corneal wound re-epithelialization. J Cell Physiol. 226 (6), 1544-1553 (2011).
- Sillman, A. L., Quang, D. M., Farboud, B., Fang, K. S., Nuccitelli, R., Isseroff, R. R. Human Dermal fibroblasts do not exhibit directional migration on collagen I in direct-current electric fields of physiological strength. Exp Dermatol. 12 (4), 396-402 (2003).
- Allen, G. M., Mogilner, A., Theriot, J. A. Electrophoresis of cellular membrane components creates the directional cue guiding keratocyte galvanotaxis. Curr Biol. 23 (7), 560-568 (2013).
- Nishimura, K. Y., Isseroff, R. R., Nuccitelli, R. Human keratinocytes migrate to the negative pole in direct current electric fields comparable to those measured in mammalian wounds. J Cell Sci. 109 (1), 199-207 (1996).
- Farboud, B., Nuccitelli, R., Schwab, I. R., Isseroff, R. R. DC electric fields induce rapid directional migration in cultured human corneal epithelial cells. Exp Eye Res. 70 (5), 667-673 (2000).
- Fang, K. S., Ionides, E., Oster, G., Nuccitelli, R., Isseroff, R. R. Epidermal growth factor receptor relocalization and kinase activity are necessary for directional migration of keratinocytes in DC electric fields. J Cell Sci. 112 (12), 1967-1978 (1999).
- Li, J., et al. Activated T lymphocytes migrate toward the cathode of DC electric fields in microfluidic devices. Lab Chip. 11 (7), 1298-1304 (2011).
- Meng, X., Arocena, M., Penninger, J., Gage, F. H., Zhao, M., Song, B. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp Neurol. 227 (1), 210-217 (2011).
- Wu, D., Ma, X., Lin, F. DC Electric Fields Direct Breast Cancer Cell Migration, Induce EGFR Polarization, and Increase the Intracellular Level of Calcium Ions. . Cell Biochem Biophys. 67 (3), 1115-1125 (2013).
- Martin-Granados, C., et al. A role for PP1/NIPP1 in steering migration of human cancer cells. PLoS One. 7 (7), 40769 (2012).
- Yang, H. Y., Charles, R. P., Hummler, E., Baines, D. L., Isseroff, R. R. The epithelial sodium channel mediates the directionality of galvanotaxis in human keratinocytes. J Cell Sci. 126 (9), 1942-1951 (2013).
- Zhao, M., et al. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442 (7101), 457-460 (2006).
- Shanley, L. J., Walczysko, P., Bain, M., MacEwan, D. J., Zhao, M. Influx of extracellular Ca2+ is necessary for electrotaxis in Dictyostelium. J Cell Sci. 119 (22), 4741-4748 (2006).
- Zhao, M., Agius-Fernandez, A., Forrester, J. V., McCaig, C. D. Directed migration of corneal epithelial sheets in physiological electric fields. Invest Ophthalmol Vis Sci. 37 (13), 2548-2558 (1996).
- Peng, H. B., Jaffe, L. F. Polarization of fucoid eggs by steady electrical fields. Dev Biol. 53 (2), 277-284 (1976).
- Lee, M., et al. Characterization of adult human prostatic epithelial-cells immortalized by polybrene-induced DNA transfection with a plasmid containing an origin-defective sv40-genome. Int J Oncol. 4 (4), 821-830 (1994).
- Berthon, P., Cussenot, O., Hopwood, L., Leduc, A., Maitland, N. Functional expression of sv40 in normal human prostatic epithelial and fibroblastic cells - differentiation pattern of non-tumorigenic cell-lines. Int J Oncol. 6 (2), 333-343 (1995).
- Aurich-Costa, J., Vannier, A., Grégoire, E., Nowak, F., Cherif, D. IPM-FISH, a new M-FISH approach using IRS-PCR painting probes: application to the analysis of seven human prostate cell lines. Genes Chromosomes Cancer. 30 (2), 143-160 (2001).
- Tyson, D. R., Inokuchi, J., Tsunoda, T., Lau, A., Ornstein, D. K. Culture requirements of prostatic epithelial cell lines for acinar morphogenesis and lumen formation in vitro: role of extracellular calcium. Prostate. 67 (15), 1601-1613 (2007).
- Lang, S. H., Sharrard, R. M., Stark, M., Villette, J. M., Maitland, N. J. Prostate epithelial cell lines form spheroids with evidence of glandular differentiation in three-dimensional Matrigel cultures. Br J Cancer. 85 (4), 590-599 (2001).
- Babona-Pilipos, R., Popovic, M. R., Morshead, C. M. A galvanotaxis assay for analysis of neural precursor cell migration kinetics in an externally applied direct current electric field. J Vis Exp. (68), (2012).
- Meng, X., et al. Electric field-controlled directed migration of neural progenitor cells in 2D and 3D environments. J Vis Exp. (60), (2012).
- Pullar, C. E., Isseroff, R. R. Cyclic AMP mediates keratinocyte directional migration in an electric field. J Cell Sci. 118 (9), 2023-2034 (2005).
- Sheridan, D. M., Isseroff, R. R., Nuccitelli, R. Imposition of a physiologic DC electric field alters the migratory response of human keratinocytes on extracellular matrix molecules. J Invest Dermatol. 106 (4), 642-646 (1996).
- Feng, J. F., et al. Guided migration of neural stem cells derived from human embryonic stem cells by an electric field. Stem Cells. 30 (2), 349-355 (2012).
- Mukerjee, E. V., Isseroff, R. R., Nuccitelli, R., Collins, S. D., Smith, R. L. Microneedle array for measuring wound generated electric fields. Conf Proc IEEE Eng Med Biol Soc. 1, 4326-4328 (2006).
- Nuccitelli, R., Nuccitelli, P., Li, C., Narsing, S., Pariser, D. M., Lui, K. The electric field near human skin wounds declines with age and provides a noninvasive indicator of wound healing. Wound Rep. and Reg. 19, 645-655 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten