É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Utilizando a pedido de clientes Galvanotaxis Chambers para Estudar Direcional migração das células da próstata
Neste Artigo
Resumo
We present a method to apply a physiological electric field to migrating, immortalized prostate cells in a custom-made galvanotaxis chamber. Using this method, we demonstrate that 2 lines of non-tumorigenic prostate cells demonstrate different degrees of migration directionality in the field.
Resumo
O campo eléctrico fisiológico serve funções biológicas específicas, tais como dirigir a migração de células no desenvolvimento embrionário, crescimento neuronal e reparação epitelial. A aplicação de um campo eléctrico de corrente directa para células cultivadas in vitro, induz a migração de células direccional, ou galvanotaxis. O método galvanotaxis 2-dimensional demonstramos aqui é modificado com feito por encomenda poli (cloreto de vinilo) (PVC) câmaras, superfície de vidro, eléctrodos de platina e a utilização de uma fase motorizada no qual as células são criadas imagens. As câmaras de PVC e eletrodos de platina apresentam baixa toxicidade e são acessíveis e re-utilizável. A superfície de vidro e a platina motorizada microscópio melhorar a qualidade das imagens e permitir a possibilidade de alterar a superfície do vidro e tratamentos para as células. Filmamos o galvanotaxis de dois, linhas de células não-tumorais imortalizada com SV40 próstata, PRN-1-1 e PNT2. Estas duas linhas de células mostram velocidades de migração semelhantes e ambos migrar em direcçãocátodo, mas mostram um grau diferente de direcionalidade em galvanotaxis. Os resultados obtidos através deste protocolo sugerem que os PRN-1-1 e as linhas de células PNT2 podem ter diferentes características intrínsecas que governam as suas respostas migratórias direcionais.
Introdução
Campos eléctricos endógenos são detectados em vários tecidos, tais como pele, 1, 32, 33 e 2 cérebro. O campo eléctrico fisiológico serve funções biológicas particulares, incluindo a orientação desenvolvimento embrionário 3, 4, guiando o crescimento de processos neuronais 5, 6 e promoção do epitélio da córnea e o fechamento da ferida 1, 7. In vitro, a aplicação de um campo eléctrico de corrente directa para células cultivadas imita o campo elétrico fisiológico e induz a migração de células direcional, ou galvanotaxis. Galvanotaxis foi estudado em fibroblastos 8, queratinócitos de peixe 9, epitelial da córnea humana e queratinócitos 10-12, 13 linfócitos, 2, neuroblastos e as células progenitoras neuronais 14. Quando exposta ao campo aplicado, a maioria das células estudadas migrar direccionalmente para a catódica (-) pólo. No entanto, várias células cancerosas, incluindo altamente metastáticocélulas de cancro da mama humano e a linha de células de cancro da próstata humano PC-3M, mover-se para a anódica (+) pólo 15, 16. Vários mecanismos são propostos para mediar galvanotaxis ou para explicar a capacidade das células para detectar o campo eléctrico, incluindo a activação de receptores EGF 12, o canal de sódio epitelial 17, PI3K e PTEN 18, e liberação de íons cálcio 15, 19. O mecanismo ainda não é totalmente compreendido, e é possível que múltiplas vias de sinalização estão envolvidos em galvanotaxis.
O método galvanotaxis 2-dimensional demonstramos aqui é útil para caracterizar a migração direccional de aderente, células móveis, quer para controlar a migração de células individuais 10, 12, 17 ou migração de uma folha de células confluentes 18, 20. Esta técnica é uma modificação Peng e Jaffe 21, e Nishimura et al. 10 com câmaras de PVC feito por encomenda, claras, com coversl removívelips permitindo a recuperação de células fácil depois galvanotaxis para análise secundária, como a imagem de imuno-fluorescência. A superfície de vidro dos câmaras galvanotaxis óptico é compatível, o que permite que a película de alta ampliação e com células fluorescentemente marcado. Ele também permite que o desenho experimental com a modificação da superfície de vidro, como a alteração do revestimento de superfície ou encargos. Espaçadores feitos de uma lamela No. são usados nas câmaras para minimizar o fluxo de corrente sobre as células; Por conseguinte, o aquecimento por efeito de Joule, o que é proporcional ao quadrado da intensidade da corrente, não sobreaquecer as células durante a experiência. As pontes que ligam agar evitar o contato direto dos eletrodos com as células e evitar a mudança do meio de pH ou concentração de íons durante galvanotaxis.
Duas linhas de células de próstata humana não tumorigénicas foram examinadas quanto à sua resposta galvanotaxis neste estudo. Os PRN-1-1 22 e PNT2 23 são ambos SV40-imortalizada, de crescimento de linhas celulares dependentes de factores expressando os marcadores epiteliais citoqueratina 5, 8, 18 e 19 com pouca ou nenhuma expressão do antigénio específico da próstata (PSA). Ambas as linhas celulares manter a morfologia poligonal de células epiteliais normais, mas cromossoma anormalidade foi observada no cariótipo 22, 24. Embora PRN-1-1 e PNT2 partes comportamentos semelhantes na maior parte das experiências, eles mostram diferenças na formação de estrutura e nos ácinos galvanotaxis. Em uma matriz 3-D, Matrigel, os PRN-1-1 células formam estruturas acinares ocas com lumens que assemelham-se a próstata normal de tecido glandular 25. No entanto, as células PNT2 formar esferóides sólidos sem um lúmen ou epitélio polarizado 26. As células PRN-1-1 também demonstram uma resposta mais elevada do que a galvanotactic PNT2 no estudo corrente. A correlação entre a formação de estrutura e acinar galvanotaxis em PRN-1-1 sugere que os sinais galvanotactic pode desempenhar um papel na organização do prmovimentos dos tecidos glandulares ostate em resposta a campos elétricos endógenos, e fornece mais características de discriminar entre estes 2 linhas celulares.
Protocolo
1. A cultura da próstata Células
- Cultura A PRN-1-1 e PNT2 próstata células em placas de 100 mm de cultura em meio RPMI 1640 suplementado com 10% de FBS e Antibiótico-antimicótico a 37 ° C com 5% de CO 2. Refrescar o meio de cultura todos os dias até as células atingirem a confluência de 80% para as experiências galvanotaxis.
2. Montagem Galvanotaxis Chambers
- Montagem câmaras inferiores
- Wipe uma câmara galvanotaxis plástico com 2-propanol. Aplicar o selante de silicone de grau marinho em torno das aberturas circulares no lado inferior de uma câmara com uma seringa e fixar uma grande lamela (Figura 1). Use a parte de trás de um aplicador de algodão para empurrar para baixo a lamela e limpe o excesso de cola com cotonetes. As aberturas circulares permitir que a forma e a corrente eléctrica para fluir sobre as células localizadas entre os dois reservatórios internos médios.
- Corte uma pequena lamela para fazer 6 mm x 25 espaçadores mm com um marcador de ponta de diamante.
- Vire a câmara. Aplicar duas bandas da cola de silicone com uma seringa e / ou uma espátula de metal para criar uma superfície de canal x 25 mm 10 mm para a fixação das células entre as duas aberturas circulares no fundo de vidro. Cole dois pedaços de vidro espaçador entre as duas aberturas circulares. Use a parte de trás dos aplicadores de algodão para empurrar para baixo os espaçadores e limpe o excesso de cola com cotonetes e / ou palitos de algodão.
- Seca-se a câmara durante 24 horas até que a cola de silicone é curado. Embeber a câmara em água destilada durante a noite para remover o resíduo de ácido acético a partir da cola. Seque a câmara para uso imediato, ou armazenar a câmara para uso posterior em um recipiente limpo.
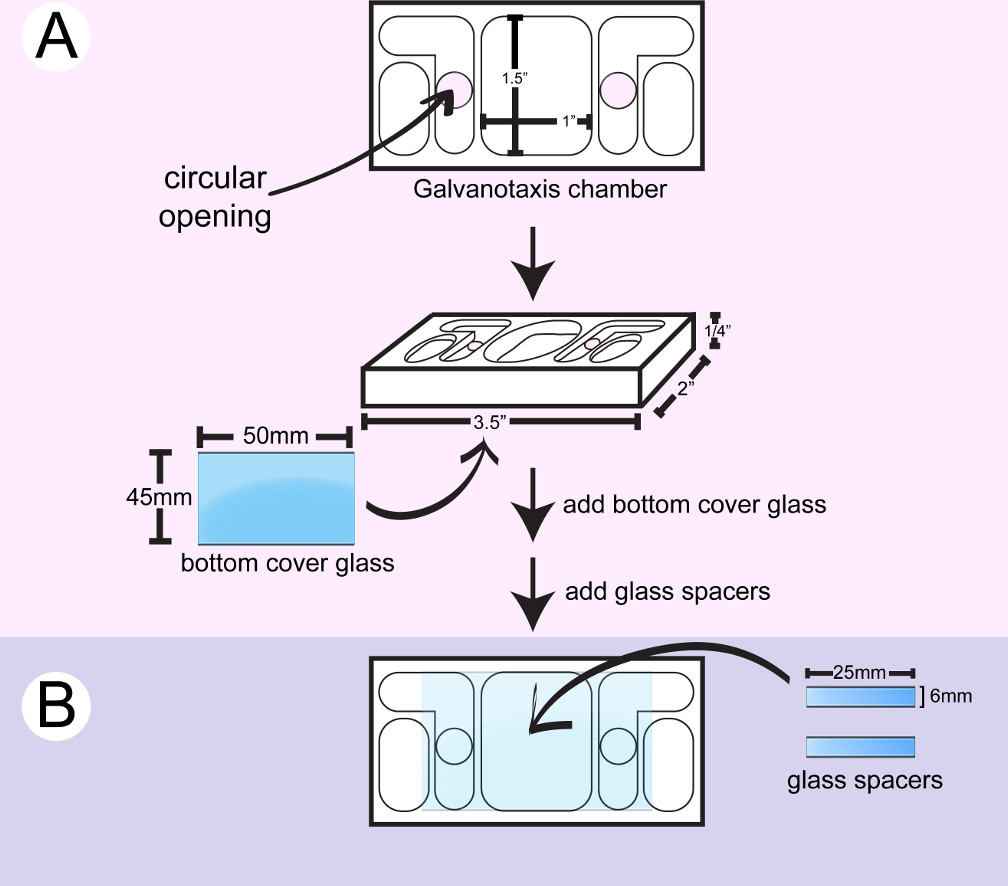
Figura 1: Assembleia da câmara na parte inferior galvanotaxis. A) Um grande lamela está ligado ao fundo de uma câmara de limpeza. B) Two peças de espaçadores de vidro são coladas entre as duas aberturas circulares para criar a 10 mm x 25 milímetros canal para as células para anexar.
- Semeando células nas câmaras galvanotaxis
- Prepare o número de exigir câmaras galvanotaxis necessários para o experimento. Cada linha ou tratamento com células requer uma única câmara galvanotaxis. Limpe as câmaras galvanotaxis com 2-propanol. Lavam-se as câmaras estéreis com PBS 3 vezes e verificar o fluxo de líquido entre as duas aberturas circulares nas câmaras.
- Coloque as câmaras em pratos de cultura de células estéril e permitir que se equilibre a 37 ° C durante 15 min. Separar as células da próstata a partir da sua placa de cultura, utilizando 5 ml de 0,25% de Tripsina-EDTA a 37 ° C durante 5 min. Neutraliza-se a tripsina-EDTA, com 5 ml de 10% de FBS em PBS.
- Transferem-se as células para tubos de 15 ml e centrifugar as células durante 5 min a 200 x g, 37 ° C. Aspirar o sobrenadante e ressuspender as células em 1 ml de meio de cultura.
- Pegue 20 μl de solução de células para carregar para uma câmara de contagem e calcular o número de células. Ajustar a concentração de células a 8 x 10 4 células / ml com meio de cultura.
- Tome as câmaras galvanotaxis fora da 37 ° C incubadora. Semente de 350 ul da suspensão de células em cada câmara.
- Incubar as células nas câmaras durante a noite em placas de cultura com Kimwipe molhado ou em uma câmara de humidade na incubadora a 37 ° C com 5% de CO 2.
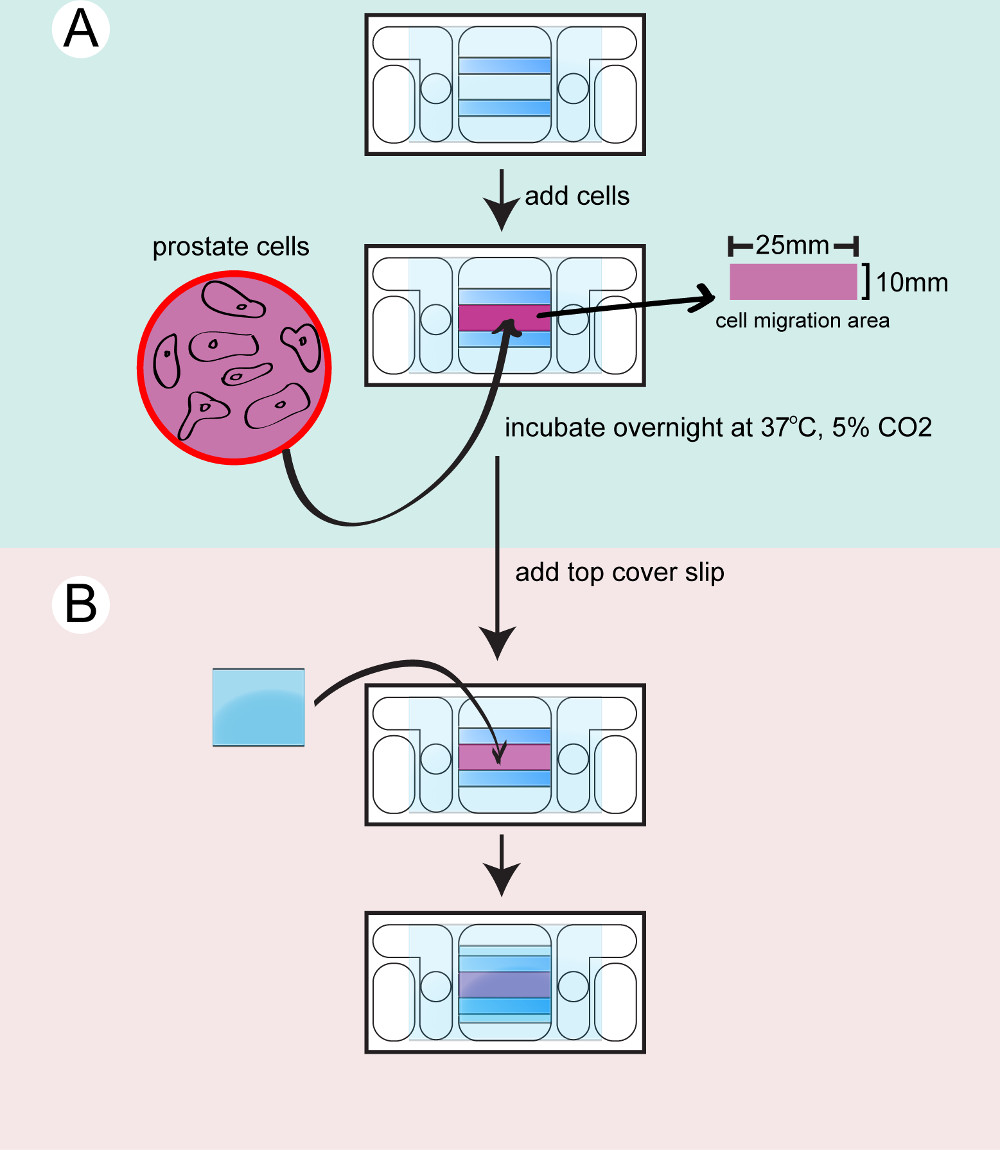
Figura 2:. Semear as células à câmara A câmara inferior é seco e limpo células A) da próstata são tripsinizadas, contadas e transferido para a câmara e incubou-se durante a noite B) Uma lamela superior está ligada para vedar a câmara antes de filmar...
- Assembling os melhores câmaras
- Monte a câmara superior antes das filmagens. O microscópio só pode acomodar imagiologia de uma única câmara de galvanotaxis de uma só vez. Aquecer-se 10 ml de meio de cultura a 37 ° C para cada câmara galvanotaxis. Transferir uma câmara galvanotaxis das incubadoras para a 37 ° C placa de aquecimento.
- Lavar as células com meio de cultura para remover as células não ligadas. Deixar a 400 ul de meio na câmara. Use uma seringa para aplicar alta graxa de vácuo no topo de ambos os espaçadores de vidro.
- Adicionar uma pequena lamela para vedar a câmara. Pressione suavemente a lamela com a parte de trás de um aplicador de algodão. Limpe o meio excesso com cotonetes.
- Seque a superfície do vidro e aplicar vácuo elevado graxa para vedar o espaço entre a lamela e a câmara. Use uma espátula de metal para espalhar a graxa. Adicionar 4 ml de meio de cultura para os reservatórios interno e verificar o fluxo de líquido entre os reservatórios.
- Faça agarpontes
- Corte um par de 2 polegadas tubo longo PVC (503/16 ID x 16/05 x 16/01 OD Wall), virar e inseri-los em um copo de 100 ml.
- Medir 200 mg de Bacto-Agar e adicioná-lo num frasco de 50 ml com 10 ml de meio de cultura para fazer 2% de gel de agar. Micro-ondas por 30 segundos. Carregar o gel de agar para o tubo de plástico com uma pipeta de transferência. Deixar as pontes de agar à temperatura ambiente durante 10 minutos para solidificar o agar.
- Adicionar 2 ml de meio de cultura para os reservatórios exteriores da câmara galvanotaxis. Inserir as pontes agar para os reservatórios interno e externo médio para conduzir a corrente.
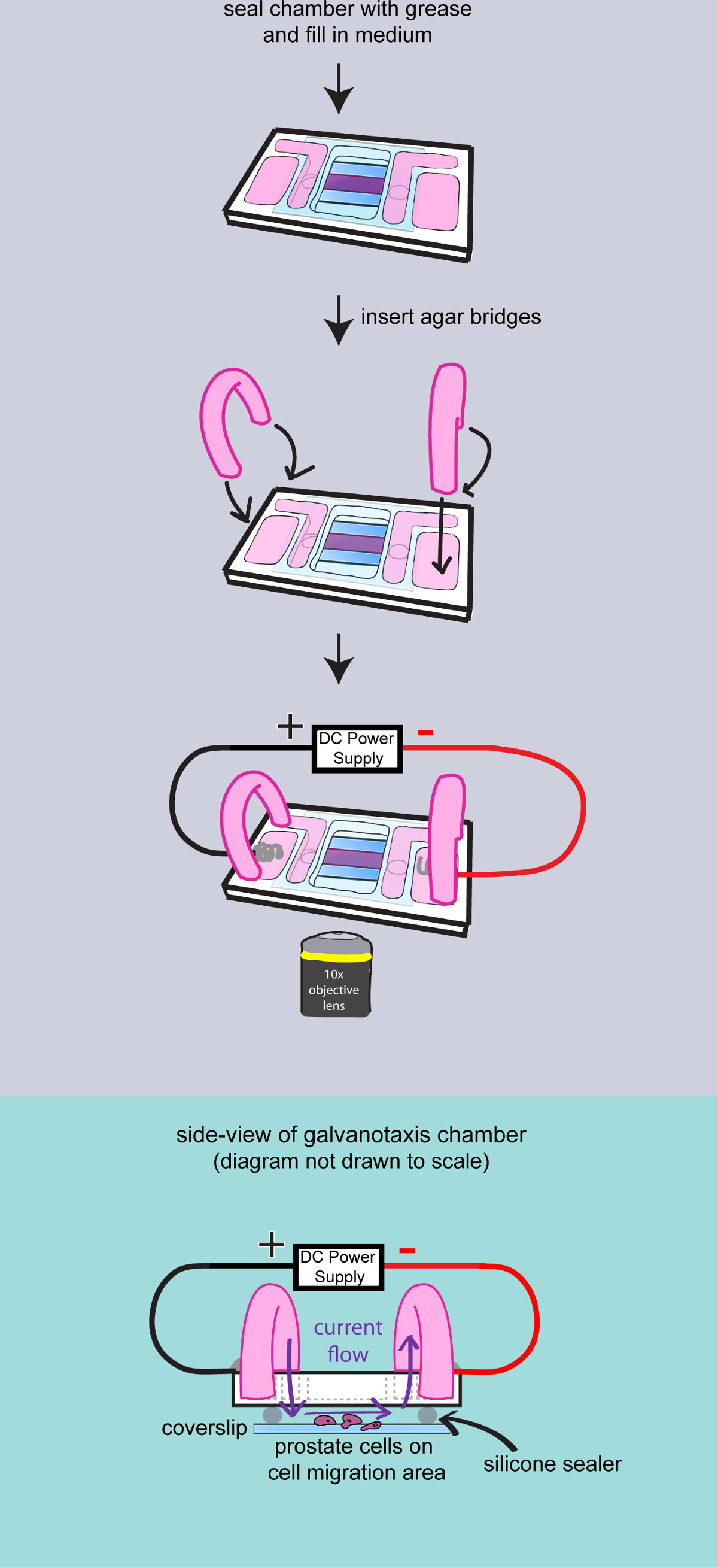
Figura 3:. Filmar as células na câmara de um diagrama para demonstrar a montagem final da câmara galvanotaxis. A câmara é completamente selado com graxa alto vácuo. O meio é adicionado to encher os reservatórios, e duas pontes de agar são inseridos dentro da câmara. Em seguida, a câmara de galvanotaxis é transferida para o estágio de microscópio e os eléctrodos estão ligados para aplicar o campo eléctrico. Vista lateral da câmara de galvanotaxis montado é mostrado para demonstrar que a corrente eléctrica flui através das células através das pontes de agar e o espaço entre o vidro de cobertura.
3. tempo-lapso
- Ligar a câmara ambiental a 37 ° C com 5% de CO 2 no ar circulante 2 h antes da imagiologia.
- Ligue o microscópio e iniciar o software de aquisição de imagem. Calibrar o estágio do microscópio e selecione a objetiva de 10X.
- Transfira as câmaras galvanotaxis ao palco microscópio, fixe a câmara com fita adesiva e concentrar-se nas células. Insira os eletrodos galvanotaxis para os reservatórios exteriores com cátodo no lado direito. Fixar o cabo e com os eléctrodos de fita.
- Ligue o bo poderx para aplicar um campo eléctrico para a câmara. Medir a tensão de saída com o voltímetro através da câmara para atingir 2,5 volts para a câmara longo de 25 mm (100 mV / mm). Manter a intensidade do campo durante a experiência, ajustando a corrente de saída.
- Selecione 10 pontos em toda a câmara de filmar no software para gerar dez filmes de lapso de tempo. Configurar as condições de aquisição em 10 minutos de intervalo, durante 2 horas.
- Iniciar filmagens e ajustar a corrente de saída, conforme necessário.
- No final da experiência, remover a câmara da fase e fixar as células com 95% de álcool. Quebre aberto a câmara com uma lâmina de barbear para limpar e reutilizá-lo.
4. Quantificação do Galvanotaxis
- Gire os filmes lapso de tempo e re-orientar o cátodo para o início das imagens. Exportar os filmes para o software de rastreamento de celular.
- Controlar manualmente a (x-y,) posição de 10-20 células em cada ponto de tempo a partir de cada filme (Figura 4 A, B).As distâncias de migração e os ângulos em relação à direcção norte-sul, a mesma orientação do campo elétrico, será calculado no software de rastreamento de celular (Figura 4C).
NOTA: A velocidade de migração média é convertida a partir da distância total migração e tempo total de filmagens. A direccionalidade é convertido a partir dos ângulos em relação ao valor de co-seno. Se as células migram com direcionalidade aleatória, a média de cosseno líquido será próximo de zero. Se as células migram directamente para o cátodo, o valor de co-seno será uma. Se as células migram directamente para o ânodo, o valor de co-seno será -1.
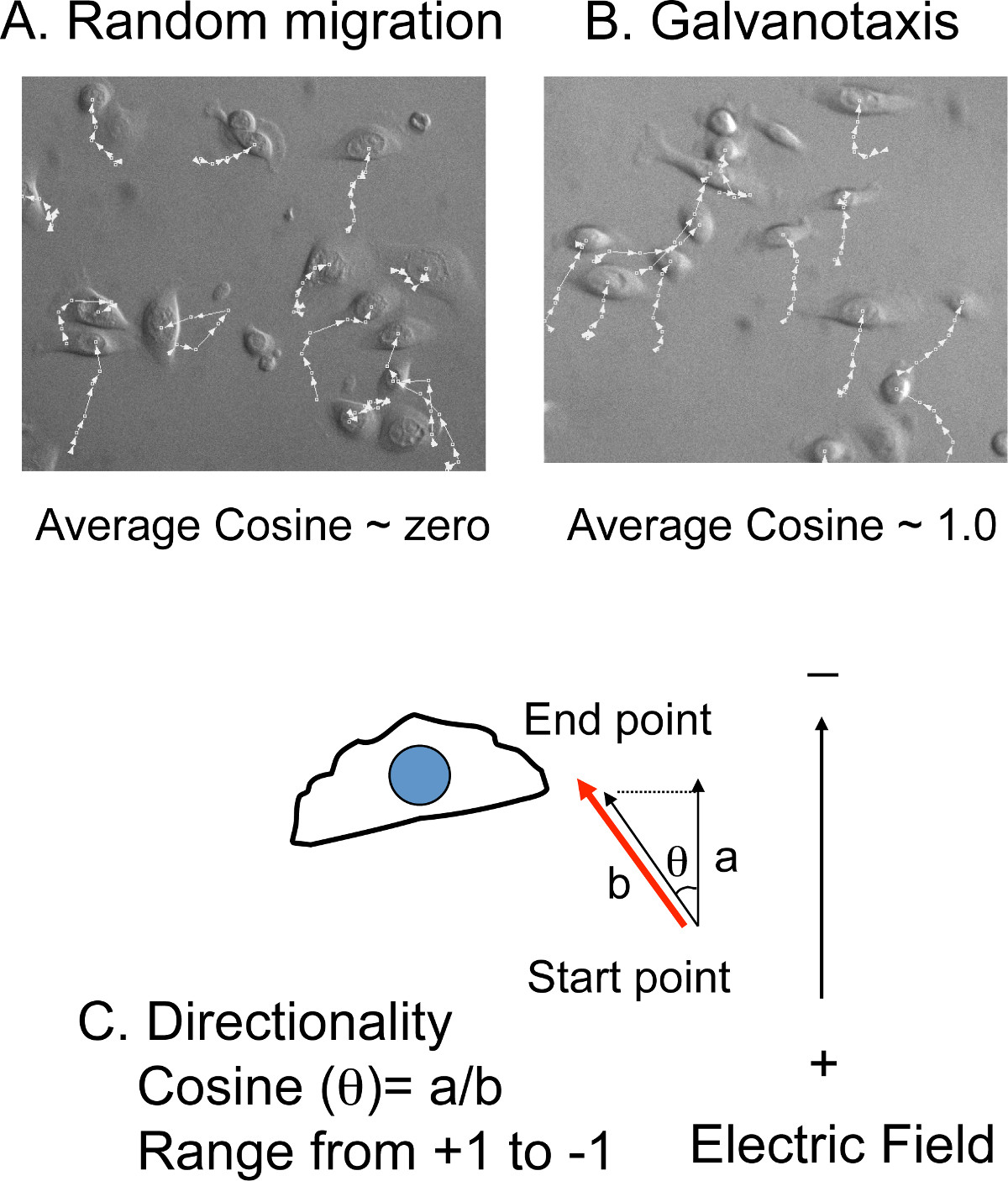
Figura 4: rastreamento de celular para medir a direcionalidade A) Sobreposição das linhas de monitoramento com imagens das células.. Os (x, y) as posições das células são manually rastreados nos filmes de lapso de tempo. . Se as células migram aleatoriamente, o cosseno médio é próximo de zero B) No entanto, se as células migram para o cátodo ou o ânodo, o valor do cosseno médio está próximo de + (cátodo) ou -. (Ânodo) 1,0 C ) A direccionalidade é apresentado pelo valor de co-seno, a qual é convertida a partir dos ângulos de migração (θ). A co-seno (θ) é igual à razão entre a distância A (a distância de migração) a distância b (a distância projectada para a direcção do campo eléctrico).
- Salve as medições. Importar os dados para uma aplicação de base de dados para calcular os resultados combinados.
- Exportar os dados combinados de média velocidade de migração e valor médio de co-seno de uma planilha para plotar os gráficos de barras (Figura 5).
Resultados
Duas linhas de células da próstata (PRN-1-1 e PNT2) foram investigadas com este método. As células em ambas as linhas de migrar a velocidades similares de 1,0 +/- 0,3 micra / min ao longo de 2 horas (Figura 5A). No entanto, o direccionamento para o campo eléctrico é de 0,7 +/- 0,3 para a PRN-linha 1-1, e 0,2 +/- 0,8 para a linha PNT2 (Figura 5B). Os resultados mostram uma diferença significativa na galvanotaxis destas duas linhas celulares (p <0,01, as células foram rastreado...
Discussão
A análise da resposta galvanotaxis de uma célula tem sido um importante indicador funcional para muitos migratório celular ou crescimento processa 27, 28. Aqui usamos uma câmara feito por encomenda com superfície de vidro para filmar duas linhas de células da próstata. Estas linhas de células demonstraram diferentes graus de galvanotaxis, e especula-se que a localização intracelular ou da activação das proteínas de mediar galvanotaxis pode ser interferido durante o processo de geração de linhas...
Divulgações
The authors have nothing to disclose.
Agradecimentos
As linhas de células de próstata são gentilmente cedido pelo Dr. Ling-Yu Wang e Dr. Hsing-Jien Kung no Centro de Câncer, UC Davis. Este projecto é financiado pelo NIH galvanotaxis concessão 4R33AI080604.
Materiais
| Name | Company | Catalog Number | Comments |
| Cells | |||
| pRNS-1-1 prostate cells | Lee, et al. (1994) | ||
| PNT2 prostate cells | Sigma-Aldrich | 95012613-1VL | Berthon, et al. (1995) |
| Medium and solutions | |||
| RPMI 1640 medium | Invitrogen | 11875-093 | warm up to 37 °C before use |
| Fetal Bovine Serum - Premium | Atlanta Biologicals | S11150 | 10% in PBS, warm up to 37 °C before use |
| Antibiotic-Antimycotic (100x) | Life Technologies | 15240 | add 5 ml to 500 ml medium |
| 2-propanol | VWR | BDH1133-5GL | |
| PBS | - | - | 137 mM NaCl, 2.7 mM KCl, 4.3 mM Na2HPO4 and 1.5 mM KH2PO4 in 1,000 ml of H2O, pH to 7.4 and autoclaved, warm up to 37 °C before use |
| 0.25% Trypsin-EDTA | Invitrogen | 25200-056 | warm up to 37 °C before use, treat cells for 3-5 min at 37 °C |
| Galvanotaxis device | |||
| Galvanotaxis chambers | Precision Plastics Inc, CA | Custom-designed (1/4" x 2" x 3.5"), non-toxic, clear PVC chambers. Please contact the authors for the design specs. | |
| Galvanotaxis electrodes | UCD electric shop | platinum coiled electrodes with flexable cords | |
| Galvanotaxis power box | Substrate Engineering, CA | custom-designed DC power output with voltmeter | |
| Microscope Cover Glass, Large, 45 x 50 mm, No. 1.5 | Fisher | 12-544-F | |
| Microscope Cover Glass, small, 25 x 25 mm, No. 1 | ThermoScientific | 3307 | |
| Diamond point marker | ThermoScientific | 750 | |
| Marine grade silicon sealer, clear | 3M | 051135-08019 | |
| High vacuum grease | Dow Corning | 2021846-0807 | |
| 6 ml syringe | Fisher Scientific | 05-561-64 | |
| Nichiryo Syringe, 1.5 ml | Nichiryo | SG-M | |
| Cotton applicators | Purtian Medical Products | 806-WC | |
| Qtips | Johnson & Johnson | 729389 | |
| Nalgene 180 PVC tubing | Nalgene | 8000-9030 | 503/16 ID x 5/16 OD x 1/16 Wall |
| Bacto-Agar | Difco | 0140-01 | make 2% agar solution |
| Razor Blade | Personna | 74-0001 | |
| Equipments and Software | |||
| Benchtop Centrifuge | Eppendorf | 5810R | operated with an A-4-62 rotor |
| Cellometer Auto T4 | Nexcelom | Auto T4 | |
| Cellometer counting chambers | Nexcelom | CHT4-SD100-002 | load 20 μl cell solutions to count |
| Culture Temp Warming plate | Bel-Art Scienceware | 370150000 | to keep the galvanotaxis chambers at 37 °C |
| Eclipse TE-2000 microscope with motorized stage and environmental chamber | Nikon | ||
| Plan Fluor 10X/0.30 objective len | Nikon | ||
| Retiga EX CCD camera | Qimaging | Cooled CCD camara, mono-color, 12-bit | |
| Compressed air with 5% CO2 | Airgas | special order | |
| Volocity 6.3 | PerkinElmer | Image acquiring software | |
| Improvision OpenLab 5.5.2 | PerkinElmer | Cell tracking software and customized to measure migration angles | |
| FileMaker Pro Advanced, 8.0 | FileMaker | ||
| Microsoft Excel 2008 for Mac | Microsoft | ||
Referências
- Reid, B., Nuccitelli, R., Zhao, M. Non-invasive measurement of bioelectric currents with a vibrating probe. Nat Protoc. 2 (3), 661-669 (2007).
- Cao, L., et al. Endogenous electric currents might guide rostral migration of neuroblasts. EMBO Rep. 14 (2), 184-190 (2013).
- Hotary, K. B., Robinson, K. R. Endogenous electrical currents and voltage gradients in Xenopus embryos and the consequences of their disruption. Dev Biol. 166 (2), 789-800 (1994).
- Hotary, K. B., Robinson, K. R. Evidence of a role for endogenous electrical fields in chick embryo development. Development. 114 (4), 985-996 (1992).
- Yamashita, M. Electric axon guidance in embryonic retina: galvanotropism revisited. Biochem Biophys Res Commun. 431 (2), 280-283 (2013).
- Wood, M. D., Willits, R. K. Applied electric field enhances DRG neurite growth: influence of stimulation media, surface coating and growth supplements. J Neural Eng. 6 (4), 046003 (2009).
- Kucerova, R., et al. The role of electrical signals in murine corneal wound re-epithelialization. J Cell Physiol. 226 (6), 1544-1553 (2011).
- Sillman, A. L., Quang, D. M., Farboud, B., Fang, K. S., Nuccitelli, R., Isseroff, R. R. Human Dermal fibroblasts do not exhibit directional migration on collagen I in direct-current electric fields of physiological strength. Exp Dermatol. 12 (4), 396-402 (2003).
- Allen, G. M., Mogilner, A., Theriot, J. A. Electrophoresis of cellular membrane components creates the directional cue guiding keratocyte galvanotaxis. Curr Biol. 23 (7), 560-568 (2013).
- Nishimura, K. Y., Isseroff, R. R., Nuccitelli, R. Human keratinocytes migrate to the negative pole in direct current electric fields comparable to those measured in mammalian wounds. J Cell Sci. 109 (1), 199-207 (1996).
- Farboud, B., Nuccitelli, R., Schwab, I. R., Isseroff, R. R. DC electric fields induce rapid directional migration in cultured human corneal epithelial cells. Exp Eye Res. 70 (5), 667-673 (2000).
- Fang, K. S., Ionides, E., Oster, G., Nuccitelli, R., Isseroff, R. R. Epidermal growth factor receptor relocalization and kinase activity are necessary for directional migration of keratinocytes in DC electric fields. J Cell Sci. 112 (12), 1967-1978 (1999).
- Li, J., et al. Activated T lymphocytes migrate toward the cathode of DC electric fields in microfluidic devices. Lab Chip. 11 (7), 1298-1304 (2011).
- Meng, X., Arocena, M., Penninger, J., Gage, F. H., Zhao, M., Song, B. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp Neurol. 227 (1), 210-217 (2011).
- Wu, D., Ma, X., Lin, F. DC Electric Fields Direct Breast Cancer Cell Migration, Induce EGFR Polarization, and Increase the Intracellular Level of Calcium Ions. . Cell Biochem Biophys. 67 (3), 1115-1125 (2013).
- Martin-Granados, C., et al. A role for PP1/NIPP1 in steering migration of human cancer cells. PLoS One. 7 (7), 40769 (2012).
- Yang, H. Y., Charles, R. P., Hummler, E., Baines, D. L., Isseroff, R. R. The epithelial sodium channel mediates the directionality of galvanotaxis in human keratinocytes. J Cell Sci. 126 (9), 1942-1951 (2013).
- Zhao, M., et al. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442 (7101), 457-460 (2006).
- Shanley, L. J., Walczysko, P., Bain, M., MacEwan, D. J., Zhao, M. Influx of extracellular Ca2+ is necessary for electrotaxis in Dictyostelium. J Cell Sci. 119 (22), 4741-4748 (2006).
- Zhao, M., Agius-Fernandez, A., Forrester, J. V., McCaig, C. D. Directed migration of corneal epithelial sheets in physiological electric fields. Invest Ophthalmol Vis Sci. 37 (13), 2548-2558 (1996).
- Peng, H. B., Jaffe, L. F. Polarization of fucoid eggs by steady electrical fields. Dev Biol. 53 (2), 277-284 (1976).
- Lee, M., et al. Characterization of adult human prostatic epithelial-cells immortalized by polybrene-induced DNA transfection with a plasmid containing an origin-defective sv40-genome. Int J Oncol. 4 (4), 821-830 (1994).
- Berthon, P., Cussenot, O., Hopwood, L., Leduc, A., Maitland, N. Functional expression of sv40 in normal human prostatic epithelial and fibroblastic cells - differentiation pattern of non-tumorigenic cell-lines. Int J Oncol. 6 (2), 333-343 (1995).
- Aurich-Costa, J., Vannier, A., Grégoire, E., Nowak, F., Cherif, D. IPM-FISH, a new M-FISH approach using IRS-PCR painting probes: application to the analysis of seven human prostate cell lines. Genes Chromosomes Cancer. 30 (2), 143-160 (2001).
- Tyson, D. R., Inokuchi, J., Tsunoda, T., Lau, A., Ornstein, D. K. Culture requirements of prostatic epithelial cell lines for acinar morphogenesis and lumen formation in vitro: role of extracellular calcium. Prostate. 67 (15), 1601-1613 (2007).
- Lang, S. H., Sharrard, R. M., Stark, M., Villette, J. M., Maitland, N. J. Prostate epithelial cell lines form spheroids with evidence of glandular differentiation in three-dimensional Matrigel cultures. Br J Cancer. 85 (4), 590-599 (2001).
- Babona-Pilipos, R., Popovic, M. R., Morshead, C. M. A galvanotaxis assay for analysis of neural precursor cell migration kinetics in an externally applied direct current electric field. J Vis Exp. (68), (2012).
- Meng, X., et al. Electric field-controlled directed migration of neural progenitor cells in 2D and 3D environments. J Vis Exp. (60), (2012).
- Pullar, C. E., Isseroff, R. R. Cyclic AMP mediates keratinocyte directional migration in an electric field. J Cell Sci. 118 (9), 2023-2034 (2005).
- Sheridan, D. M., Isseroff, R. R., Nuccitelli, R. Imposition of a physiologic DC electric field alters the migratory response of human keratinocytes on extracellular matrix molecules. J Invest Dermatol. 106 (4), 642-646 (1996).
- Feng, J. F., et al. Guided migration of neural stem cells derived from human embryonic stem cells by an electric field. Stem Cells. 30 (2), 349-355 (2012).
- Mukerjee, E. V., Isseroff, R. R., Nuccitelli, R., Collins, S. D., Smith, R. L. Microneedle array for measuring wound generated electric fields. Conf Proc IEEE Eng Med Biol Soc. 1, 4326-4328 (2006).
- Nuccitelli, R., Nuccitelli, P., Li, C., Narsing, S., Pariser, D. M., Lui, K. The electric field near human skin wounds declines with age and provides a noninvasive indicator of wound healing. Wound Rep. and Reg. 19, 645-655 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados