JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
전립선 세포의 방향 마이그레이션 연구에 맞춤 설계 Galvanotaxis 챔버를 활용
요약
We present a method to apply a physiological electric field to migrating, immortalized prostate cells in a custom-made galvanotaxis chamber. Using this method, we demonstrate that 2 lines of non-tumorigenic prostate cells demonstrate different degrees of migration directionality in the field.
초록
생리 전기장은 배아 발달, 신경 가지 상피 상처 치유에 세포의 이동을 지시하는 등 특정 생물학적 기능을 제공합니다. 시험 관내에서 배양 된 세포에 직류 전계를인가하여 세포의 이동 방향, 또는 galvanotaxis을 유도한다. 여기 보여 2 차원 galvanotaxis 방법은 주문 제작 된 폴리 (비닐 클로라이드) (PVC) 챔버, 유리 표면에, 백금 전극과 셀 묘화되는 동력 스테이지를 이용하여 수정된다. PVC 챔버 및 백금 전극은 낮은 세포 독성을 전시하고 저렴하고 다시 사용 가능한입니다. 유리 표면과 전동 현미경 스테이지는 이미지의 품질을 개선하고 세포에 유리 표면과 치료 가능한 수정을 허용한다. 우리는 두 가지 비 - 종양 형성, SV40-전립선 무한 증식 세포주, PRNS-1-1의 PNT2 galvanotaxis을 촬영. 이들 두 세포주는 유사한 이동 속도를 보여 모두를 향해 이동음극,하지만 그들은 galvanotaxis의 방향성의 다른 정도를 보여 않습니다. 이 프로토콜을 통해 얻어진 결과 PRNS-1-1 PNT2 세포주들은 지향성 응답 이동성을 관리 다른 고유 특성을 가질 수 있음을 시사한다.
서문
내인성 전기장 피부 1, 32, 33, 2와 같은 다양한 뇌 조직에서 검출된다. 생리 전계 신경 공정 5, 6의 생장을 유도하고 상피 각막 상처 봉합 1,7 촉진 지향, 배 발달 3,4- 포함한 특정 생물학적 기능을 제공. 시험관 내 배양 된 세포에 직류 전계인가 모방 생리 전기장을하고 방향 세포의 이동, 또는 galvanotaxis를 유도한다. Galvanotaxis는 neuroblasts 2, 신경 전구 세포 (14), 섬유 아세포 8, 물고기 각질 9, 인간 상피와 각막 각질 10-12 연구 13 림프구되었습니다. (-) 극인가 필드에 노출되는 경우, 세포 연구의 대부분은 방향성 cathodal 향해 이동한다. 그러나, 고도 등 여러 전이성 암세포인간의 유방암 세포와 인간 전립선 암 세포주 PC-3M이 anodal (+) 극 (15, 16)로 이동한다. 여러 메커니즘 galvanotaxis을 중재 또는 활성화를 포함하는 전기장을 감지하는 세포의 능력을 설명하기 위해 제안 EGF 12 수용체, 상피 나트륨 채널 (17)는 PI3K 및 PTEN (18), 및 칼슘의 방출이기구는 아직 완전히 이해되지. 15 (19) 이온 및 그것은 여러 신호 전달 경로가 galvanotaxis에 참여하는 것이 가능하다.
여기 보여 2 차원 galvanotaxis 방법은 점착성, 운동성 세포의 방향 이동을 특성화하기 위해, 하나 (18), (20).이 기법에서 수정 된 융합 세포의 시트를 개개의 세포 이동을 10, 12, 17 또는 이동을 모니터링하는 데 유용 펭과 제피 (21), 그리고 니시무라 등. 주문 제작, 명확한 PVC 챔버 10, 이동식 coversl와IPS와 같은 면역 형광 이미징 차 분석을위한 galvanotaxis, 후 쉽게 셀 검색을 허용. galvanotaxis 챔버의 유리 표면은 고배율과 형광 표지 된 세포와 촬영을 허용하는 광학 호환이다. 그것은 또한 표면 코팅 또는 전하 변경과 같은, 유리의 표면 개질과 실험 설계를 허용한다. 제 1 커버 글라스로 이루어지는 스페이서 위에 셀 전류 흐름을 최소화하기 위해 챔버에 사용된다; 따라서, 전류 흐름의 제곱에 비례 주울 가열, 실험 기간 동안 세포를 과열 않을 것이다. 한천 연결 교량 셀 전극의 직접 접촉을 방지하고 galvanotaxis 동안 매체의 pH 나 이온 농도의 변화를 방지한다.
두 개의 비 - 인간 종 양성 전립선 세포주는이 연구에서 galvanotaxis 그들의 응답을 조사 하였다. PRNS-1-1 22 PNT2 (23)는 모두 SV4 있습니다성장 인자 의존적 세포주는 전립선 특이 항원 (PSA)의 낮은 또는 전혀 식 5, 8, 18, 19 아세포 상피 마커를 발현하는, 0 - 불멸화. 두 세포주 정상 상피 세포의 다각형 형태를 유지하지만, 염색체 이상은 핵형 (22, 24)에서 관찰되었다. PRNS-1-1과 PNT2 대부분의 실험에서 유사한 행동을 공유하지만, 그들이 선포 구조의 형성과의 차이를 표시 할 galvanotaxis. 3-D 행렬에, 마트 리겔은 PRNS-1-1 세포는 정상적인 전립선 조직 (25)을 닮은 루멘 선포의 중공 구조를 형성한다. 그러나 PNT2 세포 내강 상피 (26) 또는 편광없이 고체 스페 로이드를 형성한다. PRNS-1-1 세포는 또한 현재 연구 PNT2보다 높은 galvanotactic 응답을 보여준다. 선포의 구조의 형성 및 galvanotaxis 간의 상관 관계는 PRNS-1-1 galvanotactic 신호 (PR)를 조직에서 역할을 할 수 있음을 시사ostate 선 조직 내생 전기장에 대응 움직임, 그리고이 두 세포주를 구별하기 위해 추가 특성을 제공한다.
프로토콜
1. 배양 전립선 세포
- 문화 PRNS-1-1 5 % CO 2, 37 ℃에서 10 % FBS와 항생제 - 안티 곰팡이로 보충 된 RPMI 1640 배지에서 100mm 배양 접시에 PNT2 및 전립선 세포. 세포 galvanotaxis 실험에 80 % 포화 상태에 도달 할 때까지 매일 배양 배지를 새로.
2. 조립 Galvanotaxis 챔버
- 하단 챔버 조립
- 2- 프로판올와 플라스틱 galvanotaxis 챔버를 닦습니다. 주사기와 챔버의 하부 측에 원형의 개구 주변 해양 급 실리콘 실러를 적용하고 큰 커브 글라스 (도 1)에 부착. 커버 글라스를 아래로 밀어 면봉으로 초과 접착제를 닦아면 주걱의 뒷면을 사용합니다. 원형 개구부는 중간 전류는 두 매질 내부 저장소 사이에 위치 된 세포 흐르게.
- 6mm × 2를 만들기 위해 작은 커버 글라스를 잘라다이아몬드 포인트 마커 5mm 스페이서.
- 챔버를 뒤집습니다. 주사기 및 / 또는 하단 유리에 2 원형 구멍 사이의 세포 부착을위한 10mm X 25mm 채널 표면을 만들 수있는 금속 주걱 실리콘 접착제의 2 줄무늬를 적용합니다. 이 원형 구멍 사이에 유리 스페이서 2 개를 붙인다. 스페이서를 아래로 밀어 면봉 및 / 또는 이쑤시개와 초과 접착제를 닦아면 어플리케이터의 뒷면을 사용합니다.
- 실리콘 접착제가 경화 될 때까지 24 시간 동안 챔버를 건조. 접착제에서 아세트산 잔기를 제거 증류수에 밤새 챔버를 담근다. 즉시 사용 가능한 챔버를 건조, 또는 깨끗한 용기에 나중에 사용하기 위해 챔버를 저장합니다.
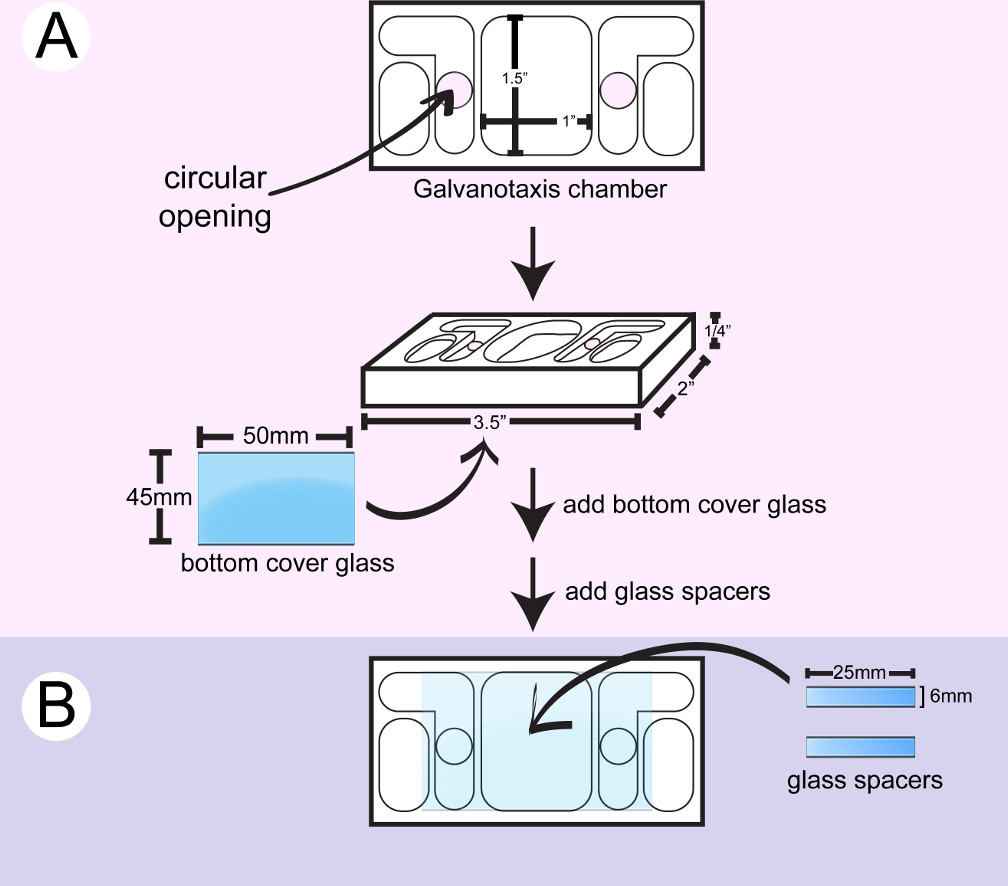
그림 1 : 하단 galvanotaxis 챔버의 조립. A)가 큰 커브 글라스) T 세정 챔버. B의 하단에 부착된다유리 스페이서의 조각이 원형 구멍 사이에 접착되어 하시다 세포 부착을위한 10mm X 25mm 채널을 만들 수 있습니다.
- galvanotaxis 챔버에 세포를 심는
- 실험에 필요한 galvanotaxis 챔버의 필요 수를 준비합니다. 각 세포주 또는 치료는 하나의 galvanotaxis 챔버가 필요합니다. 2- 프로판올과 galvanotaxis 챔버를 닦습니다. 멸균 PBS의 3 배에 실을 세척하고 챔버에서 2 원형 구멍 사이의 액체 흐름을 확인합니다.
- 무균 세포 배양 접시에있는 챔버를 동봉하고 15 분 동안 37 ℃에서 평형 수 있습니다. 5 분 동안 37 ° C에서 5 ml의 0.25 % 트립신 EDTA를 사용하여 배양 접시에서 전립선 세포를 분리. PBS에 5 ㎖의 10 % FBS와 트립신 EDTA를 중화.
- 15 ㎖의 튜브에 세포를 옮기고 200 XG, 37 ° C에서 5 분 동안 원심 분리하여 세포. 상등액을 대기음 배지 1 ㎖에 세포를 다시 일시.
- 20 μ를 타고셀 L의 용액은 카운팅 챔버에로드하고 세포 수를 산출한다. 문화 매체와 8 × 104 세포 / ㎖로 세포 농도를 조정합니다.
- 37 ° C 배양기에서 galvanotaxis 챔버를 가져 가라. 각 챔버에 세포 현탁액 350 μl를 시드.
- 킴 와이프 또는 습윤 5 % CO 2, 37 ℃에서 습도 인큐베이터 챔버에서 배양 접시에서 밤새 챔버에서 세포를 배양한다.
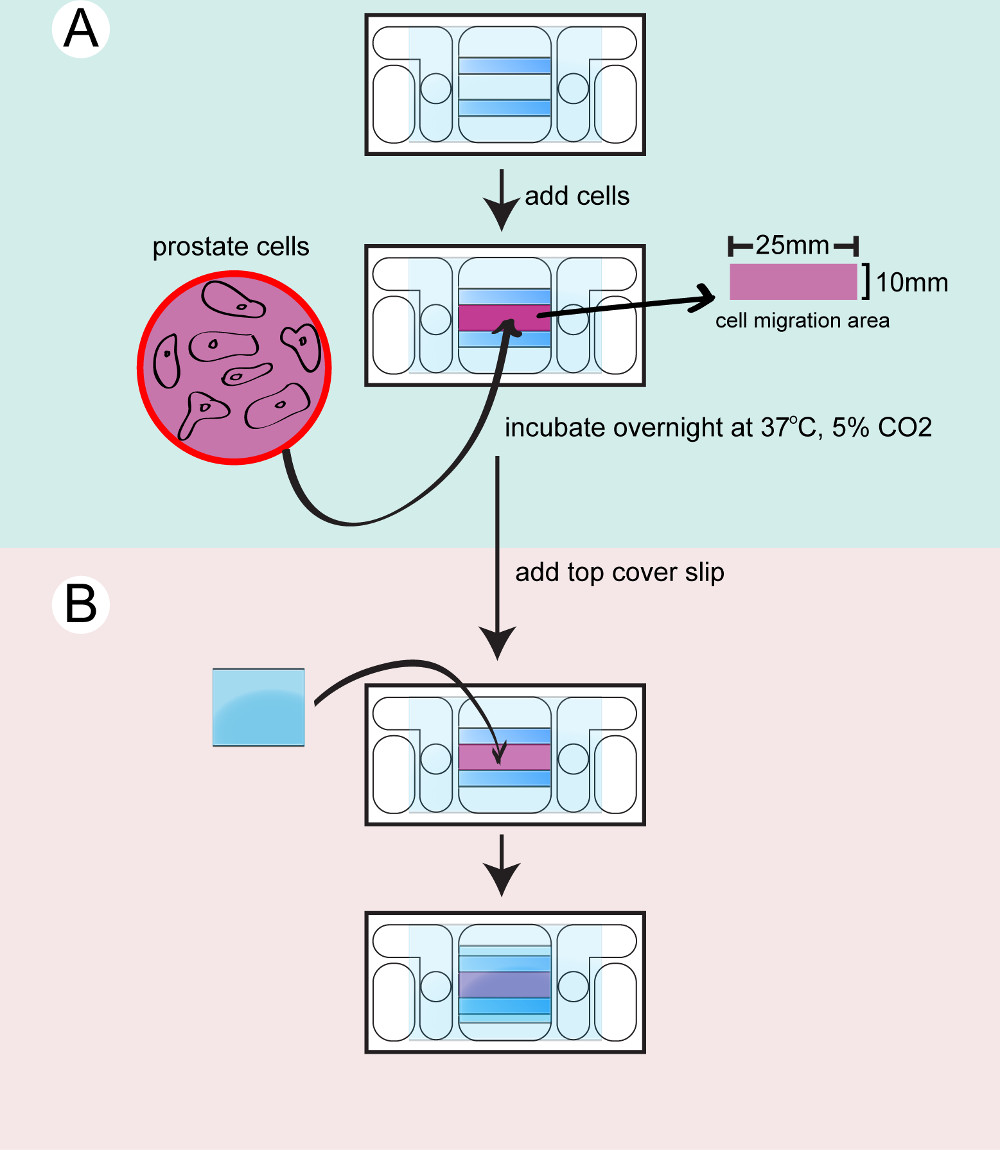
그림 2. 챔버에 세포를 시드 하부 측실을 건조 세정 A) 전립선 세포를 트립신 카운트 챔버로 이송하고, 밤새 인큐베이션 B) 상단 커버 글라스는 촬영 전에 챔버를 밀봉하도록 부착된다...
- 상단 챔버 ssembling
- 촬영하기 전에 상단 챔버를 조립합니다. 현미경은 한 번에 하나의 챔버 galvanotaxis 촬상 수용 할 수있다. 각 galvanotaxis 챔버, 37 ° C에서 배양 배지 10 ㎖ 워밍업. 37 ° C 온난화 판에 인큐베이터에서 galvanotaxis 챔버를 전송합니다.
- 부착되지 않은 세포를 제거하기 위해 문화 매체와 세포를 씻어. 챔버 내에서 매체의 400 μl를 남겨주세요. 모두 유리 스페이서의 상단에 높은 진공 그리스를 적용 할 주사기를 사용합니다.
- 챔버를 밀봉하는 작은 커버 글라스를 추가합니다. 부드럽게면 주걱의 뒷면에 커버 글라스를 누르십시오. 면봉과 초과 매체를 닦아냅니다.
- 유리 표면을 건조하고, 커버 글라스와 챔버 사이의 간격을 밀봉 높은 진공 그리스를 적용합니다. 그리스를 확산 금속 주걱을 사용합니다. 내부 저수지에 배지 4 ML을 추가하고 저수지 사이의 액체 흐름을 확인합니다.
- 한천 만들기다리
- 2 인치 길이의 PVC 튜브의 한 쌍을 잘라 (16분의 503 (내경) x 5/16 (외경) x 1/16 월), 플립과 100 비이커에 삽입합니다.
- 200mg의 박토 - 한천을 측정하고 2 % 한천 겔을 10 ml의 배지와 함께 50 ml의 플라스크에 추가한다. 30 초 동안 전자 레인지. 전송 피펫과 플라스틱 튜브에 한천 겔을로드합니다. 고형화 한천을 10 분 동안 실온에서 한천 교량 남기기.
- galvanotaxis 챔버의 외부 저수지에 2 ml의 배지를 추가합니다. 전류를 전도하기 위해 내부 및 외부 매체 저수지에 한천 다리를 삽입합니다.
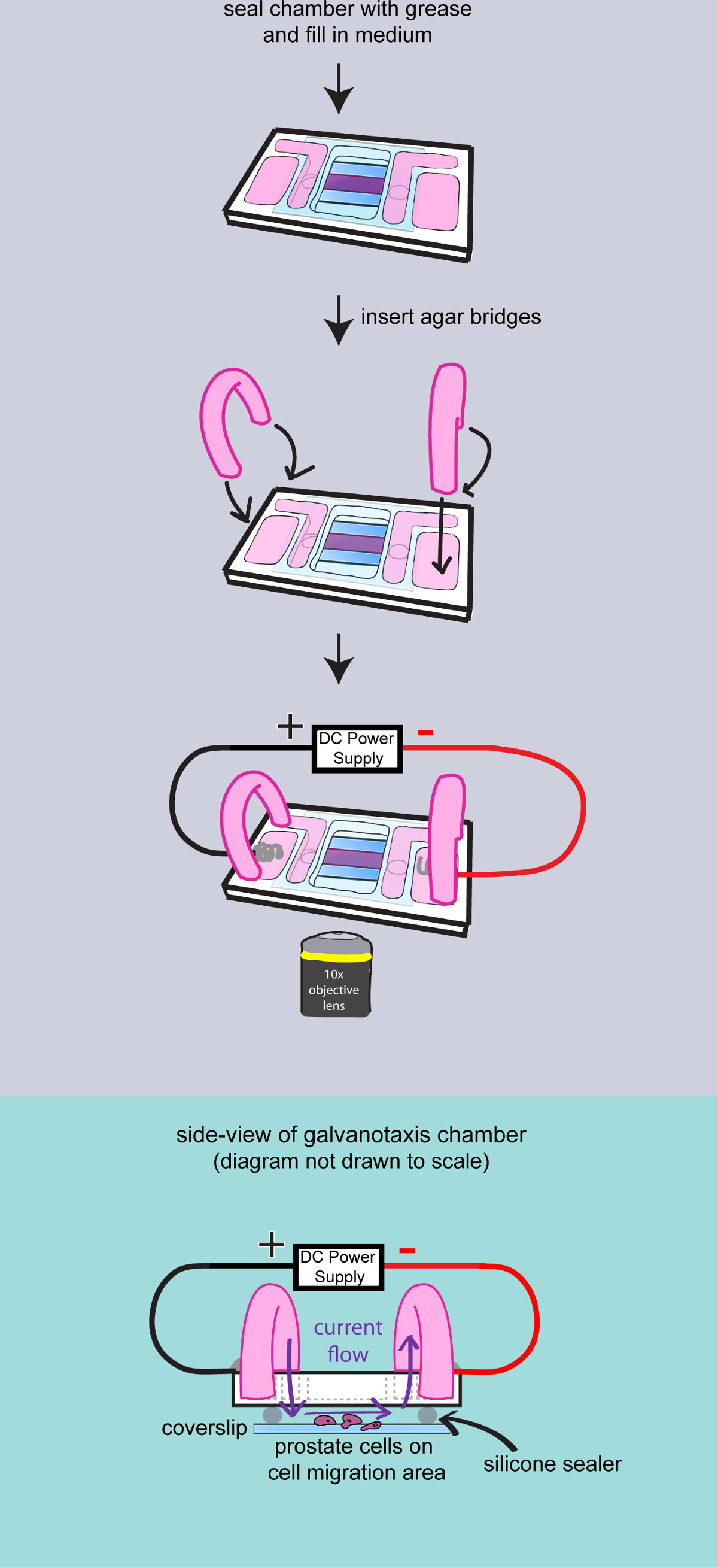
그림 3 :. 챔버에 세포를 얇은 껍질이 그림은 galvanotaxis 챔버의 최종 조립을 보여합니다. 챔버는 완전히 고 진공 그리스로 밀봉된다. 중간 t을 추가오 저수지를 작성하고 두 한천 교량 챔버에 삽입됩니다. 이어서 galvanotaxis 챔버는 현미경 스테이지에 전달되고, 전극은 전기장을 적용하도록 부착된다. 조립 galvanotaxis 챔버의 측면도는 전류가 한천 교량과 커버 유리 사이의 공간을 통해 흐르고 셀 위에 함을 입증하기에 도시된다.
3. 시간 경과 영상
- 이전 영상에 공기 순환 2 시간에서 5 % CO 2와 37 ° C에 환경 챔버에 전환합니다.
- 현미경에 전환하고 이미지 획득 소프트웨어를 시작합니다. 현미경 스테이지를 보정하고, 10 배 목표를 선택합니다.
- 현미경 무대에 galvanotaxis 챔버를 전송 테이프로 실을 확보하고 세포에 초점을 맞 춥니 다. 오른쪽에 음극과 외부 저수지에 galvanotaxis 전극을 삽입합니다. 와이어와 테이프로 전극을 고정합니다.
- 전력 보에 스위치X는 챔버에 전계를 적용한다. 25mm 긴 챔버 (100 MV / mm) 2.5 볼트에 도달 할 수 챔버에서 전압계와 출력 전압을 측정합니다. 출력 전류를 조절하여 실험 기간 동안 전계 강도를 유지한다.
- 열 시간 경과 영화를 생성하는 소프트웨어의 필름과 챔버에서 10 점을 선택합니다. 2 시간 동안 10 분 간격으로 인수 조건을 설정합니다.
- 촬영을 시작하고, 필요에 따라 출력 전류를 조정한다.
- 실험의 마지막 단계에서 챔버를 제거하고 95 % 알코올로 세포를 고정한다. 청소 면도날 열린 챔버 휴식하고 다시 사용하기.
Galvanotaxis 4. 정량화
- 시간 경과 영화와 다시의 방향 이미지의 상단에 음극을 돌립니다. 셀 추적 소프트웨어에 영화를 내 보냅니다.
- 수동으로 각 동영상 (도 4 A, B)에서 각각의 시간 지점에서 10-20 세포 (x, y)의 위치를 추적.남북 방향에 대하여 이주 거리 및 각도는, 전기장의 방향은 동일한, 셀 추적 소프트웨어 (도 4c)에서 산출한다.
주 : 평균 이동 속도가 총 이동 거리와 총 촬영 시간으로 변환됩니다. 방향성은 코사인 값 각도에서 변환된다. 세포가 임의의 방향성으로 마이그레이션하는 경우, 순 코사인의 평균은 제로에 가까운 것입니다. 세포가 음극쪽으로 이동하는 경우 직접, 코사인 값은 1이 될 것이다. 세포를 직접 애노드 측으로 이동하는 경우, 코사인 값은 -1이 될 것이다.
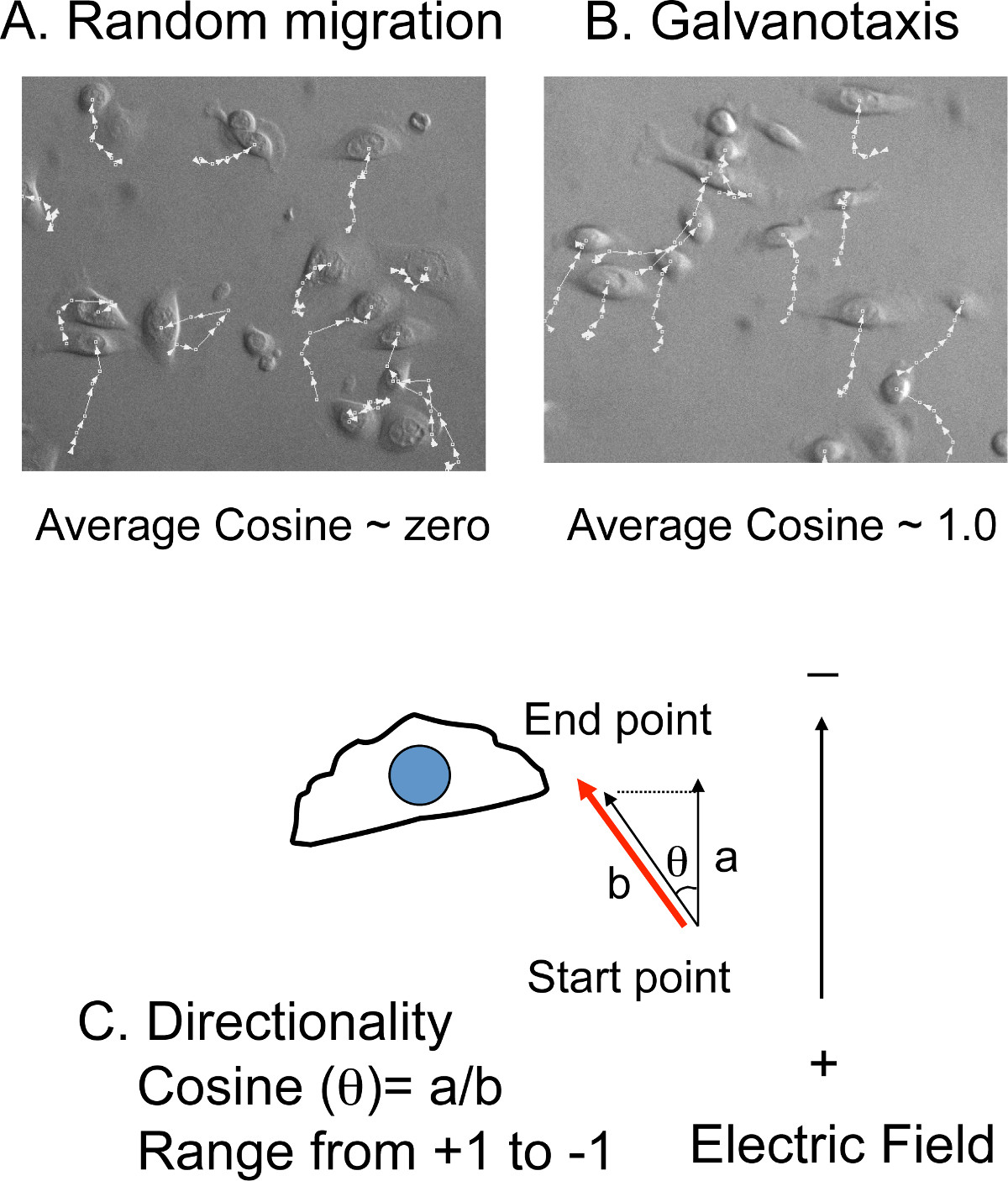
도 4 : 셀 추적 방향성을 측정하기 위해 세포 추적 이미지 라인) 오버레이.. 셀 (X, Y) 위치는 manua 아르에서야 시간 경과 영화에서 추적. . 세포는 임의로 이동하면 평균 코사인 제로에 가까운 B) 그러나, 세포가 음극 또는 양극을 향해 이동하는 경우, 평균 코사인 값 + (음극) 또는 부근 -. (양극) 1.0 C ) 방향성은 마이그레이션 각도 (θ)에서 변환 된 코사인 값에 의해 제공됩니다. 코사인 (θ)은 거리 B (전계의 방향에 투영 거리)까지의 거리 (이동 거리)의 비율과 같다.
- 측정 값을 저장합니다. 조합 된 결과를 계산하는 데이터베이스 어플리케이션에 데이터를 가져.
- 막대 그래프 (그림 5) 음모 스프레드 시트에 평균 이동 속도와 평균 코사인 값의 결합 된 데이터를 보냅니다.
결과
전립선 세포 (PRNS-1-1과 PNT2)의 두 라인은이 방법으로 조사 하였다. 두 줄의 셀은 2 시간 (도 5a)에 걸쳐 1.0 +/- 0.3 미크론 / 분의 속도로 이동 유사한. 그러나, 전계 지향성 PRNS-1-1 선 0.7 +/- 0.3 및 PNT2 라인 (도 5B) 0.2 +/- 0.8이다. 결과들은 상이한 위치 단서 지향성 응답이 발생할 다른 세포 시그널링 메커니즘을 가지고 있음을 시사 (100 세포 추적 하였다 p <0.01)이 두 세포주 galvano...
토론
셀의 galvanotaxis 응답의 분석은 많은 셀룰러 이동성 또는 성장을위한 중요한 기능 표시기 (27), (28)를 처리했다. 여기서 우리는 두 전립선 세포주 영화를 유리 표면에 특별 주문품 실을 사용한다. 이들 세포주 galvanotaxis 상이한 정도를 보여, 우리는 세포 내 위치 파악 또는 galvanotaxis - 매개 단백질의 활성화는 galvanotaxis 응답의 관측 차이의 결과로, 불멸 세포주를 생성하는 과정을 방해 할 수 있...
공개
The authors have nothing to disclose.
감사의 말
전립선 세포주 친절 암 센터, UC 데이비스 박사 링 - 유 왕 박사 싱 - 지엔 쿵에 의해 제공됩니다. 이 프로젝트는 NIH의 galvanotaxis 부여 4R33AI080604에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Cells | |||
| pRNS-1-1 prostate cells | Lee, et al. (1994) | ||
| PNT2 prostate cells | Sigma-Aldrich | 95012613-1VL | Berthon, et al. (1995) |
| Medium and solutions | |||
| RPMI 1640 medium | Invitrogen | 11875-093 | warm up to 37 °C before use |
| Fetal Bovine Serum - Premium | Atlanta Biologicals | S11150 | 10% in PBS, warm up to 37 °C before use |
| Antibiotic-Antimycotic (100x) | Life Technologies | 15240 | add 5 ml to 500 ml medium |
| 2-propanol | VWR | BDH1133-5GL | |
| PBS | - | - | 137 mM NaCl, 2.7 mM KCl, 4.3 mM Na2HPO4 and 1.5 mM KH2PO4 in 1,000 ml of H2O, pH to 7.4 and autoclaved, warm up to 37 °C before use |
| 0.25% Trypsin-EDTA | Invitrogen | 25200-056 | warm up to 37 °C before use, treat cells for 3-5 min at 37 °C |
| Galvanotaxis device | |||
| Galvanotaxis chambers | Precision Plastics Inc, CA | Custom-designed (1/4" x 2" x 3.5"), non-toxic, clear PVC chambers. Please contact the authors for the design specs. | |
| Galvanotaxis electrodes | UCD electric shop | platinum coiled electrodes with flexable cords | |
| Galvanotaxis power box | Substrate Engineering, CA | custom-designed DC power output with voltmeter | |
| Microscope Cover Glass, Large, 45 x 50 mm, No. 1.5 | Fisher | 12-544-F | |
| Microscope Cover Glass, small, 25 x 25 mm, No. 1 | ThermoScientific | 3307 | |
| Diamond point marker | ThermoScientific | 750 | |
| Marine grade silicon sealer, clear | 3M | 051135-08019 | |
| High vacuum grease | Dow Corning | 2021846-0807 | |
| 6 ml syringe | Fisher Scientific | 05-561-64 | |
| Nichiryo Syringe, 1.5 ml | Nichiryo | SG-M | |
| Cotton applicators | Purtian Medical Products | 806-WC | |
| Qtips | Johnson & Johnson | 729389 | |
| Nalgene 180 PVC tubing | Nalgene | 8000-9030 | 503/16 ID x 5/16 OD x 1/16 Wall |
| Bacto-Agar | Difco | 0140-01 | make 2% agar solution |
| Razor Blade | Personna | 74-0001 | |
| Equipments and Software | |||
| Benchtop Centrifuge | Eppendorf | 5810R | operated with an A-4-62 rotor |
| Cellometer Auto T4 | Nexcelom | Auto T4 | |
| Cellometer counting chambers | Nexcelom | CHT4-SD100-002 | load 20 μl cell solutions to count |
| Culture Temp Warming plate | Bel-Art Scienceware | 370150000 | to keep the galvanotaxis chambers at 37 °C |
| Eclipse TE-2000 microscope with motorized stage and environmental chamber | Nikon | ||
| Plan Fluor 10X/0.30 objective len | Nikon | ||
| Retiga EX CCD camera | Qimaging | Cooled CCD camara, mono-color, 12-bit | |
| Compressed air with 5% CO2 | Airgas | special order | |
| Volocity 6.3 | PerkinElmer | Image acquiring software | |
| Improvision OpenLab 5.5.2 | PerkinElmer | Cell tracking software and customized to measure migration angles | |
| FileMaker Pro Advanced, 8.0 | FileMaker | ||
| Microsoft Excel 2008 for Mac | Microsoft | ||
참고문헌
- Reid, B., Nuccitelli, R., Zhao, M. Non-invasive measurement of bioelectric currents with a vibrating probe. Nat Protoc. 2 (3), 661-669 (2007).
- Cao, L., et al. Endogenous electric currents might guide rostral migration of neuroblasts. EMBO Rep. 14 (2), 184-190 (2013).
- Hotary, K. B., Robinson, K. R. Endogenous electrical currents and voltage gradients in Xenopus embryos and the consequences of their disruption. Dev Biol. 166 (2), 789-800 (1994).
- Hotary, K. B., Robinson, K. R. Evidence of a role for endogenous electrical fields in chick embryo development. Development. 114 (4), 985-996 (1992).
- Yamashita, M. Electric axon guidance in embryonic retina: galvanotropism revisited. Biochem Biophys Res Commun. 431 (2), 280-283 (2013).
- Wood, M. D., Willits, R. K. Applied electric field enhances DRG neurite growth: influence of stimulation media, surface coating and growth supplements. J Neural Eng. 6 (4), 046003 (2009).
- Kucerova, R., et al. The role of electrical signals in murine corneal wound re-epithelialization. J Cell Physiol. 226 (6), 1544-1553 (2011).
- Sillman, A. L., Quang, D. M., Farboud, B., Fang, K. S., Nuccitelli, R., Isseroff, R. R. Human Dermal fibroblasts do not exhibit directional migration on collagen I in direct-current electric fields of physiological strength. Exp Dermatol. 12 (4), 396-402 (2003).
- Allen, G. M., Mogilner, A., Theriot, J. A. Electrophoresis of cellular membrane components creates the directional cue guiding keratocyte galvanotaxis. Curr Biol. 23 (7), 560-568 (2013).
- Nishimura, K. Y., Isseroff, R. R., Nuccitelli, R. Human keratinocytes migrate to the negative pole in direct current electric fields comparable to those measured in mammalian wounds. J Cell Sci. 109 (1), 199-207 (1996).
- Farboud, B., Nuccitelli, R., Schwab, I. R., Isseroff, R. R. DC electric fields induce rapid directional migration in cultured human corneal epithelial cells. Exp Eye Res. 70 (5), 667-673 (2000).
- Fang, K. S., Ionides, E., Oster, G., Nuccitelli, R., Isseroff, R. R. Epidermal growth factor receptor relocalization and kinase activity are necessary for directional migration of keratinocytes in DC electric fields. J Cell Sci. 112 (12), 1967-1978 (1999).
- Li, J., et al. Activated T lymphocytes migrate toward the cathode of DC electric fields in microfluidic devices. Lab Chip. 11 (7), 1298-1304 (2011).
- Meng, X., Arocena, M., Penninger, J., Gage, F. H., Zhao, M., Song, B. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp Neurol. 227 (1), 210-217 (2011).
- Wu, D., Ma, X., Lin, F. DC Electric Fields Direct Breast Cancer Cell Migration, Induce EGFR Polarization, and Increase the Intracellular Level of Calcium Ions. . Cell Biochem Biophys. 67 (3), 1115-1125 (2013).
- Martin-Granados, C., et al. A role for PP1/NIPP1 in steering migration of human cancer cells. PLoS One. 7 (7), 40769 (2012).
- Yang, H. Y., Charles, R. P., Hummler, E., Baines, D. L., Isseroff, R. R. The epithelial sodium channel mediates the directionality of galvanotaxis in human keratinocytes. J Cell Sci. 126 (9), 1942-1951 (2013).
- Zhao, M., et al. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442 (7101), 457-460 (2006).
- Shanley, L. J., Walczysko, P., Bain, M., MacEwan, D. J., Zhao, M. Influx of extracellular Ca2+ is necessary for electrotaxis in Dictyostelium. J Cell Sci. 119 (22), 4741-4748 (2006).
- Zhao, M., Agius-Fernandez, A., Forrester, J. V., McCaig, C. D. Directed migration of corneal epithelial sheets in physiological electric fields. Invest Ophthalmol Vis Sci. 37 (13), 2548-2558 (1996).
- Peng, H. B., Jaffe, L. F. Polarization of fucoid eggs by steady electrical fields. Dev Biol. 53 (2), 277-284 (1976).
- Lee, M., et al. Characterization of adult human prostatic epithelial-cells immortalized by polybrene-induced DNA transfection with a plasmid containing an origin-defective sv40-genome. Int J Oncol. 4 (4), 821-830 (1994).
- Berthon, P., Cussenot, O., Hopwood, L., Leduc, A., Maitland, N. Functional expression of sv40 in normal human prostatic epithelial and fibroblastic cells - differentiation pattern of non-tumorigenic cell-lines. Int J Oncol. 6 (2), 333-343 (1995).
- Aurich-Costa, J., Vannier, A., Grégoire, E., Nowak, F., Cherif, D. IPM-FISH, a new M-FISH approach using IRS-PCR painting probes: application to the analysis of seven human prostate cell lines. Genes Chromosomes Cancer. 30 (2), 143-160 (2001).
- Tyson, D. R., Inokuchi, J., Tsunoda, T., Lau, A., Ornstein, D. K. Culture requirements of prostatic epithelial cell lines for acinar morphogenesis and lumen formation in vitro: role of extracellular calcium. Prostate. 67 (15), 1601-1613 (2007).
- Lang, S. H., Sharrard, R. M., Stark, M., Villette, J. M., Maitland, N. J. Prostate epithelial cell lines form spheroids with evidence of glandular differentiation in three-dimensional Matrigel cultures. Br J Cancer. 85 (4), 590-599 (2001).
- Babona-Pilipos, R., Popovic, M. R., Morshead, C. M. A galvanotaxis assay for analysis of neural precursor cell migration kinetics in an externally applied direct current electric field. J Vis Exp. (68), (2012).
- Meng, X., et al. Electric field-controlled directed migration of neural progenitor cells in 2D and 3D environments. J Vis Exp. (60), (2012).
- Pullar, C. E., Isseroff, R. R. Cyclic AMP mediates keratinocyte directional migration in an electric field. J Cell Sci. 118 (9), 2023-2034 (2005).
- Sheridan, D. M., Isseroff, R. R., Nuccitelli, R. Imposition of a physiologic DC electric field alters the migratory response of human keratinocytes on extracellular matrix molecules. J Invest Dermatol. 106 (4), 642-646 (1996).
- Feng, J. F., et al. Guided migration of neural stem cells derived from human embryonic stem cells by an electric field. Stem Cells. 30 (2), 349-355 (2012).
- Mukerjee, E. V., Isseroff, R. R., Nuccitelli, R., Collins, S. D., Smith, R. L. Microneedle array for measuring wound generated electric fields. Conf Proc IEEE Eng Med Biol Soc. 1, 4326-4328 (2006).
- Nuccitelli, R., Nuccitelli, P., Li, C., Narsing, S., Pariser, D. M., Lui, K. The electric field near human skin wounds declines with age and provides a noninvasive indicator of wound healing. Wound Rep. and Reg. 19, 645-655 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유