Method Article
La interferencia de ARN de las larvas en la Red Escarabajo de Harina,
* Estos autores han contribuido por igual
En este artículo
Erratum Notice
Resumen
ARN de interferencia (RNAi) basados en técnicas de genes desmontables son el núcleo de la investigación Tribolium. Aquí, ofrecemos una visión general de nuestra técnica de RNAi larval en Tribolium castaneum. Larval RNAi es una técnica sencilla, pero de gran alcance que proporciona un acceso rápido a los fenotipos de pérdida de función, lo que permite a los investigadores estudiar las funciones de genes en diversos contextos.
Resumen
El escarabajo rojo de la harina, Tribolium castaneum, ofrece un repertorio de herramientas experimentales para estudios genéticos y de desarrollo, incluyendo una secuencia totalmente anotada genoma, la transgénesis basado en transposón, y el ARN de interferencia efectiva (RNAi). Entre estas ventajas, las técnicas de genes desmontables basados en RNAi son el núcleo de la investigación Tribolium. T. castaneum mostrar una respuesta sistémica RNAi robusta, por lo que es posible llevar a cabo RNAi en cualquier etapa de la vida por la simple inyección de ARN de doble cadena (dsRNA) en la cavidad del cuerpo del escarabajo.
En este informe, se proporciona un resumen de nuestra técnica de RNAi larval en T. castaneum. El protocolo incluye (i) aislamiento de la etapa apropiada de T. larvas castaneum para inyección, (ii) la preparación para el ajuste de la inyección, y (iii) la inyección de dsRNA. Larval RNAi es una técnica sencilla, pero de gran alcance que nos proporciona un acceso rápido a phenotyp pérdida de funciónes, incluyendo múltiples fenotipos desmontables de genes, así como una serie de fenotipos hypomorphic. Dado que prácticamente todos los T. castaneum tejidos son susceptibles a dsRNA extracelular, la técnica de RNAi larval permite a los investigadores estudiar una amplia variedad de tejidos en diversos contextos, incluyendo la base genética de las respuestas organísmicos para el medio ambiente exterior. Además, la simplicidad de esta técnica estimula una mayor participación de los estudiantes en la investigación, por lo que T. castaneum un sistema genético ideal para su uso en el aula.
Introducción
El escarabajo rojo de la harina, Tribolium castaneum, está ganando popularidad en diversos campos de la biología, debido en parte a la facilidad de realización de la interferencia de ARN (RNAi) 1-3. Técnicas de genes basados en RNAi desmontables permiten a los científicos para llevar a cabo la pérdida de la función de análisis sin utilizar métodos genéticos complejos. T. castaneum mostrar una respuesta sistémica RNAi robusta, por lo que es posible llevar a cabo RNAi en cualquier etapa a través de simple inyección de ARN de doble cadena (dsRNA) en la cavidad del cuerpo del escarabajo 4-6. Caída simultánea de múltiples genes también es factible en T. castaneum mediante la inyección de dos o más moléculas de dsRNA diferentes al mismo tiempo 7,8. Además, una serie de fenotipos hypomorphic se puede generar mediante la reducción de la concentración de inyección de dsRNA 8. Estas características hacen que las técnicas de genética inversa basada en RNAi atractivas alternativas a la genética a plazo tradicionales en T. castaneum. Dado que prácticamentetodo T. castaneum tejidos son susceptibles a moléculas de dsRNA extracelulares 9, esta técnica permite a los investigadores estudiar una amplia variedad de tejidos en diversos contextos. Además, si bien este informe se centra en la realización de RNAi en T. castaneum, muchos de los procedimientos aquí descritos son aplicables a otros insectos. Por lo tanto, este protocolo es útil para aquellos que deseen realizar la pérdida de la función de análisis en sus contextos de interés en T. castaneum, así como para los investigadores que desean aplicar una técnica basada en RNAi a otros insectos.
La inyección de dsRNA en larvas permite un análisis funcional en una variedad de etapas de la vida del escarabajo, incluyendo la larva, pupa y adulto Etapas 4,5,10. Hemos informado anteriormente de nuestro protocolo de RNAi larval general, incluidos los procedimientos de biología molecular 11. En el presente informe, nos centramos en la descripción de los procedimientos de inyección de ARN de doble cadena, que se explican mejor con ayudas visuales. Proporcionamosprocedimientos detallados paso a paso de inyección, así como ejemplos de buenas y malas de inyección. Este protocolo visual complementa nuestro protocolo anterior, y cuando se combinan, proporcionan una visión más completa de los procedimientos de larvas de RNAi en T. castaneum. Además, se discuten los parámetros de moléculas de dsRNA que podrían afectar el éxito de RNAi, la aplicación de ensayos basados en RNAi para la investigación fisiológica, así como la aplicabilidad del protocolo de RNAi de larvas en un laboratorio de enseñanza.
Protocolo
1. T. Acciones castaneum y cultivo
- Decidir sobre una T. cepa castaneum a utilizar para el experimento.
NOTA: Varios T. lab-establecido castaneum cepas están disponibles. Ga-1 (Georgia-1) es la cepa parental de Ga-2 que se utilizó para la secuenciación del genoma 3. Desde Ga-1 comparte la mayoría de los polimorfismos de ADN (tales como polimorfismos de un solo nucleótido, SNP) con Ga-2, y es más saludable que Ga-2 debido a la menor endogamia, es ideal para los experimentos de RNAi. Pu-11 es otra cepa cómodo de usar , como su expresión amarilla mejorada única proteína fluorescente (EYFP) en el futuro primordios ala nos permite distinguir el último estadio larval de otros estadios (ver Figura S4 de Clark-Hachtel et al. 2013 12). Es importante documentar que escarabajo cepa se utilizó en el experimento, como fondos genéticos parecen significativamente affect del RNAi fenotipos 13. - Preparar T. castaneum harina de cultivo mediante la adición de 5% (en peso) de la levadura de cerveza previamente tamizada a la harina de trigo integral orgánica (después de mezclar, almacenar la harina de la cultura a -20 ° C). Alícuota de la harina de cultivo (a temperatura ambiente) en 6 botellas de valores Drosophila oz de plástico (alrededor de 40 g / botella).
- T. Cultura castaneum a 30 ° C con 70% de humedad. Utilice una incubadora con humedad controlada, si es posible. Añadir 30-40 adultos por botella de cultivo (razón hombre: mujer 1: 1) para iniciar el cultivo.
NOTA: Aunque el moho es rara vez un problema a 30 ° C, temperaturas más bajas (por ejemplo, 25 ° C) con un 70% de humedad puede causar el crecimiento de moho en la harina de la cultura. Baje la humedad si esto ocurre. - La transferencia de los adultos a un nuevo frasco de cultivo cada dos semanas durante el subcultivo (véase el paso 5.2 a 5.5 para cómo aislar los adultos a partir de harina de cultivo).
NOTA: Se tarda unas tres semanas para obtener el último estadio las larvas. Alternativavamente, T. culturas castaneum se pueden mantener a una temperatura más baja (20-25 ° C), aunque con un período de cultivo más largo (tiempo de desarrollo a 25 ° C es aproximadamente el doble que a 30 ° C).
2 Preparación de Soluciones e Instrumentos para larvas inyección de dsRNA
- Sintetizar moléculas de dsRNA homólogos al gen diana por transcripción in vitro. Almacenar a -80 ° C. Ver Felipe y Tomoyasu 2011 11 para los procedimientos de biología molecular detalladas. Véase también la discusión de una serie de parámetros que deben tenerse en cuenta en el diseño de moléculas de dsRNA.
- Hacer 10 ml de tampón de fosfato de sodio 0,1 M (pH 7,6 a 25 ° C) mezclando 8,5 ml de 1 M Na 2 HPO 4 con 1,5 ml de 1 M NaH 2 PO 4. Comprobar el pH con un medidor de pH y ajustar en consecuencia.
- Hacer 1 ml de tampón 10X de inyección mediante la mezcla de 10 l de tampón de fosfato de sodio 0,1 M (pH 7,6 a 25 ° C), 100 _6; l de 0,5 M KCl, 100 l de colorante alimentario verde, y 790 l de agua doblemente destilada (ddH2O). Diluir el tampón 10x inyección para hacer 2x tampón de inyección (200 l de 10x tampón de inyección + 800 l ddH 2 O). Almacenar tanto 10x y 2x de inyección de tampones a 4 ° C hasta que se necesite.
- Preparar Sticky Glass Diapositivas.
- Cubrir un portaobjetos de vidrio entero con una forma de pegamento reposicionable para inyecciones larvales. Para adultos y pupas inyecciones, hacer dos finas tiras de pegamento a lo largo de los bordes más largos de la diapositiva.
- Deje que el pegamento se seque durante varios días, lo que garantiza que el pegamento se mantiene lo suficientemente pegajosa para adherirse escarabajos a la diapositiva, al mismo tiempo de ser lo suficientemente flexible para facilitar su eliminación después de la inyección.
NOTA: Si el pegamento se queda demasiado pegajoso, utilice un dedo y toque en la cola, lo que reducirá la pegajosidad. Cada diapositiva puede contener hasta 40 o 50 escarabajos, y puede ser reutilizado hasta que falla para sujetar los animales. Alterntivamente, cinta de doble cara también se puede utilizar, aunque la cinta se veces no adhesivo suficiente para mantener las larvas.
- Hacer una cesta eterización.
- Retire el émbolo de una jeringa desechable de 10 ml, y cortar la jeringa por la mitad alrededor de la línea 6 ml.
- Deseche la mitad inferior de la jeringa. Calentar brevemente la superficie de corte de la parte superior de la jeringa con un quemador de gas, y empujar rápidamente el plástico derretido en una pieza de malla de nylon para pegar la malla en la jeringa. Recorte cualquier exceso de malla una vez que el plástico se endurece.
- Preparar la botella de éter. Añadir 30 ml de éter en una botella de vidrio de 100 o 250 ml de boca estrecha. Añadir varias piezas de papel de seda para mejorar la evaporación del éter.
NOTA: Éter presenta un peligro de incendio y también es perjudicial. Siempre maneje éter bajo una campana de humos. Cierre la tapa bien mientras no esté en uso.
NOTA: El hielo puede ser utilizado como una alternativa más segura (tal como en un salón de clases), aunque la Sedation es menos eficaz.
3 Preparación de larvas aparato de inyección
- Publicar un platina mecánica XY en un microscopio de disección.
NOTA: etapas XY mecánica están disponibles en las principales compañías de microscopio. Alternativamente, las etapas de microscopio de bajo costo también se pueden utilizar para la mayoría de los microscopios de disección con algunas modificaciones (véase la Tabla de Materiales por ejemplo). - Coloque un manipulador de aguja mecánica cerca de la platina mecánica XY.
- Montar una jeringa de inyección. Utilice una llave de paso de cuatro vías (con conexiones Luer) para conectar una jeringa desechable de 30 ml a un soporte de aguja de vidrio, lo que permite la manipulación de la jeringa de inyección sin afectar a la presión en la aguja de inyección (véase Philip y Tomoyasu 2011 11 para la jeringa de inyección detallada montaje).
4. Tirando agujas de inyección
- Tire las agujas de vidrio borosilicato (B100-50-15, OD: 1 mm, ID: 0,5 mm, 15 cm de longitud) por unextractor de aguja.
NOTA: Para Sutter P-87 o P-97, use el ajuste "Heat = 70, Pull = 45, Vel = 75, Tiempo = 90" o seguir el capítulo 2 de la pipeta Cookbook: Adherente Cell, C. elegans, Drosophila, pez cebra y - programas recomendados. Los ajustes óptimos varían en función del modelo de la aguja extractora. El escenario de una aguja de inyección genérica Drosophila es un buen punto de partida. - Tienda sacó agujas en una caja de plástico (por ejemplo, una caja de CD de plástico) y seguro con extraíble masilla de montaje.
5. Aislamiento y Selección de las larvas
- Coloque un tamiz # 25 en un receptor tamiz.
- Coloque el contenido de la botella de cultivo (escarabajos y harina de cultura) en el tamiz, y tamizar el contenido inmediatamente. No dejar el contenido en el tamiz sin tamizar, como larvas tratará rápidamente para excavar a través del tamiz y se atascan. Tamizar agresivamente los contenidos para que la caída de harinaa través y dejar las larvas más viejas (por lo general 6 y 7 de larvas), pupas y adultos (junto con sus cutículas desechadas, exuvias) detrás en la parte superior de la criba.
- Transfiera los materiales restantes en el tamiz (escarabajos y exuviae) a la bandeja de la semilla. Siga punteando en la sartén para evitar que los escarabajos se escape.
- Retire la exuvia y las partículas de harina restante sobre la superficie de los escarabajos soplando suavemente sobre la sartén semilla.
- Pulse la sartén semilla para mover el contenido a la parte inferior de la sartén. Luego, deje el pan sin explotar durante varios segundos. Espere a que los adultos, que son más móviles que otras etapas, a salir de la pila. Retire los adultos mediante el uso de un pincel de arte (por ejemplo, 1 cm de ancho).
- Pupas independiente golpeando suavemente la bandeja de semillas mientras se mantiene la boca de la sartén ligeramente hacia abajo, como pupas tienden a rodar más rápido hacia la boca. Utilice un pincel para eliminar las pupas, dejando sólo las larvas en el platillo de la semilla.
- Plas de las larvas aisladas en una placa de Petri limpia. Seleccione una etapa apropiada de larvas para inyección y colocarlos en un plato aparte Petri.
NOTA: larvas de último estadio temprano (1-2 días después de la muda larval final) A menudo son adecuadas cuando se analiza el efecto de RNAi en morfologías de adultos, así como en la metamorfosis. Es, sin embargo, a veces es necesario para llevar a cabo RNAi en la penúltima (o incluso antes) etapa para evaluar la función del gen temprano (por ejemplo, las figuras 3E-3H. También véase Clark-Hachtel et al. 2013 12). Utilice pupas como una referencia para identificar el tamaño de las larvas de instar. El último estadio las larvas son ligeramente más largas que las pupas. Alternativamente, pu-11 puede ser usado para identificar el último estadio las larvas, así como para determinar el curso temporal del desarrollo de larvas de último estadio (Figura S4 de Clark-Hachtel et al. 2013 12). - Mantener las larvas seleccionado en una placa de Petri hasta eterización. Coloque el restode larvas y otras etapas de escarabajos (como pupas y adultos) de nuevo en una botella de cultivo con harina y devolverlo a la incubadora.
6 Preparación de agujas de inyección
- Coloque una aguja de vidrio previamente tirado sobre un portaobjetos de vidrio utilizando tachuela pegajosa o cinta de doble cara. Con unas pinzas, se examinará el tirado de la aguja mientras mira a través del microscopio de disección para ver donde las curvas de punta. Coge la zona un poco hacia el lado de la punta de donde las curvas de aguja con las pinzas y giro para romper.
- Mantenga buenos agujas y desechar otros. Considere una buena aguja como que tiene una abertura que no es ni demasiado grande ni demasiado pequeño (alrededor de 0,05 mm de diámetro. Figuras 1A y 1B), y está en ángulo para hacer la penetración de la cutícula de las larvas más fácil (Figuras 1B y 2A-2B). Considere la posibilidad de un mal aguja como (i) demasiado pequeña, por lo que la absorción de la solución de dsRNA en la aguja dificulto (paso 7) (Figuras 1D y 2D), (ii) demasiado grande, causando daño de las larvas y la posible letalidad después de la inyección (Figuras 1C y 2F), (iii) romo, lo que hace difícil la penetración de la cutícula y el aumento de la lesión.
- Inserte la aguja en el porta-agujas.
- En primer lugar, desenroscar la punta del soporte de la aguja y colocar el extremo posterior de la aguja en la punta soporte. A continuación, colocar la junta de goma debajo de la punta soporte (por lo menos 1 cm del extremo posterior de la aguja de vidrio).
- Inserte la parte posterior de la aguja en el soporte, con la junta de goma completamente insertado en la abertura del soporte de la aguja. Enrosque la punta de nuevo en el soporte.
- Coloque el soporte de la aguja montada sobre el manipulador de la aguja. Mantenga el soporte de la aguja cerca de la horizontal. Ajustar la posición del manipulador, por lo que la punta de la aguja se encuentra en el centro de la vista cuando se mira a través de la microscope.
7. Solución Frontloading dsRNA en la Aguja
- Preparar la solución de inyección de dsRNA justo antes de la inyección mediante el ajuste de la concentración con ddH 2 O y la mezcla de la solución de dsRNA con volúmenes iguales de tampón de inyección 2x (paso 2.3). Guarde la solución mezclada en el hielo. Véase la discusión con respecto a la concentración de ARN de doble cadena.
- Cortar la punta de una punta de pipeta desechable 20 l. Pipetear 10 l de la solución en la punta de pipeta recortada. Retire cuidadosamente la punta de la pipeta de la pipeta mientras se mantiene el fluido en la punta al proporcionar contrapresión. Alternativamente, retirar cuidadosamente la punta y luego pasar la solución al extremo de la punta, proporcionando la presión con un dedo.
- Coloque la punta de la pipeta con la solución de dsRNA en la platina del microscopio usando la tachuela pegajosa con la abertura hacia la punta de la aguja.
- Mirando a través del microscopio, mueva lentamente la punta cargado hacia la aguja hasta que la punta de laaguja está justo dentro de la punta de la pipeta cargada y en la solución.
- Mientras mira a través del microscopio, tire suavemente el émbolo de la jeringa de inyección para extraer lentamente la solución de ARN de doble cadena en la aguja.
NOTA: No sobrecargue la aguja. Como el final de la solución de dsRNA se aproxima a la punta de la aguja, reducir la tasa de tracción y detener la carga de la solución antes de la punta de la aguja alcanzaría aire. Si el aire llega a la punta, la solución se extrae rápidamente en el soporte de la aguja, lo que resulta en problemas de contaminación graves. Los procedimientos detallados de limpieza del soporte de la aguja se describen en Felipe y Tomoyasu 2011 11. - Retire la presión de la jeringa de inyección y de soporte de la aguja con la apertura de la llave de paso. A continuación, mover la punta de pipeta de distancia desde la punta de la aguja. Levante la aguja a partir de la etapa para evitar dañar accidentalmente la aguja al colocar las larvas en el escenario. Retire la punta de la pipeta vacía desde el escenario.
8. inyección de dsRNA
- Coloque las larvas dentro de la canasta eterización. Utilice menos de 10 larvas si el aprendizaje de la técnica. Utilice 30-40 larvas en la primera ronda, una vez familiarizado con la técnica.
- Coloque la canasta con larvas en la botella de éter y cierre la tapa.
NOTA: Éter presenta un peligro de incendio y también es perjudicial. Realice este paso bajo una campana de humos. - Larvas Etherize durante unos 3 min. Compruebe las larvas para el movimiento después de 3 min. Coloque de nuevo en la botella de éter durante otros 30 segundos si todavía se están moviendo. No Etherize durante más de 5 minutos, ya que esto puede aumentar la letalidad.
NOTA: El tiempo óptimo eterización puede variar dependiendo de la temperatura y la humedad. - Transferir las larvas anestesiado de la canasta hasta el borde antiadherente de un portaobjetos de vidrio pegajosa. Con unas pinzas, y mientras mira a través del microscopio, recoger las larvas cada uno por uno y colocarlos en la diapositiva. Colóquelos lateralmente y golpear suavemente hacia abajo sus cuerpos from cabeza a la cola con el fórceps, que se extiende ligeramente a medida que avanza, para asegurarse de que están asegurados en la diapositiva.
- Colocar la placa pegajosa con larvas en la platina del microscopio.
- Insertar la aguja cargada dsRNA suavemente en el lado dorsal de las larvas para evitar daños en el SNC. Evite también la línea media dorsal, como el corazón larval se encuentra aquí. En esta y las siguientes etapas, utilice siempre la etapa de mover las larvas a la aguja (en lugar de utilizar el manipulador de aguja para mover la aguja).
NOTA: El sitio de la inyección específica no importa como RNAi en T. castaneum parece ser sistémica. Sin embargo, es generalmente más fácil de inyectar en el lado dorsal de los segmentos torácicos o abdominales. - Después de insertar la aguja en las larvas, saque la aguja ligeramente hacia atrás para dejar espacio para el ARN de doble cadena para entrar en la cavidad del cuerpo de las larvas.
- Empuje suavemente en la jeringa de inyección hasta que el color verde a su vez las larvas (o el color de la memoria intermedia de inyección) y buscar stretched y lleno.
NOTA: Si el aprendizaje de la técnica, tratar de inyectar tanto como sea posible para determinar la cantidad de solución que se puede inyectar en una larva sin letalidad significativa. Es generalmente de aproximadamente 0,5-0,7 l. - Retire la aguja de las larvas. Al retirar la aguja, extraiga un poco atrás de la jeringa de inyección para evitar la pérdida de ARN de doble cadena (también tenga cuidado de no tirar en el aire).
- Inyectar todas las larvas en la diapositiva. Asegúrese de eliminar las larvas que no fueron inyectados con éxito. Inyección completa antes de larvas despertar (en aproximadamente 10 min).
- Retire la diapositiva con larvas inyectado desde el microscopio de inyección y dejar el portaobjetos durante 5 minutos más hasta que todas las larvas se recupere de la eterización.
- Con unas pinzas y bajo un microscopio de disección, levante suavemente las larvas de la cabeza a la cola para liberarlos de la diapositiva pegajosa. Coloque las larvas recién publicado en una placa de Petri limpia. Deja las larvas en la placa de Petri durante 10-15 minutos para permitir la inyección wound a coagularse.
- Colocar las larvas en una nueva botella con harina limpio y apropiadamente etiqueta con el nombre de la cepa, el tipo de dsRNA inyectado, la concentración de dsRNA, número de larvas inyectado, y la fecha.
- Cultura las larvas inyectado a 30 ° C con 70% de humedad. Observar las larvas de RNAi fenotipos regularmente.
NOTA: La última pupate estadio las larvas dentro de los 7 días. Entonces, las pupas se Eclose en adultos después de 7 días (si no hay anormalidad en el momento causado por RNAi).
9. Confirmación de la Rebaja y fenotípicas análisis
- Considere la posibilidad de evaluar la eficiencia de RNAi tumbar por varias técnicas de biología molecular diferentes, tales como cuantitativa transcripción reversa-PCR (QRT-PCR) y Western Blot. Ver protocolo de Miller et al. 2012 7 y Felipe y Tomoyasu 2011 11 para detallado qPCR y Western Blot, respectivamente.
- Analizar RNAi fenotipos relacionados.
NOTA: RNAi relacionadosfenotipos se pueden observar en diferentes etapas y bajo diferentes condiciones de cultivo, dependiendo de los genes que fueron dirigidos. RNAi puede afectar a la morfología del escarabajo, la metamorfosis, la fisiología y el comportamiento. ¿Con qué frecuencia la presencia de fenotipo se comprueba y bajo qué condiciones los escarabajos se crían deben adaptarse a las preguntas específicas que están siendo investigados por RNAi.
Resultados
Uno de los pasos clave para la inyección de éxito es hacer una buena aguja. Como se describe en el paso 6, la punta de la aguja debe ser roto antes de inyectar T. castaneum. Ejemplos de agujas buenos y malos se muestra en la Figura 1. Una buena aguja tiene una punta afilada y rígido, con una abertura de diámetro de aproximadamente 0,05 mm (Figura 1B).
La Figura 2 presenta una inyección de éxito (Figuras 2A y 2B), así como varios casos de inyecciones sin éxito (Figuras 2C-2F). Con una aguja de inyección de tamaño adecuado, la punta de la aguja penetra la cutícula larval con mínima resistencia (Figura 2A), y la solución dsRNA (verde) desemboca en las larvas sin ninguna fuga (Figura 2B). No sobre-inyección, ya que hará que el desbordamiento de la solución de ARN de doble cadena, incluso con una aguja de inyección de tamaño adecuado (Figura2C). Si la punta de la aguja es demasiado delgada, la punta de la aguja a menudo no penetrar en la cutícula de las larvas y curvas, lo que hace difícil la inyección (Figura 2D). Si esto sucede, el recorte de la punta de la aguja a veces ayuda. Agujas más grandes son a menudo aún utilizable, aunque con algunas dificultades para penetrar la cutícula larval (Figura 2E). Sin embargo, una gran cantidad de la solución de dsRNA es empujado fácilmente hacia fuera de la aguja incluso con una ligera presión en la jeringa de inyección, a menudo resulta en un desbordamiento de la solución de dsRNA (Figura 2F).
Al realizar RNAi, es importante tener un control positivo para evaluar que el ARNi está funcionando correctamente, y un control negativo para verificar que el efecto observado no es un efecto no específico de dsRNA o una consecuencia de los procedimientos de inyección (tales como el daño causado por inyección, o anormalidad de eterización). La inyección de dsRNA EYFP de direccionamiento puede servir como unbuen control positivo cuando se utiliza la cepa de 5,7 pu-11. Cuando EYFP dsRNA se inyecta en la última etapa larval, una reducción significativa en la señal de EYFP en el futuro los primordios de ala puede observarse tan pronto como un día después de la inyección (Figura 3A). La caída de EYFP es completa dos días después de la inyección de la EYFP dsRNA (Figura 3B), y esta caída persiste a través de la (Figuras 3C y 3D) de la etapa de pupa y durante toda la vida del escarabajo si la concentración de dsRNA es lo suficientemente alta (por ejemplo, 1 g / l) 7. EYFP dsRNA también puede ser utilizado como un control negativo, ya que es una secuencia de gen no endógeno y no debe causar interrupciones morfológicos o fisiológicos (Figuras 3A-3D).
Proporcionamos imágenes de larvas RNAi para vestigial (vg), un gen crítico ala 12, como otro ejemplo de cómo efcionará esta técnica de ARNi basados en la inyección es en T. castaneum. Cuando dsRNA para VG se inyecta en larvas penúltima etapa (una etapa antes de la última etapa larval), una pérdida completa de las estructuras de las alas puede ser observado en la fase de pupa (Figuras 3E y 3F). El adulto que resulta también carece por completo las estructuras de las alas (Figuras 3G y 3H). El resultado RNAi para vg ejemplifica tanto la solidez y el carácter sistémico de RNAi en T. castaneum.
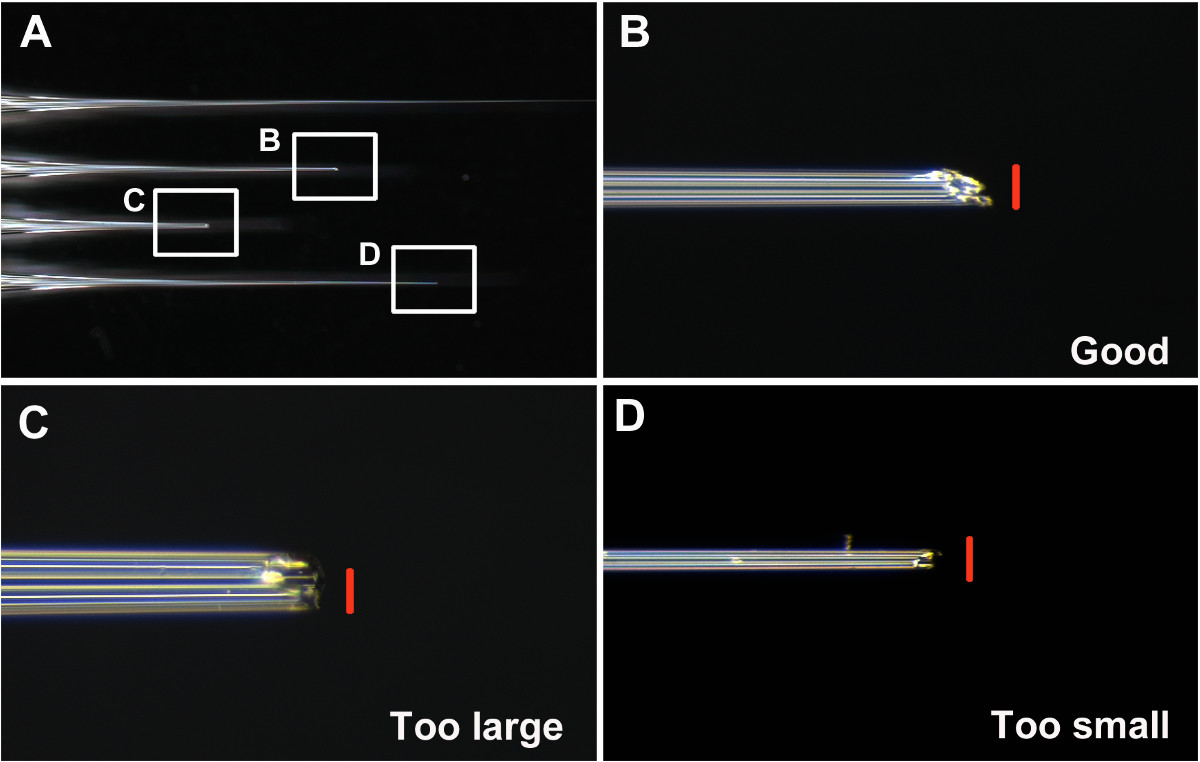
Figura 1: (A) Ejemplos de agujas ininterrumpidas, buenas y malas (B) La punta de una buena aguja bien roto-(C) La punta de una aguja rota que es demasiado grande y romo (D) La punta... de una quiebra n de aguja que es demasiado delgada. Las barras de escala (rojo) son de 0,05 mm. Por favor haga clic aquí para ver una versión más grande de esta figura.

Figura 2:... (A) una aguja de inyección de tamaño adecuado inserta en el último instar de la larva (B) Larva inyecta apropiadamente con la solución de dsRNA verde (C) de desbordamiento de la solución de dsRNA en el punto causado por la sobre-inyección de inyección (D ) una aguja fina no poder penetrar en la cutícula de las larvas. (E) Una aguja de inyección grande insertado en el último instar de la larva. (F) Larva inyecta con una aguja grande, resultando en desbordamiento y las fugas de la solución de dsRNA. Las flechas indican las agujas.ove.com/files/ftp_upload/52059/52059fig2highres.jpg "target =" _blank "> Haga clic aquí para ver una versión más grande de esta figura.
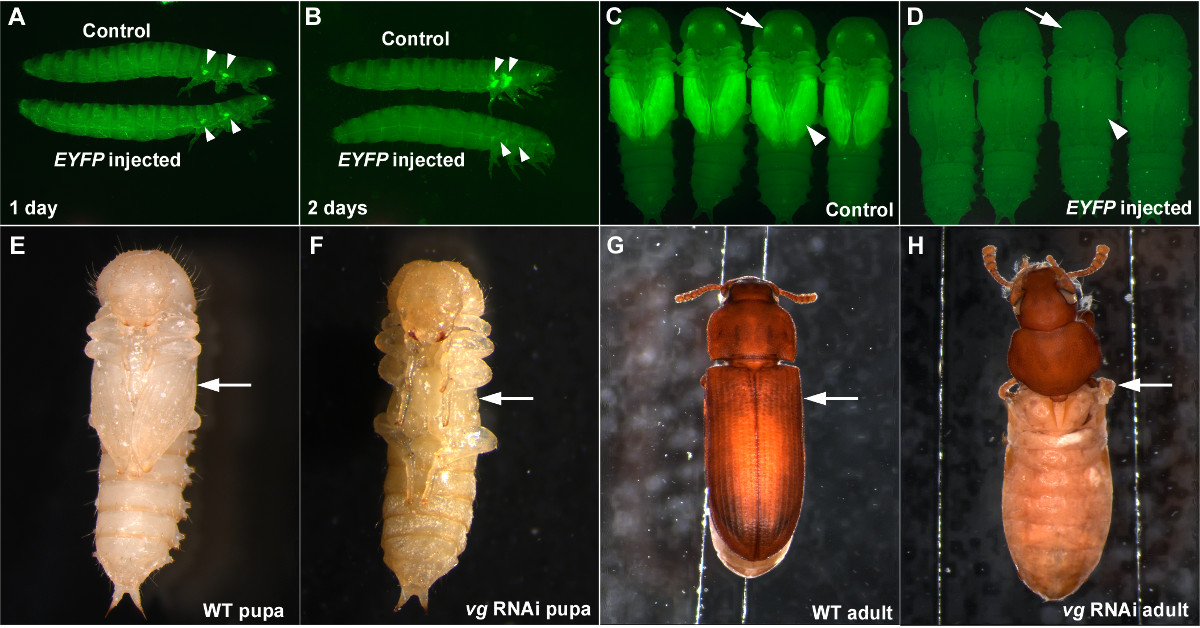
Figura 3: Ejemplos de éxito RNAi en T. castaneum. (AD) última inyección de larvas de los resultados EYFP de dsRNA en una reducción de la expresión EYFP. (A) Las larvas un día después de la inyección. (B) Las larvas de dos días después de la inyección. (C) pupas de control. (D) resultante de pupas inyección larval EYFP dsRNA. Los controles negativos son la inyección de tampón (A, B) y dsRed inyección de dsRNA (C, D). Las puntas de flecha y las flechas indican la expresión EYFP o falta de ella en los primordios y ojos ala, respectivamente. (EH) Penúltima larval RNAi para vg. (E) de tipo salvaje pupa. (F) vg RNAi pupa. La falta de estructuras de las alas es ya visible en la fase de pupa (flecha). G) de tipo salvaje adulto. (H) vg RNAi adulto. Estructuras de ala relacionados faltan por completo (flecha). Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hay una serie de cuestiones importantes que deben tenerse en cuenta para garantizar el éxito de RNAi, incluyendo la longitud y la concentración de las moléculas de ARN de doble cadena, la competencia entre las diferentes moléculas de ARN de doble cadena (al intentar derribar múltiples), y la posibilidad de fuera de objetivo efectos (OTE).
dsRNA Longitud
La longitud de las moléculas de dsRNA afecta la eficiencia de la respuesta sistémica RNAi, con un dsRNA ya ser más eficientes para desencadenar RNAi 7,14,15 (aunque actualmente se desconoce el límite más largo de dsRNA). La longitud de dsRNA debe ser más largo que 50 pb para inducir eficaz RNAi en T. castaneum 7. dsRNA entre 150 pb y 500 pb parece ser ideal para experimentos de RNAi. Aunque más largas moléculas de ARN de doble cadena se pueden utilizar también, tendrán una mayor probabilidad de OTE y el paso de genes de clonación será cada vez más difícil.
dsRNA Concentración
ve_content "> Diferentes grados de caída gen se puede lograr en función de la concentración de dsRNA. 1 g / l parece ser una concentración de partida razonable, que a menudo produce un fenotipo casi nula (puede variar dependiendo del gen (s) de interés ). RNAi se puede realizar con una concentración más alta (por ejemplo, 7-8 g / l) para obtener un fenotipo más fuerte RNAi. RNAi con una dilución en serie de dsRNA a veces puede ser beneficioso para producir una serie de fenotipos hypomorphic (datos suplementarios de Tomoyasu et al. 2009 8, y Borràs-Castells datos no publicados).RNAi Competencia
Múltiples genes desmontables se puede lograr en T. castaneum mediante la inyección de varias diferentes moléculas de dsRNA simultáneamente. Sin embargo, también se sabe que tiene varias diferentes moléculas de dsRNA presentes en el organismo a menudo resulta en la competencia entre los dsRNAs para el acceso a los componentes de RNAi 7,14. Es importante la utilización de la misma longitud y la misma concentración para todos dsRNA al intentar múltiples genes desmontables para evitar un dsRNA fuera compitiendo los demás (aunque, más ajustes de la longitud dsRNA y concentración pueden ser necesarios cuando los niveles de expresión muy diferentes entre los genes diana). Nosotros, al igual que otros, hemos realizado con éxito caída doble y triple (por ejemplo, Tomoyasu et al. 2005 16, Tomoyasu et al. 2009 17 y Yang et al. 2009 18). Aunque factible, cuádruples RNAi (o más) puede ser un reto, ya que probablemente causaría una reducción significativa de la eficiencia de RNAi para los cuatro genes diana.
Off de metas
OTE es una preocupación inherente a los enfoques basados en RNAi. Una forma de minimizar OTE es identificar regiones en el gen diana que comparten secuencias similares con otros genes y evitar estas regiones en el diseño de dsRNA. Un análisis BLAST simple en contra de la T. castaneum conjunto de genes predicho puede identificar tales regiones. Varias herramientas en línea también permiten la evaluación del potencial OTA (por ejemplo, E-RNAi 19). Realización de RNAi para dos regiones no superpuestas del gen diana es una manera fácil y eficiente para eliminar la posibilidad de que observaron fenotipos son causados por OTE. La posibilidad de OTE se minimiza si RNAi para dos regiones no superpuestas produce los mismos fenotipos (a menos que las dos regiones no superpuestas comparten una secuencia similar).
Evaluación de gen desmontables por medios distintos de los análisis fenotípico es a menudo crítico para efectivamente presentes datos relacionados con RNAi. Dos formas principales para evaluar genes desmontables son QRT-PCR y Western blot. QRT-PCR es una manera conveniente para medir el nivel del ARNm diana, y se ha utilizado en muchos estudios relacionados RNAi-incluyendo los de T. castaneum (véase Miller et al. 2012 7 por ejemplo). However, se debe tener cuidado, como hemos visto recientemente algunos casos en los que el nivel de ARNm objetivo hasta reguladas por RNAi (aunque el producto de proteína es regulada hacia abajo-) (Borràs-Castells datos no publicados). Aún no se sabe si este ARNm RNAi inducida sobre regulación puede ser generalizado o única de ciertos genes. El análisis de transferencia Western es otra manera de confirmar gen desmontables. Este método es bastante fiable, ya que mide la cantidad del producto de proteína final. El requisito de un anticuerpo específico contra la proteína producto del gen diana es una desventaja de este enfoque. La utilización de múltiples mediciones independientes además de análisis fenotípico aumentará la confianza de los datos fenotípicos obtenidos por análisis basado en RNAi.
Desde su concepción en T. castaneum, RNAi principalmente se ha usado para estudiar la función de genes en el desarrollo y formación de patrones. Estos T. estudios de desarrollo castaneum han tenido mucho éxito en caracterizing evolutivamente conservados y divergieron funciones de los genes (revisado en 2008 Denell 1 y Klingler 2004 2). Sin embargo, estudios basados en RNAi en T. castaneum no se limitan a la biología del desarrollo. Por ejemplo, el ARNi puede ser utilizado para estudiar la función de genes en una amplia gama de respuestas fisiológicas y de comportamiento, incluyendo la tolerancia al estrés, la depredación, la agresión, la elección de pareja, patrones de actividad, y los mecanismos de defensa.
Una de las dificultades de la aplicación de RNAi a estos contextos es la probabilidad de efectos pleiotrópicos. A menudo, los genes de interés tendrán una variedad de papeles en todo el T. ciclo de vida castaneum, con lo que la eliminación de genes no deseados sin efectos fenotípicos difíciles. Sin embargo, la capacidad de realizar fácilmente RNAi en una variedad de etapas a menudo puede ser una estrategia eficaz para evitar estos efectos pleiotrópicos. Por ejemplo, la realización de RNAi en los adultos en lugar de larvas o pupas podría permitirnos eludir unintendido letalidad causada por la caída de genes durante el desarrollo temprano. La flexibilidad de la respuesta de RNAi en T. castaneum por lo tanto hace que este modelo una opción atractiva para la adaptación de RNAi para los experimentos de la función de genes en las respuestas fisiológicas y de comportamiento.
El T. sistema castaneum también es ideal para su uso en un laboratorio de enseñanza. T. castaneum puede ser fácilmente cultivadas en una harina / mezcla de la levadura a temperatura ambiente (25 ° C) sin subcultivo frecuente, y las técnicas de ARNi en T. castaneum son lo suficientemente simple como para ser adaptado a un laboratorio con científicos jóvenes y de aprendizaje. Como RNAi se está convirtiendo en una técnica esencial en una variedad de campos biológicos, es fundamental que los estudiantes están expuestos a esta técnica. La naturaleza recta de avance de la técnica de RNAi larval en T. castaneum también alienta a más estudiantes a que participen en la investigación, por lo que T. castaneum un candidato ideal para un salón de clases sistema genético orientado.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al Centro de Bioinformática y Genómica Funcional (CBFG) en la Universidad de Miami para el apoyo técnico. Este trabajo fue apoyado por la Universidad de Miami subvención de puesta en marcha (YT), y la Fundación Nacional para la Ciencia (YT: IOS 0.950.964).
Materiales
| Name | Company | Catalog Number | Comments |
| Organic whole wheat flour | Heartland Mill Inc. Kansas | G1 | |
| Brewer’s yeast | MP Biomedicals | 2903312 | Sift yeast with #35 stainless sieve before use. Wear protective mask and cover the sieve with plastic wrap, as the sifted yeast is a fine particle and respiratory hazardus. |
| 6 oz plastic Drosophila stock bottles | Fisher Scientific | 11-888 | |
| Sieve | Fisher Scientific | 04-881N | 8 in. dia. x 2 in.D. Use #25 (Nominal opening 710 µm) for larvae, pupae, and adults. |
| Sieve | Fisher Scientific | 04 881 10P | 8 in. diameter #35 (Nominal seive opening: 600 µm) Stainless Steel Sieves, 8 in. dia. x 2 in.D. This sieve is ideal to remove clumps from yeast powder. |
| Sieve receiver | Fisher Scientific | 04-866B | 8 in. diameter |
| 1.5 Quart spouted sample pan | Seedburo Equipment Co. | Model 33 | collection pan |
| Incubator | BioCold Environmental Inc | BC26-IN | Keep it 30 °C with 70% humidity. |
| Na2HPO4 | Fisher Scientific | S374500 | |
| NaH2PO4 | Fisher Scientific | S397-500 | |
| KCl | Fisher Scientific | P217-500 | |
| Food dye | Kroger | green, blue, or red preferable | |
| Microscope glass slide | Fisher Scientific | 22-038-103 | |
| Tack-It Over&Over | Aleene's | Repositionable glue for sticky slides. Double sided tape can be used as an alternative, however, we found that the adhesiveness varies. | |
| Plastic CD case | Amazon | ||
| Boroslilicate glass capillary | Sutter Instrument | BF100-50-15 | O.D. 1 mm, I.D. 0.5 mm, 15 cm. Without filament |
| Needle puller | Sutter Instrument | P-87 or P-97 | |
| Removable mounting putty | Loctite Fun-Tak | ||
| Compressed gas duster | OfficeMax | OM96091 | |
| Forceps | Fine Science Tool | 11231-30 | Dumoxel #3 (to manipulate beetles) |
| Forceps | Fine Science Tool | 11252-20 | INOX #5 (to break needle tips) |
| Ethyl ether, anhydrous | Fisher Scientific | E138-500 | |
| Nylon mesh | Flystuff/Genessee Scientific | 57-102 | 120 µm pore size/49% open area |
| Media bottle, 100 ml | VWR | 89000-926 | |
| Stereomicroscope | Zeiss | SteREO Discovery V12. Injection microscope. | |
| Stereomicroscope | Fisher/Zeiss | 12-070-513 | Stemi2000. Use to break the needle and place larvae onto the sticky slide. |
| X-Y mechanical stage | Zeiss | 4354600000000000 | |
| X-Y mechanical stage | Microscopenet.com | A512 | Inexpensive alternative |
| Manipulator | Narishige | M-152 | |
| Magnetic stand | Narishige | GJ-1 | |
| Glass capillary holder | Narishige | IM-H1 | |
| 30 ml Disposable syringe | BD syringe | 309650 | BD Luer-Lok Tip |
| Four-way stopcock | Cole-Parmer Instrument Co. | EW-30600-03 | Stopcocks with Luer connections; 4-way; male slip |
| Art paint brush | Amazon | Art Advantage Oil and Acrylic Brush Set, 24-Piece | Any general paint brush will work. |
Referencias
- Denell, R. Establishment of Tribolium as a genetic model system and its early contributions to evo-devo. Genetics. 180, 1779-1786 (2008).
- Klingler, M. Tribolium. Curr Biol. 14, R639-R640 (2004).
- Richards, S., et al. The genome of the model beetle and pest Tribolium castaneum. Nature. 452, 949-955 (2008).
- Bucher, G., Scholten, J., Klingler, M. Parental RNAi in Tribolium (Coleoptera). Curr Biol. 12, 85-86 (2002).
- Tomoyasu, Y., Denell, R. E. Larval RNAi in Tribolium (Coleoptera) for analyzing adult development. Dev Genes Evol. 214, 575-578 (2004).
- Tomoyasu, Y., et al. Exploring systemic RNA interference in insects a genome-wide survey for RNAi genes in Tribolium. Genome biology. 9, R10 (2008).
- Miller, S. C., Miyata, K., Brown, S. J., Tomoyasu, Y. Dissecting systemic RNA interference in the red flour beetle Tribolium castaneum parameters affecting the efficiency of RNAi. PLoS ONE. 7, e47431 (2012).
- Tomoyasu, Y., Arakane, Y., Kramer, K. J., Denell, R. E. Repeated co-options of exoskeleton formation during wing-to-elytron evolution in beetles. Curr Biol. 19, 2057-2065 (2009).
- Miller, S. C., Brown, S. J., Tomoyasu, Y. Larval RNAi in Drosophila. Dev Genes Evol. 218, 505-510 (2008).
- Brown, S. J., Mahaffey, J. P., Lorenzen, M. D., Denell, R. E., Mahaffey, J. W. Using RNAi to investigate orthologous homeotic gene function during development of distantly related insects. Evolutio., & development. 1, 11-15 (1999).
- Philip, B. N., Tomoyasu, Y. Gene knockdown analysis by double-stranded RNA injection. Methods Mol Biol. 772, 471-497 (2011).
- Clark-Hachtel, C. M., Linz, D. M., Tomoyasu, Y. Insights into insect wing origin provided by functional analysis of vestigial in the red flour beetle. Tribolium castaneum, Proceedings of the National Academy of Sciences of the United States of America. 110, 16951-16956 (2013).
- Kitzmann, P., Schwirz, J., Schmitt-Engel, C., Bucher, G. RNAi phenotypes are influenced by the genetic background of the injected strain. BMC genomics. 14, 5 (2013).
- Parrish, S., Fleenor, J., Xu, S., Mello, C., Fire, A. Functional anatomy of a dsRNA trigger differential requirement for the two trigger strands in RNA interference. Molecular cell. 6, 1077-1087 (2000).
- Winston, W. M., Molodowitch, C., Hunter, C. P. . Systemic RNAi in C elegans requires the putative transmembrane protein SID-1. 295, 2456-2459 (2002).
- Tomoyasu, Y., Wheeler, S. R., Denell, R. E. Ultrabithorax is required for membranous wing identity in the beetle Tribolium castaneum. Nature. 433, 643-647 (2005).
- Trauner, J., et al. Large-scale insertional mutagenesis of a coleopteran stored grain pest, the red flour beetle Tribolium castaneum, identifies embryonic lethal mutations and enhancer traps. BMC Biol. 7, 73 (2009).
- Yang, X., et al. Probing the Drosophila retinal determination gene network in Tribolium (II) The Pax6 genes eyeless and twin of eyeless. Developmental biology. 333, 215-227 (2009).
- Horn, T., Boutros, M. E-RNAi a web application for the multi-species design of RNAi reagents--2010 update. Nucleic acids research. 38, 332-339 (2010).
Erratum
Formal Correction: Erratum: Larval RNA Interference in the Red Flour Beetle, Tribolium castaneum
Posted by JoVE Editors on 10/01/2015. Citeable Link.
An erratum was issued for Larval RNA Interference in the Red Flour Beetle, Tribolium castaneum. There was a typo in the settings for Sutter P-87 in step 4.1.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados