Method Article
Larven RNA-Interferenz in das rote Mehlkäfer,
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Erratum Notice
Zusammenfassung
RNA-Interferenz (RNAi) basierten Gen-Knockdown-Techniken sind der Kern der Tribolium Forschung. Hier geben wir einen Überblick über unsere Larven RNAi-Technik in Tribolium castaneum. Larven RNAi ist eine einfache, aber leistungsfähige Technik, die den schnellen Zugriff auf Verlust-Funktion Phänotypen bietet, so dass die Forscher Gen-Funktionen in verschiedenen Kontexten zu studieren.
Zusammenfassung
Der rote Mehlkäfer, Tribolium castaneum bietet ein Repertoire von Versuchswerkzeugen für genetische und Entwicklungsstudien, inklusive einer vollständig annotierte Genomsequenz, Transposon-basierten Transgenese und effektive RNA-Interferenz (RNAi). Unter diesen Vorteilen sind RNAi-basierte Gen-Knockdown-Techniken im Mittelpunkt der Tribolium Forschung. T. castaneum zeigen eine robuste systemischen RNAi-Antwort, die es ermöglichen, RNAi jederLebensPhase durchführen, indem Sie einfach die Injektion doppelsträngiger RNA (dsRNA) in die Körperhöhle des Käfers.
In diesem Bericht stellen wir einen Überblick über unsere Larven RNAi-Technik in T. castaneum. Das Protokoll umfasst (i) Isolieren der richtigen Phase des T. castaneum Larven zur Injektion, (ii) Vorbereitung für den Einspritzeinstellung und (iii) dsRNA-Injektion. Larven RNAi ist eine einfache, aber leistungsfähige Technik, die uns mit den schnellen Zugriff auf Verlust-of-function Phänotyp bietetES, darunter mehrere Gen-Knockdown-Phänotypen sowie eine Reihe von Phänotypen hypomorphen. Da fast alle T. castaneum Gewebe sind anfällig für extrazellulären dsRNA kann der Larven RNAi-Technik Forscher eine Vielzahl von Geweben in verschiedenen Zusammenhängen, einschließlich genetischer Grundlage organismal Antworten auf die Außenumgebung zu studieren. Darüber hinaus ist die Einfachheit dieser Technik stimuliert mehr Beteiligung der Studierenden in die Forschung, so dass T. castaneum ideale genetisches System für die Verwendung in einem Klassenzimmer.
Einleitung
Der rote Mehlkäfer, Tribolium castaneum, ist an Popularität gewinnt in verschiedenen Bereichen der Biologie zum Teil aufgrund der einfachen Durchführung der RNA-Interferenz (RNAi) 1-3. RNAi-basierte Gen-Knockdown-Techniken den Wissenschaftlern ermöglichen, führen loss-of-function-Analysen ohne Verwendung komplexer genetischer Methoden. T. castaneum zeigen eine robuste systemischen RNAi-Antwort, die es ermöglichen, RNAi in jeder Phase durch einfache Injektion von doppelsträngiger RNA (dsRNA) in der Käfer Körperhöhle 4-6 durchzuführen. Gleichzeitige Knockdown von mehreren Genen ist auch denkbar, in T. castaneum durch Einspritzen von zwei oder mehr verschiedenen dsRNA-Moleküle gleichzeitig 7,8. Darüber hinaus kann eine Reihe von Phänotypen hypomorphen durch Verringerung der Konzentration der dsRNA injiziert 8 erzeugt werden. Diese Eigenschaften machen RNAi-basierten Reverse genetische Techniken attraktive Alternativen zu herkömmlichen vorwärts Genetik in T. castaneum. Da praktischalle T. castaneum Gewebe sind anfällig für extrazellulären dsRNA-Moleküle 9, diese Technik können Forscher eine Vielzahl von Geweben in verschiedenen Kontexten zu untersuchen. Darüber hinaus, obwohl dieser Bericht konzentriert sich auf die Durchführung von RNAi in T. castaneum, sind hier beschrieben viele Verfahren auf andere Insekten. Daher ist dieses Protokoll nützlich für diejenigen führen möchten Verlust-Funktion analysiert in ihren Zusammenhängen von Interesse in T. castaneum, als auch für Forscher, die ein RNAi-basierte Technik, um andere Insekten gelten.
Einspritzen von dsRNA in Larven ermöglicht Funktionsanalyse bei einer Vielzahl von Käferlebensstadien, einschließlich der Larven, Puppen und adulte Stadien 4,5,10. Wir haben bereits berichtet unser Gesamtlarven RNAi-Protokoll einschließlich Molekularbiologie Verfahren 11. Im vorliegenden Bericht konzentrieren wir uns auf die Beschreibung der dsRNA Injektionsverfahren, die am besten mit visuellen Hilfen erläutert werden. Wir bietenausführliche Schritt-für-Schritt-Einspritzverfahren sowie gute und schlechte Beispiele Injektion. Diese visuelle Protokoll ergänzt unsere bisherigen Protokoll, und wenn sie kombiniert, bieten sie eine umfassendere Sicht der Larven RNAi Verfahren in T. castaneum. Darüber hinaus diskutieren wir Parameter für dsRNA-Moleküle, die den Erfolg der RNAi, die Anwendung von RNAi-basierten Assays für physiologische Forschung, sowie die Anwendbarkeit des Larven RNAi-Protokoll in einer Lehre Labor beeinträchtigen könnten.
Protokoll
1. T. castaneum Aktien und Anzucht
- Entscheiden Sie sich für eines T. castaneum Stamm für das Experiment zu verwenden.
HINWEIS: Mehrere Labor etablierten T. castaneum Stämme sind verfügbar. Ga-1 (Georgia-1) ist der elterliche Stamm von Ga-2, die für die Genomsequenzierung 3 verwendet wurde. Da Ga-1 teilt die meisten DNA-Polymorphismen (wie Single-Nukleotid-Polymorphismen, SNPs) mit Ga-2 und ist gesünder als Ga-2 durch weniger Inzucht, ist es ideal für RNAi-Experimente. Pu-11 ist eine weitere Belastung bequem zu bedienen , als seine einzigartige verbesserte gelb fluoreszierende Protein (EYFP) Ausdruck in der Zukunft Flügel Primordia erlaubt uns, die letzten Larvenstadium von anderen Stadien zu unterscheiden (siehe Abbildung S4 der Clark-Hachtel et al. 2013 12). Es ist wichtig zu dokumentieren, welche Käfer-Stamm in dem Experiment verwendet wurde, wie genetischen Hintergründen erscheinen deutlich affect die RNAi Phänotypen 13. - Bereiten T. castaneum Kultur Mehl durch Zugabe von 5% (nach Gewicht) von Pre-gesiebt Bierhefe zu Bio-Vollkornmehl (nach dem Mischen, speichern Sie die Kultur Mehl bei -20 ° C). Aliquot der Kultur Mehl (bei Raumtemperatur) in 6 Unzen Kunststoff Drosophila Vorratsflaschen (ca. 40 g / Flasche).
- Kultur T. castaneum bei 30 ° C mit 70% Feuchtigkeit. Verwenden Sie eine feuchtigkeitsgesteuerten Inkubator, wenn möglich. Fügen 30-40 Erwachsene pro Kulturflasche (männlich: weiblich Verhältnis 1: 1), um die Kultur zu starten.
HINWEIS: Obwohl Form ist selten ein Problem bei 30 ° C niedrigere Temperaturen (wie 25 ° C) mit 70% Luftfeuchtigkeit kann Schimmelpilzwachstum in der Kultur Mehl verursachen. Senken Sie die Luftfeuchtigkeit, wenn dies geschieht. - Übertragen Sie die Erwachsenen zu einer neuen Kulturflasche alle zwei Wochen zur Subkultivierung (siehe Schritt 5,2-5,5 damit wie Erwachsene aus Kultur Mehl zu isolieren).
HINWEIS: Es dauert etwa drei Wochen, um die letzten Larvenstadium zu erhalten. Alternathungsweise, T. castaneum Kulturen bei einer niedrigeren Temperatur (20-25 ° C) mit einer längeren Kultivierung Zeitraum aufbewahrt werden, wenn auch (Entwicklungszeit bei 25 ° C etwa doppelt so bei 30 ° C).
2. Herstellung von Lösungen und Instrumente zum Larven dsRNA Injektion
- Synthese von dsRNA-Moleküle homolog zu der Ziel-Gens durch in vitro-Transkription. Bei -80 ° C. Siehe Philip und Tomoyasu 2011 11 für detaillierte molekularbiologische Verfahren. Siehe auch Diskussion für eine Anzahl von Parametern, die berücksichtigt werden müssen bei der Entwicklung dsRNA-Moleküle.
- Machen 10 ml 0,1 M Natriumphosphatpuffer (pH 7,6 bei 25 ° C) durch Mischen von 8,5 ml 1 M Na 2 HPO 4 mit 1,5 ml 1 M NaH 2 PO 4. Überprüfen Sie den pH-Wert mit einem pH-Meter und entsprechend anpassen.
- Auffüllen auf 1 ml 10x Injektionspuffer durch Mischen von 10 ul 0,1 M Natriumphosphatpuffer (pH 7,6 bei 25 ° C), 100 _6; l 0,5 M KCl, 100 ul grüne Lebensmittelfarbe, und 790 ul doppelt destilliertem Wasser (ddH2O). Verdünnen Sie die 10x Injektionspuffer auf 2x Injektionspuffer (200 ul 10x Injektionspuffer + 800 ul ddH 2 O) zu machen. Lagern, 10x und 2x Injektionspuffer bei 4 ° C, bis sie benötigt.
- Bereiten Sticky Glasobjektträger.
- Decken eine ganze Glasträger mit einer Form von Haftkleber für Larven Injektionen. Für Erwachsene oder Puppen Injektionen, machen zwei dünne Streifen von Kleber entlang den längeren Kanten der Folie.
- Der Kleber für mehrere Tage, was sicherstellt, dass der Kleber klebrig bleibt genug Käfer zu der Folie haften zu trocknen, aber auch biegsam genug ist, um deren Entfernung nach der Injektion erleichtern bleibt.
HINWEIS: Wenn der Kleber bleibt zu klebrig, mit einem Finger, und tippen Sie auf den Leim, die die Klebrigkeit verringern. Jede Folie kann bis zu 40 oder 50 Käfer zu halten, und kann wiederverwendet werden, bis es nicht sicher zu halten, die Tiere. Alterntiv kann doppelseitiges Klebeband verwendet werden, wobei das Band manchmal nicht genug, um die Larven zu halten Klebstoff.
- Machen Sie ein etherization Korb.
- Entfernen Sie den Kolben aus einer 10 ml Einwegspritze, und schneiden Sie die Spritze in die Hälfte der ganzen Linie 6 ml.
- Entsorgen Sie die untere Hälfte der Spritze. Kurz erhitzen die Schnittfläche des oberen Teils der Spritze, die mit einem Gasbrenner, und schnell schieben der geschmolzene Kunststoff auf einem Stück Nylonnetz, das Netz auf die Spritze zu kleben. Schneiden Sie den über Mesh, sobald der Kunststoff aushärtet.
- Bereiten Sie die Äther-Flasche. 30 ml Äther in einen schmalen Mund-100 oder 250 ml Glasflasche. Fügen mehrere Stücke von Tissue-Papier, um die Verdampfung des Ethers zu verbessern.
HINWEIS: Ether stellt eine Brandgefahr dar und ist auch schädlich. Immer Äther behandeln unter einer Abzugshaube. Schließen Sie den Deckel fest, während nicht in Gebrauch ist.
HINWEIS: Ice kann als sicherere Alternative (wie in einem Klassenzimmer) verwendet werden, obwohl die sedation ist weniger effektiv.
3. Herstellung von Larven Pritzvorrichtung
- Ein XY-Kreuztisch auf einem Binokular.
HINWEIS: XY Kreuztische sind über führende Unternehmen Mikroskop. Alternativ können kostengünstig Mikroskoptische auch für die meisten Sezieren Mikroskope mit einigen Modifikationen verwendet werden (siehe Tabelle Werkstoffe zum Beispiel). - Legen Sie eine mechanische Nadel Manipulator in der Nähe der XY-Kreuztisch.
- Montieren Sie eine Injektionsspritze. Verwendung einer Vierwegehahn (mit Luer-Verbindungen), um eine 30 ml Einwegspritze auf eine Glasnadelhalter zu verbinden, so dass Manipulation der Injektionsspritze, ohne den Druck in der Injektionsnadel (siehe Philip und Tomoyasu 2011 11 für die detaillierte Injektionsspritze Montage).
4. Ziehen Injektionsnadeln
- Ziehen Borosilikatglas Nadeln (B100-50-15, OD: 1 mm, ID: 0,5 mm, 15 cm Länge), die durch einNadelmagnet.
HINWEIS: Sutter P-87 oder P-97, verwenden Sie die Einstellung "Heat = 70, Pull = 45, Vel = 75, Time = 90" oder folgen Sie Kapitel 2 der Pipette Cookbook: adhärenten Zell, C. elegans, Drosophila, Zebrafisch und - Empfohlene Programme. Die optimalen Einstellungen variieren je nach Modell von der Nadel abziehen. Die Einstellung für eine generische Drosophila Injektionsnadel ist ein guter Ausgangspunkt. - Shop gezogen Nadeln in einem Kunststoffgehäuse (zB ein Kunststoff CD-Hülle) und mit abnehmbaren Montage Kitt.
5. Isolierung und Selektion von Larven
- Legen Sie ein # 25-Sieb auf ein Sieb Empfänger.
- Legen Sie die Inhalte der Kulturflasche (Käfer und Kultur Mehl) auf dem Sieb und sichten den Inhalt sofort. Die Inhalte auf dem Sieb ohne Sichtung Lassen Sie nicht, wie Larven werden schnell versuchen, durch das Sieb zu graben und nicht weiterkommen. Aggressiv zu sichten den Inhalt in das Mehl fallen lassendurch und lassen ältere Larven (in der Regel 6 und 7. Larvenstadium), Puppen und Erwachsene (zusammen mit ihren abgelegten Nagelhaut, exuviae) hinter auf dem Sieb.
- Übertragen Sie die auf dem Sieb verbleibenden (Käfer und exuviae) auf den Samen Pfanne Materialien. Klopfen Sie die Pfanne, um die Käfer an der Flucht zu verhindern.
- Entfernen Sie die exuviae und die Mehlpartikel auf der Oberfläche verbleibenden der Käfer durch sanft weht über dem Samen Pfanne.
- Tippen Sie auf das Saatgut Pfanne, um den Inhalt auf den Boden der Pfanne zu bewegen. Dann lassen Sie die Pfanne ungenutztes für einige Sekunden. Warten Sie, bis die Erwachsenen, die mobiler als andere Stufen sind, um aus dem Stapel heraus. Erwachsene zu entfernen, indem ein Kunst Pinsel (beispielsweise 1 cm Breite).
- Separate Puppen durch leichtes Klopfen den Samen Pfanne, während die Mündung der Pfanne leicht nach unten, als Puppen sind in der Regel schneller zum Mund rollen. Verwenden Sie einen Pinsel, um die Puppen zu entfernen, so dass nur die Larven auf dem Saatgut Pfanne.
- PlAce den Larven isoliert in einem sauberen Petrischale. Wählen Sie einen geeigneten Stadium der Larven für die Injektion und legen Sie sie in einem separaten Petrischale.
HINWEIS: Anfang letzten Larvenstadium (1-2 Tage nach der letzten Häutung der Larven) sind oft geeignet, wenn die Analyse der RNAi-Effekt auf die Erwachsenen Morphologien sowie Metamorphose. Es ist jedoch manchmal notwendig, RNAi bei der vorletzten zuführen (oder früher) Stufe zur frühen Gen-Funktion zu bewerten (beispielsweise, 3E-3H. Siehe auch Clark-Hachtel et al. 2013 12). Verwenden Puppen als Referenzgröße, um die Larvenstadium der Larven zu identifizieren. Das letzte Larvenstadium sind etwas länger als Puppen. Alternativ können PU-11 verwendet, um die letzten Larvenstadium zu identifizieren sowie den zeitlichen Verlauf der Entwicklung des letzten Larvenstadium (Abbildung S4 in Clark-Hachtel et al. 2.013 12) zu bestimmen. - Halten Sie die ausgewählten Larven in einer Petrischale bis etherization. Legen Sie den Restder Larven und auf anderen Stufen der Käfer (wie Puppen und Erwachsene) wieder in eine Kulturflasche mit Mehl und bringen Sie es in den Inkubator.
6. Herstellung von Injektionsnadeln
- Legen Sie eine zuvor zog Glas Nadel auf einen Glasobjektträger entweder klebrig oder doppelseitiges Klebeband. Mit einer Pinzette, testen Sie die zog Ende der Nadel während Sie durch den Binokular, wo die Spitze biegt sehen. Besorgen Sie sich die Fläche, die etwas in Richtung der Spitze der Seite, wo die Nadel biegt mit der Zange und Wendung zu brechen.
- Halten gute Nadeln und verwerfen andere. Betrachten wir eine gute Nadel mit einer Öffnung, die weder zu groß noch zu klein (etwa 0,05 mm Durchmesser. 1A und 1B) und ist abgewinkelt, um das Eindringen der Larvencuticula einfacher (1B und 2A-2B) zu machen. Betrachten Sie eine schlechte Nadel (i) zu klein, so dass die Aufnahme der dsRNA-Lösung in die Nadel schwieKult (Schritt 7) (1D und 2D), (ii) zu groß ist, was zu Verletzungen und Larven möglich Letalität bei der Injektion (1C und 2F), (iii) stumpf, so dass das Eindringen der Nagelhaut schwierig und zunehmende Verletzung.
- Führen Sie die Nadel in den Nadelhalter.
- Zuerst schrauben Sie die Spitze des Nadelhalters und legen Sie das hintere Ende der Nadel in die Halterung Spitze. Legen Sie dann die Gummidichtung unter dem Halter Spitze (mindestens 1 cm vom hinteren Ende des Glas Nadel).
- Die Rücken der Nadel in die Halterung, mit der Gummidichtung vollständig in die Öffnung des Nadelhalters eingeführt. Schrauben Sie die Spitze zurück auf den Halter.
- Legen Sie die zusammengebauten Nadelhalter auf die Nadel Manipulator. Halten Sie den Nadelhalter in der Nähe von horizontal. Stellen Sie die Position des Manipulators, so dass die Spitze der Nadel in der Mitte der Ansicht befindet, wenn Sie durch den MICRoscope.
7. Frontloading dsRNA-Lösung in die Nadel
- Bereiten Sie die dsRNA Injektionslösung unmittelbar vor der Injektion durch Einstellen der Konzentration mit ddH 2 O und Mischen des dsRNA-Lösung mit gleichen Volumina 2x Injektionspuffer (Schritt 2.3). Halten Sie die Mischlösung auf Eis. Siehe Diskussion über die dsRNA-Konzentration.
- Schneiden Sie die Spitze eines 20 ul Einweg-Pipettenspitze. Je 10 ul der Lösung in die Pipettenspitze getrimmt. Entfernen Sie vorsichtig den Pipettenspitze aus der Pipette, während die Flüssigkeit an der Spitze durch Gegendruck. Alternativ entfernen Sie vorsichtig die Spitze und bewegen Sie dann die Lösung für das Ende der Spitze durch Druck mit einem Finger.
- Die Pipettenspitze mit der dsRNA-Lösung auf dem Mikroskoptisch mit klebrig mit der Öffnung nach die Spitze der Nadel.
- Blick durch das Mikroskop, langsam bewegen die geladene Spitze in Richtung der Nadel, bis die Spitze desNadel ist nur innerhalb des geladenen Pipettenspitze und in die Lösung.
- Während der Blick durch das Mikroskop, ziehen Sie den Kolben der Injektionsspritze langsam ziehen die dsRNA-Lösung in die Nadel.
HINWEIS: Überladen Sie die Nadel. Als das Ende der dsRNA Lösungsansätze die Spitze der Nadel, verlangsamen die Rate zu ziehen und das Laden der Lösung vor der Spitze der Nadel würde Luft zu erreichen. Wenn Luft die Spitze erreicht, wird die Lösung schnell in den Nadelhalter gezogen werden, was zu schweren Kontamination Fragen. Detaillierte Reinigungsverfahren des Nadelhalters in Philip und Tomoyasu 2011 11 beschrieben. - Entfernen Sie den Druck aus der Injektionsspritze und Nadelhalter durch das Öffnen der Hahn. Dann bewegen Sie die Pipettenspitze von der Spitze der Nadel. Heben Sie die Nadel aus der Bühne, um nicht versehentlich zu beschädigen die Nadel beim Aufsetzen der Larven auf der Bühne. Entfernen Sie die geleert Pipettenspitze von der Bühne.
8. dsRNA Injektion
- Legen Sie die Larven in die etherization Korb. Nutzen weniger als 10 Larven, wenn das Erlernen der Technik. Verwenden Sie 30-40 Larven in einer Runde einmal bequem mit der Technik.
- Platzieren Sie den Korb mit Larven im Äther-Flasche und den Deckel schließen.
HINWEIS: Ether stellt eine Brandgefahr dar und ist auch schädlich. Führen Sie diesen Schritt unter einer Abzugshaube. - Etherize Larven für etwa 3 min. Überprüfen Sie die Larven für die Bewegung nach 3 min. Legen Sie sie zurück in den Äther-Flasche für weitere 30 sec, wenn sie noch in Bewegung sind. Nicht länger als 5 min Etherize da dies Letalität erhöhen.
HINWEIS: Die optimale etherization Zeit kann je nach Temperatur und Luftfeuchtigkeit variieren. - Übertragen Sie die veretherte Larven aus dem Korb auf die Antihaft-Kante einer Glas klebrige Folie. Mit einer Pinzette und, während Sie durch das Mikroskop, nehmen Sie jede Larven eine nach der anderen und legen Sie sie auf die Folie. Legen Sie sie seitlich und klopfen Sie leicht nach unten ihre Körper from Kopf bis Schwanz mit der Zange, leicht Stretching ihnen, wie Sie gehen, um sicherzustellen, dass sie auf der Folie gesichert.
- Legen Sie die klebrige Rutsche mit Larven auf dem Mikroskoptisch.
- Legen Sie die dsRNA geladen Nadel vorsichtig in die dorsale Seite der Larven verhindert die Beschädigung des ZNS. Vermeiden Sie auch die Rückenmittellinie, da die Larven Herz befindet sich hier. In dieser und den folgenden Schritten immer die Bühne, um die Larven zu der Nadel (anstatt die Nadel Manipulator, um die Nadel zu bewegen) zu bewegen.
HINWEIS: Die spezifische Injektionsstelle nicht als RNAi Rolle in T. castaneum erscheint systemischen sein. Jedoch ist es üblicherweise am einfachsten in die dorsale Seite der Brust-und Bauchsegmente injizieren. - Nach dem Einlegen der Nadel in die Larven, ziehen Sie die Nadel leicht wieder auf Raum ermöglichen die dsRNA die Larvenkörperhöhle zu gelangen.
- Drücken Sie leicht auf die Injektionsspritze, bis die Larven wiederum grün (oder der Farbe des Injektionspuffer) und suchen stretched und voll.
Hinweis: Wenn das Erlernen der Technik versuchen, so viel wie möglich zu injizieren, um die Menge der Lösung, die in eine Larve ohne signifikante Letalität injiziert werden kann bestimmen. Es ist im allgemeinen etwa 0,5-0,7 ul. - Entfernen Sie die Nadel aus der Larven. Beim Entfernen der Nadel leicht wieder auf die Injektionsspritze auf dsRNA Verlust zu vermeiden ziehen (auch darauf achten, nicht in der Luft zu ziehen).
- Injizieren alle Larven auf der Folie. Achten Sie darauf, Larven, die nicht erfolgreich injiziert wurden, zu entfernen. Vollständige Injektion vor Larven aufwachen (in ca. 10 min).
- Entfernen Sie den Schlitten mit eingespritzt Larven aus der Einspritz Mikroskop und lassen Sie die Folie noch 5 Minuten, bis alle Larven erholen sich von der etherization.
- Mit Pinzette und unter einem Binokular, heben die Larven von Kopf bis Schwanz, um sie von der klebrigen Schieber freizugeben. Legen Sie die neu veröffentlichten Larven in einer sauberen Petrischale. Verlassen Sie die Larven auf der Petrischale für 10-15 min, um die Injektion w ermöglichenound gerinnen.
- Legen Sie die Larven in eine neue Flasche mit sauberem Mehl und Etikett entsprechend der Belastung einschließlich Name, die Art der dsRNA injiziert, der Konzentration der dsRNA, die Anzahl der Larven injiziert und das Datum.
- Kultur der injizierte Larven bei 30 ° C mit 70% Luftfeuchtigkeit. Beachten Sie die Larven für RNAi-Phänotypen regelmäßig.
Hinweis: Die letzten Larvenstadium verpuppen sich innerhalb von 7 Tagen. Dann werden die Puppen zu Erwachsenen nach 7 Tagen schlüpfen (wenn es keine Abnormalität in Zeit durch RNAi verursacht).
9. Bestätigung des Knockdown und phänotypische Analysen
- Sehen Beurteilung Effizienz RNAi knock down von verschiedenen molekularbiologischen Techniken, wie quantitative reverse Transkription-PCR (qRT-PCR) und Western Blotting. Siehe Miller et al. 2012 7 und Philip und Tomoyasu 2011 11 für detaillierte qPCR und Western Blot-Protokoll auf.
- Analysieren RNAi-Phänotypen im Zusammenhang.
HINWEIS: RNAi verwandtenPhänotypen können in verschiedenen Stadien und bei verschiedenen Kulturbedingungen beobachtet werden, abhängig von den Genen, die gezielt wurden. RNAi kann den Käfer Morphologie, Metamorphose, Physiologie und Verhalten beeinflussen. Wie oft die Anwesenheit von Phänotyp wird überprüft und unter welchen Bedingungen die Käfer aufgezogen werden sollten, um den spezifischen Fragen zugeschnitten werden sie durch RNAi untersucht.
Ergebnisse
Einer der wichtigsten Schritte für eine erfolgreiche Injektion ist, um eine gute Nadel machen. Wie in Schritt 6 beschrieben, wird die Spitze der Nadel muß vor dem Injizieren T. gebrochen castaneum. Beispiele für gute und schlechte Nadeln sind in Abbildung 1 dargestellt. Ein guter Nadel hat eine scharfe Spitze und steif, mit einem etwa 0,05 mm Durchmesser Öffnung (Abbildung 1B).
Figur 2 zeigt eine erfolgreiche Injektion (2A und 2B) als auch in mehreren Fällen erfolglos Injektionen (2C-2F). Mit einer richtigen Größe Injektionsnadel dringt die Nadelspitze die Larvencuticula mit minimalem Widerstand (2A), und die dsRNA-Lösung (grün) fließt in die Larven ohne Leckage (2B). Nicht zu spritzen, da es Überlauf des dsRNA-Lösung sogar mit einem richtigen Größe Injektionsnadel (Abbildung verursachen2C). Wenn die Spitze der Nadel zu dünn ist, die Nadelspitze oft nicht die Larvencuticula und Biegungen zu durchdringen, so dass die Injektion schwierig (2D). Wenn dies geschieht, Beschneiden der Nadelspitze hilft manchmal. Größere Nadeln sind oft noch brauchbar, wenn auch mit einigen Schwierigkeiten bei der Durchdringung des Larvencuticula (2E). Jedoch wird eine große Menge der dsRNA Lösung leicht aus der Nadel geschoben auch mit leichtem Druck auf die Injektionsspritze, was häufig zu einem Überlauf des dsRNA-Lösung (2F).
Bei der Durchführung von RNAi, ist es wichtig, eine positive Kontrolle zu haben, um zu beurteilen, dass RNAi ordnungsgemäß funktioniert, und eine negative Kontrolle, um sicherzustellen, dass der beobachtete Effekt nicht eine unspezifische Wirkung von dsRNA oder eine Folge von Einspritzverfahren (wie Schädigung durch Injektion oder einer Missbildung von etherization). Injektion von dsRNA Targeting EYFP kann als dienengute positive Kontrolle bei der Verwendung der PU-11-Stamm 5,7. Wenn EYFP dsRNA ist in der letzten Larvenstadium injiziert wird, kann eine signifikante Reduktion der EYFP-Signal in der Zukunft Flügel Primor Bereits einen Tag nach der Injektion (3A) beobachtet werden. Die Knockdown von EYFP abgeschlossen zwei Tage nach der Injektion des EYFP dsRNA (3B) und das Zuschlags besteht durch das Puppenstadium (3C und 3D) und während der gesamten Lebensdauer des Käfers wenn die dsRNA Konzentration hoch genug ist (wie 1 ug / ul). 7 EYFP dsRNA auch als negative Kontrolle verwendet, da es ein nicht-endogenes Gen-Sequenz und nicht morphologischen oder physiologischen Störungen (3A-3D) verursachen.
Wir stellten Bilder Larven RNAi für Rest (VG), ein kritisches Gen Flügel 12, als ein weiteres Beispiel, wie efdefekt Diese Injektion basierende RNAi-Technik ist in T. castaneum. Wenn dsRNA für vg in vorletzten Larven (eine Stufe vor dem letzten Larvenstadium) injiziert wird, kann ein vollständiger Verlust der Flügelstrukturen im Puppenstadium (3E und 3F) beobachtet werden. Die daraus resultierende Erwachsenen auch ganz fehlt Flügelstrukturen (Abbildungen 3g und 3h). Die RNAi-Ergebnis für vg beispielhaft sowohl die Robustheit und die systemische Natur der RNAi in T. castaneum.
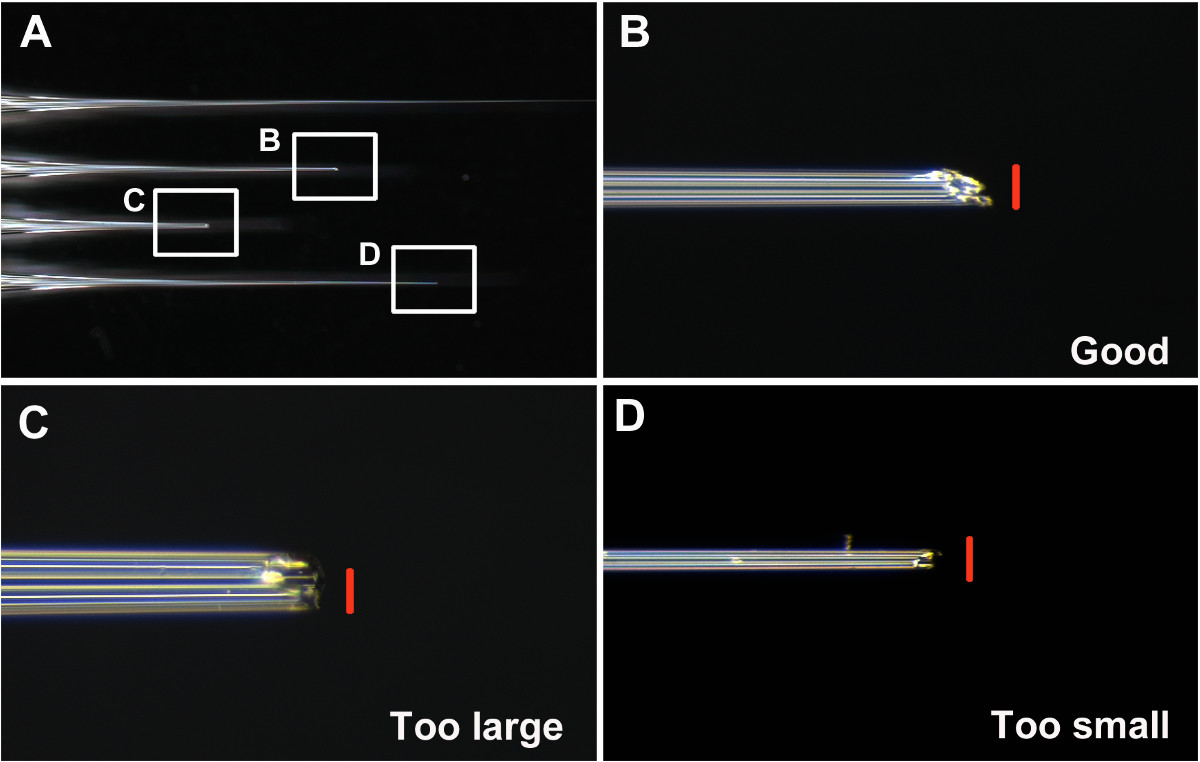
Abbildung 1: (A) Beispiele für ungebrochen, gute und schlechte Nadeln (B) Die Spitze eines gut gebrochen gute Nadel (C) Die Spitze eines gebrochenen Nadel, die zu groß und stumpf ist (D) Die Spitze... einer pleite n Nadel, die zu dünn ist. Maßstabsbalken (rot) sind 0,05 mm. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2:... (A) Eine richtig große Injektionsnadel in den letzten Larvenstadium eingesetzt (B) Larve entsprechend mit dem grünen dsRNA injizierten Lösung (C) Überlauf des dsRNA-Lösung an der Injektionsstelle durch Über Injektion verursacht (D ) Eine dünne Nadel Falls Sie die Larvencuticula eindringen. (E) Eine große Injektionsnadel in den letzten Larvenstadium eingesetzt. (F) eingespritzt Larve mit einer großen Nadel, was zu Überlauf und ein Auslaufen des dsRNA-Lösung. Pfeile zeigen die Nadeln.ove.com/files/ftp_upload/52059/52059fig2highres.jpg "target =" _blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
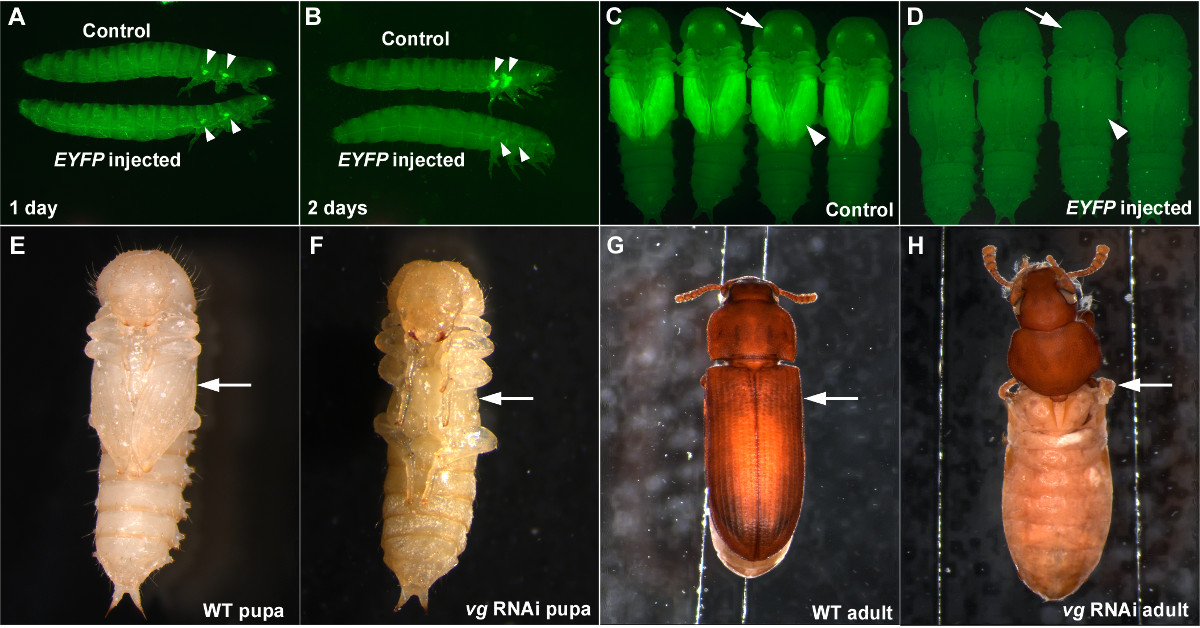
Abbildung 3: Beispiele erfolgreicher RNAi in T. castaneum. (AD) letzten Larven Injektion der EYFP-dsRNA zu einer Verringerung der Expression EYFP. (A) Larven einen Tag nach der Injektion. (B) Larven zwei Tage nach der Injektion. (C) Steuer Puppen. (D) Puppen entstehende Larven EYFP dsRNA Injektion. Die negativen Kontrollen Pufferinjektion (A, B) und dsRed dsRNA-Injektion (C, D). Pfeilspitzen und Pfeile zeigen EYFP Ausdruck oder deren Fehlen in der Flügelprimor und Augen auf. (EH) Penultimative Larven RNAi für vg. (E) Wildtyp-Puppe. (F) vg RNAi Puppe. Das Fehlen von Flügelstrukturen bereits am Puppenstadium (Pfeil). G) Wildtyp Erwachsenen. (H) vg RNAi Erwachsenen sichtbar. Flügel verwandte Strukturen sind vollständig fehlt (Pfeil). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Es gibt eine Reihe von wichtigen Fragen, die berücksichtigt, um den Erfolg zu garantieren RNAi werden müssen, einschließlich der Länge und Konzentration der dsRNA-Moleküle, Wettbewerb zwischen verschiedenen dsRNA-Moleküle (bei dem Versuch mehrere knock down), und die Möglichkeit der Off-Target-Effekte (OTE).
dsRNA Länge
Die Länge der dsRNA Moleküle beeinflusst die Effizienz der systemischen RNAi-Antwort, wobei eine längere dsRNA in dem effizienteren RNAi 7,14,15 auslösen (obwohl die längere Begrenzung der dsRNA ist derzeit unbekannt). Die dsRNA Länge braucht länger als 50 bp sein, um effektive RNAi in T. induzieren castaneum 7. dsRNA zwischen 150 bp und 500 bp scheint für RNAi-Experimente ideal. Obwohl längere dsRNA-Moleküle können auch verwendet werden, müssen sie eine erhöhte Chance OTE und das Gen-Klonierung Schritt wird zunehmend schwieriger.
dsRNA Konzentration
ve_content "> verschiedene Grade der Zuschlags Gen kann in Abhängigkeit von der Konzentration der dsRNA erreicht werden. 1 ug / ul scheint ein vernünftiger Ausgangskonzentration, die häufig erzeugt ein nahezu Null-Phänotyp sein (je nach Gen (en) von Interesse variieren ). RNAi kann mit einer höheren Konzentration (beispielsweise 7-8 ug / ul) durchgeführt, um eine stärkere RNAi-Phänotyp. RNAi mit einer seriellen Verdünnung der dsRNA erhalten kann manchmal vorteilhaft sein, eine Reihe von Phänotypen hypomorphen (Zusatzdaten von Tomoyasu erzeugen et al. 2009 8, und Borràs-Castells unveröffentlichte Daten).RNAi-Wettbewerb
Mehrere Gen Knockdown in T. erreicht werden castaneum durch Injektion von verschiedenen dsRNA-Moleküle gleichzeitig. Es ist jedoch auch bekannt, dass mit mehreren dsRNA Moleküle im Organismus vorhandene oft in Konkurrenz zwischen den dsRNAs für den Zugriff auf die RNAi-Komponenten 7,14. Es ist wichtig, die gleiche Länge und die gleiche Konzentration für alle dsRNA zu verwenden, wenn versucht mehrere Gen Zuschlags einer dsRNA aus konkurrierenden die andere (obwohl vermeiden, weitere Anpassungen der dsRNA Länge und Konzentration erforderlich, wenn die Expressionsniveaus erheblich zu unterscheiden Zielgene). Wir, als auch andere, haben erfolgreich doppelt und dreifach durchgeführt Zuschlags (zB Tomoyasu et al. 2.005 16, Tomoyasu et al. 2009 17, und Yang et al. 2009 18). Obwohl machbar, Vierbett-RNAi (oder mehr) könnte eine Herausforderung sein, da es wahrscheinlich zu erheblichen Reduktion der RNAi Effizienz für alle vier Zielgene.
Off-Targeting
OTE ist eine inhärente Interesse für RNAi-basierte Ansätze. Ein Weg, um OTE zu minimieren ist es, Regionen in der Ziel-Gens, die ähnliche Sequenzen mit anderen Genen teilen erkennen und zu vermeiden, diese Regionen bei der Gestaltung dsRNA. Eine einfache BLAST-Analyse gegen die T. castaneum vorhergesagt Gen-Set können solche Regionen zu identifizieren. Mehrere Online-Tools ermöglichen auch Bewertung potenzieller OTE (zB E-RNAi-19). Ausführen RNAi für zwei nicht-überlappenden Bereichen des Target-Gens ist eine einfache und effiziente Weise, um die Möglichkeit, die Phänotypen von OTE konstatiert beseitigen. Die Möglichkeit der OTE wird minimiert, wenn RNAi für zwei nicht-überlappenden Regionen zu den gleichen Phänotyp (es sei denn, die beiden nicht überlappenden Regionen eine ähnliche Sequenz).
Auswertung Gen durch andere als phänotypische Analysen mittels Knockdown ist oft entscheidend, um effektiv vorhanden RNAi-Daten. Zwei große Möglichkeiten, um Gen-Knockdown zu bewerten sind qRT-PCR und Western-Blot-Analyse. qRT-PCR ist ein bequemer Weg, um das Niveau der Ziel-mRNA zu messen, und hat sich in vielen RNAi bezogenen Studien einschließlich der in T. verwendet castaneum (siehe Miller et al. 2012 7 zum Beispiel). HowevER ist Vorsicht eingenommen werden, da wir in letzter Zeit einige Fälle, in denen das Ziel-mRNA-Ebene hochreguliert durch RNAi (obwohl das Proteinprodukt herunterreguliert) (Borràs-Castells unveröffentlichte Daten) zu sehen. Es ist derzeit nicht bekannt, ob diese RNAi induzierte mRNA Hochregulation kann verbreitet oder eindeutig bestimmte Gene sein. Western-Blot-Analyse ist ein weiterer Weg, um Gen-Knockdown bestätigen. Dieses Verfahren ist sehr zuverlässig, da sie die Menge der endgültigen Proteinprodukt mißt. Das Erfordernis eines spezifischen Antikörpers gegen das Proteinprodukt des Zielgens ist ein Nachteil dieses Ansatzes. Verwendung von mehreren unabhängigen Messungen zusätzlich zu phänotypische Analyse wird das Vertrauen der von RNAi-basierten Analyse erhaltenen phänotypischen Daten zu erhöhen.
Seit seiner Vorstellung in T. castaneum, RNAi wurde in erster Linie verwendet, um Gen-Funktion in der Entwicklung und Musterbildung zu studieren. Diese T. castaneum Entwicklungsstudien wurden in CHARAC sehr erfolgreichzeichnenden evolutionär konserviert und auseinander Funktionen von Genen (in Denell 2008 1 und 2004 2 Klingler überprüft). Allerdings RNAi-basierte Studien in T. castaneum sind nicht auf die Entwicklungsbiologie beschränkt. So kann beispielsweise genutzt werden, um RNAi Gen-Funktion in einer Vielzahl von physiologischen und Verhaltensreaktionen, einschließlich Stresstoleranz, Plünderung, Aggression, Partnerwahl, Aktivitätsmuster und Abwehrmechanismen zu studieren.
Eine Schwierigkeit der Anwendung von RNAi auf diesen Zusammenhängen ist die Wahrscheinlichkeit, pleiotrope Effekte. Oft Gene von Interesse wird eine Vielzahl von Rollen in der gesamten T. haben castaneum Lebenszyklus, wodurch die Entfernung von Genen, ohne unbeabsichtigte phänotypischen Wirkungen schwierig. Allerdings kann die Fähigkeit, leicht durchzuführen RNAi bei einer Vielzahl von Phasen oft eine wirksame Strategie zur Vermeidung dieser pleiotropen Effekte. Zum Beispiel, die Durchführung von RNAi bei Erwachsenen statt Larven oder Puppen könnte es uns ermöglichen, zu umgehen unbeeher durch Gen-Knockdown Letalität verursacht während der frühen Entwicklung. Die Flexibilität des RNAi-Antwort in T. castaneum macht somit dieses Modell eine attraktive Wahl für die Anpassung RNAi Experimente der Genfunktion in physiologischen und Verhaltensreaktionen.
Die T. castaneum System ist auch ideal für die Verwendung in einem Lehrlabor. T. castaneum auf einem Mehl / Hefe-Mischung bei Raumtemperatur (25 ° C) ohne häufige Subkultivierung leicht kultiviert werden, und RNAi-Techniken in T. castaneum sind einfach genug, um zu einem Labor mit kleinen Lern Wissenschaftler angepasst werden. RNAi ist zu einem wesentlichen Technik in einer Vielzahl von biologischen Bereich, ist es wichtig, dass die Schüler auf diese Technik ausgesetzt. Die geradlinige Art der Larven RNAi-Technik in T. castaneum fördert auch mehr Studenten in die Forschung einbezogen werden, so dass T. castaneum ein heißer Kandidat für ein Klassenzimmer ausgerichtet genetisches System.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken dem Zentrum für Bioinformatik und Funktionelle Genomik (CBFG) an der Miami University für technische Unterstützung. Diese Arbeit wurde von der Miami University Gründungszuschuss (YT) und der National Science Foundation (: IOS 0.950.964 YT) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Organic whole wheat flour | Heartland Mill Inc. Kansas | G1 | |
| Brewer’s yeast | MP Biomedicals | 2903312 | Sift yeast with #35 stainless sieve before use. Wear protective mask and cover the sieve with plastic wrap, as the sifted yeast is a fine particle and respiratory hazardus. |
| 6 oz plastic Drosophila stock bottles | Fisher Scientific | 11-888 | |
| Sieve | Fisher Scientific | 04-881N | 8 in. dia. x 2 in.D. Use #25 (Nominal opening 710 µm) for larvae, pupae, and adults. |
| Sieve | Fisher Scientific | 04 881 10P | 8 in. diameter #35 (Nominal seive opening: 600 µm) Stainless Steel Sieves, 8 in. dia. x 2 in.D. This sieve is ideal to remove clumps from yeast powder. |
| Sieve receiver | Fisher Scientific | 04-866B | 8 in. diameter |
| 1.5 Quart spouted sample pan | Seedburo Equipment Co. | Model 33 | collection pan |
| Incubator | BioCold Environmental Inc | BC26-IN | Keep it 30 °C with 70% humidity. |
| Na2HPO4 | Fisher Scientific | S374500 | |
| NaH2PO4 | Fisher Scientific | S397-500 | |
| KCl | Fisher Scientific | P217-500 | |
| Food dye | Kroger | green, blue, or red preferable | |
| Microscope glass slide | Fisher Scientific | 22-038-103 | |
| Tack-It Over&Over | Aleene's | Repositionable glue for sticky slides. Double sided tape can be used as an alternative, however, we found that the adhesiveness varies. | |
| Plastic CD case | Amazon | ||
| Boroslilicate glass capillary | Sutter Instrument | BF100-50-15 | O.D. 1 mm, I.D. 0.5 mm, 15 cm. Without filament |
| Needle puller | Sutter Instrument | P-87 or P-97 | |
| Removable mounting putty | Loctite Fun-Tak | ||
| Compressed gas duster | OfficeMax | OM96091 | |
| Forceps | Fine Science Tool | 11231-30 | Dumoxel #3 (to manipulate beetles) |
| Forceps | Fine Science Tool | 11252-20 | INOX #5 (to break needle tips) |
| Ethyl ether, anhydrous | Fisher Scientific | E138-500 | |
| Nylon mesh | Flystuff/Genessee Scientific | 57-102 | 120 µm pore size/49% open area |
| Media bottle, 100 ml | VWR | 89000-926 | |
| Stereomicroscope | Zeiss | SteREO Discovery V12. Injection microscope. | |
| Stereomicroscope | Fisher/Zeiss | 12-070-513 | Stemi2000. Use to break the needle and place larvae onto the sticky slide. |
| X-Y mechanical stage | Zeiss | 4354600000000000 | |
| X-Y mechanical stage | Microscopenet.com | A512 | Inexpensive alternative |
| Manipulator | Narishige | M-152 | |
| Magnetic stand | Narishige | GJ-1 | |
| Glass capillary holder | Narishige | IM-H1 | |
| 30 ml Disposable syringe | BD syringe | 309650 | BD Luer-Lok Tip |
| Four-way stopcock | Cole-Parmer Instrument Co. | EW-30600-03 | Stopcocks with Luer connections; 4-way; male slip |
| Art paint brush | Amazon | Art Advantage Oil and Acrylic Brush Set, 24-Piece | Any general paint brush will work. |
Referenzen
- Denell, R. Establishment of Tribolium as a genetic model system and its early contributions to evo-devo. Genetics. 180, 1779-1786 (2008).
- Klingler, M. Tribolium. Curr Biol. 14, R639-R640 (2004).
- Richards, S., et al. The genome of the model beetle and pest Tribolium castaneum. Nature. 452, 949-955 (2008).
- Bucher, G., Scholten, J., Klingler, M. Parental RNAi in Tribolium (Coleoptera). Curr Biol. 12, 85-86 (2002).
- Tomoyasu, Y., Denell, R. E. Larval RNAi in Tribolium (Coleoptera) for analyzing adult development. Dev Genes Evol. 214, 575-578 (2004).
- Tomoyasu, Y., et al. Exploring systemic RNA interference in insects a genome-wide survey for RNAi genes in Tribolium. Genome biology. 9, R10 (2008).
- Miller, S. C., Miyata, K., Brown, S. J., Tomoyasu, Y. Dissecting systemic RNA interference in the red flour beetle Tribolium castaneum parameters affecting the efficiency of RNAi. PLoS ONE. 7, e47431 (2012).
- Tomoyasu, Y., Arakane, Y., Kramer, K. J., Denell, R. E. Repeated co-options of exoskeleton formation during wing-to-elytron evolution in beetles. Curr Biol. 19, 2057-2065 (2009).
- Miller, S. C., Brown, S. J., Tomoyasu, Y. Larval RNAi in Drosophila. Dev Genes Evol. 218, 505-510 (2008).
- Brown, S. J., Mahaffey, J. P., Lorenzen, M. D., Denell, R. E., Mahaffey, J. W. Using RNAi to investigate orthologous homeotic gene function during development of distantly related insects. Evolutio., & development. 1, 11-15 (1999).
- Philip, B. N., Tomoyasu, Y. Gene knockdown analysis by double-stranded RNA injection. Methods Mol Biol. 772, 471-497 (2011).
- Clark-Hachtel, C. M., Linz, D. M., Tomoyasu, Y. Insights into insect wing origin provided by functional analysis of vestigial in the red flour beetle. Tribolium castaneum, Proceedings of the National Academy of Sciences of the United States of America. 110, 16951-16956 (2013).
- Kitzmann, P., Schwirz, J., Schmitt-Engel, C., Bucher, G. RNAi phenotypes are influenced by the genetic background of the injected strain. BMC genomics. 14, 5 (2013).
- Parrish, S., Fleenor, J., Xu, S., Mello, C., Fire, A. Functional anatomy of a dsRNA trigger differential requirement for the two trigger strands in RNA interference. Molecular cell. 6, 1077-1087 (2000).
- Winston, W. M., Molodowitch, C., Hunter, C. P. . Systemic RNAi in C elegans requires the putative transmembrane protein SID-1. 295, 2456-2459 (2002).
- Tomoyasu, Y., Wheeler, S. R., Denell, R. E. Ultrabithorax is required for membranous wing identity in the beetle Tribolium castaneum. Nature. 433, 643-647 (2005).
- Trauner, J., et al. Large-scale insertional mutagenesis of a coleopteran stored grain pest, the red flour beetle Tribolium castaneum, identifies embryonic lethal mutations and enhancer traps. BMC Biol. 7, 73 (2009).
- Yang, X., et al. Probing the Drosophila retinal determination gene network in Tribolium (II) The Pax6 genes eyeless and twin of eyeless. Developmental biology. 333, 215-227 (2009).
- Horn, T., Boutros, M. E-RNAi a web application for the multi-species design of RNAi reagents--2010 update. Nucleic acids research. 38, 332-339 (2010).
Erratum
Formal Correction: Erratum: Larval RNA Interference in the Red Flour Beetle, Tribolium castaneum
Posted by JoVE Editors on 10/01/2015. Citeable Link.
An erratum was issued for Larval RNA Interference in the Red Flour Beetle, Tribolium castaneum. There was a typo in the settings for Sutter P-87 in step 4.1.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten