Method Article
La evaluación de las interacciones leucocito-endotelio en condiciones de flujo en un
En este artículo
Resumen
A continuación, presentamos un protocolo que permite al investigador evaluar la dinámica de reclutamiento de leucocitos ex vivo mediante la conexión de una cámara recubierta con moléculas de adhesión endoteliales derivado al sistema circulatorio de un ratón. Este método ofrece ventajas significativas ya que permite la evaluación de leucocitos en condiciones biológicas relativas.
Resumen
Interacciones leucocito-endotelial son los primeros eventos y críticos en la inflamación aguda y crónica y pueden, cuando se desregula, mediar lesión tisular que conduce a daños patológicos permanente. Ensayos convencionales existentes permiten el análisis de moléculas de adhesión de leucocitos sólo después de la extracción de leucocitos de la sangre. Esto requiere la sangre que someterse a varios pasos antes de leucocitos de sangre periférica (PBL) pueden estar listos para el análisis, que a su vez puede estimular PBL que influyen en los resultados de la investigación. El ensayo de cámara de flujo micro autoperfused, sin embargo, permite a los científicos estudiar primeras leucocitos desregulación funcional utilizando el flujo sistémico de un ratón vivo mientras que teniendo la libertad de manipular una cámara recubierta. A través de un modelo de la enfermedad, la expresión funcional de las moléculas de adhesión de leucocitos puede ser evaluado y cuantificado en una cámara de micro-vidrio recubierto con moléculas de adhesión endotelial inmovilizados ex vivo. En este modelo, la sangre fluyeentre la arteria carótida común derecha e izquierda de la vena yugular externa de un ratón vivo bajo anestesia, lo que permite la interacción de los PBL nativos en la cámara. Análisis experimental en tiempo real se logra con la ayuda de un microscopio intravital, así como un dispositivo de presión Harvard Apparatus. La aplicación de un regulador de flujo en el punto de entrada de la cámara de vidrio permite condiciones de flujo fisiológicas comparables entre los experimentos. La velocidad de rodadura de leucocitos es el resultado principal y se mide utilizando los Institutos Nacionales de Salud software de acceso abierto ImageJ. En resumen, el ensayo de cámara de flujo micro autoperfused proporciona un entorno fisiológico óptimo para estudiar la interacción leucocitos endotelial y permite a los investigadores sacar conclusiones precisas al estudiar la inflamación.
Introducción
La inflamación es la respuesta universal del cuerpo a la lesión y es un paso crucial tanto en la función del sistema inmune innato y adaptativo. En respuesta a una lesión y / o estímulos inflamatorios, las células endoteliales upregulate moléculas de adhesión específicas; esto conduce a la extravasación de leucocitos a través del endotelio microvascular, principalmente en las vénulas capilares de correos. Este proceso se inicia con la inmovilización de los leucocitos de flujo libre en el torrente sanguíneo en el endotelio. Laminación estable y firme adhesión de los leucocitos, que a su vez conduce a la transmigración y la secreción de agentes citotóxicos, siguen este tethering 1,2. Las selectinas son conocidos para mediar en los primeros pasos de la cascada de 3-5; integrinas son responsables de las etapas posteriores de la adhesión firme y la transmigración 1,6-8.
Un creciente cuerpo de evidencia sugiere leucocitos y moléculas de adhesión endoteliales tienen un papel vital en modelos animales de lesión por isquemia y reperfusión, Asma, psoriasis, esclerosis múltiple, y la degeneración macular relacionada con la edad 9-12. En estas condiciones, la respuesta inflamatoria está mal dirigido a atacar al propio cuerpo, lo que resulta en el desgaste del tejido sano. Agentes antiinflamatorios existentes (como los medicamentos no esteroides antiinflamatorios, corticosteroides u otros agentes quimioterapéuticos) conllevan el riesgo de efectos secundarios graves con el uso a largo plazo 13. Por lo tanto, es de gran interés contar con las herramientas adecuadas, con la capacidad de identificar moléculas específicas de la enfermedad, que en última instancia puede ser objetivo de tener el efecto antiinflamatorio deseada sin dejar de ser no tóxicos 14.
Existente en métodos in vitro, como el ensayo de adhesión de leucocitos estática fueron utilizados ya en 1976 15. La cámara de flujo paralelo se utilizó por primera vez en vitro en 1987 para estudiar las interacciones leucocito-endotelio en condiciones de flujo. En estos experimentos, estimulado human leucocitos polimorfonucleares (PMN) a partir de sangre venosa fueron perfundidos sobre una monocapa de células humanas primarias endoteliales de vena umbilical (HUVEC). Para el control de las condiciones de flujo hemodinámico, la bomba de jeringa Harvard Apparatus 16 fue empleado. Alternativamente, para evitar el aislamiento leucocitos artificial, se utilizó sangre completa en combinación con la cámara de vidrio recubiertas con las moléculas de adhesión inmovilizados 17.
Para evitar la estimulación de leucocitos y para estudiar mecánicamente su interacción con las moléculas de adhesión en condiciones fisiológicas aproximadas, un ex vivo autoperfused, extracorporal, circuito arteriovenoso se desarrolló 16. En este circuito, la sangre fluye entre la arteria carótida común derecha y la izquierda de la vena yugular externa de un ratón vivo bajo anestesia, lo que permite la interacción de los PBL nativas dentro de una cámara microflujo de vidrio recubiertas con las moléculas de adhesión individuales o co-inmovilizada. Una de las principales ventajas de este system es la capacidad de emplear ratones genéticamente modificados, en los que se manipulan las vías inflamatorias directa o indirectamente. Además, existe la posibilidad de determinar la contribución aislada de moléculas de adhesión de leucocitos a la inflamación, libre de activación externa, bajo condiciones de flujo. La aplicación de un regulador de flujo en el punto de entrada de la cámara de flujo ofrece una amplia gama de variaciones experimentales de las fuerzas de cizallamiento para imitar ya sea sistemas venosos 18-22 arterial o. Aquí se describe con gran detalle un protocolo relativo a la preparación y realización de la cámara de ensayo vivo autoperfused ex microflujo.
Protocolo
Todos los experimentos con animales se manejan de acuerdo con la Asociación para la Investigación en Visión y Oftalmología para el uso de animales en Oftálmica y Vision Research, y las directrices y normas establecidas por el Massachusetts Eye and Ear Infirmary Comité de Cuidado de Animales.
El día antes del experimento:
1. Preparación de la Tubería de la cámara de flujo
- Para preparar el lado yugular, conecte 1 cm tubo de polietileno PE10 a un tubo de silicio 6 cm, seguido de tubo de polietileno de 5 cm. Por el lado de la carótida, preparar de manera similar a la parte yugular con la adición de un tubo en T en el tubo de silicona 6 cm aproximadamente 1,5 cm de distancia del tubo de polietileno de 1 cm (Figura 1A, B). Con el fin de insertar el tubo en T, ampliar el tubo de silicona mediante el uso de unas pinzas finas si es necesario.
- Conecte un extremo de 10 cm de tubo de silicona para el transductor de presión a continuación, inserte el extremo T del s carótidaide T-tubo en el otro extremo. Asegúrese de que la conexión de los sitios estén apretadas y sin fugas. Aplicar una pequeña pieza rectangular de Parafilm sobre el lugar donde el tubo encaja, si es necesario, para evitar fugas (Figura 1C).
2. El recubrimiento de la Cámara
- Preparar la proteína de revestimiento de la superficie endotelial (por ejemplo, P selectina, molécula de adhesión intercelular-1 (ICAM-1), vascular proteína-1 de adhesión celular (VCAM-1)) en 0,1% de BSA. Como pauta, 1 g de proteína en 200 l de BSA es suficiente para recubrir 4-5 cámaras. Usando una jeringa de 1 ml conectada a una aguja de 25 G, en infusión cada cámara (0,04 x 0,4 x 50 mm) con la proteína de recubrimiento de la superficie endotelial. Guarde las cámaras recubiertas en un tubo de 15 ml a 4 ° C durante la noche.
El día del experimento:
3. Preparación de la Cámara
- Retire las cámaras revestidas de 4 ° C y conectar la tubería yugular y carótida para cada lado. Sellar las connections estirando con cuidado una pequeña pieza rectangular de parafina sobre el lugar donde la tubería cumple con la cámara. Con una jeringa, llenar la cámara y el tubo con 0,1% de BSA (compruebe si hay fugas). Incubar durante 45 min.
- Preparar una placa de Petri de 35 mm para mantener la cámara mediante la reducción de muescas en cada lado del plato. Estabilizar la cámara en las muescas; a continuación, utilizar una pequeña gota de silicona para fijar la cámara al plato en el sitio dentada. Asegúrese de que la cámara está nivelada mirando bajo el microscopio. Deje que la silicona se seque por lo menos 15 minutos.
- Llene una jeringa de 60 ml de bloqueo con heparina y conectar con el transductor de presión. Conectar el transductor de presión a la tubería de la carótida en el siguiente orden: Transductor, tubo de silicona, y T-tubo.
- Utilice un PE50 1 cm entre el tubo de silicona conectado al transductor y el tubo en T para asegurar la conexión. Pase el tubo de silicona de la arteria carótida a través de la pinza de presión (Figura 1D). Ejecute 100USP heparina excelentes referenciasugh el tubo y la cámara hasta que no queden burbujas de aire.
4. Configuración del Software
- Para preparar el software, encienda la computadora, un microscopio y un dispositivo de laboratorio abierto. Haga doble clic en la aplicación suite de Leica (LAS) (o equivalente) y preparar una carpeta para guardar el video: ver → → adquieren película → definir secuencia de clips (clips = 15, tiempo de grabación = 30 seg, y los intervalos = 15 seg) a continuación, haga clic en el signo "+" para confirmar.
- Para registrar la presión del flujo de abrir el LabChart (o equivalente) de archivos y coordinar el nombre del archivo a la carpeta de grabación en el paso 4.1, arriba.
5. Procedimiento Quirúrgico
- Anestesiar un 8-10 semanas de edad de ratón usando una combinación de ketamina (60 mg / kg) y xilazina (6 mg / kg) inyectado por vía intraperitoneal (IP). Confirme que la sedación profunda se logra dentro de 5 a 10 minutos por la pérdida de reflejo de retirada pedal. Si es necesario, isofluranoemitido a través de la mascarilla se puede dar cuando sea necesario.
- Mientras que bajo anestesia, coloque una almohadilla de calentamiento debajo de la jaula y se puso a 37 ° C para mantener la temperatura corporal. Una vez confirmada la anestesia adecuada, coloque el ratón en una posición ventral y el abrigo de los ojos con el ungüento de bacitracina para evitar la sequedad ocular.
- A partir de entonces, afeitar el pelo en el sitio de la incisión con una cuchilla de afeitar y limpiar a fondo el sitio con alcohol.
- Una vez totalmente anestesiado asegurar el animal con cinta manteniendo el ratón en una posición ventral. Exponer la zona del cuello con unas tijeras y extirpar la glándula tiroides para exponer la tráquea y los vasos (Figura 2).
- Limpie la arteria carótida hasta que esté totalmente expuesta con cuidado de no dañar el nervio vago (Figura 2B). Dobla un pedazo de sutura y pasar la curva debajo de la arteria carótida luego se corta en la curva por lo que ahora hay 2 piezas de sutura debajo de la carótida. Loop cada sutura en nudos (no apriete elnudos).
- Repetir el mismo procedimiento para exponer la vena yugular izquierda (Figura 2C), la preparación de las suturas de la misma manera (Figura 2D).
- Conecte el tubo a la vasculatura del ratón.
- Heparinizar el ratón mediante la inyección de 1 ml de heparina IP.
- Apretar la sutura superior en la arteria carótida. Coloque la abrazadera buque un precio tan bajo como puede ir en la arteria carótida (Figura 3A). El uso de fórceps para mantener la arteria por la sutura superior y hacer una pequeña incisión, de aproximadamente 1/8 de la circunferencia de la arteria, utilizando las microtijeras (Figura 3B).
- Pase el tubo de la arteria carótida a través de la segunda nudo en la sutura superior y en la incisión realizada en la arteria. Tie fuera de la sutura inferior de modo que la arteria se sella alrededor de la tubería (se deben hacer varios nudos para asegurar un sello hermético; Figura 3C).
- Repita el mismo procedimiento para insertar el tubo vena yugular (el vasopinza no es necesario para el lado yugular; Figura 3D).
- Pruebe el flujo por la liberación de la abrazadera del buque. Si no hay fugas de mover el ratón para el microscopio y conectar la tubería de la carótida y la vena yugular a la tubería de cámara (ver video adjunto para la demostración de procedimiento quirúrgico).
6. Grabación del balanceo de velocidad
- Abra la abrazadera de la carótida para llenar la cámara, haciendo un circuito con el sistema circulatorio del ratón. Dejar que la sangre circule durante 3-5 minutos para que se estabilicen las condiciones de flujo. Durante el período de espera de 3-5 min, ajuste la platina del microscopio de manera que la cámara está a nivel de un extremo a otro con el objetivo del microscopio y su borde es paralelo a la ventana de grabación de vídeo en la pantalla.
- Llene la placa de Petri modificado que contiene la cámara de vidrio con agua y luego bajar el objetivo de inmersión en agua 10 veces en el plato de manera que las células que fluyen a través de la cámara son visibles.La intensidad de la luz puede tener que ser ajustada para una visualización adecuada de las células. En general una menor intensidad es mejor.
- Ajustar la pinza del tubo de modo que el transductor lee una constante 30 mm Hg, correlacionando a una presión de flujo fisiológico medio, o como se desee.
- Pulse "Inicio" para iniciar la grabación tanto el video como la presión con el primer lapso de tiempo cerca del final yugular y en movimiento contra el flujo hacia el final de la carótida hasta que se complete.
NOTA: Varias condiciones de revestimiento utilizando diferentes moléculas de adhesión pueden ser estudiados en el mismo ratón mediante el uso de múltiples cámaras. Sólo una de las cámaras se graba en un momento.- Cuando se termina la grabación, cerrar la válvula en el sitio de entrada, detener el flujo de sangre. Retire la cámara y adaptarse a una nueva cámara (recubierto con una molécula de adhesión diferente) al circuito usando pinzas finas en una mano y fórceps ranurados en la otra mano. Reanudar la grabación de la nueva cámara como se indica en los pasos06.01 a 06.04.
- La eutanasia de todos los ratones por asfixia con CO2 seguida de una dislocación de la médula espinal al final del experimento. El procedimiento se terminal, por lo tanto, los ratones se sacrificaron mediante una dislocación de la médula espinal al final del experimento.
7. Interpretación de los resultados
- Para analizar los datos registrados utilizan el plugin "M TrackJ" para el software ImageJ 23.
- Convertir el archivo en escala de grises Seleccione Archivo → Importar → → AVI convertir a escala de grises.
- Estandarizar los marcos Seleccione → Imagen → → propiedad por entrar en los intervalos de la trama (i) → global. Calcular los intervalos de la trama dividiendo la duración total de vídeo (normalmente 30 segundos) por el número de fotogramas en un vídeo (que se muestra en la esquina superior de la ventana de vídeo J Image).
- Medir el flujo de cada leucocitos por Seleccione el plugin → M TrackJ → Añadir pistas → seleccione un leucocito→ Seguir con cada fotograma durante 15 - 20 segundos → Fusionar.
- Repita el paso 7.4 para todos los leucocitos a la vista.
- Determinar la velocidad media rodar de los leucocitos de Select medida → dos columnas aparecen → Copiar todo de la M TrakJ: Orugas en una hoja de cálculo. La columna titulada "V significar" es la de leucocitos de rodadura medido en píxeles / segundo. Convertir en m / seg dividiendo por 2/3.
- Para analizar el punto culminante de datos de presión y exportación en una hoja de cálculo y realizar el siguiente cálculo:? P (mm Hg) y t (dinas / cm 2) para una comparación entre cada grupo experimental. Una vez calculado, copie los datos en el software de prisma para su representación gráfica.
Resultados
Durante cada grabación leucocitos sólo interactúan son evidentes en la cámara. Los resultados de un experimento representativo se pueden ver en la Figura 4. Las flechas blancas indican leucocitos individuales que fueron capturados por la molécula de adhesión de interés y están rodando a lo largo de la cámara, entre otros de flujo libre dentro del flujo sanguíneo. Un artefacto común fuera de la cámara se puede ver con las grandes esferas oscuras en todas las imágenes. Las esferas oscuras ayudan al lector apreciar el movimiento de leucocitos en relación a un punto fijo. Los leucocitos avance durante un período de 22 seg se puede ver en relación con las esferas. El gráfico en la misma figura muestra un gráfico final de los datos, donde Tx1 disminuye la velocidad de rotación (un giro a la izquierda) y Tx2 aumenta la velocidad (un giro a la derecha) en comparación con el control.
0 "/>
Figura 1: Preparación de tubos para la cámara de flujo. (A) Herramientas necesarias para la tubería y conjunto de cámara (cámara de vidrio micro 0,4 x 0,04 x 50 mm, polietileno tubería PE10, PE60 tubería de polietileno, tubo de silicona 002, tubo y, t de tubo, 35 mm placa de Petri, pinzas finas, finas tijeras, soporte de tubo, pinza vascular, sutura de seda 7-0. (B) Preparación de la arteria carótida y la tubería de la vena yugular para la re-dirigir el flujo de la sangre del ratón a través de la cámara de recubrimiento. (C) Conexión de la tubería de arteria carótida para el transductor de presión. (D) Pase el tubo del transductor a través de la abrazadera para ajustar la velocidad del flujo sanguíneo. Haga clic aquí para ver una versión más grande de esta figura.
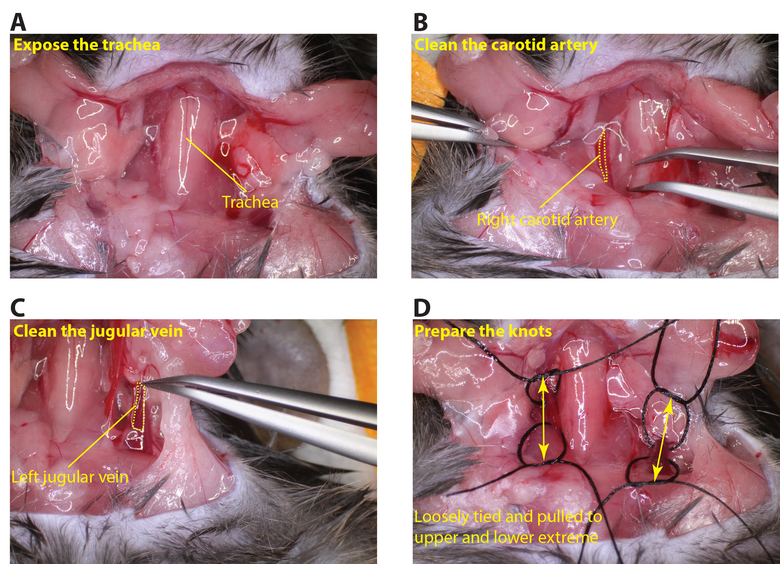
Figura 2:. La exposición de la arteria carótida y la vena yugular (A) cortar cuidadosamente la zona del cuello para exponer la tráquea (B) Limpiar la arteria carótida derecha de modo que un trozo de sutura se puede pasar por debajo de la vasija (punteado amarillo. línea describe la arteria carótida). (C) Limpie la vena yugular izquierda para que un pedazo de sutura se puede pasar bajo el buque (línea amarilla punteada esboza la vena yugular). (D) Se encargará vagamente unida suturas en las zonas superior e inferior de la arteria carótida y la vena yugular (las flechas indican las regiones superior e inferior de los vasos). Haga clic aquí para ver una versión más grande de esta figura.
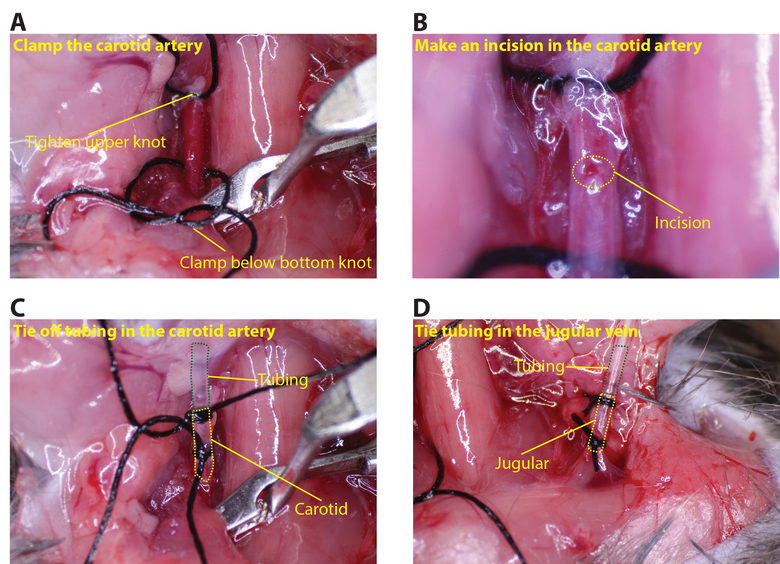
Figura 3: Conexión de la tubería a tque la arteria carótida y la vena yugular. (A) Apriete el nudo superior en la carótida y coloque la abrazadera debajo del nudo inferior. (B) Uso de las micro tijeras, hacer una pequeña incisión en la carótida, alrededor de 1/8 de la circunferencia (círculo amarillo de puntos indica la incisión). ( C) Inserte la tubería en la carótida y seguro con al menos dos suturas (línea punteada verde muestra el tubo y la línea de puntos de color amarillo de la arteria carótida). (D) Del mismo modo insertar la tubería en la yugular (línea punteada verde muestra la tubería y la amarillo línea de puntos la vena yugular). Haga clic aquí para ver una versión más grande de esta figura.
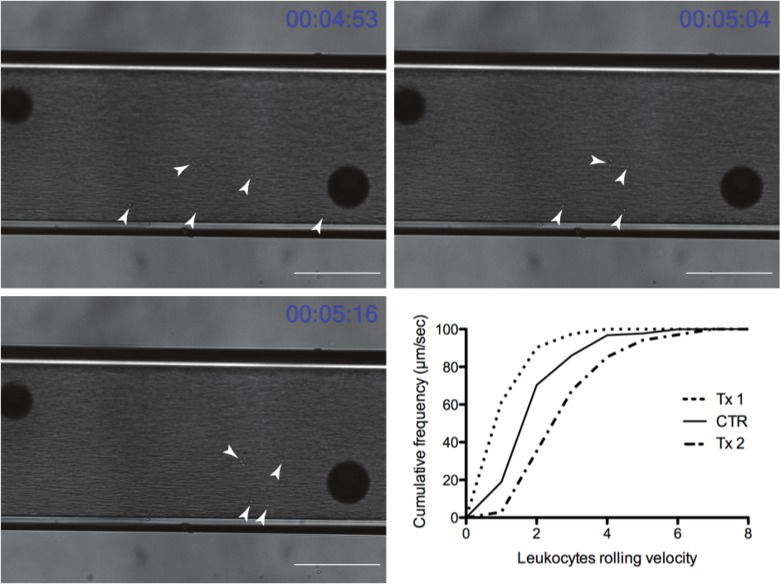
Figura 4: evolución temporal Representante de leucocitos de rodadura a través del cham flujober (barra de escala = 100 micras) (puntas de flecha blancas señalan los leucocitos de rodadura). Gráfico muestra resultados representativos después de la exportación en un programa de gráficos (Tx1 y Tx2 son grupos de tratamiento experimental y CTR es el grupo de control). Tx1 representa un tratamiento en el cual los leucocitos ralentizar conduce a una disminución en los leucocitos velocidad y un desplazamiento a la izquierda de la gráfica en comparación con el grupo no tratado (CTR) de laminación, mientras que Tx2 conduce a un desplazamiento a la derecha refleja un aumento en los leucocitos velocidad de rodadura. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
El proceso de reclutamiento de leucocitos es un paso crucial en la respuesta inflamatoria; que implica la migración de los leucocitos desde el sistema circulatorio hacia los tejidos diana, donde son capaces de ejercer su función efectora. El reclutamiento de leucocitos es integral en una variedad de condiciones inflamatorias, tales como las placas ateroscleróticas, infarto de miocardio, isquemia / reperfusión, y la cirugía de trasplante 1, así como múltiples condiciones neuro-inflamatorias relacionadas con el SNC 10-12,20,24,25. Teniendo en cuenta la diversidad de las condiciones de la enfermedad que se extiende por el reclutamiento de leucocitos, la cámara de microflujo autoperfused proporciona una herramienta indispensable que permite al investigador la posibilidad de estudiar la dinámica de migración de leucocitos.
Durante las últimas décadas, una variedad de ensayos in vitro se han desarrollado para estudiar la dinámica de la adhesión celular de leucocitos 26. Desafortunadamente, todos estos ensayos requieren la extracción delos leucocitos de la sangre, la introducción de activación mecánica. Para acercarnos al entorno in vivo, se hicieron adaptaciones para recoger muestras de sangre entera y controlar las condiciones de flujo hemodinámico 16,17. Este sentido, ampliar los avances previos en el campo mediante la vinculación de una cámara recubierta con el sistema circulatorio del ratón. Somos capaces de regular el flujo de la sangre a un rango fisiológico y estudiar la dinámica de leucocitos de rodadura. La cámara recubierta nos da la capacidad para estudiar las interacciones de leucocitos con las moléculas de adhesión específicas. Dado que el sistema está funcionando como una unidad operada por un ratón vivo, imita más de cerca el entorno natural, que nos permite estudiar las interacciones leucocito-endotelial en una variedad de modelos inmunológicos ratón. Además, este sistema nos permite tomar ventaja de los múltiples modelos de ratón genéticos disponibles. Mientras que el sistema no se replica completamente el entorno in vivo, proporciona una plataforma para estudiar específic elementos de los leucocitos en condiciones fisiológicas, una hazaña que no ha sido posible anteriormente. A pesar de que esto nos lleva un paso más cerca de un entorno más fisiológica existen limitaciones en el sistema. No replicar completamente la matriz 3D complejo de la vasculatura tan sólo somos capaces de evaluar ciertos elementos de las interacciones de leucocitos que están restringidas a la capa de la cámara. Además, el gran cuidado se debe tomar para garantizar un sistema cerrado a la circulación del ratón siguiendo todos los pasos mencionados en el protocolo. La introducción de burbujas de aire afectará en gran medida la precisión y la reproducibilidad de los experimentos.
Mientras que se describe el uso de la cámara de Autoperfused Microflow para evaluar la dinámica de leucocitos de rodadura el procedimiento tiene el potencial para ser personalizados por los investigadores para estudiar una variedad de enfermedades. Por ejemplo, las células cancerosas metastatizan mediante la expresión de muchas de las integrinas comunes compartidos por los leucocitos. Studying sus dinámicas rodantes en un entorno que imita más de cerca un entorno in vivo podría ayudar en el conocimiento, y, posiblemente, la predicción, de la naturaleza invasiva de ciertas células cancerosas. Un posible enfoque podría ser combinar una técnica de etiquetado para las células cancerosas, tales como GFP 27, junto con el ensayo de cámara de flujo para rastrear la dinámica de rodadura de las células cancerosas que expresan GFP. Dada la flexibilidad del recubrimiento de la cámara con una variedad de sustancias y la conexión de múltiples cámaras para el mismo ratón será interesante ver cómo se modifica este procedimiento para su uso en otros laboratorios en combinación con ratones genéticamente modificados y modelos de enfermedad. La técnica descrita aquí sólo toca un potencial de aplicación mucho más amplio que sólo está limitado por la creatividad del investigador.
Divulgaciones
The authors (L.M., H.S., and K.M.C.) have no competing financial interests to disclose.
Agradecimientos
Las investigaciones realizadas en esta publicación fue apoyada por el Instituto Nacional del Ojo de los Institutos Nacionales de Salud de los números de adjudicación: R01EY022084 / S1 (KMC), T32EY007145 (HS) y P30EY014104. El contenido es responsabilidad exclusiva de los autores y no representa necesariamente las opiniones oficiales de los Institutos Nacionales de Salud. El apoyo adicional fue proporcionada por el Fondo de Massachusetts Leonístico de Investigación (KMC) y un Premio Especial Académico de Investigación para la Prevención de la Ceguera (a KMC).
Materiales
| Name | Company | Catalog Number | Comments |
| Material | Vendor | Part number | |
| Micro glass chamber 0.4x0.04x50mm | VitroCom | 2540-050 | |
| Polyethylene tubing PE 10 | Fisher Scientific | 427400 | |
| Polyethylene tubing PE 60 | Fisher Scientific | 427416 | |
| Silicone tubing 002 | Fisher Scientific | 11-189-15A | |
| Y tube | Value Plastics | Y210-6 | |
| T tube | value plastics | T410-6 | |
| Silicone gel | Hardware store - Home Depo | ||
| 35mm petri dish | Corning | 430165 | |
| Parafilm | Pechiney Plastic Packaging | PM996 | |
| Fine forceps | FST | 11253-25 | |
| Fine scissors | FST | 15000-08 | |
| Tube holder | FST | 00608-11 | |
| Clamp applicator | FST | 18057-14 | |
| Vascular clamp | FST | 18055-04 | |
| 6-0 silk sutures | George Tiemann & Co | 160-1215-6/0 | |
| 25x1G needles | BD | 305125 | |
| 30x1/2G needles | BD | 305106 | |
| Heparin 100 USP units/ml | Hospital pharmacy |
Referencias
- Barreiro, O., Sanchez-Madrid, F. Molecular basis of leukocyte-endothelium interactions during the inflammatory response. Revista Espanola de Cardiologia. 62, 552-562 (2009).
- Muller, W. A. Leukocyte-endothelial-cell interactions in leukocyte transmigration and the inflammatory response. Trends in Immunology. 24, 327-334 (2003).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20, 525-532 (2008).
- Mehta, P., Cummings, R. D., McEver, R. P. Affinity and kinetic analysis of P-selectin binding to P-selectin glycoprotein ligand-1. The Journal of Biological Chemistry. 273, 32506-32513 (1998).
- Nicholson, M. W., Barclay, A. N., Singer, M. S., Rosen, S. D., vander Merwe, P. A. Affinity and kinetic analysis of L-selectin (CD62L) binding to glycosylation-dependent cell-adhesion molecule-1. The Journal of Biological Chemistry. 273, 763-770 (1998).
- Sandig, M., Negrou, E., Rogers, K. A. Changes in the distribution of LFA-1, catenins, and F-actin during transendothelial migration of monocytes in culture. Journal of Cell Science. 110 (22), 2807-2818 (1997).
- Shaw, S. K., et al. Coordinated redistribution of leukocyte LFA-1 and endothelial cell ICAM-1 accompany neutrophil transmigration. The Journal of Experimental Medicine. 200, 1571-1580 (2004).
- Woodfin, A., et al. JAM-A mediates neutrophil transmigration in a stimulus-specific manner in vivo: evidence for sequential roles for JAM-A and PECAM-1 in neutrophil transmigration. Blood. 110, 1848-1856 (2007).
- Blankenberg, S., Barbaux, S., Tiret, L. Adhesion molecules and atherosclerosis. Atherosclerosis. 170, 191-203 (2003).
- Parmeggiani, F., et al. Mechanism of inflammation in age-related macular degeneration. Mediators of Inflammation. 2012, 546786 (2012).
- Ding, X., Patel, M., Chan, C. C. Molecular pathology of age-related macular degeneration. Progress in Retinal and Eye Research. 28, 1-18 (2009).
- Xu, H., Chen, M., Forrester, J. V. Para-inflammation in the aging retina. Progress in Retinal and Eye Research. 28, 348-368 (2009).
- Peterson, K., et al. Drug Class Review: Nonsteroidal Antiinflammatory Drugs (NSAIDs): Final Update 4 Report. Drug Class Reviews. , (2010).
- Ulbrich, H., Eriksson, E. E., Lindbom, L. Leukocyte and endothelial cell adhesion molecules as targets for therapeutic interventions in inflammatory disease. Trends in Pharmacological Sciences. 24, 640-647 (2003).
- Stamper, H. B., Woodruff, J. J. Lymphocyte homing into lymph nodes: in vitro demonstration of the selective affinity of recirculating lymphocytes for high-endothelial venules. The Journal of Experimental Medicine. 144, 828-833 (1976).
- Lawrence, M. B., McIntire, L. V., Eskin, S. G. Effect of flow on polymorphonuclear leukocyte/endothelial cell adhesion. Blood. 70, 1284-1290 (1987).
- Abbitt, K. B., Nash, G. B. Characteristics of leucocyte adhesion directly observed in flowing whole blood in vitro. British Journal of Haematology. 112, 55-63 (2001).
- Smith, M. L., Sperandio, M., Galkina, E. V., Ley, K. Autoperfused mouse flow chamber reveals synergistic neutrophil accumulation through P-selectin and E-selectin. Journal of Leukocyte Biology. 76, 985-993 (2004).
- Yuan, J., Melder, R. J., Jain, R. K., Munn, L. L. Lateral view flow system for studies of cell adhesion and deformation under flow conditions. BioTechniques. 30, 388-394 (2001).
- Moalem, G., et al. Autoimmune T cells protect neurons from secondary degeneration after central nervous system axotomy. Nature Medicine. 5, 49-55 (1999).
- Hafezi-Moghadam, A., Thomas, K. L., Cornelssen, C. A novel mouse-driven ex vivo flow chamber for the study of leukocyte and platelet function. American Journal of Physiology. Cell Physiology. 286, 876-892 (2004).
- Almulki, L., et al. Surprising up-regulation of P-selectin glycoprotein ligand-1 (PSGL-1) in endotoxin-induced uveitis. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology. 23, 929-939 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Rapalino, O., et al. Implantation of stimulated homologous macrophages results in partial recovery of paraplegic rats. Nature Medicine. 4, 814-821 (1998).
- Yoles, E., et al. Protective autoimmunity is a physiological response to CNS trauma. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 21, 3740-3748 (2001).
- Buchanan, M. R., Vazquez, M. J., Gimbrone, M. A. Arachidonic acid metabolism and the adhesion of human polymorphonuclear leukocytes to cultured vascular endothelial cells. Blood. 62, 889-895 (1983).
- Connor, K. M., et al. Manganese superoxide dismutase enhances the invasive and migratory activity of tumor cells. Cancer Res. 67, 10260-10267 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados