Method Article
의 흐름 조건에서 백혈구 - 내피 상호 작용을 평가
요약
여기서는 조사자 마우스 순환계 유래 내피 부착 분자로 코팅 챔버를 연결하여 백혈구 보충 생체 역학을 평가할 수 있도록하는 프로토콜을 제시한다. 이 상대적인 생물학적 조건하에 백혈구 평가 가능 때문에이 방법은 상당한 이점을 제공한다.
초록
백혈구 - 내피 상호 작용은 급성 및 만성 염증의 초기에 중요한 이벤트이며, 조절 곤란하면, 영구 병리학 적 손상으로 이어지는 조직 손상을 중재 할 수 있습니다. 기존의 종래 분석법은 혈액으로부터 백혈구 추출 후 백혈구 부착 분자의 분석을 허용한다. 이는 말초 혈액 백혈구 (말초 혈액 림프구)가 차례로 연구 결과에 영향을 미치는 말초 혈액 림프구를 자극 할 수있는 분석을위한 준비를하기 전에 몇 가지 단계를 받아야하는 혈액이 필요합니다. autoperfused 마이크로 흐름 챔버 분석은, 그러나, 과학자들은 코팅 챔버를 조작하는 자유를하면서 라이브 마우스의 전신 흐름을 사용하여 기능 조절 장애 초기 백혈구를 연구 할 수 있습니다. 질병 모델을 통해, 백혈구 부착 분자의 기능적 발현을 평가할 수있다 고정화 내피 세포 부착 분자 생체 코팅 유리 마이크로 챔버 정량화. 이 모델에서 혈액 흐름챔버 내의 네이티브 말초 혈액 림프구의 상호 작용을 허용 우측 총 경동맥과 마취 살아있는 마우스의 왼쪽 외부 경정맥 사이. 실시간 분석 실험은 생체 내에 현미경의 도움뿐만 아니라 하버드 장치 압력 장치에 의해 달성된다. 유리 챔버의 입력 시점에서 유동 조절기의 어플리케이션의 사이에 유사한 생리 학적 실험 유량 조건을 허용한다. 백혈구 롤링 속도는 주요 결과이며, 건강 오픈 액세스 소프트웨어 ImageJ에 국립 연구소를 사용하여 측정한다. 요약하면, autoperfused 마이크로 흐름 챔버 분석은 백혈구를 내피 세포의 상호 작용을 연구하는 최적의 생리 학적 환경을 제공하고 염증을 연구 할 때 연구자는 정확한 결론을 도출 할 수 있습니다.
서문
염증은 손상에 대한 신체의 보편적 인 반응이다 모두 선천성 및 후천성 면역 시스템 기능에 중요한 단계입니다. 부상 및 / 또는 염증성 자극에 응답하여, 특정 내피 세포 부착 분자를 상향 조절; 이것은 주로 후 모세관 세정맥에, 미세 혈관 내피 세포를 통해 혈관 외 유출을 백혈구에 이르게. 이 과정은 내피 세포에 혈류의 자유 흐르는 백혈구의 테 더링으로 시작합니다. 안정 압연 및 다시 윤회와 세포 독성 제의 분비로 연결 백혈구의 밀착성이가 1,2 테 더링 따릅니다. 셀렉틴은 계단식 3-5의 초기 단계를 매개하는 것으로 알려져있다; 인테그린은 회사의 부착과 윤회 1,6-8의 이후 단계에 대한 책임이 있습니다.
증거의 성장 몸은 허혈 재관류 손상 동물 모델에서 백혈구와 내피 세포 부착 분자가 중요한 역할을 제안합니다천식, 건선, 다발성 경화증, 및 연령 관련 황반 변성증 9-12. 이러한 조건 하에서, 염증 반응은 건강한 조직의 파괴의 결과, 자신의 몸을 공격하는 오 분사된다. (예를 들면 비 스테로이드 성 항염증제, 코르티코 스테로이드 또는 다른 화학 요법 제와 같은) 기존의 항염증제는 장기 사용 (13)으로 심각한 부작용의 위험을 수행한다. 따라서, 비 - 독성을 유지하면서 14 궁극적으로 목적하는 항 염증 효과가 대상이 될 수있는 질병 특정한 분자를 식별하는 능력을 가진 적절한 도구를 가지고 큰 관심사이다.
이러한 정적 백혈구 유착 검정 시험 관내 방법으로서 기존 빠르면 1976 15로 하였다. 병류 챔버는 제 1 유동 조건에서 백혈구의 내피 상호 작용을 연구하기 위해 1987 년에 시험 관내에서 사용 하였다. 이들 실험에서, 구호 물자를 자극N 정맥혈에서 다형 핵 백혈구 (백혈구)는 기본 인간 제대 정맥 내피 세포 (HUVEC를)의 단층을 통해 관류 하였다. 혈역학 유동 조건에 대해 제어하기 위해 하버드 장치 주사기 펌프 (16)를 사용 하였다. 대안 적으로, 인공 백혈구 분리를 피하기 위해, 전혈 고정화 부착 분자 (17)로 코팅 된 유리 용기와 조합하여 사용 하였다.
백혈구 자극을 방지하고 기계적으로 대략적인 생리적 조건에서 부착 분자와의 상호 작용을 연구하기 위해, 생체 autoperfused, extracorporal은, 동정맥 회로 (16)를 개발 하였다. 이 회로에서 혈액 단일 또는 공동 고정화 부착 분자로 코팅 된 유리 마이크로 플로우 챔버 내에 네이티브 말초 혈액 림프구의 상호 작용을 가능하게 마취 살아있는 마우스의 우측 총 경동맥과 좌측 외부 경정맥 사이에 흐른다. 이 정기적 복용하기에 가장 큰 장점m은 염증 경로가 직접 또는 간접적으로 조작하는 유전자 조작 된 마우스를 사용하는 능력이다. 또한, 유동 조건 하에서, 외부의 자유 활성 염증, 백혈구 부착 분자의 격리 기여를 정확하게 할 수있는 능력이있다. 유동 챔버의 입력 시점에서 유동 조절기의 애플리케이션은 동맥 또는 정맥 시스템 18-22를 모방하는 전단력의 실험 변동 폭넓게 제공한다. 여기에서 우리는 훌륭한 세부 사항에 생체 autoperfused 마이크로 플로우 챔버 분석의 준비와 성능에 관한 프로토콜을 설명합니다.
프로토콜
동물의 모든 실험은 안과 및 비전 연구에서 동물의 사용을위한 비전 및 안과 문 협회에 대한 연구에 따라 처리하고, 지침과 규정은 매사추세츠 눈과 귀 양호실 동물 관리위원회 규정.
실험 전날 :
유량 용기 용 튜브 1. 준비
- 경정맥면을 준비하려면, 5cm 폴리에틸렌 튜브 다음 6cm 실리콘 튜브에 1cm PE10 폴리에틸렌 튜브를 연결합니다. 경동맥 측, 약 1.5 cm 떨어진 1cm 폴리에틸렌 튜브에서 6cm 실리콘 튜브 내의 T-튜브의 첨가 경정맥 측 비슷하게 준비 (도 1A, B). T 관을 삽입하기 위해, 필요하다면 미세 핀셋을 이용하여 실리콘 튜브를 넓혀.
- 압력 변환기에 실리콘 튜브 10cm의 일단을 연결하는 것은 다음 경동맥 T (S)의 단부를 삽입다른 쪽 끝으로 IDE T-튜브. 사이트가 꽉 연결을 확인하고 무료 누출. 필요한 경우 튜브가 함께 맞는 곳을 통해 파라 필름의 작은 사각형 조각을 적용, 누설 (그림 1C)을 방지합니다.
2. 상공 회의소 코팅
- 내피 표면 단백질 코팅을 준비 (예를 들어, P 셀렉틴, 간 부착 분자 -1 (ICAM-1), 혈관 세포 부착 단백질 -1 (VCAM-1)) 0.1 % BSA에서. 가이드 라인으로, 단백질의 1 μg의 200 μL에서 BSA는 4-5 챔버 코트에 충분하다. 내피 표면 코팅 단백질과 각 챔버 (0.04 X 0.4 X 50mm)를 주입, 25 G 바늘에 연결된 1 ML의 주사기를 사용하여. 4 ° C에서 하룻밤 15 ML 튜브에 코팅 챔버를 저장합니다.
실험 일 :
3. 상공 회의소 준비
- 4 ° C에서 코팅 챔버를 제거하고 각 측면에 경정맥과 경동맥 튜브를 연결합니다. 접속 .. 물개조심스럽게 튜브가 챔버를 만나는 곳 이상의 파라 필름의 작은 사각형 조각을 늘려서 기능. 주사기를 사용, 0.1 % BSA (누출 검사)와 챔버와 튜브를 입력합니다. 45 분 동안 품어.
- 접시의 양쪽에있는 노치를 절단하여 챔버를 보유하는 35mm 페트리 접시를 준비합니다. 홈에서 실을 안정; 다음 노치 사이트에있는 접시에 실을 부착하는 실리콘의 작은 방울을 사용합니다. 챔버는 현미경으로 조사하여 수준인지 확인합니다. 실리콘은 적어도 15 분 동안 건조시킵니다.
- 헤파린 60 ml의 잠금 주사기를 입력하고 압력 변환기에 연결합니다. 트랜스 듀서, 실리콘 튜브, 및 T-관 : 경동맥 다음과 같은 순서로 튜브에 압력 변환기를 연결합니다.
- 트랜스 듀서와 연결을 확보하기 위해 T-튜브에 연결된 실리콘 튜브 사이에 1cm의 PE50을 사용합니다. 가압 클램프 (도 1d)를 통해 경동맥 실리콘 튜브를 통과한다. 100USP 헤파린 죽을 실행우 기포는 튜브와 챔버가 없을 때까지.
4. 소프트웨어 설정
- 소프트웨어를 준비하려면, 컴퓨터, 현미경, 개방 실험실 장치의 전원을 켭니다. 더블 라이카 애플리케이션 스위트 (LAS) (또는 동급)을 클릭하고 비디오 저장할 폴더를 준비 : 검색을 → 획득 → 영화 → 클립의 순서를 정의 (클립 = 15, 녹화 시간 = 30 초, 그리고 간격 = 15 초) 다음 확인하기 위해 "+"기호를 클릭합니다.
- 유동 압력이 위의 단계 4.1에 기록 폴더에 파일 이름을 LabChart (또는 동급) 파일을 열고 좌표를 기록합니다.
5. 수술
- 케타민 (60 ㎎ / kg)과 자일 라진 (6 ㎎ / kg)의 조합을 사용하여 8-10 주령 마우스를 마취하여 복강 내 (IP) 주사. 깊은 진정 페달 철수 반사의 손실로 5 ~ 10 분 이내에 얻을 수 있는지 확인합니다. 필요한 경우, 이소 플루 란 경우필요에 따라 얼굴 마스크를 통해 전달을들 수있다.
- 마취하는 동안, 케이지에서 온난화 패드를 배치하고 체온을 유지하기 위해 37 ° C로 설정. 적절한 마취가 확인되면, 안구 건조를 방지하기 위해 바시 트라 신 연고와 복부 위치와 코트에 눈을 마우스를 놓습니다.
- 그 후, 면도날을 사용하여 절개 부위에서 털을 면도하고 철저 알코올 현장 청소.
- 일단 완전 마취하면 테이프 복부 위치에 마우스를 유지하는 동물을 고정. 가위로 목 영역을 노출하고 기관 및 선박 (그림 2A)를 노출하는 갑상선을 제거합니다.
- 완전히 미주 신경 (그림 2B)을 손상하지 않도록주의하면서 노출 될 때까지 경동맥를 청소합니다. 봉합사의 조각을 접어 후 경동맥 아래에 봉합의 2 개는 지금 거기 그래서 굽힘 절단 경동맥 아래 벤드를 전달합니다. 루프 매듭으로 각 봉합 (를 체결하지노트).
- 동일한 방식으로 (도 2D)에 봉합사를 제조 좌측 경정맥 (도 2C)을 노출시키기 위해 동일한 절차를 반복한다.
- 마우스 혈관에 튜브를 연결합니다.
- 헤파린 IP 1 ㎖를 주입하여 마우스를 Heparinize.
- 경동맥에 상단 봉합을 조입니다. 이 경동맥 (그림 3A)에 갈 수 낮은 선박 클램프를 놓습니다. microscissors (그림 3B)를 사용하여, 작은 절개, 동맥의 둘레의 약 1/8을 상단 봉합에 의한 동맥을 잡고 수 있도록 집게를 사용합니다.
- 상부 봉합사 및 동맥 내로 만들어진 절개를 통하여 제 매듭 경동맥 튜빙 합격. 동맥 (도 3C를 여러 매듭이 단단히 밀착을 보장해야한다) 튜브 주위에 밀봉되도록 낮은 봉합을 묶어.
- (경정맥 관을 삽입하기위한 용기를 동일한 절차를 반복클램프는 경정맥 측면에 대한 필요하지 않습니다 그림 3D)를.
- 선박 클램프를 풀어 흐름을 테스트합니다. 누출이없는 경우 현미경으로 마우스를 이동하고 챔버 튜브 (수술 과정을 보여주는 부착 된 비디오 참조) 경동맥 튜브 및 경정맥을 연결합니다.
6. 녹음 회전 속도
- 마우스 순환 시스템 회로를 만들고, 챔버를 채우기 위해 경동맥 클램프를 연다. 흐름 조건이 안정되도록 피가 3 ~ 5 분 동안 순환 할 수 있습니다. 챔버는 현미경 대물 한 단부에서 다른 레벨이고 가장자리는 화면에 영상 녹화 윈도우로 평행이되도록 3-5 분의 대기 기간 동안, 현미경 스테이지를 조절.
- 챔버를 통해 흐르는 셀이 보이도록 한 다음 접시에 10X 수침 대물 낮은 유리 물 챔버를 포함하는 수정 된 페트리 접시를 채운다.광 강도는 셀의 적절한 시청 조절 될 필요가있다. 일반적으로 낮은 강도가 더 낫다.
- 트랜스 듀서는 중간 생리 흐름 압력에 상관, 꾸준한 30mm 수은을 읽도록하거나, 원하는대로 튜브에 클램프를 조정합니다.
- 를 눌러 비디오 및 경정맥 끝 가까이에 완료 될 때까지 경동맥 끝쪽으로의 흐름에 대해 이동 처음 경과와 압력을 모두 기록 시작하기 위해 "시작".
주의 : 다른 접착 분자를 이용한 여러 코팅 조건은 다중 챔버를 사용하여 동일한 마우스에서 연구 될 수있다. 오직 하나의 챔버는 한번에 기록된다.- 기록이 완료되면, 혈류 정지, 입력 사이트 밸브를 닫는다. 챔버를 제거하고 다른 손에 한 손으로 미세 집게와 홈 집게를 사용하여 회로 (다른 접착 분자로 코팅 된) 새로운 실을 맞습니다. 단계에 설명 된대로 새로운 실에 대한 기록 재개6.1-6.4.
- CO에 의해 실험의 끝에서 척수 탈구 다음이 질식을 마우스를 모두 안락사. 절차는, 따라서, 마우스는 실험의 끝에 척수 전위 단자 의해 안락사된다.
7. 결과 해석
- 기록 된 데이터가 ImageJ에 소프트웨어 (23)은 "M TrackJ"플러그인을 사용하여 분석합니다.
- 파일 → 가져 오기 →의 AVI → 그레이 스케일로 변환하여 그레이 스케일로 파일을 변환합니다.
- 글로벌 → 프레임 간격 (i)를 입력 재산 → → 선택 → 이미지로 프레임을 표준화. (J 비디오 이미지 윈도우의 상부 모서리에 도시)에 하나의 비디오 프레임의 개수에 의해 비디오 전체 기간 (통상 30 초)을 나누어 프레임 간격을 계산한다.
- M TrackJ가 → 백혈구를 선택 트랙을 추가 → → 선택 플러그인하여 각 백혈구의 흐름을 측정→ (15)에 대한 각각의 프레임을 추적 - 20 초 → 병합.
- 보기에서 모든 백혈구 단계를 반복 7.4.
- 두 개의 열 복사 → M TrakJ의 모든 표시 → 선택 측정하여 백혈구의 평균 압연 속도를 결정 스프레드 시트로 추적합니다. "V 의미"열 픽셀 / 초 단위로 측정 백혈구 롤링입니다. 2/3로 나누어 μm의 / 초로 변환합니다.
- 스프레드 시트로 압력 데이터 하이라이트 및 수출을 분석하고 다음과 같은 계산을 수행하려면 ΔP (mmHg로)와 t (다인 / cm 2) 각 실험군 간의 비교. 계산하면, 그래프에 대한 프리즘 소프트웨어로 데이터를 복사합니다.
결과
각 기록 만 상호 작용 백혈구 동안 챔버에 분명하다. 대표적인 실험의 결과는도 4에서 볼 수있다. 흰색 화살표 관심 분자 접착에 의해 캡처하고, 혈류 내의 다른 자유 유동 챔버들 사이를 따라 굴러 개별 백혈구 가리. 챔버 외부의 일반적인 이슈는 모든 이미지에 큰 어두운 분야로 볼 수있다. 어두운 분야에서는 독자가 고정 점과 관련하여, 백혈구 이동을 이해할 도움. 22 초의 기간에 걸쳐 발전 백혈구는 관련 분야에서 볼 수있다. 동 도면에 그래프 TX1 압연 속도 (좌측 시프트)을 감소시키고 TX2는 대조군에 비해 속도 (우측 시프트)을 증가 최종 데이터 그래프를 보여준다.
0 "/>
그림 1 : 유량 용기 용 튜브의 준비. (A) 도구 실리콘은 002, Y 튜브, T 관, 35mm 페트리 접시, 미세 집게, 미세 가위 튜브, 튜브 및 챔버 어셈블리 (마이크로 유리 챔버 0.4 × 0.04 × 50 mm의 폴리에틸렌 튜브 PE10, 폴리에틸렌 튜브 PE60에 필요한, 튜브 홀더, 혈관 클램프 7-0 실크 봉합사. 코팅 챔버를 통해 마우스 혈액의 흐름을 다시 향하게하는 경동맥과 경정맥 튜빙 (B)의 제조. (C) 압력 변환기에 경동맥 연결 튜브. (D) 혈액의 흐름의 속도를 조정할 수있는 클램프를 통해 트랜스 듀서에서 튜브를 전달합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
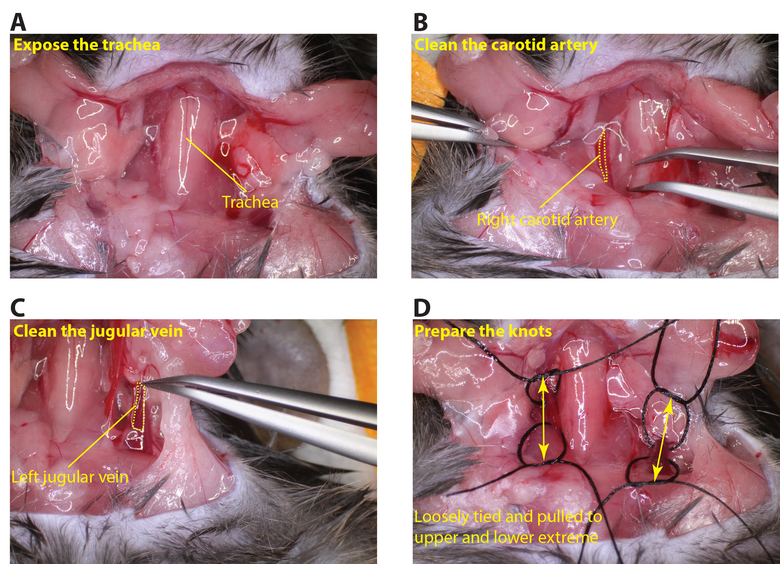
그림 2.. 경동맥과 경정맥을 노출하기 (A)을 조심스럽게 황색 점선 ((B) 기관을 노출 넥 영역을 잘라 봉합 부분이 용기의 아래에 전달 될 수 있도록 우측 경동맥 청소 라인) 경동맥을 설명합니다. 봉합사의 조각 (노란 점선 라인은 경정맥을 설명) 선박에서 통과 될 수 있도록 (C)이 왼쪽 경정맥를 청소합니다. (D) 느슨하게 상부 및 하부 지역에서 봉합을 묶어 정렬 경동맥과 경정맥 (화살표 용기의 상부 및 하부 영역을 표시)의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
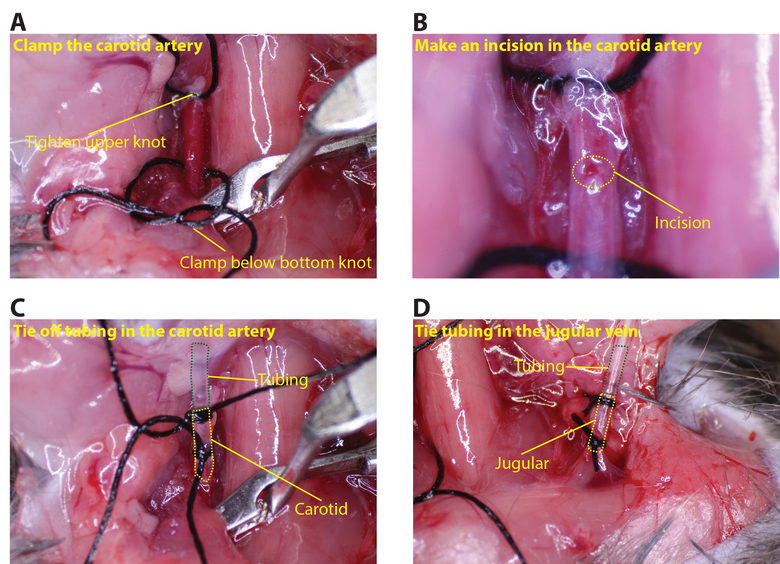
그림 3 : 튜브를 연결하기 t하기그는 동맥 및 경정맥을 경동맥. (A) 경동맥에 위 매듭을 조여와 하부 매듭 아래의 클램프를 배치합니다. (B)를 microscissors를 사용하여 경동맥에 작은 절개를, 약 1/8 둘레 (점선 노란색 원은 절개를 나타낸다). ( C)는 경동맥에 튜브를 삽입하고 두 개 이상의 봉합 (녹색 점선 튜브와 노란색 점선 경동맥을 보여줍니다) 고정합니다. (D)을 마찬가지로 녹색 점선은 튜브와를 보여줍니다 (경정맥에 튜브를 삽입 노란색 점선 경정맥). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
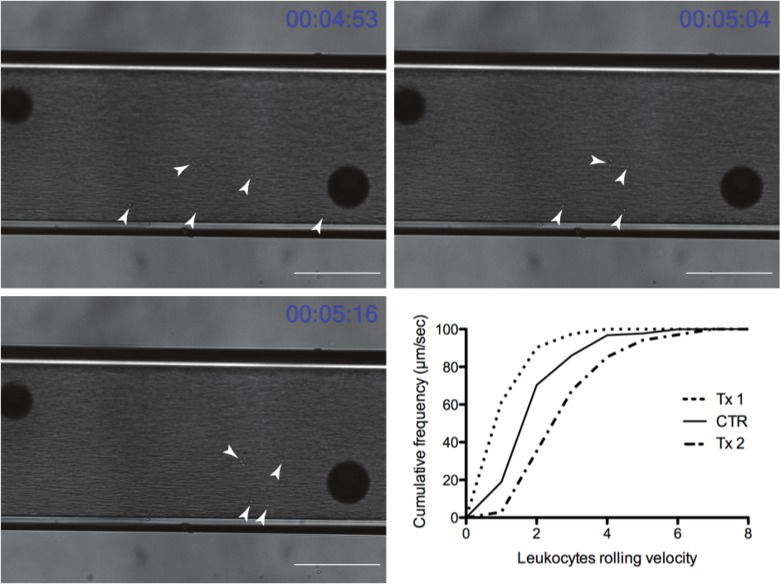
그림 4 : 흐름 참을 통해 압 백혈구의 대표적인 시간 코스BER (스케일 바 = 100 ㎛) (흰색 화살촉 롤링 백혈구 지적이). 그래프는 그래프 프로그램으로 보낸 후에 대표적인 결과를 보여줍니다 (TX1과 TX2는 실험 치료 그룹이며, CTR은 대조군)입니다. TX2는 속도 롤링 백혈구의 증가를 반영 우측 시프트 리드하면서 TX1은 속도 및 미처리 군 (CTR)와 비교하여 그래프의 좌측 시프트 압연 백혈구의 감소로 이어지는 느리게 백혈구하는 치료를 나타낸다. 를 클릭하세요 여기에이 그림의 더 큰 버전을 볼 수 있습니다.
토론
백혈구 보충 프로세스는 염증 반응에서 중요한 단계이다; 이것은 그들이 그들의 작동 자 기능을 발휘할 수있는 표적 조직쪽으로 순환계에서 백혈구의 이동을 수반한다. 백혈구 보충은 죽상 경화성 플라크, 심근 경색, 허혈 / 재관류 및 이식 수술 일뿐만 아니라, 여러 CNS 관련 신경 염증성 질환 같은 염증성 10-12,20,24,25 다양한 조건에서 적분된다. 백혈구 보충 스팬은 autoperfused 마이크로 플로우 챔버는 조사자 백혈구 이주 역학을 연구 할 수있는 능력을 허용하는 필수 불가결 한 도구를 제공하는 질병 상태의 다양성을 고려.
지난 수십 년간, 시험 관내 검정법 다양한 백혈구 세포 유착 (26)의 동역학을 연구하기 위해 개발되었다. 불행히도, 이러한 모든 분석의 추출을 필요혈액에서 백혈구, 기계 활성화를 소개합니다. 생체 내 환경에 근접하게, 적응은 전혈 시료를 수집하고 혈역학 유동 조건 (16, 17)를 제어하도록 하였다. 여기서는 마우스 순환 시스템으로 코팅 챔버를 연결하여 필드 이전 발전을 연장한다. 우리는 생리적 범위로 혈액의 흐름을 조절하고 백혈구 롤링의 역학을 연구 할 수 있습니다. 코팅 챔버는 우리에게 특정 접착 분자와 백혈구의 상호 작용을 연구 할 수있는 기능을 제공합니다. 시스템이 살아있는 마우스에 의해 조작 수단으로서 기능하기 때문에,보다 밀접 우리 면역 마우스 모델의 다양한 백혈구 - 내피 세포 상호 작용을 연구 할 수 있도록, 자연 환경을 모방. 또한,이 시스템은 우리가 제공되는 다중 유전자 마우스 모델을 활용할 수있다. 시스템이 완전히 생체 환경을 복제하지 않지만, 그것은보고 특정을 연구하는 플랫폼을 제공한다생리적 조건에서 백혈구의 C 원소, 이전에 가능하지 않았다 묘기. 이 걸음 더 가까이 더 생리적 환경에 우리를 데려 간다하더라도 시스템에 대한 제한 사항이 있습니다. 우리가 실 코팅으로 제한됩니다 백혈구 상호 작용의 특정 요소를 평가하는 유일한 수 있도록 완전히 혈관의 복잡한 3D 매트릭스를 복제하지 않습니다. 게다가,주의 깊게 프로토콜에서 언급 된 모든 단계에 따라 마우스의 순환하는 폐쇄 시스템을 확인해야한다. 기포의 도입은 크게 실험의 재현성 및 정확성에 영향을 미칠 것이다.
우리는 백혈구 롤링 역학을 평가 Autoperfused 마이크로 플로우 챔버의 사용을 설명하지만 절차는 다양한 질환을 연구 수사관 개인화 될 가능성이있다. 예를 들어, 암 세포는 백혈구 공유 공통 인테그린 많은 표현함으로써 전이. 나머지 공부g 더 가깝게 우리의 지식에 도움이 될 수있는 생체 내 환경을 모방 설정 및 특정 암 세포 침입의 가능성이 자연 예측에서의 롤링 역학. 하나의 가능한 접근법은 GFP를 발현하는 암세포의 롤링 역학을 추적하는 유량 용기 분석과 함께, 예컨대 27과 GFP 암세포에 대해 라벨링 기술을 결합 할 수있다. 그것은이 절차가 유전자 변형 마우스 및 질병 모델과 함께 다른 실험실에서 사용하기 위해 수정 방식을 볼 수 흥미로운 일이 될 것이다 물질의 다양한 챔버를 코팅과 같은 마우스에 여러 개의 챔버를 연결의 유연성을 감안할 때. 우리가 여기에서 설명하는 기술은 오직 연구자의 창의성에 의해 제한된다 훨씬 광범위한 응용 가능성에 감동.
공개
The authors (L.M., H.S., and K.M.C.) have no competing financial interests to disclose.
감사의 말
R01EY022084 / S1 (KMC), T32EY007145 (HS) 및 P30EY014104 :이 책에서보고 된 연구는 보너스 번호에 따라 국립 보건원 (NIH)의 국립 안과 연구소에 의해 지원되었다. 내용은 전적으로 저자의 책임이며 반드시 국립 보건원의 공식 견해를 대변하지 않습니다. 추가 지원은 매사추세츠 라이온스 안구 연구 기금 (KMC)와 (KMC에) 실명 예방 연구에서 특별 장학생 상에 의해 제공되었다.
자료
| Name | Company | Catalog Number | Comments |
| Material | Vendor | Part number | |
| Micro glass chamber 0.4x0.04x50mm | VitroCom | 2540-050 | |
| Polyethylene tubing PE 10 | Fisher Scientific | 427400 | |
| Polyethylene tubing PE 60 | Fisher Scientific | 427416 | |
| Silicone tubing 002 | Fisher Scientific | 11-189-15A | |
| Y tube | Value Plastics | Y210-6 | |
| T tube | value plastics | T410-6 | |
| Silicone gel | Hardware store - Home Depo | ||
| 35mm petri dish | Corning | 430165 | |
| Parafilm | Pechiney Plastic Packaging | PM996 | |
| Fine forceps | FST | 11253-25 | |
| Fine scissors | FST | 15000-08 | |
| Tube holder | FST | 00608-11 | |
| Clamp applicator | FST | 18057-14 | |
| Vascular clamp | FST | 18055-04 | |
| 6-0 silk sutures | George Tiemann & Co | 160-1215-6/0 | |
| 25x1G needles | BD | 305125 | |
| 30x1/2G needles | BD | 305106 | |
| Heparin 100 USP units/ml | Hospital pharmacy |
참고문헌
- Barreiro, O., Sanchez-Madrid, F. Molecular basis of leukocyte-endothelium interactions during the inflammatory response. Revista Espanola de Cardiologia. 62, 552-562 (2009).
- Muller, W. A. Leukocyte-endothelial-cell interactions in leukocyte transmigration and the inflammatory response. Trends in Immunology. 24, 327-334 (2003).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20, 525-532 (2008).
- Mehta, P., Cummings, R. D., McEver, R. P. Affinity and kinetic analysis of P-selectin binding to P-selectin glycoprotein ligand-1. The Journal of Biological Chemistry. 273, 32506-32513 (1998).
- Nicholson, M. W., Barclay, A. N., Singer, M. S., Rosen, S. D., vander Merwe, P. A. Affinity and kinetic analysis of L-selectin (CD62L) binding to glycosylation-dependent cell-adhesion molecule-1. The Journal of Biological Chemistry. 273, 763-770 (1998).
- Sandig, M., Negrou, E., Rogers, K. A. Changes in the distribution of LFA-1, catenins, and F-actin during transendothelial migration of monocytes in culture. Journal of Cell Science. 110 (22), 2807-2818 (1997).
- Shaw, S. K., et al. Coordinated redistribution of leukocyte LFA-1 and endothelial cell ICAM-1 accompany neutrophil transmigration. The Journal of Experimental Medicine. 200, 1571-1580 (2004).
- Woodfin, A., et al. JAM-A mediates neutrophil transmigration in a stimulus-specific manner in vivo: evidence for sequential roles for JAM-A and PECAM-1 in neutrophil transmigration. Blood. 110, 1848-1856 (2007).
- Blankenberg, S., Barbaux, S., Tiret, L. Adhesion molecules and atherosclerosis. Atherosclerosis. 170, 191-203 (2003).
- Parmeggiani, F., et al. Mechanism of inflammation in age-related macular degeneration. Mediators of Inflammation. 2012, 546786 (2012).
- Ding, X., Patel, M., Chan, C. C. Molecular pathology of age-related macular degeneration. Progress in Retinal and Eye Research. 28, 1-18 (2009).
- Xu, H., Chen, M., Forrester, J. V. Para-inflammation in the aging retina. Progress in Retinal and Eye Research. 28, 348-368 (2009).
- Peterson, K., et al. Drug Class Review: Nonsteroidal Antiinflammatory Drugs (NSAIDs): Final Update 4 Report. Drug Class Reviews. , (2010).
- Ulbrich, H., Eriksson, E. E., Lindbom, L. Leukocyte and endothelial cell adhesion molecules as targets for therapeutic interventions in inflammatory disease. Trends in Pharmacological Sciences. 24, 640-647 (2003).
- Stamper, H. B., Woodruff, J. J. Lymphocyte homing into lymph nodes: in vitro demonstration of the selective affinity of recirculating lymphocytes for high-endothelial venules. The Journal of Experimental Medicine. 144, 828-833 (1976).
- Lawrence, M. B., McIntire, L. V., Eskin, S. G. Effect of flow on polymorphonuclear leukocyte/endothelial cell adhesion. Blood. 70, 1284-1290 (1987).
- Abbitt, K. B., Nash, G. B. Characteristics of leucocyte adhesion directly observed in flowing whole blood in vitro. British Journal of Haematology. 112, 55-63 (2001).
- Smith, M. L., Sperandio, M., Galkina, E. V., Ley, K. Autoperfused mouse flow chamber reveals synergistic neutrophil accumulation through P-selectin and E-selectin. Journal of Leukocyte Biology. 76, 985-993 (2004).
- Yuan, J., Melder, R. J., Jain, R. K., Munn, L. L. Lateral view flow system for studies of cell adhesion and deformation under flow conditions. BioTechniques. 30, 388-394 (2001).
- Moalem, G., et al. Autoimmune T cells protect neurons from secondary degeneration after central nervous system axotomy. Nature Medicine. 5, 49-55 (1999).
- Hafezi-Moghadam, A., Thomas, K. L., Cornelssen, C. A novel mouse-driven ex vivo flow chamber for the study of leukocyte and platelet function. American Journal of Physiology. Cell Physiology. 286, 876-892 (2004).
- Almulki, L., et al. Surprising up-regulation of P-selectin glycoprotein ligand-1 (PSGL-1) in endotoxin-induced uveitis. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology. 23, 929-939 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Rapalino, O., et al. Implantation of stimulated homologous macrophages results in partial recovery of paraplegic rats. Nature Medicine. 4, 814-821 (1998).
- Yoles, E., et al. Protective autoimmunity is a physiological response to CNS trauma. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 21, 3740-3748 (2001).
- Buchanan, M. R., Vazquez, M. J., Gimbrone, M. A. Arachidonic acid metabolism and the adhesion of human polymorphonuclear leukocytes to cultured vascular endothelial cells. Blood. 62, 889-895 (1983).
- Connor, K. M., et al. Manganese superoxide dismutase enhances the invasive and migratory activity of tumor cells. Cancer Res. 67, 10260-10267 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유