Method Article
Évaluer les interactions de leucocytes-endothélial dans des conditions d'écoulement dans un
Dans cet article
Résumé
Ici, nous présentons un protocole qui permet à l'enquêteur d'évaluer la dynamique du recrutement de leucocytes ex vivo en connectant une chambre revêtue d'adhérence des molécules dérivées de l'endothélium dans le système circulatoire d'une souris. Cette méthode offre des avantages importants, car il permet l'évaluation de leucocytes dans des conditions biologiques relatives.
Résumé
interactions leucocytes-endothélial sont des événements précoces et critiques dans l'inflammation aiguë et chronique et peuvent, lorsque dérégulé, médiation lésion tissulaire entraînant des dommages pathologique permanente. Des analyses classiques existants permettent l'analyse des molécules d'adhésion des leucocytes seulement après l'extraction de leucocytes à partir du sang. Cela nécessite le sang subir plusieurs étapes avant de leucocytes du sang périphérique (PBL) peuvent être prêtes pour l'analyse, qui à son tour peut stimuler PBL influençant les résultats de recherche. Le dosage de la chambre d'écoulement micro autoperfused, cependant, permet aux scientifiques d'étudier début des leucocytes dérégulation fonctionnelle en utilisant le flux systémique d'une souris vivante tout en ayant la liberté de manipuler une chambre couché. Grâce à un modèle de la maladie, l'expression fonctionnelle de molécules d'adhésion de leucocytes peut être évaluée et quantifiée dans une chambre micro-verre revêtue de molécules immobilisées d'adhérence endotheliale ex vivo. Dans ce modèle, le sang se écouleentre le droit artère carotide commune gauche et la veine jugulaire externe d'une souris vivante sous anesthésie, ce qui permet l'interaction de PBL indigènes dans la chambre. Analyse expérimentale en temps réel est réalisée à l'aide d'un microscope intravitale ainsi qu'un dispositif de pression de l'appareil Harvard. L'application d'un régulateur d'écoulement au niveau du point de la chambre de verre d'entrée permet des conditions d'écoulement physiologiques comparables entre les essais. Leucocytes vitesse de roulement est le résultat principal et est mesurée en utilisant les National Institutes of Health libre accès ImageJ logiciel. En résumé, le micro dosage de chambre d'écoulement autoperfused fournit un environnement physiologique optimale pour étudier l'interaction leucocytes endothéliale et permet aux chercheurs de tirer des conclusions précises lorsque l'on étudie l'inflammation.
Introduction
Inflammation est la réponse universelle de l'organisme à une lésion et est une étape cruciale à la fois la fonction immunitaire innée et adaptative système. En réponse à une blessure et / ou des stimuli inflammatoires, les cellules endothéliales régulation positive des molécules d'adhésion spécifiques; ce qui conduit à extravasation des leucocytes à travers l'endothélium microvasculaire, principalement dans les veinules post-capillaires. Ce processus commence par attacher des leucocytes à écoulement libre dans le sang sur l'endothélium. Laminage stable et ferme adhésion des leucocytes, qui à son tour conduit à la transmigration et la sécrétion d'agents cytotoxiques, suivent cette attacher 1,2. Les sélectines sont connus pour arbitrer les étapes précoces de la cascade de 3 à 5; intégrines sont responsables pour les étapes ultérieures de cabinet adhérence et la transmigration 1,6-8.
Un nombre croissant de preuves suggère leucocytes et des molécules d'adhésion endothéliales ont un rôle vital dans les modèles animaux de lésions de reperfusion d'ischémie, L'asthme, le psoriasis, la sclérose en plaques et la dégénérescence maculaire liée à l'âge de 9 à 12. Dans ces conditions, la réponse inflammatoire est mal orienté à attaquer son propre corps, entraînant la dégradation des tissus sains. Des agents anti-inflammatoires existants (tels que les médicaments non-stéroïdiens anti-inflammatoires, les corticostéroïdes ou d'autres agents chimiothérapeutiques) portent le risque d'effets indésirables graves avec l'utilisation à long terme 13. Par conséquent, il est d'un grand intérêt d'avoir les outils appropriés avec la possibilité d'identifier des molécules spécifiques de la maladie, qui peut finalement être la cible d'avoir l'effet anti-inflammatoire désiré tout en restant non toxique 14.
Existante de méthodes in vitro tels que le test d'adhérence des leucocytes statique ont été utilisés dès 1976 15. La chambre d'écoulement parallèle a été utilisé pour la première in vitro en 1987 pour étudier les interactions leucocytes-endothélial dans des conditions d'écoulement. Dans ces expériences, stimulée human leucocytes polymorphonucléaires (PMN) à partir de sang veineux ont été perfuses sur une monocouche de cellules primaires humaines endotheliales de veine ombilicale (HUVEC). Pour contrôler les conditions d'écoulement hémodynamique, la pompe Appareil de seringue Harvard a été utilisé 16. En variante, pour éviter l'isolement de leucocytes artificiel, le sang total a été utilisé en combinaison avec la chambre de verre revêtue de molécules d'adhésion 17 immobilisées.
Pour éviter une stimulation des leucocytes et d'étudier de façon mécanique leur interaction avec les molécules d'adhésion dans des conditions physiologiques approximatives, ex vivo autoperfused, extracorporelle, circuit artérioveineux est développé 16. Dans ce circuit, le sang se écoule entre le droit artère carotide commune gauche et la veine jugulaire externe d'une souris sous anesthésie en direct, ce qui permet l'interaction de PBL natifs dans une chambre de microflux de verre revêtue de molécules d'adhérence simples ou co-immobilisée. Un avantage majeur à ce system est la capacité d'utiliser des souris génétiquement modifiées, dans lesquelles les voies inflammatoires sont directement ou indirectement manipulé. En outre, il existe la possibilité d'identifier la contribution isolé de molécules d'adhérence des leucocytes à l'inflammation, exempt d'activation externe, dans des conditions d'écoulement. L'application d'un régulateur de débit au point de la chambre de flux d'entrée fournit une large gamme de variations expérimentales de forces de cisaillement pour imiter soit artérielle ou systèmes veineux 18-22. Ici, nous décrivons en détail un protocole concernant la préparation et l'exécution de l'ex vivo autoperfused dosage de la chambre de microflux.
Protocole
Toutes les expériences sur les animaux ont été traités conformément à l'Association pour la recherche en vision et ophtalmologie Déclaration pour l'utilisation d'animaux dans ophtalmique et Vision Research, et les directives et règlements énoncés par le Ear Infirmary Comité de protection des animaux Massachusetts Eye et.
La veille de l'expérience:
1. Préparation des tubes de la Chambre de débit
- Pour préparer le côté jugulaire, connectez une cm PE10 tuyaux en polyéthylène à un tube de silicium de 6 cm par 5 cm suivi des tuyaux en polyéthylène. Pour la partie de la carotide, de préparer de manière similaire au côté jugulaire avec l'addition d'un tube en T dans le tube de silicium de 6 cm à environ 1,5 cm de la 1 cm de tubulure en polyéthylène (figure 1A, B). Pour insérer le tube en T, d'élargir le tube de silicium en utilisant une pince fine si nécessaire.
- Branchez une extrémité de 10 cm de tube de silicone pour le capteur de pression puis insérez la fin de la carotide s Tide tube en T dans l'autre extrémité. Vérifiez que la connexion des sites sont serrés et sans fuite. Appliquer une petite pièce rectangulaire de parafilm sur lequel se emboîte le tube, si nécessaire, pour éviter les fuites (figure 1C).
2. Revêtement la Chambre
- Préparation de la protéine de revêtement de surface endotheliale (par exemple, P-sélectine, molécule d'adhésion intercellulaire-1 (ICAM-1), protéine vasculaire-1 d'adhésion cellulaire (VCAM-1)) dans 0,1% de BSA. A titre indicatif, 1 pg de protéine dans 200 pi de BSA est assez pour recouvrir 4-5 chambres. En utilisant une seringue de 1 ml reliée à une aiguille G 25, infuser chaque chambre (0,04 x 0,4 x 50 mm) avec une protéine de revêtement de surface endotheliale. Stocker les chambres revêtues dans un tube de 15 ml à 4 ° C jusqu'au lendemain.
Le jour de l'expérience:
3. Préparation de la Chambre
- Enlever les chambres recouvertes de 4 ° C et raccorder le tuyau jugulaire et la carotide de chaque côté. Sceller les rapproons en étirant attentivement une petite pièce rectangulaire de parafilm sur l'endroit où le tuyau se réunit la chambre. En utilisant une seringue, remplir la chambre et le tube avec 0,1% de BSA (vérifier les fuites). Incuber pendant 45 min.
- Préparer un plat de 35 mm de Petri à maintenir la chambre en coupant encoches de chaque côté de l'assiette. Stabiliser la chambre dans les encoches; puis utiliser une petite goutte de silicone à apposer la chambre à l'antenne sur le site crantée. Assurez-vous que la chambre est de niveau en regardant sous le microscope. Laisser le silicone sécher pendant au moins 15 min.
- Remplir une seringue de verrouillage 60 ml avec de l'héparine et à connecter le transducteur de pression. Connecter le transducteur de pression à la tubulure de la carotide dans l'ordre suivant: transducteur, un tube de silicium et T-tube.
- Utiliser un 1 cm entre la tubulure PE50 de silicium relié au transducteur et le tube en T pour sécuriser la connexion. Passez le tube de silicium de l'artère carotide dans le collier de pression (figure 1D). Exécutez 100USP héparine Through le tube et la chambre jusqu'à ce qu'il n'y a pas de bulles d'air.
4. Mise en place du logiciel
- Pour préparer le logiciel, allumez l'ordinateur, microscope, et un dispositif de laboratoire ouvert. Double-cliquez sur le Leica Application Suite (LAS) (ou l'équivalent) et de préparer un dossier pour enregistrer la vidéo: parcourir → → acquérir film → définir séquence de clips (clips = 15, temps d'enregistrement = 30 sec, et les intervalles = 15 sec) puis cliquez sur le signe "+" pour confirmer.
- Pour enregistrer la pression d'écoulement ouvrir le LabChart (ou équivalent) fichier et coordonner le nom de fichier dans le dossier d'enregistrement à l'étape 4.1, ci-dessus.
5. Procédure chirurgicale
- 10.8 anesthésier un week-old souris en utilisant une combinaison de kétamine (60 mg / kg) et de xylazine (6 mg / kg) injecté par voie intraperitoneale (IP). Assurez-vous que la sédation profonde est atteint dans 5-10 min par la perte du retrait de la pédale réflexe. Si nécessaire, l'isofluraneenvoyé par masque peut être donnée au besoin.
- Alors que sous anesthésie, placer un coussin chauffant sous la cage et mettre à 37 ° C pour maintenir la température du corps. Une fois l'anesthésie adéquate est confirmée, placez la souris dans une position ventrale et le manteau les yeux avec bacitracine onguent pour prévenir la sécheresse oculaire.
- Par la suite, de se raser les cheveux à l'endroit de l'incision à l'aide d'une lame de rasoir et nettoyer le site avec de l'alcool.
- Une fois complètement anesthésié sécuriser l'animal avec du ruban adhésif en gardant la souris dans une position ventrale. Exposer la région du cou avec des ciseaux et enlever la glande thyroïde pour exposer la trachée et des vaisseaux (figure 2A).
- Nettoyez l'artère carotide jusqu'à ce qu'il soit entièrement exposé en prenant soin de ne pas endommager le nerf vague (figure 2B). Pliez un morceau de suture et passer le virage sous l'artère carotide puis couper au niveau du coude il ya donc maintenant deux morceaux de suture en dessous de la carotide. Boucle chaque suture en noeuds (ne pas serrer lesnœuds).
- Répétez la même procédure pour exposer la veine jugulaire gauche (figure 2C), la préparation des sutures de la même manière (Figure 2D).
- Connectez le tuyau à la vascularisation de la souris.
- Hépariner la souris par injection de 1 ml d'héparine IP.
- Serrer la suture supérieure sur l'artère carotide. Placez la pince aussi bas qu'il peut aller sur l'artère carotide (figure 3A) de la cuve. Utiliser des pinces pour maintenir l'artère par la suture supérieure et une petite incision, environ 1/8 de la circonférence de l'artère, en utilisant les microciseaux (figure 3B).
- Faire passer le tube de l'artère carotide par l'intermédiaire du second noeud dans le fil de suture supérieure et dans l'incision pratiquée dans l'artère. Attacher la suture inférieure de sorte que l'artère est scellée autour du tube (plusieurs noeuds doivent être prises pour assurer un joint étanche, la figure 3C).
- Répétez la même procédure pour insérer le tube de la veine jugulaire (le navirepince ne est pas nécessaire pour le côté jugulaire; Figure 3D).
- Testez le flux en relâchant la pince de navire. Se il n'y a pas de fuites déplacer la souris pour le microscope et raccorder le tuyau de la carotide et la veine jugulaire à la tubulure de chambre (voir vidéo ci-jointe pour la démonstration d'intervention chirurgicale).
6. Enregistrement de Rolling Velocity
- Ouvrir la pince carotide pour remplir la chambre, ce qui rend un circuit avec le système circulatoire de la souris. Laisser le sang de circuler pendant 3-5 min, de manière à ce que les conditions d'écoulement se stabilisent. Au cours de la période d'attente de 3-5 minutes, ajuster la platine du microscope de telle sorte que la chambre est au niveau d'une extrémité à l'autre de l'objectif du microscope et son bord est parallèle à la fenêtre d'enregistrement vidéo sur l'écran.
- Remplissez la boîte de Pétri modifié contenant la chambre de verre avec de l'eau puis abaissez l'objectif de l'immersion en eau 10X dans le plat de sorte que les cellules se écoulant à travers la chambre sont visibles.L'intensité de la lumière peut être ajusté pour une visualisation adéquate des cellules. En général, une intensité plus faible est mieux.
- Régler la pince sur le tube de sorte que le transducteur lit une constante 30 mm Hg, en corrélation avec une pression physiologique fluide en écoulement, ou comme on le souhaite.
- Appuyez sur "Start" pour lancer l'enregistrement à la fois la vidéo et la pression avec le premier laps de temps près de la fin jugulaire et se déplaçant à contre-courant vers la fin de la carotide jusqu'à leur achèvement.
NOTE: Plusieurs conditions de revêtement utilisant différentes molécules d'adhésion peuvent être étudiés dans la même souris en utilisant plusieurs chambres. Une seule chambre est enregistré à la fois.- Lorsque l'enregistrement est terminé, fermer la vanne sur le site d'entrée, l'arrêt de la circulation sanguine. Retirer la chambre et se adapter à une nouvelle chambre (couché avec une molécule d'adhérence différente) au circuit à l'aide de pinces fines dans une main et pince rainurés dans l'autre main. Reprendre l'enregistrement de la nouvelle chambre comme indiqué dans les étapes06.01 à 06.04.
- Euthanasier toutes les souris par asphyxie au CO2 suivie d'une dislocation de la moelle épinière à la fin de l'expérience. La procédure est terminal, par conséquent, les souris sont euthanasiées par dislocation de la moelle épinière à la fin de l'expérience.
7. Interprétation des résultats
- Pour analyser les données enregistrées utiliser le plugin "M TrackJ" pour le logiciel ImageJ 23.
- Convertir le fichier en niveaux de gris par Sélectionnez Fichier → Importer → → AVI convertir en niveaux de gris.
- Standardiser les cadres Sélectionnez l'image → → → propriété de pénétrer dans les intervalles de trame (i) → mondiale. Calculer les intervalles de trame en divisant la durée totale de la vidéo (généralement 30 sec) par le nombre de trames dans une vidéo (indiqué dans le coin supérieur de la fenêtre d'image vidéo J).
- Mesurer le débit de chaque leucocytes par Choisir le plugiciel → M TrackJ → Ajouter pistes → sélectionner un leucocyte→ Suivi avec chaque image pour 15-20 sec → Fusionner.
- Répétez l'étape 7.4 pour tous les leucocytes en vue.
- Déterminer la vitesse moyenne de roulement des leucocytes par Select mesure → deux colonnes apparaissent → Copier tous les M TrakJ: Tracks dans un tableur. La colonne intitulée "V signifie" est le roulement des leucocytes mesurée en pixels / seconde. Convertir en um / sec en divisant par 2/3.
- Pour analyser le point culminant de données de pression et d'exportation dans un tableur et d'effectuer le calcul suivant: AP (mm Hg) et t (dyne / cm 2) pour une comparaison entre chaque groupe expérimental. Une fois calculée, copier les données dans le logiciel de prisme pour le graphisme.
Résultats
Au cours de chaque enregistrement leucocytes ne interagissant sont évidents sur la chambre. Les résultats d'une expérience représentative peut être vu dans la figure 4. Les flèches blanches indiquent leucocytes individuels qui ont été capturés par la molécule d'adhérence d'intérêt et déploient le long de la chambre entre autres ceux à écoulement libre dans le flux sanguin. Un artefact commun en dehors de la chambre peut être vu avec les grandes sphères sombres dans toutes les images. Les sphères sombres aident le lecteur à apprécier le mouvement des leucocytes par rapport à un point fixe. Les leucocytes avancement sur une période de 22 secondes peut être considérée en relation avec les sphères. Le graphique sur la même figure montre un tracé final de ces données où Tx1 diminue la vitesse de roulement (un déplacement vers la gauche) et Tx2 augmente la vitesse (un déplacement vers la droite) par rapport au témoin.
0 "/>
Figure 1: Préparation du tube de la chambre d'écoulement. (A) des outils nécessaires pour les tubes et ensemble de chambre (chambre de verre micro 0,4 x 0,04 x 50 mm, tuyaux en polyéthylène PE10, des tuyaux en polyéthylène PE60, le silicium tube 002, Y tubes, T tubes, 35 mm boîte de Petri, pinces fines, des ciseaux fins, support de tube, pince vasculaire, 7-0 suture de soie. (B) Préparation de l'artère carotide et la tubulure de la veine jugulaire pour re-diriger le flux de sang de souris à travers la chambre revêtue. (C) Raccordement de la tubulure de l'artère carotide pour le transducteur de pression. (D) Passez le tube du transducteur à travers la pince pour régler le débit de l'écoulement de sang. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
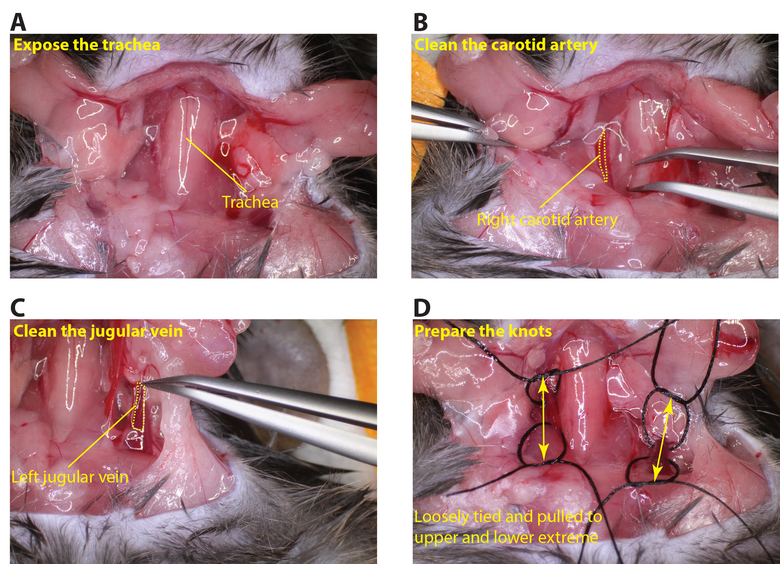
Figure 2:. L'exposition de l'artère carotide et la veine jugulaire (A) Découpez soigneusement la zone du cou pour exposer la trachée (B) Nettoyez l'artère carotide droite de sorte qu'un morceau de suture peut être passé sous le bateau (pointillé jaune. ligne décrit l'artère carotide). (C) Nettoyez la veine jugulaire gauche de sorte qu'un morceau de suture peut être adopté en vertu du navire (ligne jaune parsemé décrit la veine jugulaire). (D) organisez moins reliée sutures dans les régions supérieures et inférieures de l'artère carotide et la veine jugulaire (flèches indiquent les régions supérieures et inférieures des vaisseaux). Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
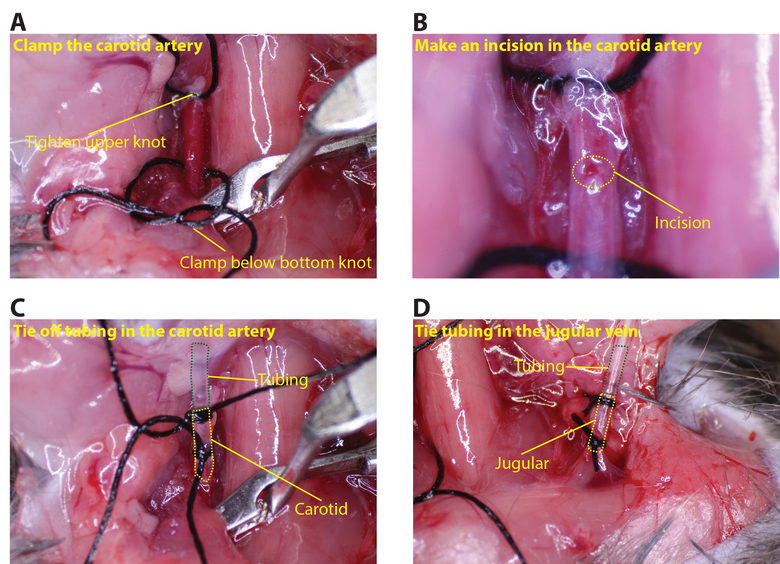
Figure 3: Connexion du tube à til artère carotide et la veine jugulaire. (A) Serrez le noeud supérieure sur la carotide et placez la pince-dessous du noeud inférieur. (B) En utilisant les microciseaux, faire une petite incision dans la carotide, environ 1/8 de la circonférence (cercle jaune en pointillés indique l'incision). ( C) Insérer le tube dans la carotide et sécurisé avec au moins deux sutures (ligne pointillée verte indique le tube et la ligne pointillée jaune l'artère carotide). (D) insérer même tube dans la veine jugulaire (ligne pointillée verte montre le tube et le jaune ligne pointillée la veine jugulaire). Se il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
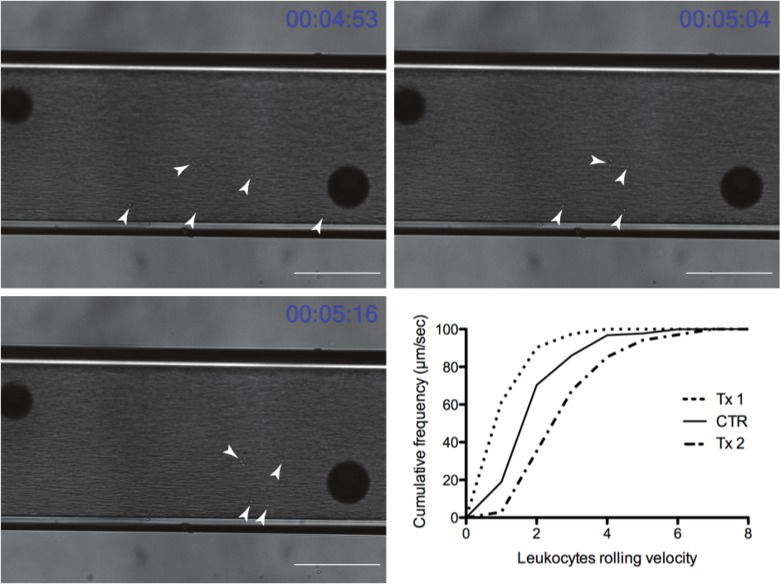
Figure 4: évolution dans le temps représentant des leucocytes roulant à travers le cham de fluxbre (barre d'échelle = 100 um) (pointes de flèches blanches soulignent leucocytes roulant). Graphique représente résultats représentatifs après l'exportation dans un programme graphique (Tx1 Tx2 et sont des groupes de traitement expérimental et CTR est le groupe de contrôle). Tx1 représente un traitement dans lequel les leucocytes ralentir conduisant à une diminution des leucocytes roulant vitesse et un décalage vers la gauche du graphique par rapport au groupe non traité (CTR), tandis que Tx2 conduit à un décalage vers la droite reflétant une augmentation dans les leucocytes roulant vitesse. Se il vous plaît cliquez sur ici pour voir une version plus grande de cette figure.
Discussion
Le processus de recrutement des leucocytes est une étape cruciale dans la réponse inflammatoire; elle implique la migration de leucocytes à partir du système circulatoire vers les tissus cibles, où ils sont capables d'exercer leur fonction effectrice. Le recrutement des leucocytes est solidaire dans une variété de conditions inflammatoires telles que les plaques d'athérosclérose, infarctus du myocarde, de l'ischémie / reperfusion et une chirurgie de transplantation, ainsi que plusieurs conditions neuro-inflammatoire du système nerveux central liés 10-12,20,24,25. Compte tenu de la diversité des conditions de la maladie qui se étend de recrutement des leucocytes, la chambre de microflux autoperfused fournit un outil indispensable permettant l'enquêteur la possibilité d'étudier la dynamique de la migration des leucocytes.
Au cours des dernières décennies, une variété d'essais in vitro ont été développées pour étudier la dynamique des leucocytes adhésion cellulaire 26. Malheureusement, tous ces essais nécessitent l'extraction deles leucocytes du sang, l'introduction de l'activation mécanique. Pour se rapprocher de l'environnement in vivo, des adaptations ont été faites pour recueillir des échantillons de sang total et de contrôler les conditions d'écoulement hémodynamique 16,17. Ici, nous présentons les progrès antérieurs dans le domaine de liaison d'une chambre revêtue au système circulatoire de la souris. Nous sommes en mesure de réguler le flux du sang à une gamme physiologique et étudier la dynamique des leucocytes roulant. La chambre revêtu nous donne la possibilité d'étudier les interactions de leucocytes avec des molécules d'adhésion spécifiques. Comme le système fonctionne comme une unité actionnée par une souris vivante, il imite plus étroitement l'environnement naturel, ce qui permet d'étudier les interactions des leucocytes-endothélial dans une variété de modèles de souris immunologiques. En outre, ce système nous permet de tirer parti des modèles multiples de souris génétiques disponibles. Bien que le système ne se réplique pas totalement l'environnement in vivo, il offre une plate-forme pour étudier spécific éléments des leucocytes dans des conditions physiologiques, un exploit qui n'a pas été possible auparavant. Même si cela nous prend un pas de plus vers un environnement plus physiologique il ya des limites au système. Il ne se réplique pas complètement la matrice 3D complexe de la vascularisation de sorte que nous ne sommes en mesure d'évaluer certains éléments des interactions de leucocytes qui sont limités au revêtement de la chambre. En outre, un grand soin doit être pris pour assurer un système fermé à la circulation de la souris en suivant toutes les étapes mentionnées dans le protocole. L'introduction des bulles d'air affectera considérablement la précision et la reproductibilité des expériences.
Bien que nous décrivons l'utilisation de la chambre Autoperfused Microflow pour l'évaluation dynamique de roulement de leucocytes de la procédure a le potentiel d'être personnalisés par des chercheurs d'étudier une variété de maladies. Par exemple, les cellules cancéreuses se métastasent en exprimant un grand nombre des intégrines communs partagés par les leucocytes. StudyIng leurs dynamique de roulement dans un cadre qui imite plus étroitement un environnement in vivo pourrait contribuer à notre connaissance, et peut-être la prédiction, de la nature invasive de certaines cellules cancéreuses. Une approche possible pourrait consister à combiner une technique de marquage des cellules cancéreuses, telles que la GFP 27, ainsi que le dosage de la chambre d'écoulement pour suivre la dynamique de roulement des cellules cancéreuses exprimant la GFP. Compte tenu de la souplesse du revêtement de la chambre avec une variété de substances et la connexion de plusieurs chambres à la même souris, il sera intéressant de voir comment ce procédé est modifié pour être utilisé dans d'autres laboratoires, en combinaison avec des souris génétiquement modifiées et des modèles de maladies. La technique que nous décrivons ici touche juste sur un potentiel d'application beaucoup plus large qui ne est limitée que par la créativité de l'enquêteur.
Déclarations de divulgation
The authors (L.M., H.S., and K.M.C.) have no competing financial interests to disclose.
Remerciements
Recherche présentée dans cette publication a été soutenu par le National Eye Institute des National Institutes of Health sous les numéros d'attribution: R01EY022084 / S1 (KMC), T32EY007145 (HS) et P30EY014104. Le contenu est de la seule responsabilité des auteurs et ne représentent pas nécessairement les vues officielles des National Institutes of Health. Un soutien supplémentaire a été fourni par le Fonds Massachusetts Lions Eye Research (KMC) et un prix spécial Scholar de la recherche à Prevent Blindness (à KMC).
matériels
| Name | Company | Catalog Number | Comments |
| Material | Vendor | Part number | |
| Micro glass chamber 0.4x0.04x50mm | VitroCom | 2540-050 | |
| Polyethylene tubing PE 10 | Fisher Scientific | 427400 | |
| Polyethylene tubing PE 60 | Fisher Scientific | 427416 | |
| Silicone tubing 002 | Fisher Scientific | 11-189-15A | |
| Y tube | Value Plastics | Y210-6 | |
| T tube | value plastics | T410-6 | |
| Silicone gel | Hardware store - Home Depo | ||
| 35mm petri dish | Corning | 430165 | |
| Parafilm | Pechiney Plastic Packaging | PM996 | |
| Fine forceps | FST | 11253-25 | |
| Fine scissors | FST | 15000-08 | |
| Tube holder | FST | 00608-11 | |
| Clamp applicator | FST | 18057-14 | |
| Vascular clamp | FST | 18055-04 | |
| 6-0 silk sutures | George Tiemann & Co | 160-1215-6/0 | |
| 25x1G needles | BD | 305125 | |
| 30x1/2G needles | BD | 305106 | |
| Heparin 100 USP units/ml | Hospital pharmacy |
Références
- Barreiro, O., Sanchez-Madrid, F. Molecular basis of leukocyte-endothelium interactions during the inflammatory response. Revista Espanola de Cardiologia. 62, 552-562 (2009).
- Muller, W. A. Leukocyte-endothelial-cell interactions in leukocyte transmigration and the inflammatory response. Trends in Immunology. 24, 327-334 (2003).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20, 525-532 (2008).
- Mehta, P., Cummings, R. D., McEver, R. P. Affinity and kinetic analysis of P-selectin binding to P-selectin glycoprotein ligand-1. The Journal of Biological Chemistry. 273, 32506-32513 (1998).
- Nicholson, M. W., Barclay, A. N., Singer, M. S., Rosen, S. D., vander Merwe, P. A. Affinity and kinetic analysis of L-selectin (CD62L) binding to glycosylation-dependent cell-adhesion molecule-1. The Journal of Biological Chemistry. 273, 763-770 (1998).
- Sandig, M., Negrou, E., Rogers, K. A. Changes in the distribution of LFA-1, catenins, and F-actin during transendothelial migration of monocytes in culture. Journal of Cell Science. 110 (22), 2807-2818 (1997).
- Shaw, S. K., et al. Coordinated redistribution of leukocyte LFA-1 and endothelial cell ICAM-1 accompany neutrophil transmigration. The Journal of Experimental Medicine. 200, 1571-1580 (2004).
- Woodfin, A., et al. JAM-A mediates neutrophil transmigration in a stimulus-specific manner in vivo: evidence for sequential roles for JAM-A and PECAM-1 in neutrophil transmigration. Blood. 110, 1848-1856 (2007).
- Blankenberg, S., Barbaux, S., Tiret, L. Adhesion molecules and atherosclerosis. Atherosclerosis. 170, 191-203 (2003).
- Parmeggiani, F., et al. Mechanism of inflammation in age-related macular degeneration. Mediators of Inflammation. 2012, 546786 (2012).
- Ding, X., Patel, M., Chan, C. C. Molecular pathology of age-related macular degeneration. Progress in Retinal and Eye Research. 28, 1-18 (2009).
- Xu, H., Chen, M., Forrester, J. V. Para-inflammation in the aging retina. Progress in Retinal and Eye Research. 28, 348-368 (2009).
- Peterson, K., et al. Drug Class Review: Nonsteroidal Antiinflammatory Drugs (NSAIDs): Final Update 4 Report. Drug Class Reviews. , (2010).
- Ulbrich, H., Eriksson, E. E., Lindbom, L. Leukocyte and endothelial cell adhesion molecules as targets for therapeutic interventions in inflammatory disease. Trends in Pharmacological Sciences. 24, 640-647 (2003).
- Stamper, H. B., Woodruff, J. J. Lymphocyte homing into lymph nodes: in vitro demonstration of the selective affinity of recirculating lymphocytes for high-endothelial venules. The Journal of Experimental Medicine. 144, 828-833 (1976).
- Lawrence, M. B., McIntire, L. V., Eskin, S. G. Effect of flow on polymorphonuclear leukocyte/endothelial cell adhesion. Blood. 70, 1284-1290 (1987).
- Abbitt, K. B., Nash, G. B. Characteristics of leucocyte adhesion directly observed in flowing whole blood in vitro. British Journal of Haematology. 112, 55-63 (2001).
- Smith, M. L., Sperandio, M., Galkina, E. V., Ley, K. Autoperfused mouse flow chamber reveals synergistic neutrophil accumulation through P-selectin and E-selectin. Journal of Leukocyte Biology. 76, 985-993 (2004).
- Yuan, J., Melder, R. J., Jain, R. K., Munn, L. L. Lateral view flow system for studies of cell adhesion and deformation under flow conditions. BioTechniques. 30, 388-394 (2001).
- Moalem, G., et al. Autoimmune T cells protect neurons from secondary degeneration after central nervous system axotomy. Nature Medicine. 5, 49-55 (1999).
- Hafezi-Moghadam, A., Thomas, K. L., Cornelssen, C. A novel mouse-driven ex vivo flow chamber for the study of leukocyte and platelet function. American Journal of Physiology. Cell Physiology. 286, 876-892 (2004).
- Almulki, L., et al. Surprising up-regulation of P-selectin glycoprotein ligand-1 (PSGL-1) in endotoxin-induced uveitis. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology. 23, 929-939 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Rapalino, O., et al. Implantation of stimulated homologous macrophages results in partial recovery of paraplegic rats. Nature Medicine. 4, 814-821 (1998).
- Yoles, E., et al. Protective autoimmunity is a physiological response to CNS trauma. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 21, 3740-3748 (2001).
- Buchanan, M. R., Vazquez, M. J., Gimbrone, M. A. Arachidonic acid metabolism and the adhesion of human polymorphonuclear leukocytes to cultured vascular endothelial cells. Blood. 62, 889-895 (1983).
- Connor, K. M., et al. Manganese superoxide dismutase enhances the invasive and migratory activity of tumor cells. Cancer Res. 67, 10260-10267 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon