Method Article
הערכת אינטראקציות יקוציט-האנדותל תחת תנאי זרימה ב
In This Article
Summary
כאן, אנו מציגים פרוטוקול המאפשר לחוקר להעריך דינמיקת גיוס לויקוציטים לשעבר vivo על ידי חיבור קאמרי מצופים במולקולות דבקות-נגזר האנדותל למערכת הדם של עכבר. שיטה זו מציעה יתרונות משמעותיים שכן הוא מאפשר להערכה לויקוציטים בתנאים ביולוגיים יחסי.
Abstract
אינטראקציות יקוציט-האנדותל הן אירועים מוקדמים וקריטיים בדלקת אקוטית וכרונית ויכולות, כאשר dysregulated, לתווך פגיעה ברקמות שהובילו לניזק פתולוגי קבוע. מבחני קונבנציונליים קיימים מאפשרים הניתוח של מולקולות הידבקות לויקוציטים רק לאחר המיצוי של לויקוציטים מהדם. זה מחייב את הדם לעבור כמה צעדים לפני leukocytes דם ההיקפית (PBLs) יכולה להיות מוכנה לניתוח, אשר בתורו יכול לעורר PBLs משפיע על ממצאי המחקר. Assay תא זרימת מייקר autoperfused, לעומת זאת, מאפשר למדענים לחקור leukocytes המוקדמת dysregulation התפקודי באמצעות הזרימה המערכתית של עכבר חי בזמן שיש חופש מניפולציה קאמרית מצופה. באמצעות מודל מחלה, הביטוי הפונקציונלי של מולקולות הידבקות לויקוציטים ניתן להעריך ולכמת בתא מיקרו-זכוכית מצופה במולקולות דבקות אנדותל משותקים vivo לשעבר. במודל זה, הדם זורםבין עורק התרדמה המשותף תקין ווריד הצוואר חיצוני השמאלי של עכבר חי בהרדמה, המאפשר האינטראקציה של PBLs ילידים בתא. ניסוי ניתוח בזמן אמת מושגת בסיוע מיקרוסקופ intravital כמו גם מכשיר לחץ הרווארד Apparatus. היישום של זרימת רגולטור בנקודת תא זכוכית הקלט מאפשר זרימת תנאים פיסיולוגיים דומים בין הניסויים. מתגלגל ליקוציט מהירות היא התוצאה העיקרית ונמדדת באמצעות המכון הלאומי לImageJ תוכנת גישה פתוחה בריאות. לסיכום, assay תא זרימת מייקר autoperfused מספק סביבה פיזיולוגית אופטימלית ללמוד leukocytes אינטראקציה אנדותל ומאפשר לחוקרים להסיק מסקנות מדויקות כאשר לומדים דלקת.
Introduction
דלקת היא התגובה האוניברסלית של הגוף לפציעה והיא צעד חיוני בשני תפקוד המערכת החיסונית המולדת ובעלי כושר הסתגלות. בתגובה לפציעה ו / או גירויים דלקתיים, תאי האנדותל upregulate מולקולות הדבקה ספציפיות; זה מוביל לויקוציטים extravasation דרך האנדותל כלי הדם, בעיקר בvenules נימי פוסט. תהליך זה מתחיל עם קשירה של לויקוציטים זרימה החופשי בזרם הדם על האנדותל. גלגול יציב והידבקות חברה של לויקוציטים, אשר בתורו מוביל לגלגול ואת ההפרשה של חומרים ציטוטוקסיים, בצע את זה קשירת 1,2. Selectins ידוע לתווך שלבים המוקדמים של המפל 3-5; integrins אחראי לצעדים מאוחר יותר של הידבקות חברה וגלגול 1,6-8.
גוף הולך וגדל של ראיות מצביע על כדוריות דם לבנות ומולקולות דבקות אנדותל יש תפקידים חיוניים במודלים של בעלי חיים של פגיעת reperfusion איסכמיה, אסטמה, פסוריאזיס, טרשת נפוצה, וניוון מקולרים הקשור לגיל 9-12. בתנאים אלה, התגובה הדלקתית היא הטעתה לתקוף גוף של האדם עצמו, וכתוצאה מכך ההתמוטטות של רקמה בריאה. סוכנים קיימים אנטי דלקתיים (כגון תרופות לא-סטרואידיות נוגדות דלקת, סטרואידים, או תרופות כימותרפיות אחרות) לשאת את הסיכון לתופעות לוואי חמור עם שימוש ארוך טווח 13. לכן, זה עניין רב ליש את הכלים המתאימים עם היכולת לזהות מולקולות ספציפיות למחלה, אשר בסופו יכול להיות ממוקדת ליש השפעה אנטי דלקתית הרצויה תוך שמירה על 14 שאינם רעילים.
קיימים בשיטות מבחנה כגון assay ההידבקות לויקוציטים סטטי שמשו כתחילה גם 1976 15. תא הזרימה המקביל היה בשימוש לראשונה במבחנה בשינה 1987 כדי לחקור אינטראקציות יקוציט-האנדותל תחת תנאי זרימה. בניסויים אלה, מגורה הומאn leukocytes polymorphonuclear (PMNs) מהדם ורידים היו perfused מעל monolayer של תאים ראשוניים אנושיים וריד טבור אנדותל (HUVECs). כדי לשלוט על זרימת hemodynamic תנאים, משאבת מזרק Apparatus הרווארד הועסקה 16. לחלופין, כדי למנוע בידוד leukocytes מלאכותי, כל הדם היה בשימוש בשילוב עם תא הזכוכית מצופה במולקולות הדבקה משותקות 17.
כדי להימנע מגירוי לויקוציטים וללמוד באופן מכניסטי האינטראקציה שלהם עם מולקולות ההידבקות בתנאים פיסיולוגיים משוערים, לשעבר vivo autoperfused, extracorporal, מעגל arteriovenous פותח 16. במעגל זה, הדם זורם בין עורק התרדמה המשותף תקין ווריד הצוואר חיצוני השמאלי של עכבר חי בהרדמה, המאפשר אינטראקציה של PBLs ילידים בתוך תא microflow זכוכית מצופה מולקולות הידבקות בודדות או-משותק במשותף. יתרון גדול לתוכנה לזהמ 'היא היכולת להעסיק עכברים מהונדסים גנטי, שבו מסלולים דלקתיים באופן ישיר או עקיף מניפולציות. בנוסף, יש את היכולת לאתר את התרומה בודדת של מולקולות הידבקות לויקוציטים לדלקת, ללא הפעלה חיצונית, תחת תנאי זרימה. היישום של זרימת רגולטור בנקודת תא זרימת הקלט מספק מגוון רחב של וריאציות ניסיוניות של כוחות הגזירה לחקות או עורקים או ורידי מערכות 18-22. כאן אנו מתארים בפירוט רב בפרוטוקול הנוגע לעריכה ולביצועים של vivo לשעבר autoperfused assay תא microflow.
Protocol
כל הניסויים בבעלי חיים יטופלו בהתאם לעמותה למחקר בהצהרת חזון ורפואת עיניים לשימוש בבעלי חיים ברפואת עיניים ומחקר חזון, ואת ההנחיות והתקנות שנקבעו על ידי Eye מסצ'וסטס ואוזן ועדת טיפול בבעלי חיים מרפאת.
היום לפני הניסוי:
1. הכנת Tubing ללשכת תזרים
- כדי להכין את צד הצוואר, להתחבר 1 סנטימטר PE10 צינורות פוליאתילן לצינורות סיליקון 6 סנטימטר ואחרי צינורות פוליאתילן 5 סנטימטר. לצד הראש, להכין באופן דומה לצד הצוואר עם התוספת של T-צינור בתוך צינור סיליקון 6 סנטימטר על 1.5 סנטימטרים מצינורות פוליאתילן 1 סנטימטר (איור 1 א ', ב'). על מנת להכניס את T-הצינור, להרחיב את צינור סיליקון באמצעות מלקחיים עדינים במידת צורך.
- חבר קצה אחד של 10 סנטימטרים של צינורות סיליקון למתמר הלחץ לאחר מכן הכנס את הסוף של T של התרדמהIDE T-צינור לתוך הקצה השני. ודא חיבור אתרים הדוקים ולדלוף חופשיים. החל חתיכה מלבנית קטנה של parafilm על שם צינורות משתלבים יחד, במידת צורך, כדי למנוע דליפה (איור 1 ג).
2. ציפוי הקאמרי
- הכן את חלבון ציפוי פני השטח אנדותל (למשל, selectin P, הידבקות אינטר מולקולה-1 (ICAM-1), חלבון-1 כלי דם הידבקות תא (VCAM-1)) בBSA 0.1%. כקו מנחה, 1 מיקרוגרם של חלבון ב200 μl BSA הוא מספיק כדי מעיל 4-5 תאים. באמצעות מזרק 1 מיליליטר מחובר למחט 25 G, להחדיר בכל תא (0.04 x 0.4 x 50 מ"מ) עם חלבון ציפוי פני השטח האנדותל. אחסן את התאים המצופים בצינור 15 מיליליטר ב 4 ° C למשך לילה.
היום של הניסוי:
3. הכנה הקאמרית
- הסר את התאים המצופים מ4 ° C ולחבר את צינורות הצוואר וצוואר לכל צד. לאטום את connectiתוספות על ידי מתיחת חתיכה מלבנית קטנה של parafilm על שם צינורות עומדים בחדר בזהירות. באמצעות מזרק, למלא את התא וצינורות עם BSA 0.1% (לבדוק דליפה). דגירה של 45 דקות.
- הכן צלחת פטרי 35 מ"מ להחזיק את התא על ידי חיתוך חריצים בכל צד של המנה. לייצב את התא בחריצים; לאחר מכן השתמשתי בטיפה קטנה של סיליקון לצרף את התא לצלחת באתר מחורצים. ודא שהתא הוא ברמה ע"י הסתכלות תחת המיקרוסקופ. לאפשר לסיליקון להתייבש במשך לפחות 15 דקות.
- ממלאי מזרק נעילת 60 מיליליטר עם הפרין ולהתחבר למתמר הלחץ. חבר את מתמר הלחץ בצינור הראשי בצו הבא: מתמר, צינורות סיליקון, ו- T-צינור.
- השתמש PE50 1 סנטימטר בין צינורות סיליקון מחוברים למתמר וT-הצינור לאבטחת החיבור. להעביר את צינורות סיליקון העורק הראשי דרך מהדק הלחץ (1D איור). הפעל 100USP הפרין throאיכס צינורות וקאמריים עד שאין בועות אוויר.
4. הגדרת התוכנה
- כדי להכין את התוכנה, הפעל את המחשב, מיקרוסקופ, ומכשיר מעבדה פתוח. לחץ לחיצה כפולה על חבילת Leica היישום (LAS) (או שווה ערך) ולהכין תיקייה כדי לשמור את הווידאו: לגלוש → לרכוש → סרט → להגדיר רצף של קטעים (קטעים = 15 זמן הקלטה, = 30 שניות, ו= 15 שניות במרווחים) לאחר מכן לחץ על הסימן "+" כדי לאשר.
- כדי להקליט את לחץ הזרימה לפתוח את LabChart (או שווה ערך) קובץ ולתאם את שם הקובץ לתיקיית ההקלטה בשלב 4.1, לעיל.
5. נוהל כירורגי
- הרדימי עכבר 8-10 שבועות בן באמצעות שילוב של קטמין (60 מ"ג / קילוגרם) ו xylazine (6 מ"ג / קילוגרם) מוזרק תוך-peritoneally (IP). ודא שהרגעה עמוקה מושגת תוך 5-10 דקות על ידי אובדן של רפלקס נסיגת דוושה. במידת הצורך, isofluraneיישלח באמצעות מסיכת פנים יכולים להינתן בהתאם לצורך.
- בעוד בהרדמה, למקם כרית חימום מתחת לכלוב ומוגדר 37 ° C כדי לשמור על טמפרטורת גוף. לאחר הרדמה נכונה הוא אישר, מניח את העכבר בעמדה ומעיל הגחון העיניים עם משחת הבסיטרצין כדי למנוע יובש עיני.
- לאחר מכן, לגלח את השיער באתר החתך באמצעות סכין גילוח ולנקות ביסודיות את האתר עם אלכוהול.
- ברגע שהרדמה מלא לאבטח את החיה עם קלטת שמירת העכבר בעמדת הגחון. לחשוף את אזור הצוואר במספריים ולהסיר את בלוטת התריס לחשוף (איור 2 א) קנה הנשימה וכלי דם.
- נקה את עורק התרדמה עד שהוא נחשף במלוא נזהר שלא לפגוע בעצב התועה (איור 2). מקפלים פיסת התפר ולהעביר את העיקול מתחת לעורק הראשי ואז לחתוך בעיקול אז עכשיו יש 2 חתיכות של תפר מתחת לראש. לולאה כל תפר ומסתבך (לא להדקקשר).
- חזור על אותו ההליך כדי לחשוף את וריד הצוואר השמאלי (איור 2 ג), מכין את התפרים באותו אופן (איור 2 ד).
- חבר את הצינור לכלי הדם בעכבר.
- Heparinize העכבר על ידי הזרקת 1 מיליליטר של IP הפרין.
- הדק את התפר העליון על העורק הראשי. הנח את מהדק הכלי הנמוך כמו זה יכול ללכת על עורק התרדמה (איור 3 א). שימוש במלקחיים כדי להחזיק את העורק על ידי התפר העליון ולעשות חתך קטן, על 1/8 של ההיקף של העורק, באמצעות microscissors (איור 3).
- להעביר את צינורות העורק הראשי דרך הקשר השני בתפר העליון ולתוך החתך שנעשה בעורק. לקשור את התפר התחתון, כך שהעורק אטום סביב הצינור (כמה קשרים צריכים להיעשות כדי להבטיח חותם חזק; איור 3 ג).
- חזור על אותו תהליך החדרת צינורות וריד הצוואר (הכלימהדק אין צורך לצד הצוואר; איור 3D).
- בדוק את הזרימה על ידי שחרור מהדק הכלי. אם אין דליפות להזיז את העכבר למיקרוסקופ ולחבר את הצינור הראשי ווריד הצוואר לצינורות קאמריים (ראה וידאו מצורף להפגנה של הליך כירורגי).
6. ההקלטה רולינג Velocity
- פתח את מהדק התרדמה כדי למלא את החדר, מה שהופך את מעגל עם מערכת דם עכבר. לאפשר לדם לזרום במשך 3-5 דקות, כך שתנאי הזרימה לייצב. בתקופת ההמתנה של 3-5 דקות, להתאים את הבמה מיקרוסקופ כדי שהתא הוא ברמה מקצה אחד לקצה השני במטרה מיקרוסקופ והקצה שלה הוא מקביל לחלון וידאו הקלטה על המסך.
- מלא את צלחת פטרי שונה המכילה את תא הזכוכית עם מים ואז להנמיך את מטרת הטבילה במי 10X לתוך הצלחת כך שהתאים זורמים דרך התא גלויים.עוצמת האור יכולה להיות מותאמת לצפייה נאותה של התאים. בדרך כלל בעוצמה נמוכה יותר היא טובה יותר.
- התאם את המהדק על צינורות כך שמתמר קורא 30 מ"מ כספית יציב, מקשר ללחץ זרימה פיסיולוגי בינוני, או לפי צורך.
- לחץ על "התחל" כדי להתחיל להקליט הן וידאו ולחץ עם לשגות הפעם הראשונה קרוב לסוף הצוואר ונע נגד הזרם לקראת סוף התרדמה עד לסיומה.
הערה: תנאי ציפוי כמה באמצעות מולקולות הדבקה שונות ניתן ללמוד באותו העכבר באמצעות תאים מרובים. רק תא אחד נרשם בכל פעם.- כאשר ההקלטה סיימה, לסגור את הברז באתר הקלט, לעצור את זרימת הדם. הסר את התא ולהתאים קאמרי חדש (מצופה במולקולת הידבקות שונה) למעגל באמצעות מלקחיים עדינים ביד אחת ומלקחיים מחורצים ביד השנייה. לחדש את ההקלטה לתא החדש כפי שתואר בשלבים6.1-6.4.
- להרדים את כל העכברים על ידי CO 2 מחנק ואחריו נקע בחוט השדרה בסוף הניסוי. הליך מסוף, ולכן, העכברים מורדמים על ידי נקע בחוט השדרה בסוף הניסוי.
7. לפרש את התוצאות
- כדי לנתח את הנתונים שנרשמו להשתמש בתוסף "M TrackJ" לתוכנת ImageJ 23.
- להמיר את הקובץ לגוונים אפורים על ידי AVI → היבוא בחר → קובץ → להמיר לגוונים אפורים.
- לתקנן את מסגרות תמונה על ידי בחירת → → → הרכוש להיכנס למרווחי המסגרת (i) → הגלובלי. לחשב את מרווחי מסגרת על ידי חלוקת משך וידאו הכולל (בדרך כלל 30 שניות) במספר המסגרות בוידאו אחד (שמוצג בפינה העליונה של תמונת חלון וידאו J).
- למדוד את הזרימה של כל ויקוציטים על ידי תוסף בחר → M TrackJ → להוסיף מסלולי → לבחור ויקוציטים→ לעקוב אחר זה עם כל מסגרת 15 - מיזוג → 20 שניות.
- חזור על שלב 7.4 עבור כל כדוריות הדם לבנות בתצוגה.
- לקבוע את הממוצע מתגלגל המהירות של כדוריות הדם לבנות במידה בחר → שתי עמודות מופיעות → העתק כל TrakJ M: מסלולים לגיליון אלקטרוני. הטור שכותרתו "אומר V" הוא גלגול ויקוציטים נמדד בפיקסלים / שני. להמיר מיקרומטר / sec ידי חלוקה 2/3.
- כדי לנתח את נתוני שיא לחץ ויצוא לגיליון אלקטרוני ולבצע את החישוב הבא: ΔP (מ"מ כספית) וt (דִין / 2 סנטימטר) להשוואה בין כל קבוצת ניסוי. ברגע שמחושב, להעתיק את הנתונים לתוכנת פריזמה לגרפים.
תוצאות
במהלך כל אינטראקציה leukocytes רק הקלטה ניכרים על החדר. תוצאות מניסוי נציג שניתן לראות באיור 4. החיצים הלבנים מצביעים על leukocytes בודדת שנתפסו על-ידי מולקולת ההידבקות של ריבית ומתגלגלות לאורך קאמרי בקרב חופשיים זורמים אלה אחרים בזרימת הדם. חפץ משותף מחוץ לחדר שניתן לראות בתחומים אפלים הגדולים בכל התמונות. התחומים הכהים לסייע לקורא להעריך את התנועה לויקוציטים ביחס לנקודה קבועה. לויקוציטים קידום על פני תקופה של 22 שניות ניתן לראות ביחס לתחומים. הגרף באותו איור מציג עלילה סופית של הנתונים שבו TX1 מקטין את מהירות הגלגול (מעבר לשמאל) וTX2 מגביר את המהירות (תזוזה ימינה) בהשוואה לשליטה.
0 "/>
איור 1: הכנת צינורות לתא הזרימה. כלים () הנדרשים לצינורות והרכבת תא (תא זכוכית מיקרו 0.4 x 0.04 x 50 מ"מ, PE10 צינורות פוליאתילן, צינורות פוליאתילן PE60, סיליקון צינורות 002, צינור Y, צינור T, 35 מ"מ צלחת פטרי, מלקחיים עדינים, מספריים בסדר, בעל צינור, מהדק כלי דם, 7-0 תפר משי. הכנה (B) של עורק התרדמה וצינורות וריד הצוואר להכוונה מחדש את זרימת הדם בעכבר דרך החדר המצופה. (C) חיבור צינורות העורק הראשי למתמר הלחץ. (ד) להעביר את צינורות ממתמר דרך המהדק כדי להתאים את קצב זרימת הדם. לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
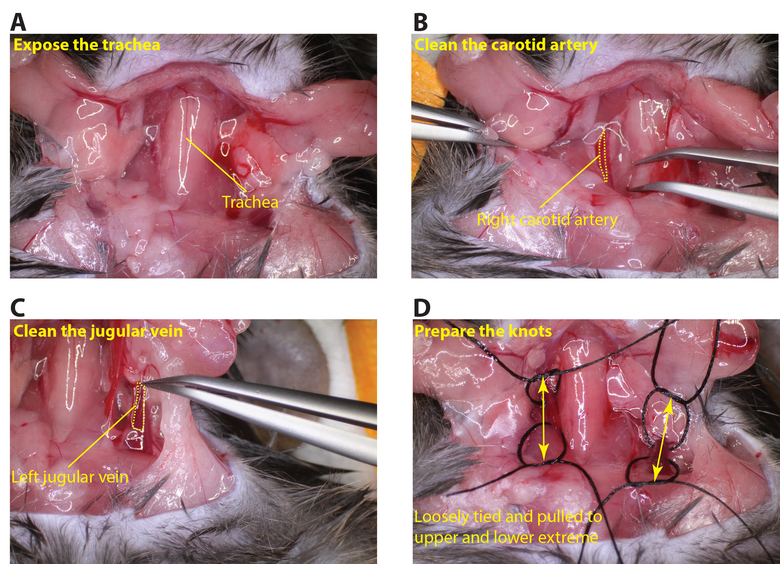
איור 2:. חשיפת העורק הראשי ווריד הצוואר () לחתוך בזהירות את אזור הצוואר כדי לחשוף את קנה הנשימה (B) נקה את העורק הראשי ימין, כך שפיסת התפר יכול לעבור מתחת לכלי השייט (מנוקד צהוב. קו מתאר את העורק הראשי). (ג) נקה את וריד הצוואר השמאלי כך שפיסת התפר יכול לעבור מתחת לספינה (קו צהוב מנוקד מתאר את וריד הצוואר). (ד) לארגן קשור ברישול תפרים באזורים העליונים ותחתונים של עורק התרדמה ווריד הצוואר (חיצים הצביעו על האזורים העליונים ותחתונים של כלי). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
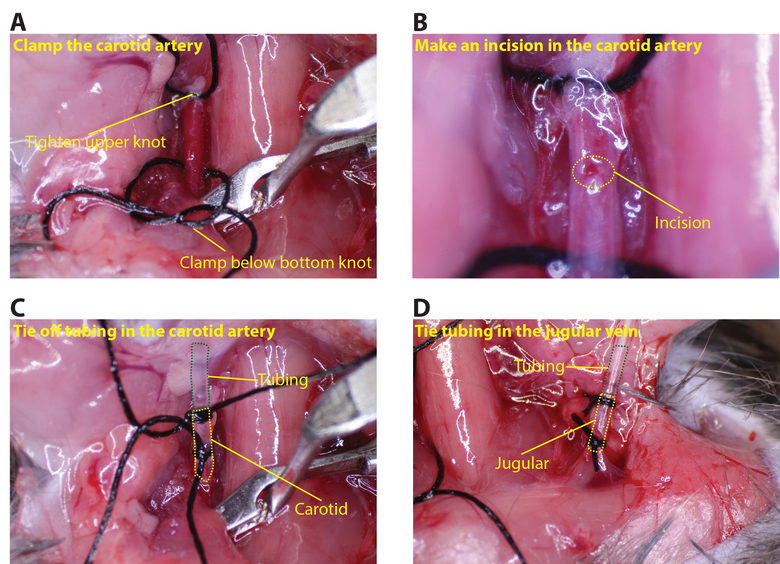
איור 3: חיבור צינורות לtהוא התרדמה עורקים ועורק הצוואר. () להדק את הקשר העליון על הצוואר ולמקם את המהדק מתחת לקשר נמוך יותר. (ב) שימוש בmicroscissors, לעשות חתך קטן בצוואר, על 1/8 ההיקף (העיגול צהוב מקווקו מציין את החתך). ( C) הכנס את הצינור לתוך התרדמה ובטוחה עם לפחות שני תפרים (קו מקווקו ירוק מראה את הצינור וקו המקווקו הצהוב העורק הראשי). (ד) באופן דומה להכניס צינורות בצוואר (קו מקווקו ירוק מראה את הצינור ו קו מקווקו צהוב וריד הצוואר). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
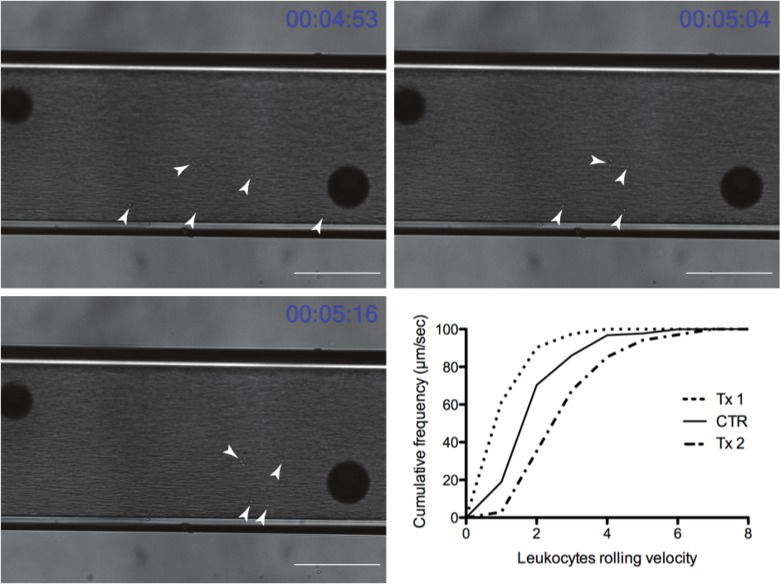
איור 4: כמובן זמן נציג של לויקוציטים מתגלגל בזרימה צ'אםבער (בר = 100 מיקרומטר Scale) (ראשי חץ לבנים להצביע leukocytes מתגלגלת). הגרף מתאר תוצאות נציג לאחר היצוא לתכנית גרפים (TX1 וTX2 הם קבוצות טיפול ניסיוני וCTR הוא קבוצת הביקורת). TX1 מייצג טיפול בי לויקוציטים להאט מוביל לירידה בלויקוציטים מתגלגל מהירות ומשמרת השמאלית של הגרף בהשוואה לקבוצה שלא טופלה (CTR), ואילו TX2 מוביל לשינוי תקין המשקף עלייה בכדוריות דם לבנות מתגלגלות מהירות. אנא לחץ על כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
תהליך הגיוס לויקוציטים הוא צעד חיוני בתגובה הדלקתית; זה כרוך בהגירה של לויקוציטים ממערכת הדם לכיוון רקמות יעד, שבו הם יכולים להפעיל פונקצית מפעיל שלהם. גיוס לויקוציטים הוא חלק בלתי נפרד במגוון רחב של מצבים דלקתיים כגון פלאק טרשת עורקים, אוטם שריר לב, איסכמיה / reperfusion, וניתוח השתלה 1, כמו גם תנאי נוירו-הדלקתי של מערכת העצבים המרכזית הקשורים מרובים 10-12,20,24,25. בהתחשב במגוון של תנאי המחלה שתוחלת גיוס לויקוציטים, קאמרי microflow autoperfused מספקת כלי הכרחי המאפשר לחוקר את היכולת ללמוד דינמיקת הגירה לויקוציטים.
במהלך העשורים האחרונים, מגוון רחב של מבחני במבחנה פותחו כדי ללמוד את הדינמיקה של הידבקות תא ויקוציטים 26. למרבה הצער, כל אלה מבחני דורשים החילוץ שלכדוריות הדם לבנות מהדם, מציגים הפעלה מכאנית. כדי להתקרב לסביבת in vivo, עיבודים נעשו כדי לאסוף דגימות דם שלמות ולשלוט על זרימת hemodynamic תנאי 16,17. כאן, אנו מרחיבים את ההתקדמות הקודמת בתחום על ידי קישור קאמרי מצופה למערכת הדם של עכבר. אנו מסוגלים לווסת את זרימת הדם לטווח פיסיולוגי וללמוד את הדינמיקה של גלגול ויקוציטים. התא המצופה נותן לנו את היכולת ללמוד אינטראקציות ויקוציטים עם מולקולות הדבקה ספציפיות. מאחר שהרשת פועלת כיחידה המופעלת על ידי עכבר חי, היא מחקה באופן הדוק יותר על הסביבה הטבעית, ומאפשרת לנו ללמוד אינטראקציות יקוציט-האנדותל במגוון רחב של דגמי עכבר חיסוניים. בנוסף, מערכת זו מאפשרת לנו לנצל את המודלים של העכברים הגנטיים המרובים הזמינים. בזמן שהמערכת לא לשכפל את הסביבה בvivo לחלוטין, הוא מספק פלטפורמה ללמוד ספציפיאלמנטים של ג לויקוציטים בתנאים פיסיולוגיים, הישג שלא היה אפשרי בעבר. למרות שזה לוקח אותנו צעד אחד קרוב יותר לסביבה פיזיולוגית יותר יש מגבלות למערכת. זה לא לשכפל לחלוטין מטריצת 3D המורכבת של כלי דם ולכן אנחנו יכולים רק להעריך אלמנטים מסוימים של אינטראקציות ויקוציטים שמוגבלות לציפוי קאמרי. בנוסף, יש לנקוט זהירות רבה על מנת להבטיח מערכת סגורה למחזור העכבר על ידי ביצוע כל השלבים שהוזכרו בפרוטוקול. כניסתה של בועות אוויר תשפיע באופן משמעותי את הדיוק ואת שחזור של הניסויים.
בעוד אנו מתארים את השימוש של חדר Autoperfused Microflow להערכת דינמיקה מתגלגל לויקוציטים ההליך יש את הפוטנציאל להיות מותאמים אישית על ידי חוקרים ללמוד מגוון רחב של מחלות. לדוגמא, תאים סרטניים לשלוח גרורות בהבעת רבות של integrins המשותף של כדוריות דם לבנות. ת'מחקרg דינמיקת גלגולם בסביבה המחקה באופן הדוק יותר סביבת in vivo יכול לעזור בידע שלנו, ואולי החיזוי, של הטבע פולשנית של תאי סרטן מסוימים. גישה אפשרית אחת יכולה להיות לשלב טכניקת תיוג לתאים הסרטניים, כגון 27 GFP, יחד עם assay תא זרימה כדי לעקוב אחר דינמיקת גלגול של התאים הסרטניים המבטאים GFP. בהתחשב בגמישות של ציפוי קאמרי עם מגוון רחב של חומרים וחיבור תאים מרובים לאותו העכבר יהיה מעניין לראות איך הליך זה הוא שונה לשימוש במעבדות אחרות בשילוב עם עכברים מהונדסים גנטי ומודלי מחלה. הטכניקה שאנו מתארים כאן רק נוגעת בפוטנציאל יישום רחב הרבה יותר, כי הוא מוגבל רק על ידי היצירתיות של החוקר.
Disclosures
The authors (L.M., H.S., and K.M.C.) have no competing financial interests to disclose.
Acknowledgements
מחקר שפורסם בפרסום זה נתמכה על ידי העין הלאומית של המכון הלאומי לבריאות במספרי הפרס: R01EY022084 / S1 (KMC), T32EY007145 (HS) וP30EY014104. התוכן הוא באחריות בלעדית של הכותבים ולא בהכרח מייצג את הדעות הרשמיות של המכון הלאומי לבריאות. תמיכה נוספת מסופק על ידי מסצ'וסטס אריות חקר העין הקרן (KMC) וScholar פרס מיוחד ממחקר למניעת עיוורון (למועצת הקיבוץ המאוחדת).
Materials
| Name | Company | Catalog Number | Comments |
| Material | Vendor | Part number | |
| Micro glass chamber 0.4x0.04x50mm | VitroCom | 2540-050 | |
| Polyethylene tubing PE 10 | Fisher Scientific | 427400 | |
| Polyethylene tubing PE 60 | Fisher Scientific | 427416 | |
| Silicone tubing 002 | Fisher Scientific | 11-189-15A | |
| Y tube | Value Plastics | Y210-6 | |
| T tube | value plastics | T410-6 | |
| Silicone gel | Hardware store - Home Depo | ||
| 35mm petri dish | Corning | 430165 | |
| Parafilm | Pechiney Plastic Packaging | PM996 | |
| Fine forceps | FST | 11253-25 | |
| Fine scissors | FST | 15000-08 | |
| Tube holder | FST | 00608-11 | |
| Clamp applicator | FST | 18057-14 | |
| Vascular clamp | FST | 18055-04 | |
| 6-0 silk sutures | George Tiemann & Co | 160-1215-6/0 | |
| 25x1G needles | BD | 305125 | |
| 30x1/2G needles | BD | 305106 | |
| Heparin 100 USP units/ml | Hospital pharmacy |
References
- Barreiro, O., Sanchez-Madrid, F. Molecular basis of leukocyte-endothelium interactions during the inflammatory response. Revista Espanola de Cardiologia. 62, 552-562 (2009).
- Muller, W. A. Leukocyte-endothelial-cell interactions in leukocyte transmigration and the inflammatory response. Trends in Immunology. 24, 327-334 (2003).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20, 525-532 (2008).
- Mehta, P., Cummings, R. D., McEver, R. P. Affinity and kinetic analysis of P-selectin binding to P-selectin glycoprotein ligand-1. The Journal of Biological Chemistry. 273, 32506-32513 (1998).
- Nicholson, M. W., Barclay, A. N., Singer, M. S., Rosen, S. D., vander Merwe, P. A. Affinity and kinetic analysis of L-selectin (CD62L) binding to glycosylation-dependent cell-adhesion molecule-1. The Journal of Biological Chemistry. 273, 763-770 (1998).
- Sandig, M., Negrou, E., Rogers, K. A. Changes in the distribution of LFA-1, catenins, and F-actin during transendothelial migration of monocytes in culture. Journal of Cell Science. 110 (22), 2807-2818 (1997).
- Shaw, S. K., et al. Coordinated redistribution of leukocyte LFA-1 and endothelial cell ICAM-1 accompany neutrophil transmigration. The Journal of Experimental Medicine. 200, 1571-1580 (2004).
- Woodfin, A., et al. JAM-A mediates neutrophil transmigration in a stimulus-specific manner in vivo: evidence for sequential roles for JAM-A and PECAM-1 in neutrophil transmigration. Blood. 110, 1848-1856 (2007).
- Blankenberg, S., Barbaux, S., Tiret, L. Adhesion molecules and atherosclerosis. Atherosclerosis. 170, 191-203 (2003).
- Parmeggiani, F., et al. Mechanism of inflammation in age-related macular degeneration. Mediators of Inflammation. 2012, 546786 (2012).
- Ding, X., Patel, M., Chan, C. C. Molecular pathology of age-related macular degeneration. Progress in Retinal and Eye Research. 28, 1-18 (2009).
- Xu, H., Chen, M., Forrester, J. V. Para-inflammation in the aging retina. Progress in Retinal and Eye Research. 28, 348-368 (2009).
- Peterson, K., et al. Drug Class Review: Nonsteroidal Antiinflammatory Drugs (NSAIDs): Final Update 4 Report. Drug Class Reviews. , (2010).
- Ulbrich, H., Eriksson, E. E., Lindbom, L. Leukocyte and endothelial cell adhesion molecules as targets for therapeutic interventions in inflammatory disease. Trends in Pharmacological Sciences. 24, 640-647 (2003).
- Stamper, H. B., Woodruff, J. J. Lymphocyte homing into lymph nodes: in vitro demonstration of the selective affinity of recirculating lymphocytes for high-endothelial venules. The Journal of Experimental Medicine. 144, 828-833 (1976).
- Lawrence, M. B., McIntire, L. V., Eskin, S. G. Effect of flow on polymorphonuclear leukocyte/endothelial cell adhesion. Blood. 70, 1284-1290 (1987).
- Abbitt, K. B., Nash, G. B. Characteristics of leucocyte adhesion directly observed in flowing whole blood in vitro. British Journal of Haematology. 112, 55-63 (2001).
- Smith, M. L., Sperandio, M., Galkina, E. V., Ley, K. Autoperfused mouse flow chamber reveals synergistic neutrophil accumulation through P-selectin and E-selectin. Journal of Leukocyte Biology. 76, 985-993 (2004).
- Yuan, J., Melder, R. J., Jain, R. K., Munn, L. L. Lateral view flow system for studies of cell adhesion and deformation under flow conditions. BioTechniques. 30, 388-394 (2001).
- Moalem, G., et al. Autoimmune T cells protect neurons from secondary degeneration after central nervous system axotomy. Nature Medicine. 5, 49-55 (1999).
- Hafezi-Moghadam, A., Thomas, K. L., Cornelssen, C. A novel mouse-driven ex vivo flow chamber for the study of leukocyte and platelet function. American Journal of Physiology. Cell Physiology. 286, 876-892 (2004).
- Almulki, L., et al. Surprising up-regulation of P-selectin glycoprotein ligand-1 (PSGL-1) in endotoxin-induced uveitis. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology. 23, 929-939 (2009).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Rapalino, O., et al. Implantation of stimulated homologous macrophages results in partial recovery of paraplegic rats. Nature Medicine. 4, 814-821 (1998).
- Yoles, E., et al. Protective autoimmunity is a physiological response to CNS trauma. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 21, 3740-3748 (2001).
- Buchanan, M. R., Vazquez, M. J., Gimbrone, M. A. Arachidonic acid metabolism and the adhesion of human polymorphonuclear leukocytes to cultured vascular endothelial cells. Blood. 62, 889-895 (1983).
- Connor, K. M., et al. Manganese superoxide dismutase enhances the invasive and migratory activity of tumor cells. Cancer Res. 67, 10260-10267 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved