Method Article
Evaluación no invasiva de la eficacia de nuevas terapias para Intestinal Patologías recurriendo a imágenes de Endoscópica serie de ratones vivos
En este artículo
Resumen
We describe methods for longitudinal monitoring of the efficacy of therapeutics for the treatment of colonic pathologies in mice using a rigid endoscope. This protocol can be readily used for the characterization of the therapeutic response of an individual tumor in live mice and also for monitoring potential disease relapse.
Resumen
Animal models of inflammatory bowel disease (IBD) and colorectal cancer (CRC) have provided significant insight into the cell intrinsic and extrinsic mechanisms that contribute to the onset and progression of intestinal diseases. The identification of new molecules that promote these pathologies has led to a flurry of activity focused on the development of potential new therapies to inhibit their function. As a result, various pre-clinical mouse models with an intact immune system and stromal microenvironment are now heavily used. Here we describe three experimental protocols to test the efficacy of new therapeutics in pre-clinical models of (1) acute mucosal damage, (2) chronic colitis and/or colitis-associated colon cancer, and (3) sporadic colorectal cancer. We also outline procedures for serial endoscopic examination that can be used to document the therapeutic response of an individual tumor and to monitor the health of individual mice. These protocols provide complementary experimental platforms to test the effectiveness of therapeutic compounds shown to be well tolerated by mice.
Introducción
El cáncer colorrectal (CCR) es la 4ª causa más común del cáncer en todo el mundo 1. A pesar de los significativos avances en nuestra comprensión de la base familiar de esta enfermedad, la predisposición genética sólo contribuye a ~ 20% de los casos de CCR 2. El resto se atribuye a numerosos factores extrínsecos y ambientales, incluyendo la inflamación crónica. En los seres humanos, la relación entre la inflamación crónica y el cáncer de colon es evidente en la colitis ulcerosa (CU) de los pacientes, que tienen un mayor riesgo de desarrollar cáncer de colon colitis asociada (CAC), en función de la duración, extensión y gravedad de la enfermedad inflamatoria 3 -5. De acuerdo con ello, nuevas terapias se encuentran en desarrollo para controlar la respuesta inmune y la producción asociada de factores de crecimiento por promover el microambiente tumoral inflamatoria 6-8. No es un requisito creciente para modelos animales pre-clínicos apropiados para caracterizar la eficacia terapéutica deestos fármacos contra el desarrollo y progresión de la enfermedad.
Los modelos de ratón han demostrado de manera inequívoca que el microambiente inflamatoria contribuye a la progresión de la CRC, incluso en ausencia de inflamación abierta 9,10. Estos modelos incluyen el uso de las sales de sodio de sulfato de dextrano polisacárido (DSS), proporcionada en el agua de bebida de los ratones, al modelo de lesión epitelial y la enfermedad intestinal inflamatoria aguda y crónica (IBD) 11,12. Aunque el mecanismo por el cual DSS induce daño de la mucosa y colitis no se comprende completamente, algunos estudios sugieren que DSS inhibe las actividades celulares de la transcriptasa inversa ribonucleasa y dentro de las células, o promueve la formación de complejos de nano-lípido que se fusionan con la membrana de colon que conduce a daño epitelial 13,14. Las modificaciones al modelo DSS estándar también han proporcionado una información valiosa sobre los mecanismos por los cuales las células epiteliales del colon mantienen la homeostasis del tejido y regula respuesta inmune de la mucosa finales 15.
La administración intraperitoneal de azoximetano (AOM) solo, o en combinación con DSS, proporciona un modelo para examinar la interacción entre las mutaciones somáticas en la mucosa epitelial y el microambiente inflamatorio y del estroma 16,17. AOM es un metabolito del carcinógeno 1,2-dimetilhidrazina (DMH) que no resulten directamente en mutaciones en el ADN. En lugar de ello, AOM se hidroliza para metilazoximetanol (MAM) por la isoforma del citocromo CYP2E1 en el hígado, donde MAM se conjuga con ácido glucurónico y luego transportado a la intestino a través de las secreciones biliares 18. Se cree que la β-glucuronidasa bacteriana contribuye a la degradación de MAM resultante en la alquilación de ADN y la acumulación de mutaciones en células epiteliales 19. La mayoría de los tumores de colon inducida por AOM-albergan mutaciones sin sentido en el gen que codifica la β-catenina, lo que hace la proteína resistente a degradati proteasomalen, lo que resulta en la activación aberrante de la vía Wnt de señalización canónica 20. Cuando la actividad de la OMA se combina con el daño de la mucosa inducida por DSS, la herida resultante respuesta de curación crea un microambiente propicio para el crecimiento y la expansión del epitelio mutado. En una variación de este modelo, la administración repetitiva de AOM solo durante un período de varias semanas puede ser utilizado para modelar cáncer colorrectal esporádico, en ausencia de colitis inducida por DSS 10,17. Estos dos modelos gratuitos proporcionan parámetros experimentales para estudiar CAC y esporádica CRC, respectivamente, ambos de los cuales están asociados con un microambiente tumoral pro-inflamatoria 10.
El uso de la endoscopia en serie en ratones fue iniciado por Becker y sus colegas 21, y permite la monitorización longitudinal de la colitis y la progresión tumoral. Aquí proporcionamos tres protocolos pre-clínicos basados en daño de la mucosa inducida por DSS y / o AOM mediada tumor de inducción para inducir reproducible patologías del colon específicos. El primer protocolo describe la inducción de daño de la mucosa aguda en respuesta a la administración de DSS para provocar muchas de las características histopatológicas de la EII. El segundo protocolo se basa en tres ciclos consecutivos de administración de DSS para imitar los brotes de inflamación observada comúnmente en pacientes con EII, y puede llevarse a cabo en conjunción con las mutaciones inducidas por AOM. El protocolo final se basa en mutaciones esporádicas epiteliales inducida por AOM. Para cada uno de estos protocolos, nos expandimos en los procedimientos estándar pertinentes para incluir métodos de intervención profilácticas y terapéuticas que hemos desarrollado para controlar la eficacia de nuevos fármacos.
Protocolo
El Instituto de Investigación Médica comité de ética animal Walter y Eliza Ayuntamiento aprobó cada uno de los procedimientos descritos en estos protocolos.
1. Preparación de ratones experimentales
- Componer cohortes experimentales de al menos 4 géneros igualado 6-8 semanas de edad C57BL / 6 ratones (M. musculus) que se crían y alojan en el mismo libre de patógenos específicos (SPF) animalario / habitación y provistos de alimentos y el agua tratada en autoclave. El uso de ratones hembra permitirá co-vivienda de ratones de diferentes líneas, números de caja de límite, y reducir la variación de jaula a jaula.
- Asegúrese de que los ratones son al menos 6 semanas de edad para permitir procedimientos de endoscopia utilizando la vaina endoscopia diámetro 3,0 mm.
- Utilice los ratones de los mismos antecedentes genéticos, y en lo posible, de las jaulas almacenados en el mismo rack para reducir las variaciones asociadas con la microflora intestinal. Las variaciones en la microflora entre instalaciones de los animales deben tenerse en cuenta cuando planeesn determinar los ratones y genotipos de control apropiadas para cada experimento 22.
- Marcos ratones mediante recortes de oído / del dedo del pie, tatuajes o similares para permitir una fácil identificación.
- Pesar los ratones en el día 0, para determinar los pesos de la línea de base experimentales.
- Realizar endoscopia (ver Sección 5) de los ratones en el día 0 para grabar fenotipos colon basales.
2. Juicio Pre-clínica en un daño epitelial y Colitis Modelo Agudo
- Preparar una solución del agente terapéutico a ensayar. Para la terapéutica entregados por sonda oral (po), preparar soluciones a un volumen máximo de 100 l. Para la terapéutica entregados por inyección intraperitoneal (ip), preparar soluciones a un volumen máximo de 200 l.
NOTA: repetida ip o po administración del fármaco durante períodos prolongados de tiempo puede provocar un comportamiento del ratón alterado. Alterne el lugar de la inyección ip para evitar malestar prolongado. Para la administración po, proporcionar los ratones con autocsemillas de girasol lamió como un "regalo" para reducir al mínimo la asociación negativa con el procedimiento de alimentación forzada. - En el Día 1, administrar el terapéutico de interés (preparado en el paso 2.1) y los controles pertinentes del vehículo. En el ejemplo proporcionado (Figura 6A), 5 g de humano recombinante (rh) iInterleukin (IL) -11 proteína se disolvió en 200 l tampón fosfato salino (PBS) y se administra ip
- Determinar el tiempo y la frecuencia de las administraciones, que será dependiente de el perfil farmacocinético establecido para el reactivo terapéutico que se está probando. La figura 1 esboza el tratamiento profiláctico usando dos inyecciones diarias IP en el transcurso del experimento.
- Monitorear, incluyendo consistencia de las heces y la presencia de sangre, y pesar cada ratón diaria. En los días de tratamiento, con un peso debería coincidir con la administración del fármaco terapéutico para minimizar el estrés a los ratones causadas por la manipulación repetida.
- En el Día 3, preparar 2,5% (2,5 g / 100 ml) solución de DSS en el agua potable proporcionado rutinariamente a los ratones por la instalación de animales. Aproximadamente 5 ml / ratón / día se requiere de una solución de DSS para el experimento. El consumo de agua DSS puede cambiar si la temperatura ambiente de la instalación de animales fluctúa.
NOTA: DSS es un irritante y debe ser utilizado de acuerdo con las instrucciones MSDS. - Proporcionar DSS fresco a los ratones ad libitum en botellas de agua limpia durante 5 días continuos. En la tarde del día 5, proporcionar agua potable normal además bolitas de comida puré y un suplemento de proteína proporcionada en pequeñas placas de Petri (100 g bolitas de comida / 10 g batido de proteína / 10 ml de agua). Esto evita la deshidratación y ayuda a minimizar la grave pérdida de peso.
- La eutanasia a los ratones por CO 2 intoxicación y recoger tejidos para posterior análisis histológico en la mañana del día 8, o cuando los ratones experimentan ≥15% de pérdida de peso por más de tres cdía onsecutive, lo que ocurra primero.
NOTA: Ajustar la dosis DSS entre 1.4% (w / v) en función de la microflora de las instalaciones de animales y el lote del DSS. Llevar a cabo, las pruebas por lotes de rutina para establecer la dosis apropiada de DSS y eludir variación de lote a lote. La dosificación apropiada debe basarse en la pérdida de peso (no mayor que 15% del peso original) y confirmó la histopatología colitis.
3. Juicio Pre-clínica en una colitis crónica o Modelo cáncer asociado-Colitis
- Para el modelo de colitis crónica comenzar desde el paso 3.7.
- Para el modelo de cáncer de colitis asociada (CAC), en el Día 1, inyectar cada ratón con 10 mg / kg (w / w) azoximetano (AOM, 250 l, ip).
NOTA: OMA es un carcinógeno y debe ser manejado de acuerdo con las instrucciones MSDS. - Las soluciones madre de OMA se preparan como 10 mg / ml alícuotas y se almacenaron a -20 ° C. En el día de la inyección, la solución madre AOM se descongela y se diluye a 1 mg / ml en PBS. Congelación y descongelación repetida de la solución madre OMA deben ser evitados.
- La dosis AOM se puede ajustar entre 8-12 mg / kg. Se requiere una prueba de rutina por lotes para establecer la dosis AOM apropiada con el fin de eludir la toxicidad a los ratones debido a la variación de lote a lote.
- Durante los Días 1-7 siguientes pesos administración OMA serán estables y por esta razón el monitoreo de peso puede ser omitido durante los días 1-7 de evitar la manipulación de animales que excretan metabolitos citotóxicos en sus heces.
- En el Día 7 ropa de cama debe ser cambiado después de procedimientos citotóxicos. Una vez que el cambio de ropa de cama es completa, los animales ya no requieren procedimientos de manipulación de citotóxicos, ya que ya no se excretan metabolitos citotóxicos.
- En el Día 8, preparar 2,5% (2,5 g / 100 ml) solución de DSS (como se describe en el paso 2.5) y proporcionar a los ratones ad libitum.
- Pesar ratones diariamente durante todo el experimento y vigilar los signos de la enfermedad, incluyendo fu volantesr, encorvando, heces con sangre y el movimiento reducida.
- El día 13, se retira la solución DSS y proporcionar los ratones con el agua potable normal hasta el día 28. Días 8-28 constituyen un "ciclo" del protocolo colitis / CAC crónica.
- Los días 13 a 28, cuando los ratones se les da agua potable normal, proporcionar a los ratones con bolitas de comida puré y un suplemento de proteína proporcionada en pequeñas placas de Petri (100 g bolitas de comida / 10 g batido de proteína / 10 ml de agua). Esto evita la deshidratación y ayuda a minimizar la grave pérdida de peso.
NOTA: Los suplementos de proteína en masa no debe proporcionar cuando los ratones están recibiendo DSS-que contiene el agua potable con el fin de garantizar la coherencia en el consumo de DSS. - El día 20 realizar el segundo examen endoscópico para monitorear la salud individual ratón (véase la Sección 5).
- El día 29 de repetición del ciclo DSS (Ciclo 2: 2,5% (w / v) DSS dio durante los días 29 a 33 y de agua potable normal durante Días 34-50).
- El día 40 realizan la third examen endoscópico para monitorear la salud individual del ratón y determinar la carga tumoral (ver Sección 5).
- Si no hay tumores son visibles por endoscopia en el día 40, comenzará un tercer ciclo DSS en los días 50-72 (Ciclo 3: 2,5% (w / v) DSS dio durante los días 50-55 y normal de agua potable durante los días 56 a 72). Generalmente, los tumores son visibles por el día 40 y por lo tanto el tercer ciclo de DSS se puede omitir.
- Una vez que los tumores se hacen visibles por examen endoscópico, asignar a cada ratón una puntuación endoscópica del tumor (ver Sección 5) y asignar los ratones individuales de cohortes con cargas tumorales basales similares.
- En el día 42 (o cuando los tumores son visibles), administrar el compuesto terapéutico o control del vehículo relevantes (ver sección 2.2). El momento de las dosis será dependiente en el perfil farmacocinético de la terapéutica. Un ejemplo de un tratamiento de intervención inyecta ip tres veces por semana en ratones con tumores establecidos se proporciona (Figura 2).
- Realizar eexámenes ndoscopic una vez por semana durante la duración del tratamiento terapéutico para controlar la carga tumoral. En general, de 4 semanas de un tratamiento terapéutico es suficiente para observar una respuesta al tratamiento objetivo. Después del cese del tratamiento, una cohorte de ratones también se puede controlar mediante endoscopia para la recaída del tumor.
- La eutanasia a los ratones por CO 2 intoxicación y recoger tejidos para análisis bioquímico y / o histológica en la mañana del día 72, o cuando los ratones experimentan ≥15% de pérdida de peso por más de tres días consecutivos, lo que ocurra primero.
4. Juicio Pre-clínica en un esporádico Cáncer Colorrectal
- En el Día 1, inyectar cada ip ratón con 10 mg / kg OMA (véase el paso 3.2). La dosis AOM se puede ajustar entre 8-12 mg / kg. Se requiere una prueba de rutina por lotes para establecer la dosis AOM apropiada con el fin de eludir la toxicidad a los ratones debido a la variación de lote a lote.
- Repetir la inyección en el primer día de cada semanapara los siguientes 5 semanas (Figura 3). Los ratones deben ser manejados de acuerdo a los procedimientos de seguridad citotóxicos para la totalidad de los 6 semanas.
- Pese cada ratón en el día de la inyección de AOM para minimizar la angustia de los ratones causadas por la manipulación repetida.
NOTA: OMA es un carcinógeno y debe ser manejado de acuerdo con las instrucciones MSDS. - Todos los animales deben ser manejados de acuerdo a los procedimientos de seguridad citotóxicos para las 6 semanas de inyecciones ip AOM requeridos para este protocolo.
- Durante la semana 8 realizar el examen endoscópico para monitorear tumores emergentes (véase la Sección 5). El examen endoscópico se debe realizar cada dos semanas hasta que los tumores se vuelven visibles. En general, de tipo salvaje C57BL / 6 animales comienzan a desarrollar tumores en aproximadamente 40 semanas después de la administración inicial de AOM.
- Una vez que los tumores se hacen visibles por examen endoscópico, asigne a cada ratón una puntuación endoscópica del tumor (ver Sección 5) y asignar los ratones individuales a una cohorte con similares cargas del tumor antes del comienzo del tratamiento terapéutico.
- Durante la semana 40 (o cuando los tumores son visible por primera vez), administrar el compuesto terapéutico o el control del vehículo en cuestión.
- El momento de las dosis será dependiente en el perfil farmacocinético de la terapéutica (véase el paso 2.1). Un ejemplo de un tratamiento de intervención inyecta ip 3 veces a la semana en ratones con tumores establecidos se proporciona (Figura 3).
- Realizar semanal examen endoscópico para la duración de los períodos de tratamiento terapéuticos para controlar la carga tumoral. Generalmente, de 4 semanas de un tratamiento terapéutico es suficiente para una respuesta al tratamiento objetivo. Tras la interrupción del tratamiento, una cohorte de ratones también se puede controlar mediante la endoscopia para la recidiva tumoral.
- La eutanasia a los ratones por CO 2 intoxicación y recoger tejidos para análisis bioquímico y / o histológico del colon y tumores durante 45 semanas, o después de 4 semanas de terapia.
- El equipo de la endoscopia debe ser montado de acuerdo con procedimientos estándar 16.
- Esterilizar y limpiar la sonda endoscópica con etanol al 70% o un lubricante anti-bacteriana.
- Los videos pueden ser grabados en un ordenador portátil o de escritorio y software de medios estándar, como iMovie. Un monitor de ordenador estándar, en lugar de un monitor de calidad médica, es suficiente para visualizar el colon durante el procedimiento de endoscopia (Figura 4).
- Anestesie grupos de 5-6 ratones simultáneamente en una cámara con 3% de isoflurano en 100% de O 2 a una velocidad de 0,2-0,4 L / min. Una vez que los ratones se anestesian, que se confirma con pizca dedo del pie; los niveles isoflurano deben ser alterados para 0,5-2% para el mantenimiento.
- Eliminar un ratón individual de la cámara, y colocarlo parte ventral hacia arriba con su cabeza asegurada en una ojiva. Anestesia completas deben ser monitoreados y las patas traseras deben ajustarse de manera que son stretched detrás del ratón.
- Coloca un ungüento veterinario en los ojos de los ratones para evitar la sequedad.
- Sostenga la cola del ratón donde se encuentra con la espina dorsal más baja para revelar claramente el ano. Inserte la funda de endoscopio rígido en un vaso de precipitados de agua y ajustar el flujo de aire para permitir la liberación de una pequeña burbuja a la vez.
- El flujo de aire permitirá que el colon se infle. Si el flujo de aire es demasiado fuerte, el aire se bombea en el estómago del ratón. No se requiere lubricación adicional.
- Introduzca con cuidado la funda de endoscopio rígido en el recto. En general, el endoscopio puede ser insertado hasta 3 cm, momento en que los dos puntos en las curvas de ratones y no es accesible para el endoscopio rígido.
- Una dificultad común durante los procedimientos de endoscopia es la obstrucción de acceso al lumen del colon debido a la materia fecal. Evite esto mediante un ligero masaje del vientre de los ratones antes del procedimiento para fomentar la defecación, o maniobrar cuidadosamente el endoscopio alrededor del Fecal de materia durante el procedimiento. El peristaltismo también puede ocurrir, durante el cual el endoscopio debe ser mantenido en su posición hasta que la musculatura del colon se relaja.
- Iniciar grabación de vídeo en cualquier etapa del procedimiento de endoscopia. Enfermedad de puntuación puede ser grabado por un asistente con experiencia durante el procedimiento, o en un momento posterior de los archivos de vídeo.
- Tras el examen endoscópico, devolver los ratones a su jaula y monitorearlos durante la recuperación de la anestesia. Los animales son generalmente despierto y móvil dentro de 2 min después de la retirada de la administración de isoflurano nariz cono.
- Asegúrese de que estos procedimientos son realizados por un científico experimentado. Cada procedimiento de endoscopia tomará aproximadamente 2 minutos por ratón.
6. Enfermedades de puntuación
- Para controlar la colitis, la puntuación de los vídeos para el Índice murino endoscópico de colitis Severidad (MEICS) 16, que documenta los cambios en (i) el espesor de la pared del colon indicado por la transparencia, (Ii) consistencia de las heces, (iii) la integridad de los vasos sanguíneos y la presencia, (iv) las úlceras y zonas de regeneración que se presentan en una forma granular, (v) el sangrado indican mediante depósitos de fibrina (Figura 5a).
- Para controlar la carga tumoral, anotar los vídeos para la incidencia y el tamaño del tumor. El tamaño del tumor se determina por el diámetro de la luz del colon ocupados por el tumor 16 (Figura 5b). Es común el uso de ambos parámetros colitis y de puntuación tumor para un solo ratón. El uso de la endoscopia, los tumores individuales y la salud de la mucosa del colon se puede controlar a través del tiempo, proporcionando una lectura de salida para el éxito de nuevas terapias en un solo animal.
- (Opcional) Las imágenes fijas se pueden extraer de los vídeos para la generación de figuras representativas (Figura 6).
Resultados
La pérdida de peso se utiliza como un parámetro estándar para monitorizar la enfermedad asociada con la colitis, que se utiliza de forma rutinaria para monitorizar la salud general de los ratones. Animales en general mantienen su peso, mientras que contienen DSS agua se administra, y sólo empiezan a perder peso cuando se vuelven a agua potable normal. Parámetros de pérdida de peso aceptables deben establecerse de acuerdo con el comité de ética animal de la institución. Con el fin de prevenir la deshidratación asociada con la diarrea prolongada, utilizar la disposición de la rutina de puré (bolitas de comida puré y se mezcla con el agua potable) suplementado con un batido de proteínas, además de agua potable normal.
Como una alternativa la anestesia, la ketamina / xilazina o agentes similares pueden ser utilizados, si el equipo de isoflurano no está disponible. Debido a la naturaleza rígida del endoscopio, estos procedimientos sólo permiten la visualización de las más distales 3 cm del colon de ratón. Endoscopios nuevos con capacidades adicionales (incluyendo flexibilidad y fluorescencia) están disponibles dependiendo de las necesidades del experimento. Sin embargo, ya que los efectos deletéreos de DSS se limitan principalmente al colon distal de ratones, con la patología más leve observado en el colon medio, el endoscopio rígido no dificulta el seguimiento de la salud de la mucosa de ratones individuales. Aunque se describe un protocolo para el tratamiento profiláctico de la colitis inducida por DSS aguda, este protocolo puede modificarse fácilmente para poner a prueba las estrategias de tratamiento de intervención. La eficacia de un fármaco diseñado para aliviar el daño epitelial y la colitis puede ser monitoreado longitudinalmente en ratones individuales y se cuantificó basándose en los parámetros de puntuación descrito (Figura 5). Esto es ventajoso respecto a los diseños tradicionales experimentales, que requieren el sacrificio de los ratones en los puntos de tiempo específicos durante el protocolo experimental, y no permite la caracterización de la respuesta de la enfermedad a un tratamiento en el tiempo.
t "> Los estudios clínicos en seres humanos han puesto de manifiesto una considerable variabilidad en cómo los diferentes tumores en un paciente individual responder a tratamientos. Los procedimientos que se describen aquí proporcionan un medio para controlar la carga tumoral global, así como la respuesta al tratamiento de los tumores individuales a lo largo de un experimento. Es importante tener en cuenta que los protocolos de intervención que se describen para los modelos de cáncer no tienen en cuenta los efectos de una terapia en la iniciación del tumor. protocolos profilácticos, con el tratamiento proporcionado antes de cuando los tumores se hacen visibles por endoscopia, se requieren para obtener esta información. Los protocolos descritos aquí proporcionan información sobre los efectos terapéuticos sobre la sobre la progresión (medida por el tamaño del tumor) de los tumores individuales. La regresión del tumor también puede ser indicado por una reducción en el número de tumores visibles.g "/>
Figura 1:. Control de la eficacia de una terapia de tratamiento profiláctico en un modelo de daño colónica aguda El protocolo experimental (a) requiere 8 días desde el inicio hasta su finalización. Se administran Therapeutics (b) desde el día 1 para los tratamientos profilácticos. DSS se proporciona en el agua potable (c) desde el día 3 del protocolo experimental. La endoscopia se realiza (d) supervisar la progresión de la enfermedad en los animales. Puntos de tiempo sugeridos incluyen el día 0 (sin tratar) y el Día 2 (vigilancia de la salud), el día 5 y 8 (para determinar la carga de la enfermedad). El experimento se termina (e) la mañana del Día 8. En un ratón de tipo salvaje (f) la progresión de la enfermedad aumenta con el tiempo.
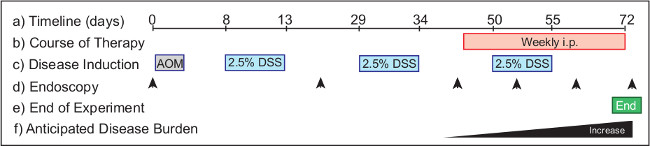
Figura 2: Seguimiento de la eficacia de la terapia de intervención en un modelo of colitis asociada a cáncer. El protocolo experimental (a) requiere 72 días desde el inicio hasta su finalización. Therapeutics (b) se administraron a ratones con tumores establecidos a partir del día 46 para tratamientos de intervención. AOM (c) se inyecta en el Día 1, y DSS se proporciona en el agua potable en el transcurso de tres ciclos del protocolo experimental, comenzando en el Día 8. La endoscopia (d) se lleva a cabo para controlar la progresión de la enfermedad en los animales. Puntos de tiempo sugeridos incluyen el día 0 (sin tratamiento), el día 20 (vigilancia de la salud) y el Día 40 (a los animales del grupo de acuerdo con la carga tumoral). La endoscopia se realiza semanalmente durante el curso del tratamiento terapéutico para supervisar los resultados de la enfermedad. El experimento (e) se termina la mañana del día 72. En una carga tumoral de tipo salvaje del ratón (f) aumenta desde el día 40 en adelante.

Figura 3:. Control de la eficacia de la terapia de intervención en un modelo de cáncer colorrectal espontánea El protocolo experimental (a) requiere> 50 semanas desde el inicio hasta su finalización. Therapeutics (b) se administraron a ratones con tumores establecidos para tratamientos de intervención. AOM (c) se inyecta en el Día 1, y posteriormente semanal durante 6 inyecciones consecutivas en el transcurso del protocolo experimental. Endoscopia (d) se lleva a cabo para controlar la progresión de la enfermedad en los animales. Puntos de tiempo sugeridos incluyen el día 0 (sin tratar) y la Semana 8 (de monitorización de tumores) y cada dos semanas allí después (para establecer la carga tumoral). La endoscopia se realiza semanalmente durante el curso del tratamiento para monitorear los resultados terapéuticos. El experimento (e) se termina en la Semana 50. En una carga tumoral de tipo salvaje del ratón (f) aumenta desde la Semana 40 en adelante. p>

Figura 4:. Equipo de puesta a punto El montaje experimental (a) para la unidad de endoscopia, con piezas individuales de equipo indicado. El endoscopio rígido (b), con componentes individuales indicó. Barra de escala = 2,5 cm. Haga clic aquí para ver una versión más grande de esta figura.
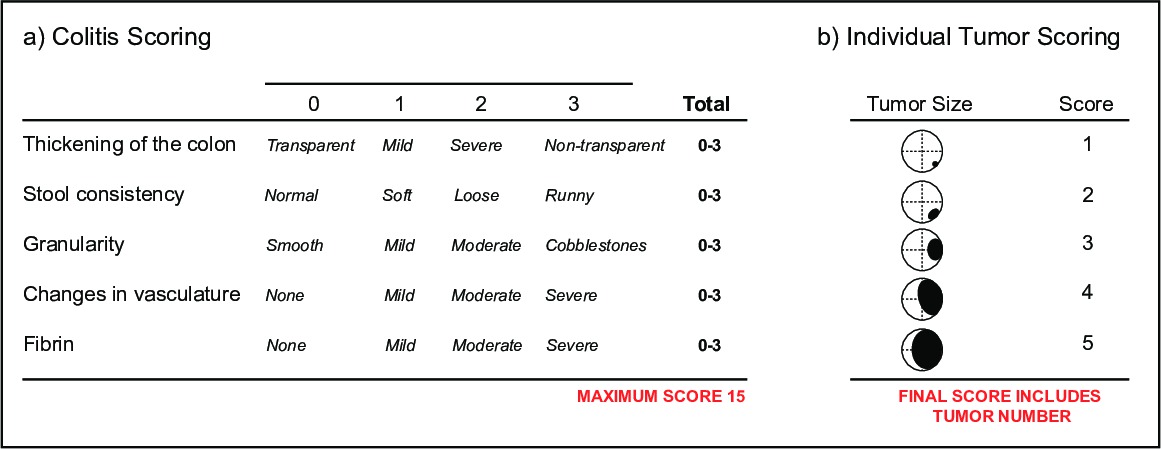
Figura 5:. Parámetros de la enfermedad de puntuación por endoscopia Un esquema (a) del Índice endoscópica murino de colitis Severidad (MEICS). Un esquema (b) de los parámetros individuales de puntuación tumor.en / ftp_upload / 52383 / 52383fig5highres.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
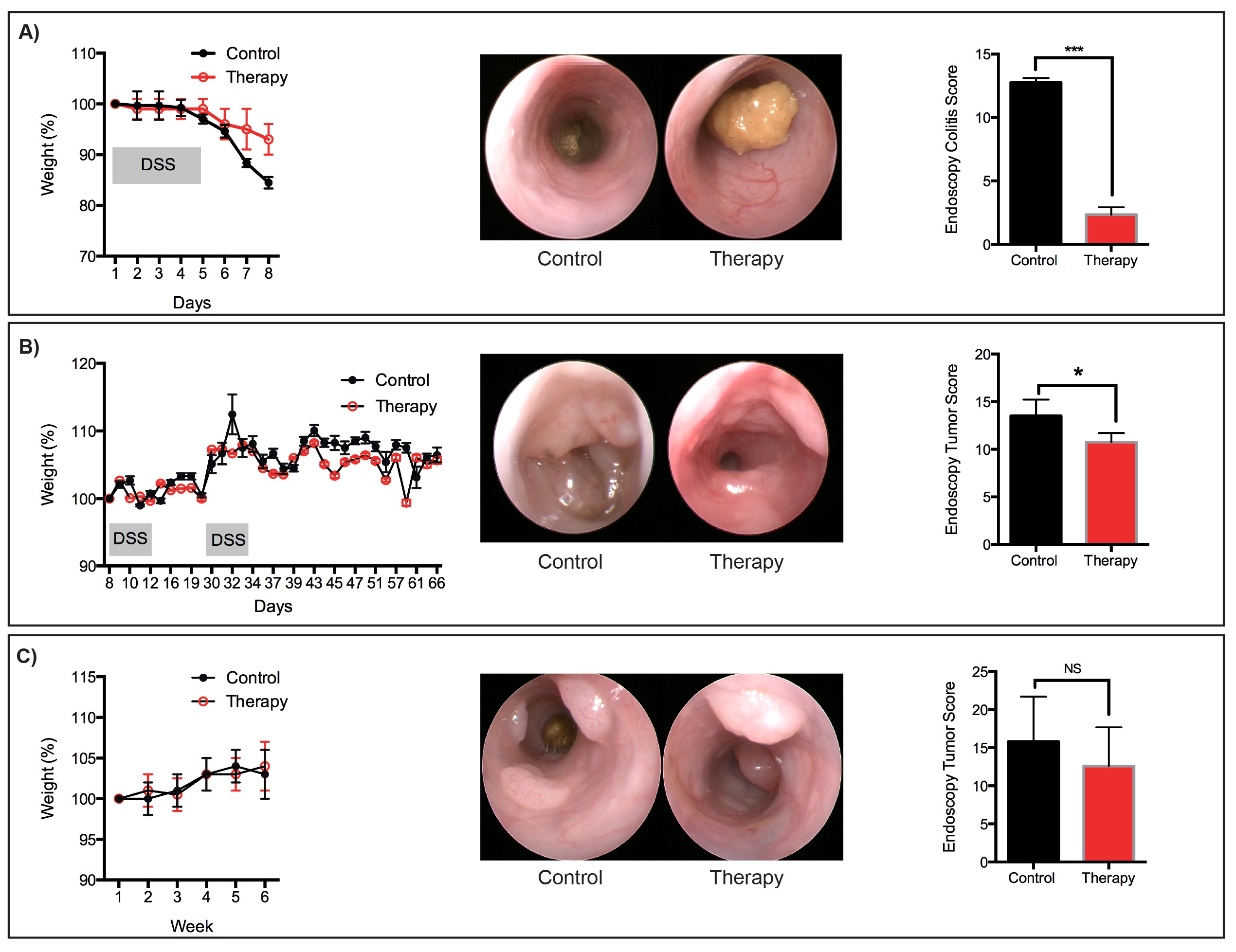
Figura 6: tratamientos terapéuticos representativos de pérdida de peso Representante, imágenes endoscópicas y partituras para:. (A) aguda DSS-indujo daño de la mucosa (b) tumores que se desarrolló siguiendo el protocolo / DSS AOM (c) Los tumores que se desarrollaron después de la secuencial.. protocolo OMA. N = 3 ratones por grupo. * P <0,05, *** p <0,001 (t de Student). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los tres protocolos que se describen los métodos de contorno de la inducción fiable y reproducible de patología de la enfermedad del colon en ratones. Cuando se combina con las estrategias de intervención esbozadas aquí vigilancia endoscópica de rutina y, estos protocolos proporcionarán poderosa visión pre-clínico sobre la eficacia de la terapéutica. Nuestros laboratorios utilizan rutinariamente todos estos protocolos para monitorear el éxito de nuevos productos terapéuticos 10,23,24.
Hay un número de consideraciones al elegir un modelo animal pre-clínicos para probar nuevas terapias. Estos incluyen pertinencia del modelo de la enfermedad humana, y la contribución del microambiente tumoral a la acción propuesta de la diana terapéutica. Aquí proporcionamos tres protocolos para la intervención terapéutica en modelos de enfermedades intestinales establecidos. Estos modelos son reproducibles y la entrega de reactivos para inducir la enfermedad es fácil de manejar. Es importante destacar que los modelos son muy relevantesa múltiples facetas y etapas de inicio colitis, y de la iniciación y progresión tumoral. Los investigadores deben tener en cuenta los antecedentes genéticos de las cepas de ratones utilizados en el diseño de experimentos, como la susceptibilidad a la enfermedad inducida por DSS y / o AOM puede variar considerablemente 25. Además, diferentes comunidades microbianas pueden tener diferentes capacidades metabólicas en el contexto de la OMA, que se metaboliza por las bacterias. Advertimos contra el uso de diferentes cohortes de ratones que nacieron en diferentes instalaciones de los animales (incluidos los proveedores comerciales) en un solo experimento. Del mismo modo, los diferentes microflora en ratones utilizados de diferentes instalaciones puede provocar diferentes respuestas del huésped a DSS-indujeron daños barrera epitelial 11. Además, el análisis apropiado de tejido (por ejemplo la purificación de ARN) también debe ser considerado, ya que la capacidad de DSS para inhibir la transcriptasa inversa tendrá un impacto en el análisis molecular posterior 26,27.
Mouse endoscopia es una técnica de vanguardia para controlar repetidamente inicio de la enfermedad y la progresión en un ratón individual. La posibilidad de grabar vídeos y extraer imágenes fijas permite un fácil monitoreo de múltiples parámetros de la enfermedad y los tumores. Además de mejorar el bienestar de los animales, la vigilancia endoscópica también reduce la necesidad de múltiples cohortes de ratones experimentales, que tradicionalmente fueron sacrificados en diferentes puntos de tiempo para realizar un seguimiento de evolución de la enfermedad. El sistema de puntuación MEICS no es un sustituto para el análisis histopatológico, pero proporciona un medio alternativo para controlar daños a la salud de los animales y de la mucosa en ratones vivos. Ratón endoscopia es una técnica de laboratorio especializado, y todos los procedimientos deben ser realizados por personal capacitado para garantizar la manipulación y el manejo adecuado de los ratones, así como para proporcionar una calidad constante en las imágenes utilizadas para la puntuación enfermedad. En las manos de personal cualificado, hemos encontrado que la endoscopia induce poco o ningún daño a la tumors que causarían sangrado intra-tumoral. Para los protocolos terapéuticos descritos, consideramos endoscopia muy ventajosa, ya que proporciona una manera de determinar la carga inicial del tumor, y nos permite cohortes grupo de animales con cargas tumorales similares antes de la administración de un fármaco terapéutico. Monitorización secuencial de los ratones permite a los investigadores a determinar la eficacia de nuevas terapias desde el principio, con la opción de terminar los experimentos fallidos de manera oportuna.
A medida que nuestra comprensión de la enfermedad inflamatoria intestinal y el cáncer colorrectal antelación, se identificarán nuevos objetivos para la terapia. Modelos animales apropiados serán integrales a asegurar que las nuevas terapias más prometedoras se mueven hacia los ensayos clínicos.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We would like to thank CSL Ltd. for supporting the purchase of the endoscopy equipment. The research in the laboratory of ME is supported by the Ludwig Institute for Cancer Research, and the laboratories of TP and ME are supported by the Victorian State Government Operational Infrastructure Support and the National Health and Medical Research Council of Australia. ME is an NHMRC Senior Research Fellow.
Materiales
| Name | Company | Catalog Number | Comments |
| Dextran sulfate sodium (MW 36,000-50,000) | MP Biochemicals | 160110 | Requires batch testing. |
| Azoxymethane | Sigma | A5486-100MG | Requires batch testing. |
| Vanilla protein shake | N/A | N/A | Available from hospital pharmacies. |
| Isoflurane | PPC | M60303 | This is a restricted reagent, which should be stored under lock and key. |
| 70% ethanol | N/A | N/A | Standard lab reagent. |
| Coloview miniendoscopic system | |||
| Endovision Tricam | Karl Storz | 20212001-020 | |
| Xenon 175 light source with anti-fog pump | Karl Storz | 20134001 | |
| HOPKINS straight Forward Telescope | Karl Storz | 64301AA | |
| Endoscopic sheath (total diameter 3 mm) | Kalr Stroz | 61029C | |
| Fiber optic light cable | Kalr Stroz | 69495ND | |
| Computer and media player software | Apple | iMovie | |
| Scale | Any | Any scale suitable for weighing mice. |
Referencias
- Tenesa, A., Dunlop, M. G. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat Rev Genet. 10, 353-358 (2009).
- Rustgi, A. K. The genetics of hereditary colon cancer. Genes Dev. 21, 2525-2538 (2007).
- Rutter, M., et al. Severity of inflammation is a risk factor for colorectal neoplasia in ulcerative colitis. Gastroenterology. 126, 451-459 (2004).
- Eaden, J. A., Abrams, K. R., Mayberry, J. F. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 48, 526-535 (2001).
- Lakatos, P. L., Lakatos, L. Risk for colorectal cancer in ulcerative colitis: changes, causes and management strategies. World J Gastroenterol. 14, 3937-3947 (2008).
- Xiang, B., Snook, A. E., Magee, M. S., Waldman, S. A. Colorectal cancer immunotherapy. Discov Med. 15, 301-308 (2013).
- Feng, Q. Y., et al. Anti-EGFR and anti-VEGF agents: Important targeted therapies of colorectal liver metastases. World J Gastroenterol. 20, 4263-4275 (2014).
- Dinarello, C. A. Anti-inflammatory Agents: Present and Future. Cell. 140, 935-950 (2010).
- Grivennikov, S. I., et al. Adenoma-linked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth. Nature. 491, 254-258 (2012).
- Putoczki, T., Thiem, S., Loving, A., Busuttil, R. A., Wilson, N. A., Ziegler, P., Nguyen, P., Preaudet, A., Farid, R., Edwards, K., Boglev, Y., Luwor, R. B., Jarnicki, A. J., Horst, D., Boussioutas, A., Heath, J., Sieber, O., Nash, A., Greten, F., McKenzie, B. S., Ernst, M. Interleukin-11 is the dominant IL-6 family cytokine during gastrointestinal tumorigenesis and can be targeted therapeutically. Cancer Cell. 24, 257-271 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. J Biomed Biotechnol. 2012, 718617(2012).
- Rose, W. A. 2nd, Sakamoto, K., Leifer, C. A. Multifunctional role of dextran sulfate sodium for in vivo modeling of intestinal diseases. BMC Immunol. 13, 41(2012).
- Laroui, H., et al. Dextran sodium sulfate (DSS) induces colitis in mice by forming nano-lipocomplexes with medium-chain-length fatty acids in the colon. PLoS One. 7, e32084(2012).
- Miyazawa, F., Olijnyk, O. R., Tilley, C. J., Tamaoki, T. Interactions between dextran sulfate and Escherichia coli ribosomes. Biochim Biophys Acta. 145, 96-104 (1967).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14, 141-153 (2014).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nat Protoc. 2, 1998-2004 (2007).
- Schwitalla, S., et al. Loss of p53 in Enterocytes Generates an Inflammatory Microenvironment Enabling Invasion and Lymph Node Metastasis of Carcinogen-Induced Colorectal Tumors. Cancer Cell. 23, 93-106 (2013).
- Fiala, E. S. Investigations into the metabolism and mode of action of the colon carcinogens 1,2-dimethylhydrazine and azoxymethane. 40, 2436-2445 (1977).
- Chen, J., Huang, X. F. The signal pathways in azoxymethane-induced colon cancer and preventive implications. Cancer Biol Ther. 8, 1313-1317 (2009).
- Bollrath, J., et al. gp130-mediated Stat3 activation in enterocytes regulates cell survival and cell-cycle progression during colitis-associated tumorigenesis. Cancer Cell. 15, 91-102 (2009).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nat Protoc. 1, 2900-2904 (2006).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139, 485-498 (2009).
- Thiem, S., et al. mTORC1 inhibition restricts inflammation-associated gastrointestinal tumorigenesis in mice. J Clin Invest. 123, 767-781 (2013).
- Stuart, E., et al. Therapeutic inhibition of Jak activity inhibits progression of gastrointestinal tumors in mice. Mol Cancer Ther. 13, 468-474 (2014).
- De Robertis, M., et al. The AOM/DSS murine model for the study of colon carcinogenesis: From pathways to diagnosis and therapy studies. J Carcinog. 10, 9(2011).
- Viennois, E., Chen, F., Laroui, H., Baker, M. T., Merlin, D. Dextran sodium sulfate inhibits the activities of both polymerase and reverse transcriptase: lithium chloride purification, a rapid and efficient technique to purify RNA. BMC Res Notes. 6, 350(2013).
- Kerr, T. A., et al. Dextran sodium sulfate inhibition of real-time polymerase chain reaction amplification: a poly-A purification solution. Inflamm Bowel Dis. 18, 344-348 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados