Method Article
生きたマウスのシリアル内視鏡イメージングを使用して、腸の異常のための新しい治療の有効性の非侵襲的評価
要約
We describe methods for longitudinal monitoring of the efficacy of therapeutics for the treatment of colonic pathologies in mice using a rigid endoscope. This protocol can be readily used for the characterization of the therapeutic response of an individual tumor in live mice and also for monitoring potential disease relapse.
要約
Animal models of inflammatory bowel disease (IBD) and colorectal cancer (CRC) have provided significant insight into the cell intrinsic and extrinsic mechanisms that contribute to the onset and progression of intestinal diseases. The identification of new molecules that promote these pathologies has led to a flurry of activity focused on the development of potential new therapies to inhibit their function. As a result, various pre-clinical mouse models with an intact immune system and stromal microenvironment are now heavily used. Here we describe three experimental protocols to test the efficacy of new therapeutics in pre-clinical models of (1) acute mucosal damage, (2) chronic colitis and/or colitis-associated colon cancer, and (3) sporadic colorectal cancer. We also outline procedures for serial endoscopic examination that can be used to document the therapeutic response of an individual tumor and to monitor the health of individual mice. These protocols provide complementary experimental platforms to test the effectiveness of therapeutic compounds shown to be well tolerated by mice.
概要
大腸癌(CRC)は、世界中の悪性腫瘍1の4 番目の最も一般的な原因である。この疾患の家族の基礎の理解の重要な進歩にもかかわらず、遺伝的素因だけのCRCケース2の〜20%のに貢献しています。残りは、慢性炎症を含む多くの外因性および環境要因に起因する。ヒトでは、慢性炎症および結腸癌との間のリンクは、炎症性疾患3の期間に応じて、程度及び重症度、大腸炎関連大腸癌(CAC)を発症する危険性がより高い潰瘍性大腸炎(UC)患者において明らかである-5。したがって、新しい治療法は、免疫応答および炎症、腫瘍の微小環境6-8による成長促進因子の関連した生産を制御するために開発されている。の治療効力を特徴付けるための適切な前臨床動物モデルの増加要件は存在し疾患の発症および進行に対するこれらの薬剤。
マウスモデルは、明白に、炎症性微小環境でも明白な炎症9,10の非存在下で、CRCの進行に寄与することが実証されている。これらのモデルは、上皮損傷および急性および慢性炎症性腸疾患(IBD)11,12をモデル化するためのマウスの飲料水に設けられた多糖、デキストラン硫酸ナトリウム(DSS)の使用を含む。 DSSは、粘膜障害および大腸炎を誘導するメカニズムは完全には理解されていないが、いくつかの研究では、DSSは、細胞内で細胞の逆転写酵素とRNA分解酵素活性を阻害する、または損傷上皮に至る結腸膜と融合ナノ - 脂質複合体の形成を促進することを示唆している13,14。標準のDSSモデルへの変更は、また結腸上皮細胞は組織の恒常性とのRegu性を維持するメカニズムに重要な洞察を提供してきました後半粘膜免疫応答15。
アゾキシメタン(AOM)の腹腔内投与は、単独で、またはDSSとの組み合わせで、上皮粘膜および炎症および間質微小環境16,17に体細胞変異の間の相互作用を調べるためのモデルを提供します。 AOMは、直接DNA変異を生じない発癌物質1,2-ジメチルヒドラジン(DMH)の代謝産物である。その代わりに、AOMはMAMがグルクロン酸と抱合した後、胆汁の分泌物18を介して腸に搬送され、肝臓、シトクロムアイソフォームCYP2E1によって(MAM)methylazoxymethanolに加水分解される。これは、細菌のβグルクロニダーゼは、DNAアルキル化および上皮細胞19における変異の蓄積をもたらすMAMの分解に寄与すると考えられている。ほとんどのAOM誘発性結腸腫瘍はプロテアソームdegradatiに耐性タンパク質をレンダリングする、をコードする遺伝子βカテニンにおけるミスセンス変異を抱くカノニカルWntシグナル伝達経路20の異常な活性化、その結果、上に。 AOMの活性はDSSによって誘発粘膜損傷と組み合わせると、その後の創傷治癒応答は、成長と変異誘発された上皮の拡大を助長している微小環境を作成します。このモデルのバリエーションでは、数週間の期間にわたって単独でAOMの反復投与は、DSS誘導性大腸炎10,17の非存在下で、散発性結腸直腸癌をモデル化するために使用することができる。これらの2つの相補のモデルは、炎症促進性の腫瘍微小環境10に関連付けられてどちらもそれぞれCAC及び散発性CRCを研究するための実験的な設定を提供する。
マウスにおけるシリアル視鏡の使用は、ベッカーと同僚21によって開拓され、大腸炎および腫瘍進行の長手方向の監視を可能にした。ここでは、DSS誘導性粘膜損傷および/またはAOM媒介TUに基づいて3前臨床プロトコルを提供MOR誘導が再現可能に特定の結腸の病理を誘導する。第一のプロトコルは、IBDに関連した病理組織学的機能の多くを引き出すDSSの投与に応答して、急性粘膜損傷を誘発説明しています。第二のプロトコルは、一般にIBDの患者で観察炎症のフレアを模倣するためにDSS投与の3つの連続したサイクルに基づいており、AOM誘発性の変異と組み合わせて実施することができる。最終的なプロトコルはAOM誘発性散発上皮の変異に基づいています。これらのプロトコルのそれぞれに対して、我々は、新薬の有効性をモニターするために開発した予防的および治療的介入の方法を含む、関連する標準的な手順を拡張。
プロトコル
医学研究動物倫理委員会のウォルターとエリザ·ホール研究所は、これらのプロトコルに記載された手順のそれぞれを承認した。
実験マウスの作製
- 少なくとも4性別の実験的コホートを構成するには、飼育さと同じ特定の病原体を含まない(SPF)動物施設/部屋に収容し、オートクレーブ食料と水で提供されて6〜8週齢のC57BL / 6マウス( ハツカネズミ ) が一致した。雌マウスの使用は、異なる株からのマウスの共同住宅を可能にボックス番号を制限し、ケージにケージのばらつきを減少させる。
- そのマウスを確認し3.0ミリメートルの直径の内視鏡検査シースを使用して、内視鏡検査の手続きを可能にするために、年齢の少なくとも6週間である。
- 腸内細菌叢に関連した変動を低減するために、同じラックに格納されているケージから、同じ遺伝的背景のマウス、および可能な場合に使用します。動物施設との間の細菌叢の変動が考慮WHEに入れなければならないnは各実験22に対する適切な対照マウスと遺伝子型を決定する。
- 耳/つま先の切り抜き、タトゥー、または類似のことでマークマウスが簡単に識別できるようにする。
- ベースライン実験的な重みを決定するために、0日目にマウスを計量。
- 内視鏡検査を実行し、ベースライン結腸の表現型を記録するために、0日目にマウスの(第5節参照)。
上皮損傷と急性大腸炎モデル2.前臨床試験
- 治療剤の溶液を調製するテストされる。強制経口(PO)で配信治療のため、100μlに最大音量の解決策を準備する。腹腔内(IP)注射によって送達治療のために、200μlの最大音量の解決策を準備する。
注:長期間にわたって繰り返さipまたは経口薬剤投与は、変更されたマウスの動作が発生することができます。長期の不快感を避けるには、ip注射部位を交互に。経口投与のために、AUTOCをマウスに与える経管栄養の手順で不利な関連性を最小限にするために「御馳走」としてヒマワリの種をlaved。 - 1日目に、目的の治療(ステップ2.1で調製)と、適切な車両制御を管理する。 ( 図6A)提供される例では、組換えヒト5μgの(相対湿度)iInterleukin(IL)-11タンパク質を、200μlのリン酸緩衝生理食塩水(PBS)に溶解し、腹腔内投与した
- テストされている治 療薬のために確立された薬物動態プロファイルに依存するであろう、行政のタイミングと頻度を決定します。 図1は 、実験の過程で一日二回の腹腔内注射を使用して予防的治療の概要を説明します。
- 便の硬さと血液の存在を含め、監視し、毎日、各マウスの重量を量る。治療の日には、計量を繰り返し取り扱いによって引き起こされるマウスにストレスを最小限に抑えるために、治療薬の投与と一致する必要があります。
- 3日目に、2.5%(2.5グラム/ 100ミリリットル)日常動物施設によってマウスに提供飲料水中のDSS溶液を調製。約5ミリリットル/ DSS溶液のマウス/日の実験のために必要とされる。動物施設の環境温度が変動した場合にDSS水の消費量が変化してもよい。
注:DSSが刺激性で、MSDSの指示に従って処理する必要があります。 - 5連続日間きれいな水ボトルのマウスを自由に新鮮なDSSを提供します。 5日目の夜には、マッシュポテト食品ペレットと小さなペトリ皿(100グラムの食物ペレット/ 10グラムのプロテインシェイク/ 10ミリリットル水)に提供されるタンパク質のサプリメントに加えて、通常の飲料水を提供する。これは脱水を防ぎ、厳しい減量を最小限に抑えることを支援します。
- CO 2中毒によりマウスを安楽死させると8日目の朝に、その後の組織学的分析のための組織を収集し、またはマウスは以上3つのCのための≥15%の重量損失が発生した場合最初のいずれか早いonsecutive日、。
注:(w / v)の動物施設とDSSのバッチの微生物叢に応じて1から4パーセントの間でDSSの投与量を調整します。適切なDSSの投与量および回避バッチ間の変動を確立するために、ルーチンバッチ試験を行う。適切な投与量は、体重減少(元の重量の15%より大きくない)に基づいており、大腸組織病理を確認すべきである。
慢性大腸炎や大腸炎関連癌モデル3.前臨床試験
- 慢性大腸炎モデルの場合はステップ3.7から始める。
- 大腸炎関連癌(CAC)モデルの場合は、1日目に、10mg / kgの(w / w)のアゾキシメタン(AOM、250μL、腹腔内)で各マウスを注入する。
注:AOMは発がん性物質であるとMSDSの指示に従って処理する必要があります。 - AOMのストック溶液は、10mg / mlのアリコートとして調製し、-20℃で保存する。注射の日に、AOMのストック溶液を、1mg / mで解凍し、希釈するPBS中のL。 AOMストック溶液の凍結融解の繰り返しは避けるべきである。
- AOM用量は8-12 mg / kgを間に調整することができる。ルーチンバッチ試験は、バッチ間の変動によるマウスに毒性を回避するために、適切なAOM投与量を確立するために必要とされる。
- 1-7日間、AOM投与重みが安定する、以下、この理由のため、重量の監視は、その糞便中に細胞傷害性代謝産物を排出します処理動物を避けるために日1-7中に省略することができる。
- 7日目、すべての寝具は、細胞毒性の手順に従って変更する必要がある。寝具の変更が完了したら、彼らはもはや細胞傷害性代謝産物を排出されませんように、動物は、もはや、細胞毒性取り扱い手順を必要としません。
- 8日目に、2.5%(2.5グラム/ 100ml)で(ステップ2.5で説明したように)DSS溶液を調製し、マウスを自由に与える。
- 実験を通して毎日のマウスを計量し、病気の兆候を監視し、フリルFUを含むR、ハンチング、血便と縮小の動き。
- 13日目に、DSS溶液を除去し、28日8-28日まで通常の飲料水をマウスに与える慢性大腸炎/ CACプロトコルの1「サイクル」を構成している。
- 日13-28、にマウスを通常の飲用水が与えられたときに、マッシュ食品ペレットを有するマウス、小さなペトリ皿(100gの食物ペレット/ 10gのプロテインシェイク/水10ml)に設けられたタンパク質サプリメントを提供する。これは脱水を防ぎ、厳しい減量を最小限に抑えることを支援します。
注:マウスはDSS消費の一貫性を確保するために、DSSを含む飲料水を受信しているときマッシュ中のタンパク質サプリメントが提供されるべきではない。 - 20日目に(第5節参照)個々のマウスの健康状態を監視するために第二の内視鏡検査を行う。
- 日に29リピートDSSサイクル(サイクル2:2.5%(V)DSSデイズ34から50の間、日29-33、通常の飲料水の間に提供/ w)である。
- 40日目THIを行う個々のマウスの健康状態を監視し、腫瘍量を決定するための内視鏡検査をRD(セクション5を参照)。
- 全く腫瘍が40日内視鏡検査によって表示されていない場合は、日数50から72(2.5%(V)DSSデイズ56から72の間、日50-55、通常の飲料水の間に提供/ wのサイクル3)上の第三のDSSサイクルを開始。一般的に、腫瘍は40日目から見えるので、DSSの第3サイクルを省くことができる。
- 腫瘍は内視鏡検査によって目に見えるようになると、各マウスに内視鏡的腫瘍スコアを割り当てる( セクション5を参照)と同じようなベースラインの腫瘍負担とコホートに個々のマウスを割り当てる。
- 42日(または時腫瘍が見える)で、治療化合物または関連する車両制御を管理する(2.2節を参照してください)。投与量のタイミングは、治療薬の薬物動態プロファイルに依存するであろう。介入治療の例が提供され、確立された腫瘍( 図2)を有するマウスに週三回腹腔内注射。
- Eを実行します腫瘍負荷を監視するための治療処置の期間にわたって週1回ndoscopic試験。一般に、治療的処置の4週間客観治療反応を観察するのに十分である。治療の中止後に、マウスのコホートは、腫瘍の再発のために内視鏡検査によりモニターすることができる。
- CO 2中毒によるマウスを安楽死させるとマウスは以上の3日間連続≥15%の減量を経験するとき、または、いずれか早い方の日72日の朝、生化学的および/ または組織学的分析のために組織を集める。
散発性結腸直腸癌モデルにおける4.前臨床試験
- 1日目に、10mg / kgのAOM(ステップ3.2参照)で各マウスの腹腔内注入する。 AOM用量は8-12 mg / kgを間に調整することができる。ルーチンバッチ試験は、バッチ間の変動によるマウスに毒性を回避するために、適切なAOM投与量を確立するために必要とされる。
- 各週の最初の日に注射を繰り返します次の5週間( 図3)。マウスは、全体の6週間の細胞毒性安全手順に従って処理してください。
- 繰り返し処理によって引き起こされるマウスに苦痛を最小限にするためにAOM注射の日に、各マウスを計量。
注:AOMは発がん性物質であるとMSDSの指示に従って処理する必要があります。 - すべての動物は、このプロトコルに必要AOMの腹腔内注射の6週間の細胞毒性安全手順に従って処理してください。
- 週8中、新興の腫瘍のために監視するために内視鏡検査を行う(第5節参照)。腫瘍が見えるようになるまで、内視鏡検査では隔週行われるべきである。一般的に、野生型C57BL / 6動物はAOMの最初の投与後、約40週間までに腫瘍の開発を始める。
- 腫瘍は内視鏡検査によって目に見えるようになると、各マウスに内視鏡的腫瘍スコアを割り当てる(セクション5を参照)と類似したとのコホートへの個々のマウスを割り当て治療的処置の開始前に腫瘍の負担。
- 週40(または時腫瘍が最初に表示されている)の間に、治療化合物または関連する車両制御を管理する。
- 投与量のタイミングは、治療の薬物動態プロファイルに依存することになる(ステップ2.1参照)。介入治療の例が提供され、確立された腫瘍( 図3)を有するマウスに週3回腹腔内注射。
- 腫瘍負荷を監視するための治療の治療期間の間、内視鏡検査を毎週実行します。一般に、治療的処置の4週間客観治療反応のために十分である。治療中止後、マウスのコホートは、腫瘍再発のための内視鏡検査によりモニターすることができる。
- CO 2中毒によりマウスを安楽死させると週45の間、生化学的および/ またはコロンと腫瘍の組織学的分析のための組織を収集し、または治療の4週間後。
- 内視鏡検査機器は、標準的な手順16に従って実装してください。
- 70%エタノールまたは抗細菌性潤滑剤を内視鏡プローブを滅菌し、きれい。
- ビデオは、iMovieのように、ラップトップまたはデスクトップコンピュータおよび標準メディアソフトウェアを使用して記録することができる。標準的なコンピュータのモニタではなく、医療グレードのモニター、内視鏡検査手順( 図4)の間にコロンを可視化するのに十分である。
- 0.2 L /分の速度で同時に100%O 2中の3%イソフルランを有するチャンバ内に5~6匹のマウスの群を麻酔。マウスは、つま先のピンチによって確認され、麻酔をかけた後、イソフルランレベルはメンテナンスのために0.5から2パーセントに変更する必要があります。
- チャンバーから個々のマウスを外し、鼻コーンに固定その頭でそれ腹側を上に配置します。全身麻酔は、監視されるべきであり、それらが複数あるように後ろ足を調整すべきであるマウスの後ろに出tretched。
- 乾燥を防ぐために、マウスの眼に獣医軟膏を置きます。
- それは明らかに肛門を明らかにするために下部脊椎を満たしているマウスの尾を持ってください。水のビーカーに硬性内視鏡シースを挿入し、一度に一つの小さな気泡の放出を可能にするために空気の流れを調整します。
- 空気の流れは、コロンが膨張するように許可されます。気流が強すぎると、空気は、マウスの胃にポンピングされる。追加給油は必要ありません。
- 慎重に直腸内に硬性内視鏡シースを挿入します。一般的に、内視鏡は、マウス曲線にコロンをその時点で3センチ、まで挿入し、硬性内視鏡にアクセスすることはできませんすることができます。
- 内視鏡検査手順の間に一般的な難しさが原因糞便に大腸の内腔へのアクセスの遮断である。優しく排便を奨励する前に手順にマウスの腹のマッサージ、または慎重にFECA周り内視鏡を操作することで、これを避ける手順中のL状物質。蠕動は、大腸の筋肉組織が弛緩するまで内視鏡を位置に保持されるべき時に、も発生することがあります。
- 内視鏡検査手順の任意の段階で録画を開始する。疾患スコアは、処置中に経験豊富なアシスタントによって記録、またはビデオファイルから、後の時点ですることができる。
- 内視鏡検査の後、彼らのケージにマウスを返し、麻酔からの回復中にそれらを監視。動物は、イソフルランを投与ノーズコーンから除去した後2分以内に、一般的に目を覚まし、モバイルである。
- これらの手順は、経験豊富な科学者によって行われていることを確認します。各内視鏡検査の手順は、マウス当たり約2分かかります。
6.病スコアリング
- (i)の変化を文書大腸炎重症度のマウス内視鏡指数(MEICS)16、透明性によって示される結腸壁の厚さのためにビデオをスコア、大腸炎を監視するには(ii)の便の硬さ、(iii)は、血管の完全性とが存在することを、粒状形で存在するが、(v)のフィブリン沈着( 図5a)で示さ出血こと再生の(iv)の潰瘍および領域。
- 腫瘍負荷を監視するには、腫瘍の発生率とサイズのビデオをスコア。腫瘍サイズは、腫瘍16( 図5b)によって占有結腸内腔の直径によって決定される。これは、単一のマウス用炎および腫瘍の両方のスコアリングパラメータを使用することが一般的である。内視鏡検査、個々の腫瘍および結腸粘膜の健康を使用すると、単一の動物において新しい治療の成功のための読み出しを提供し、経時的にモニターすることができる。
- (オプションの)静止画像が代表図形( 図6)を生成するためにビデオから抽出することができる。
結果
体重減少は、日常的に、マウスの全体的な健康状態を監視するために使用される大腸炎に関連する疾患をモニターするために、標準的なパラメータとして使用される。動物は、一般的には、DSS含有水が投与されている間、自分の体重を維持し、唯一のそれらは通常の飲料水に戻されたときに緩い重量に開始します。許容重量損失のパラメータは、金融機関の動物倫理委員会に合わせて確立されるべきである。長期の下痢に関連付けられた脱水を防ぐために、通常の飲料水に加えて、プロテインシェイクを補充したマッシュのルーチン提供を(食物ペレットがマッシュポテトや飲料水と混合)を使用する。
代替麻酔、ケタミン/キシラジンまたは類似の薬剤などのイソフルラン機器が利用できない場合に、使用することができる。による内視鏡の剛性の性質のために、これらの手順は、マウス結腸の最も遠位3cmの可視化を可能にする。との新しい内視鏡 (柔軟性と蛍光を含む)の追加機能は、実験の必要性に応じてご利用いただけます。 DSSの有害な影響は、主に中央結腸において観察され、より穏やかな病理を有するマウスの遠位結腸に限定されているので、硬性内視鏡は、個々のマウスの粘膜の健康のモニタリングを妨げない。我々は、急性DSS誘発大腸炎の予防的処置のためのプロトコルを説明しているが、このプロトコルは、容易に介入治療戦略をテストするために改変することができる。上皮損傷および大腸炎を軽減するために設計された薬剤の有効性は、個々のマウスにおいて、縦方向に監視され( 図5)に記載のスコアリングパラメータに基づいて定量することができる。これは、実験プロトコルの間、特定の時点でマウスの殺処分を必要とする伝統的な実験デザインよりも有利であり、経時治療に対する疾病の応答の特徴付けを可能にしない。
トン ">ヒトでの臨床試験では、個々の患者に治療に応答する方法の異なる腫瘍においてかなりの変動性を強調している。ここで説明する手順は、全体的な腫瘍量、ならびににわたって個々の腫瘍の治療応答をモニターする手段を提供する実験の。それは、癌モデルについて概説されている介入プロトコルは考慮に腫瘍の開始に対する治療の影響を取ることはありませんことを考慮することが重要である。予防的なプロトコル、事前の腫瘍は内視鏡検査によって可視になったときに提供される治療で、この情報を得るために必要とされる。ここで説明するプロトコルは、進行に対する治療効果についての情報を提供する個々の腫瘍(腫瘍サイズで測定)。腫瘍退縮も見える腫瘍の数の減少によって示され得る。グラム "/>
図1:急性大腸損傷のモデルでは予防的治療療法の有効性を監視(a)の実験プロトコルは、開始から完了まで8日間が必要です。治療薬は、予防的治療のために1日目から(b)に投与される。 DSSは、実験プロトコルの3日目から飲料水を(c)に設けられている。内視鏡検査は、動物における疾患の進行をモニターするために(d)を実施する。推奨の時点では、5日目と8(疾病負担を決定するために)0日目(未処理)と2日目(ヘルスモニタリング)などがあります。実験は、野生型マウスでは8日目の朝(f)の経時的な疾患の増加の進行(e)を終了する。
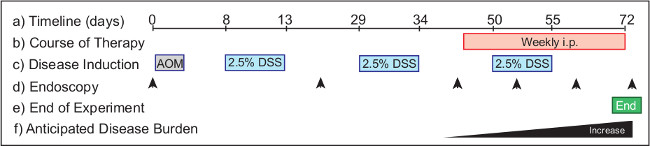
図2:モデルOに介入療法の有効性を監視するF大腸炎関連癌は。実験プロトコル(A)は、スタートから完成まで72日を要する。 (b)は、治療薬は、介入治療のために46日目から確立された腫瘍を有するマウスに投与される。 AOM(c)は 1日目に注入され、DSSは、内視鏡検査(d)は 、動物における疾患の進行を監視するために実行される8日目に開始し、実験プロトコルの3つのサイクルにわたって飲料水に設けられている。推奨の時点では(腫瘍量に応じた群の動物に)0日目(未処理)、20日(ヘルスモニタリング)、および40日目を含む。内視鏡検査は、疾患の転帰を監視するために治療的処置の過程にわたって毎週実施される。実験(e)は、以降40日目から増加し、野生型マウス(f)は 、腫瘍負荷において72日目の朝に終了される。

図3:自発的な大腸癌のモデルに介入療法の有効性をモニタリングする実験プロトコルは(a)の開始から完了まで> 50週間が必要です。 (b)は、治療薬は、介入の治療のための確立された腫瘍を有するマウスに投与される。 AOM(c)は、実験プロトコルの経過にわたって毎週、その後6つの連続した注射のための1日目に注入している。内視鏡検査(d)は、動物における疾患の進行をモニターするために行われる。推奨の時点では、隔週そこ(腫瘍量を確立するために)の後に0日目(未処理)および8週目(腫瘍監視)とが含まれる。内視鏡検査は、治療の結果をモニターするため、治療の過程にわたって毎週実施される。実験(e)は、以降の週40から増加する野生型マウス(f)は 、腫瘍負荷において50週で終了した。 P>

図4:機器のセットアップ装置の個々の部分と、内視鏡装置用の実験装置は、(a)は 、示された。個々のコンポーネントとの硬性内視鏡(b)は 、示された。スケールバー= 2.5 cmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
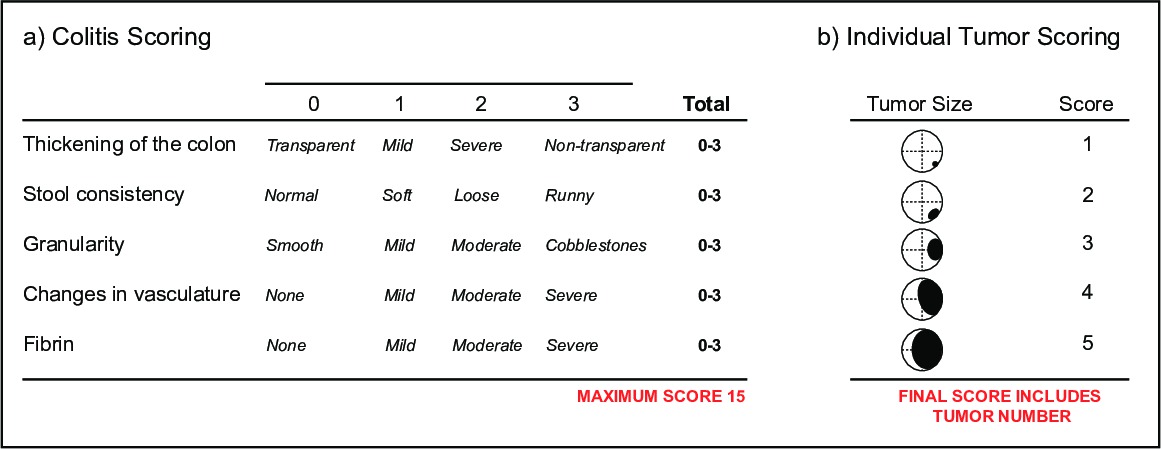
図5:内視鏡検査によるスコアリング病パラメータ大腸炎重症度のマウス内視鏡指数(MEICS)の概要(a)に。。個々の腫瘍のスコアリングパラメータの概要(b)にES / ftp_upload / 52383 / 52383fig5highres.jpg「ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
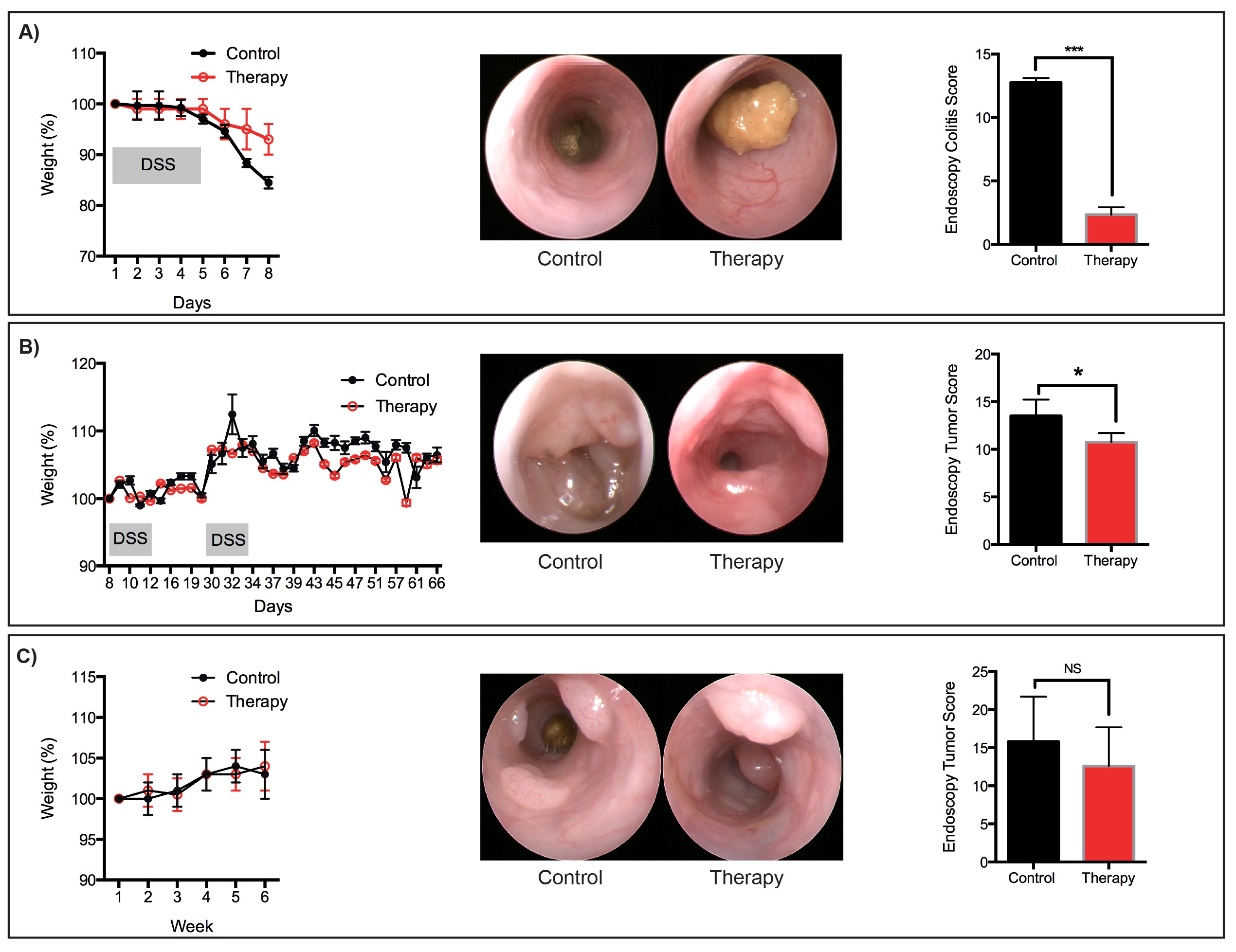
図6:代表治療的処置のための代表的な減量、内視鏡画像とスコア:。。。シーケンシャル以下の開発(A)急性DSS誘発粘膜損傷AOM / DSSプロトコルに従って開発された(b)の腫瘍(C)腫瘍AOMプロトコル。群当たりN = 3匹のマウス。 * P <0.05、*** P <0.001(スチューデントのt検定)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
マウスでの大腸疾患病理の信頼性と再現性誘導の概略の方法を説明している3つのプロトコル。ルーチン内視鏡監視とここで概説介入戦略と組み合わせることで、これらのプロトコルは、治療薬の有効性への強力な前臨床洞察を提供します。私たちの研究室は、定期的に新規治療薬10,23,24の成功を監視するために、これらのプロトコルのすべてを使用する。
新しい治療法を試験するための前臨床動物モデルを選択する考慮事項が数多くあります。これらは、ヒト疾患のモデルの妥当性、および治療標的の提案アクションに腫瘍微小環境の寄与を含む。ここでは、確立された腸疾患モデルにおける治療的介入のための3つのプロトコルを提供する。これらのモデルは、再現可能であり、疾患を誘発する試薬の配信は、管理が容易である。重要なことは、モデルは非常に関連しています複数のファセットと大腸炎の発症、および腫瘍の開始と進行のステージに。 DSSおよび/ またはAOMにより誘発される疾患に対する感受性はかなり25を変化させることができるように研究者は、考慮した実験を設計する際に使用されるマウス系統の遺伝的背景を取る必要があります。さらに、異なる微生物群集は細菌によって代謝されるAOMの文脈において異なる代謝能力を有することができる。私たちは、単一の実験で(商用ベンダーを含む)を別の動物施設に生まれたマウスの異なるコホートを使用しないことを警告する。同様に、異なる施設から使用したマウスの異なる微生物叢は、上皮バリアの損傷11誘発性をDSSに、異なる宿主応答を誘発し得る。逆転写酵素を阻害するDSSの能力は、その後の分子解析26,27に影響するので、(例えば、RNA精製の ための)組織の適切な分析もまた、考慮されるべきである。
マウスの内視鏡検査を繰り返し、個々のマウスにおける疾患の発症および進行を監視するための最先端の技術である。ビデオを録画や静止画を抽出する能力は、複数の疾患パラメータおよび腫瘍の監視を簡単に行うことが可能。動物福祉を改善することに加えて、内視鏡監視はまた、伝統的に疾患の転帰を追跡するために異なる時点で殺処分された実験用マウスの複数のコホートの必要性を低減する。 MEICSスコアリングシステムは、病理組織学的分析に代わるものではありませんが、代替が生きたマウスでの動物の健康および粘膜損傷を監視する手段を提供する。マウスの内視鏡検査は、専門の研究室の技術であり、すべての手順は、マウスの適切な操作と取り扱いを確保するため、ならびに疾患のスコアリングに使用される画像で一貫した品質を提供するために訓練を受けた担当者が行ってください。資格のある個人の手では、内視鏡検査はtumoにほとんど、あるいは全く損傷を誘導することを見出した腫瘍内出血を引き起こすRS。それは初期の腫瘍負荷を決定する手段を提供し、治療薬の投与前に類似した腫瘍の負担と動物群のコホートに私たちを可能にするので概要を治療プロトコルのために、我々は、内視鏡検査は非常に有利考える。マウスの連続監視がタイムリーに失敗した実験を終了させるオプションを指定して、早い段階で新しい治療法の有効性を決定するために、研究者を可能にします。
炎症性腸疾患および結腸直腸癌の進行についての理解として、治療のための新たな標的が同定される。適切な動物モデルは、最も有望な新しい治療法が臨床試験に向けて移動されることを確実に不可欠であろう。
開示事項
The authors have nothing to disclose.
謝辞
We would like to thank CSL Ltd. for supporting the purchase of the endoscopy equipment. The research in the laboratory of ME is supported by the Ludwig Institute for Cancer Research, and the laboratories of TP and ME are supported by the Victorian State Government Operational Infrastructure Support and the National Health and Medical Research Council of Australia. ME is an NHMRC Senior Research Fellow.
資料
| Name | Company | Catalog Number | Comments |
| Dextran sulfate sodium (MW 36,000-50,000) | MP Biochemicals | 160110 | Requires batch testing. |
| Azoxymethane | Sigma | A5486-100MG | Requires batch testing. |
| Vanilla protein shake | N/A | N/A | Available from hospital pharmacies. |
| Isoflurane | PPC | M60303 | This is a restricted reagent, which should be stored under lock and key. |
| 70% ethanol | N/A | N/A | Standard lab reagent. |
| Coloview miniendoscopic system | |||
| Endovision Tricam | Karl Storz | 20212001-020 | |
| Xenon 175 light source with anti-fog pump | Karl Storz | 20134001 | |
| HOPKINS straight Forward Telescope | Karl Storz | 64301AA | |
| Endoscopic sheath (total diameter 3 mm) | Kalr Stroz | 61029C | |
| Fiber optic light cable | Kalr Stroz | 69495ND | |
| Computer and media player software | Apple | iMovie | |
| Scale | Any | Any scale suitable for weighing mice. |
参考文献
- Tenesa, A., Dunlop, M. G. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat Rev Genet. 10, 353-358 (2009).
- Rustgi, A. K. The genetics of hereditary colon cancer. Genes Dev. 21, 2525-2538 (2007).
- Rutter, M., et al. Severity of inflammation is a risk factor for colorectal neoplasia in ulcerative colitis. Gastroenterology. 126, 451-459 (2004).
- Eaden, J. A., Abrams, K. R., Mayberry, J. F. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 48, 526-535 (2001).
- Lakatos, P. L., Lakatos, L. Risk for colorectal cancer in ulcerative colitis: changes, causes and management strategies. World J Gastroenterol. 14, 3937-3947 (2008).
- Xiang, B., Snook, A. E., Magee, M. S., Waldman, S. A. Colorectal cancer immunotherapy. Discov Med. 15, 301-308 (2013).
- Feng, Q. Y., et al. Anti-EGFR and anti-VEGF agents: Important targeted therapies of colorectal liver metastases. World J Gastroenterol. 20, 4263-4275 (2014).
- Dinarello, C. A. Anti-inflammatory Agents: Present and Future. Cell. 140, 935-950 (2010).
- Grivennikov, S. I., et al. Adenoma-linked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth. Nature. 491, 254-258 (2012).
- Putoczki, T., Thiem, S., Loving, A., Busuttil, R. A., Wilson, N. A., Ziegler, P., Nguyen, P., Preaudet, A., Farid, R., Edwards, K., Boglev, Y., Luwor, R. B., Jarnicki, A. J., Horst, D., Boussioutas, A., Heath, J., Sieber, O., Nash, A., Greten, F., McKenzie, B. S., Ernst, M. Interleukin-11 is the dominant IL-6 family cytokine during gastrointestinal tumorigenesis and can be targeted therapeutically. Cancer Cell. 24, 257-271 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. J Biomed Biotechnol. 2012, 718617 (2012).
- Rose, W. A., Sakamoto, K., Leifer, C. A. Multifunctional role of dextran sulfate sodium for in vivo modeling of intestinal diseases. BMC Immunol. 13, 41 (2012).
- Laroui, H., et al. Dextran sodium sulfate (DSS) induces colitis in mice by forming nano-lipocomplexes with medium-chain-length fatty acids in the colon. PLoS One. 7, e32084 (2012).
- Miyazawa, F., Olijnyk, O. R., Tilley, C. J., Tamaoki, T. Interactions between dextran sulfate and Escherichia coli ribosomes. Biochim Biophys Acta. 145, 96-104 (1967).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14, 141-153 (2014).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nat Protoc. 2, 1998-2004 (2007).
- Schwitalla, S., et al. Loss of p53 in Enterocytes Generates an Inflammatory Microenvironment Enabling Invasion and Lymph Node Metastasis of Carcinogen-Induced Colorectal Tumors. Cancer Cell. 23, 93-106 (2013).
- Fiala, E. S. Investigations into the metabolism and mode of action of the colon carcinogens 1,2-dimethylhydrazine and azoxymethane. 40, 2436-2445 (1977).
- Chen, J., Huang, X. F. The signal pathways in azoxymethane-induced colon cancer and preventive implications. Cancer Biol Ther. 8, 1313-1317 (2009).
- Bollrath, J., et al. gp130-mediated Stat3 activation in enterocytes regulates cell survival and cell-cycle progression during colitis-associated tumorigenesis. Cancer Cell. 15, 91-102 (2009).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nat Protoc. 1, 2900-2904 (2006).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139, 485-498 (2009).
- Thiem, S., et al. mTORC1 inhibition restricts inflammation-associated gastrointestinal tumorigenesis in mice. J Clin Invest. 123, 767-781 (2013).
- Stuart, E., et al. Therapeutic inhibition of Jak activity inhibits progression of gastrointestinal tumors in mice. Mol Cancer Ther. 13, 468-474 (2014).
- De Robertis, M., et al. The AOM/DSS murine model for the study of colon carcinogenesis: From pathways to diagnosis and therapy studies. J Carcinog. 10, 9 (2011).
- Viennois, E., Chen, F., Laroui, H., Baker, M. T., Merlin, D. Dextran sodium sulfate inhibits the activities of both polymerase and reverse transcriptase: lithium chloride purification, a rapid and efficient technique to purify RNA. BMC Res Notes. 6, 350 (2013).
- Kerr, T. A., et al. Dextran sodium sulfate inhibition of real-time polymerase chain reaction amplification: a poly-A purification solution. Inflamm Bowel Dis. 18, 344-348 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved