Method Article
Avaliação não invasiva da eficácia de novos Therapeutics para Intestinal Patologias Usando imagem endoscópica série da Vivo Ratos
Neste Artigo
Resumo
We describe methods for longitudinal monitoring of the efficacy of therapeutics for the treatment of colonic pathologies in mice using a rigid endoscope. This protocol can be readily used for the characterization of the therapeutic response of an individual tumor in live mice and also for monitoring potential disease relapse.
Resumo
Animal models of inflammatory bowel disease (IBD) and colorectal cancer (CRC) have provided significant insight into the cell intrinsic and extrinsic mechanisms that contribute to the onset and progression of intestinal diseases. The identification of new molecules that promote these pathologies has led to a flurry of activity focused on the development of potential new therapies to inhibit their function. As a result, various pre-clinical mouse models with an intact immune system and stromal microenvironment are now heavily used. Here we describe three experimental protocols to test the efficacy of new therapeutics in pre-clinical models of (1) acute mucosal damage, (2) chronic colitis and/or colitis-associated colon cancer, and (3) sporadic colorectal cancer. We also outline procedures for serial endoscopic examination that can be used to document the therapeutic response of an individual tumor and to monitor the health of individual mice. These protocols provide complementary experimental platforms to test the effectiveness of therapeutic compounds shown to be well tolerated by mice.
Introdução
O câncer colorretal (CCR) é a 4ª causa mais comum de tumor maligno em todo o mundo 1. Apesar dos progressos significativos em nossa compreensão da base familiar desta doença, a predisposição genética contribui apenas para ~ 20% dos casos 2 CRC. O restante é atribuído a vários fatores extrínsecos e ambientais, incluindo a inflamação crônica. Nos seres humanos, a ligação entre a inflamação crónica e o cancro do cólon é evidente em colite ulcerosa (UC) pacientes, que têm um maior risco de desenvolvimento de cancro do cólon associada à colite (CAC), dependendo da duração, amplitude e da gravidade da doença inflamatória 3 -5. Consequentemente, novas terapias estão em desenvolvimento para controlar a resposta imunitária e a produção de factores de crescimento associados factores pelo microambiente tumoral inflamatório 6-8. Existe uma exigência crescente de modelos animais pré-clínicos apropriados para caracterizar a eficácia terapêutica deestas drogas contra o desenvolvimento e progressão da doença.
Modelos de ratos têm inequivocamente demonstrado que o microambiente inflamatório contribui para a progressão da CRC, mesmo na ausência de inflamação evidente 9,10. Estes modelos incluem a utilização do sulfato de sódio polissacárido dextrano (DSS), fornecido na água de beber dos ratos, para modelar lesão epitelial e doença intestinal inflamatória aguda e crónica (IBD) 11,12. Embora o mecanismo pelo qual DSS induz lesão da mucosa e colite não é completamente compreendido, alguns estudos sugerem que o DSS inibe as actividades de transcriptase reversa e de ribonuclease celulares no interior das células, ou promove a formação de complexos de nano-lipídico que se fundem com a membrana epitelial do cólon levando a danos 13,14. Modificações ao modelo DSS padrão também forneceram uma visão significativa sobre os mecanismos pelos quais as células epiteliais do cólon manter a homeostase do tecido e regularidadetarde respostas imunes nas mucosas 15.
A administração intraperitoneal de Azoximetano (OMA) sozinho, ou em combinação com DSS, fornece um modelo para a análise da interacção entre as mutações somáticas na mucosa epitelial e estromal no microambiente inflamatório e 16,17. OMA é um metabólito da substância cancerígena 1,2-dimetil-hidrazina (DMH), que não resultam diretamente em mutações no DNA. Em vez disso, a AOM é hidrolisado para methylazoxymethanol (MAM) pela isoforma do citocromo CYP2E1 no fígado, onde MAM é conjugado com o ácido glucorónico e, em seguida, transportados para o intestino através de secreções biliares 18. Pensa-se que o β-glucuronidase bacteriana contribui para a degradação do MAM resultando na alquilação de DNA e a acumulação de mutações em células epiteliais 19. A maioria dos tumores do cólon induzida por AOM abrigar mutações missense no gene que codifica a β-catenina, tornando a proteína resistente a degradação de proteossomono, o que resulta na activação aberrante da canónica via de sinalização Wnt-20. Quando a atividade da OMA é combinada com a lesão da mucosa provocada por DSS, a ferida que se seguiu a resposta de cura cria um microambiente que é propício para o crescimento e expansão do epitélio mutado. Numa variação deste modelo, a administração repetitiva de OMA sozinho ao longo de um período de várias semanas pode ser usado para modelar o cancro colorectal esporádica, na ausência de colite induzida por DSS 10,17. Estes dois modelos de cortesia fornecer configurações experimentais para estudar as CAC e esporádica CRC, respectivamente, ambas as quais estão associadas com um microambiente tumoral pró-inflamatória 10.
O uso de endoscopia de série em camundongos foi iniciada por Becker e seus colegas 21, e permite o monitoramento longitudinal da colite e progressão tumoral. Aqui nós fornecemos três protocolos pré-clínicos com base em danos na mucosa induzida por DSS e / ou mediada por AOM tumor indução para induzir reproducibly patologias do cólon específicos. O primeiro protocolo descreve induzir danos na mucosa aguda em resposta à administração de DSS para induzir muitas das características histológicas associadas com IBD. O segundo protocolo baseia-se em três ciclos consecutivos de administração DSS para simular as chamas de inflamação normalmente observadas em doentes de IBD, e pode ser levada a cabo em conjunção com mutações induzidas por AOM. O protocolo final é baseado em mutações esporádicas epiteliais induzida pela OMA. Para cada um destes protocolos, vamos expandir sobre os procedimentos padrões relevantes a incluir métodos de intervenção profiláticas e terapêuticas que temos desenvolvido para monitorar a eficácia de novos medicamentos.
Protocolo
O Institute of Medical Research comissão ética animal Walter e Eliza Salão aprovado cada um dos procedimentos descritos nestes protocolos.
1. Preparação de Experimental Ratos
- Componha coortes experimentais de pelo menos 4 sexo do 6-8 semanas de idade camundongos C57BL / 6 (M. musculus) que são criados e mantidos no mesmo patógeno específico livre (SPF) facilidade animal / quarto e fornecidos com alimentos e água autoclavada. A utilização de ratinhos fêmea irá permitir a co-habitação de ratos a partir de diferentes linhas, número de caixa de limite, e reduzir a variação gaiola para gaiola.
- Certifique-se de que os ratos são pelo menos 6 semanas da idade para permitir procedimentos de endoscopia usando a 3,0 milímetros de diâmetro endoscopia bainha.
- Use ratinhos do mesmo fundo genético, e sempre que possível, a partir de gaiolas armazenados na mesma prateleira para reduzir as variações associadas com a microflora intestinal. Variações na microflora entre instalações para animais deve ser tomado em consideração when determinar os ratos e genótipos de controlo adequadas para cada experimento 22.
- Mark camundongos por recortes de ouvido / dedo do pé, tatuagens, ou similares para permitir a fácil identificação.
- Pese ratinhos no dia 0, para determinar pesos de base experimental.
- Realizar endoscopia (ver Seção 5) de ratos no dia 0 para gravar fenótipos colônicas basais.
2. Julgamento pré-clínicos em um dano epitelial e aguda Colite Modelo
- Prepara-se uma solução do agente terapêutico a ser testado. Para terapêutica entregues por sonda oral (po), preparar soluções para um volume máximo de 100 mL. Para terapêutica entregues por (ip) injecção intraperitoneal, preparar soluções para um volume máximo de 200 mL.
NOTA: repetida ip ou po administração da droga por períodos prolongados de tempo pode resultar em alteração de comportamento mouse. Alternar o local da injecção ip para evitar desconforto prolongado. Para a administração po, fornecer os camundongos com autocsementes de girassol laved como um 'mimo' para minimizar a associação negativa com o procedimento gavage. - No Dia 1, administrar o agente terapêutico de interesse (preparado no passo 2.1) e veículos de controlo apropriados. No exemplo fornecido (Figura 6A), 5 ug de humano recombinante (rh) iInterleukin (IL) -11 proteína foi dissolvido em 200 ul de tampão fosfato salino (PBS) e administrado ip
- Determine o tempo e frequência das administrações, que será dependente da perfil farmacocinético estabelecido para o reagente terapêutico que está sendo testado. A Figura 1 delineia o tratamento profilático com injecções ip duas vezes ao dia ao longo do curso do experimento.
- Monitorar, incluindo a consistência das fezes e da presença de sangue, e pesar cada rato diariamente. Nos dias de tratamento, a pesagem deve coincidir com a administração do fármaco terapêutico para minimizar o stress aos ratinhos por manuseamento repetido.
- No Dia 3, preparar 2,5% (2,5 g / 100 ml) solução de DSS na água potável rotineiramente fornecida aos ratinhos pela instalação para animais. Cerca de 5 ml / rato / dia de solução DSS é necessário para o experimento. O consumo da água DSS podem alterar-se a temperatura ambiente da instalação para animais flutua.
NOTA: DSS é um agente irritante e devem ser tratados de acordo com as instruções FDSM. - Fornecer DSS fresco para o ad libitum camundongos em garrafas de água potável para 5 dias contínuos. Na noite do dia 5, fornecer água potável normal, além de pelotas de alimentos purê e um suplemento de proteína fornecida em pequenas placas de Petri (100 g pelotas de alimentos / 10 g shake de proteína / 10 ml de água). Isso evita a desidratação e ajuda com a minimização de perda de peso grave.
- Eutanásia camundongos por CO 2 intoxicação e coletar tecidos para posterior análise histológica, na manhã do dia 8, ou quando os ratos experimentar a perda de peso ≥15% por mais de três consecutive dias, o que ocorrer primeiro.
NOTA: Ajustar a dose DSS entre 1-4% (w / v) dependendo da microflora da instalação para animais e o lote de DSS. Realizar, testes em lotes de rotina para determinar a dosagem apropriada DSS e contornar variação de lote para lote. A dosagem apropriada deve ser baseada na perda de peso (não superior a 15% do peso original) e histopatologia confirmou colite.
3. Teste pré-clínica numa colite crónica ou cancro do Modelo-colite associada
- Para o modelo de colite crônica começam a partir do passo 3.7.
- Para o modelo de cancro associado a colite (CAC), no dia 1, cada rato com injectar 10 mg / kg (w / w) Azoximetano (AOM, 250 ul, ip).
NOTA: OMA é uma substância cancerígena e devem ser tratados de acordo com as instruções FDSM. - As soluções de reserva são preparadas como AOM a 10 mg / ml e alíquotas armazenadas a -20 ° C. No dia da injecção, a solução estoque AOM é descongelado e diluído para 1 mg / ml em PBS. Congelamento e descongelamento da solução estoque OMA repetida deve ser evitada.
- A dose AOM pode ser ajustado entre 8-12 mg / kg. São necessários ensaios lote de rotina para estabelecer a dosagem AOM apropriado a fim de contornar a toxicidade para camundongos, devido a variação de lote para lote.
- Durante os dias 07/01 seguinte pesos administração AOM será estável e por esta razão a monitorização do peso pode ser omitido durante Dias 1-7 para evitar manipulação de animais que excretam metabólitos citotóxicos em suas fezes.
- No dia 7 de roupa de cama precisa ser mudado de acordo com procedimentos citotóxicos. Uma vez que a mudança de roupa de cama é completa, os animais já não necessitam de procedimentos de manuseio citotóxicos, como eles não serão mais excretando metabolitos citotóxicos.
- No Dia 8, preparar 2,5% (2,5 g / 100 ml) solução de DSS (tal como descrito no passo 2.5) e fornecer para o ad libitum ratinhos.
- Pesar ratos diariamente durante todo o experimento e monitorar os sinais de doença, incluindo fu babadosr, curvando, fezes com sangue e movimento reduzido.
- No dia 13, remover a solução DSS e fornecer os ratos com água potável normal até o dia 28. Dias 28/08 constituem um "ciclo" do protocolo colite / CAC crônica.
- Nos dias 13-28, quando os ratos recebem água potável normal, fornecer os ratos com pelotas de alimentos purê e um suplemento de proteína fornecida em pequenas placas de Petri (100 g grãos de ração / 10 g de proteína de agitação / 10 ml de água). Isso evita a desidratação e ajuda com a minimização de perda de peso grave.
NOTA: Os suplementos de proteína em puré não deve ser fornecida quando os ratos estão recebendo DSS contendo água potável, a fim de garantir a consistência no consumo DSS. - No dia 20 a realização do segundo exame endoscópico para monitorar a saúde individual do rato (ver item 5).
- No dia 29 de repetir o ciclo DSS (Ciclo 2: 2,5% (w / v) DSS oferecido durante Dias 29-33 e água potável normal durante 34-50 dias).
- No dia 40 realizar o thiEterno endoscopia para monitorar de saúde individual do mouse e determinar carga tumoral (veja seção 5).
- Se não há tumores são visíveis por endoscopia no dia 40, começa um terceiro ciclo DSS nos dias 50-72 (Ciclo 3: 2,5% (w / v) DSS oferecido durante Dias 50-55 e água potável normal durante 56-72 dias). Em geral, os tumores são visíveis por Dia 40 e, por conseguinte, o terceiro ciclo de DSS podem ser omitidos.
- Uma vez que os tumores se tornam visíveis por exame endoscópico, atribua a cada rato um score tumor endoscópica (ver item 5) e atribuir camundongos individuais para coortes com encargos semelhantes tumores basais.
- No dia 42 (ou quando os tumores são visíveis), administrar o composto terapêutico ou o controle do veículo relevante (ver secção 2.2). A calendarização das doses será dependente do perfil farmacocinético da terapêutica. Um exemplo de um tratamento de intervenção injectados ip três vezes por semana em ratinhos com tumores estabelecidos é fornecida (Figura 2).
- Execute eexames ndoscopic uma vez por semana durante a duração do tratamento terapêutico para monitorar a carga tumoral. Geralmente, 4 semanas de um tratamento terapêutico é suficiente para observar uma resposta objetiva tratamento. Após a cessação do tratamento, um grupo de ratinhos pode também ser monitorizada por endoscopia de recidiva tumoral.
- Eutanásia camundongos por CO 2 intoxicação e coletar tecidos para análise bioquímica e / ou histológica na manhã do dia 72 ou quando os ratos experimentar a perda de peso ≥15% por mais de três dias consecutivos, o que ocorrer primeiro.
4. Julgamento pré-clínica em uma Cancro colorretal esporádico
- No dia 1, injetar cada ip rato com 10 mg / kg AOM (veja o passo 3.2). A dose AOM pode ser ajustado entre 8-12 mg / kg. São necessários ensaios lote de rotina para estabelecer a dosagem AOM apropriado a fim de contornar a toxicidade para camundongos, devido a variação de lote para lote.
- Repetir a injecção no primeiro dia de cada semanapara as cinco semanas seguintes (Figura 3). Os ratinhos devem ser tratados de acordo com os procedimentos de segurança citotóxicos para toda a 6 semanas.
- Pesar cada rato no dia da injeção AOM para minimizar o sofrimento para os ratos causados pelo manuseio repetido.
NOTA: OMA é uma substância cancerígena e devem ser tratados de acordo com as instruções FDSM. - Todos os animais devem ser tratados de acordo com os procedimentos de segurança citotóxicos para as 6 semanas de injeções ip OMA necessários para este protocolo.
- Durante a semana 8 realizar exame endoscópico para monitorizar tumores emergentes (ver seção 5). O exame endoscópico deve ser realizada a cada duas semanas até que os tumores se tornam visíveis. De um modo geral, de tipo selvagem C57BL / 6 animais começam a desenvolver tumores de cerca de 40 semanas após a administração inicial de AOM.
- Uma vez que os tumores se tornam visíveis por exame endoscópico, atribuir a cada rato uma pontuação tumor endoscópica (ver item 5) e atribuir camundongos indivíduo a uma coorte com semelhante cargas de tumor antes do início do tratamento terapêutico.
- Durante a semana de 40 (ou quando os tumores são de primeira visível), administrar o composto terapêutico ou o controle do veículo em questão.
- A calendarização das doses será dependente do perfil farmacocinético da terapêutica (ver passo 2.1). Um exemplo de um tratamento de intervenção injectado ip 3 vezes por semana em ratinhos com tumores estabelecidos é fornecida (Figura 3).
- Realizar semanal para o exame endoscópico duração dos períodos de tratamento terapêutico para monitorar a carga tumoral. Geralmente, um de 4 semanas de tratamento terapêutico são suficientes para uma resposta objectiva tratamento. Após a interrupção do tratamento, um grupo de ratos também podem ser monitorados por endoscopia para recidiva tumoral.
- Eutanásia ratinhos por CO 2 intoxicação e colher tecidos para análise bioquímica e / ou histológico do cólon e tumores durante 45 semanas, ou após 4 semanas de terapia.
- O equipamento de endoscopia deve ser montada de acordo com os procedimentos padrão 16.
- Esterilizar e endoscópio limpar a sonda com etanol a 70% ou um lubrificante anti-bacteriana.
- Os vídeos podem ser gravados utilizando um computador laptop ou desktop e software de mídia padrão, como o iMovie. Um monitor de computador padrão, em vez de um monitor de grau médico, é suficiente para a visualização do cólon durante o procedimento endoscópico (Figura 4).
- Anestesiar grupos de 5-6 ratos em simultâneo numa câmara com 3% de isoflurano em 100% de O 2 a uma taxa de 0,2-0,4 l / min. Uma vez que os ratos são anestesiados, o que é confirmado por aperto do dedo do pé; os níveis de anestésico deve ser alterada para 0,5-2% para manutenção.
- Remover um ratinho individual da câmara, e colocá-lo lado ventral com a cabeça presa em um nariz de cone. Anestesia cheios devem ser monitorizadas e as patas traseiras deve ser ajustada de modo que eles são stretched atrás do mouse.
- Coloque uma pomada veterinário sobre os olhos dos ratos para prevenir o ressecamento.
- Segure a cauda do rato, onde se encontra com a parte inferior da coluna para revelar claramente o ânus. Introduza a bainha endoscópio rígido para uma proveta de água e ajustar o fluxo de ar para permitir a libertação de uma pequena bolha de cada vez.
- O fluxo de ar vai permitir que o cólon para inflar. Se o fluxo de ar é muito forte, o ar será bombeado para dentro do estômago do rato. Nenhuma lubrificação adicional é necessária.
- Insira cuidadosamente a bainha endoscópio rígido no recto. Geralmente, o endoscópio pode ser inserido até 3 cm, altura em que os dois pontos em curvas de ratos e não é acessível ao endoscópio rígido.
- Uma dificuldade comum durante procedimentos endoscópicos é o bloqueio do acesso ao lúmen do cólon devido à matéria fecal. Evite isso, massageando suavemente da barriga de ratos antes do procedimento para incentivar a defecação, ou cuidadosamente manobrar o endoscópio em torno do Fecal assunto durante o procedimento. Peristaltismo também pode ocorrer, durante o qual o endoscópio deve ser mantido em posição até que a musculatura do cólon relaxa.
- Iniciar a gravação de vídeo em qualquer fase do procedimento de endoscopia. Scoring doença pode ser gravado por um assistente experiente durante o procedimento, ou em um ponto de tempo mais tarde a partir dos arquivos de vídeo.
- Após o exame endoscópico, retornar os ratos para sua gaiola e monitorá-los durante a recuperação da anestesia. Os animais são geralmente acordado e móvel em até 2 minutos após a remoção do isoflurano administrar nariz cone.
- Certifique-se de que esses procedimentos são realizados por um cientista experiente. Cada procedimento de endoscopia levará aproximadamente 2 min por mouse.
6. Doença Scoring
- Para monitorar colite, marcar vídeos para o Índice de murino endoscópica de Colite Gravidade (MEICS) 16, que documenta mudanças em (i) a espessura da parede do cólon indicado pela transparência, (Ii) a consistência das fezes, (iii) a integridade dos vasos sanguíneos e na presença, (iv) as úlceras e as zonas de regeneração que se apresentam numa forma granular, (v) o sangramento indicado por depósitos de fibrina (Figura 5a).
- Para monitorar a carga tumoral, marcar vídeos para incidência e tamanho do tumor. A dimensão do tumor é determinada pelo diâmetro do lúmen do cólon ocupados pelo tumor 16 (Figura 5b). É comum a utilização de ambos os parâmetros de pontuação e colite tumor para um único rato. Usando endoscopia, tumores individuais e a saúde da mucosa do cólon pode ser monitorizado ao longo do tempo, fornecendo uma li-a para o sucesso de novas terapêuticas num único animal.
- (Opcional) As imagens fixas podem ser extraídos dos vídeos para a geração de números representativos (Figura 6).
Resultados
Perda de peso é utilizada como um parâmetro padrão para monitorizar a doença associada com colite, que é utilizada rotineiramente para monitorizar a saúde geral dos ratos. Animais em geral, manter o seu peso enquanto DSS contendo água é administrado, e só começar a perder peso quando eles são devolvidos à água potável normal. Parâmetros de perda de peso aceitável deve ser estabelecida de acordo com o comitê de ética animal da instituição. A fim de evitar a desidratação associada à diarreia prolongada, utilizar o fornecimento de mosto de rotina (peletes alimentares amassada e misturada com água de beber), suplementado com uma agitação da proteína em adição à água de beber normal.
Como uma alternativa a anestesia, a cetamina / xilazina ou agentes similares pode ser usado, se o equipamento isoflurano não está disponível. Devido à natureza rígida do endoscópio, estes processos permitem apenas a visualização das mais 3 centímetros distais do cólon do rato. Endoscópios mais novos, com recursos adicionais (incluindo flexibilidade e fluorescência) estão disponíveis, dependendo das necessidades do experimento. No entanto, uma vez que os efeitos deletérios da SCD é limitada principalmente no cólon distai de ratinhos, com a patologia mais suave observada no cólon médio, o endoscópio rígido não prejudicar o acompanhamento da saúde das mucosas de ratinhos individuais. Embora os autores descrevem um protocolo para o tratamento profilático de colite induzida por DSS aguda, este protocolo pode facilmente ser modificado para testar estratégias de tratamento de intervenção. A eficácia de um fármaco de modo a aliviar danos epiteliais e colite pode ser monitorizada longitudinalmente em ratinhos individuais e quantificada com base nos parâmetros de pontuação descritas (Figura 5). Isto é vantajoso em relação a modelos experimentais tradicionais, as quais requerem o abate de ratinhos, em pontos de tempo específicos durante o protocolo experimental, e não permite a caracterização da resposta a um tratamento da doença ao longo do tempo.
t "> estudos clínicos em seres humanos revelaram uma considerável variabilidade em como diferentes tumores num paciente individual responder aos tratamentos. Os procedimentos que são descritos aqui proporcionam um meio para monitorar a carga tumoral total, bem como a resposta ao tratamento de tumores individuais ao longo de um experimento. É importante considerar que as protocolos de intervenção que são descritas para os modelos de câncer não levam em conta os efeitos de uma terapia em iniciação tumor. protocolos de profilaxia, com o tratamento prestado antes quando os tumores se tornam visíveis por endoscopia, são necessários para obter essa informação. Os protocolos descritos aqui fornecem informações sobre os efeitos terapêuticos sobre o sobre a progressão (medida pelo tamanho do tumor) de tumores individuais. regressão do tumor pode também ser indicada por uma redução no número de tumores visíveis.g "/>
Figura 1:. A monitorização da eficácia de uma terapia de tratamento profilático num modelo de dano agudo do cólon O protocolo experimental (um) requer oito dias do início ao fim. Therapeutics são administrados (b) a partir do dia 1 para tratamentos profiláticos. DSS é fornecido na água de beber (c) a partir do dia 3 do protocolo experimental. A endoscopia é realizada (d) acompanhar a progressão da doença nos animais. Timepoints sugeridas incluem Dia 0 (sem tratamento) e Dia 2 (vigilância da saúde), Dia 5 e 8 (para determinar a carga de doença). A experiência é terminada (e) na manhã do Dia 8. Em um ratinho de tipo selvagem (f) a progressão da doença aumenta com o tempo.
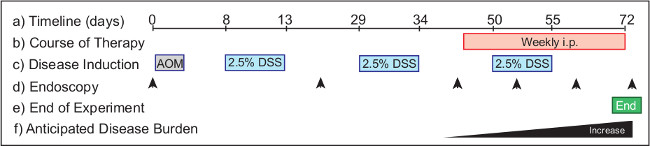
Figura 2: Monitorando a eficácia da terapia de intervenção em um modelo of colite associada ao cancro. O protocolo experimental (um) requer 72 dias do início ao fim. Therapeutics (b) são administrados a ratinhos com tumores estabelecidos a partir do dia 46 para os tratamentos de intervenção. AOM (c) é injectado no Dia 1, e DSS é fornecido na água de beber durante o decurso de três ciclos do protocolo experimental, começando no Dia 8. A endoscopia (d) é realizado para monitorar a progressão da doença nos animais. Timepoints sugeridas incluem Dia 0 (não tratada), Dia 20 (vigilância da saúde), e dia 40 (para os animais do grupo de acordo com a carga tumoral). A endoscopia é realizada semanalmente durante o curso do tratamento terapêutico para monitorizar os efeitos da doença. O experimento (e) é encerrado na manhã do dia 72. Em um fardo tumor do tipo selvagem do mouse (f) aumenta de dia 40 em diante.

Figura 3:. Acompanhamento da eficácia da terapia de intervenção em um modelo de câncer colorretal espontânea O protocolo experimental (a) requer> 50 semanas do início ao fim. Therapeutics (b) são administrados a ratinhos com tumores estabelecidos para tratamentos de intervenção. AOM (c) é injectado no dia 1, e em seguida semanalmente durante 6 injecções consecutivas ao longo do curso do protocolo experimental. A endoscopia (d) é realizado para monitorar a progressão da doença nos animais. Timepoints sugeridas incluem Dia 0 (sem tratamento) e Semana 8 (monitoramento de tumor) e quinzenal lá depois (para estabelecer a carga tumoral). A endoscopia é realizada semanalmente durante o curso de tratamento para monitorizar os resultados terapêuticos. O experimento (e) é encerrado na Semana 50. Em uma carga tumoral de tipo selvagem do rato (f) aumenta desde a Semana 40 em diante. p>

Figura 4:. Equipamento set-up O experimental set-up (a) para a unidade endoscópica, com peças individuais de equipamento indicado. O endoscópio rígido (b), com os componentes individuais indicados. Barra de escala = 2,5 cm. Clique aqui para ver uma versão maior desta figura.
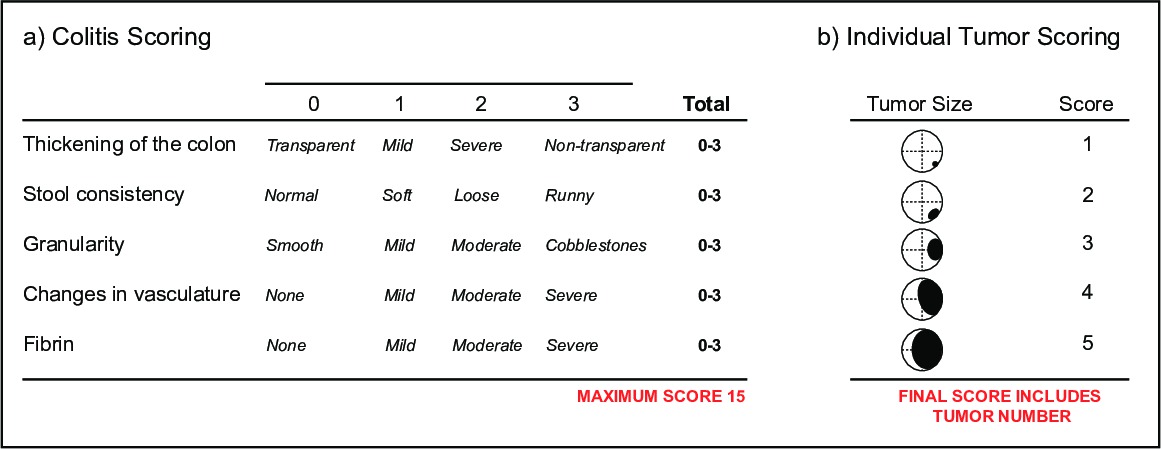
Figura 5:. Scoring parâmetros de doença por endoscopia Um esboço (a) do Índice Endoscopic Murino de Colite Gravidade (MEICS). Um esboço (b) dos parâmetros de pontuação tumor individuais.es / ftp_upload / 52383 / "target =" _ 52383fig5highres.jpg blank "> Clique aqui para ver uma versão maior desta figura.
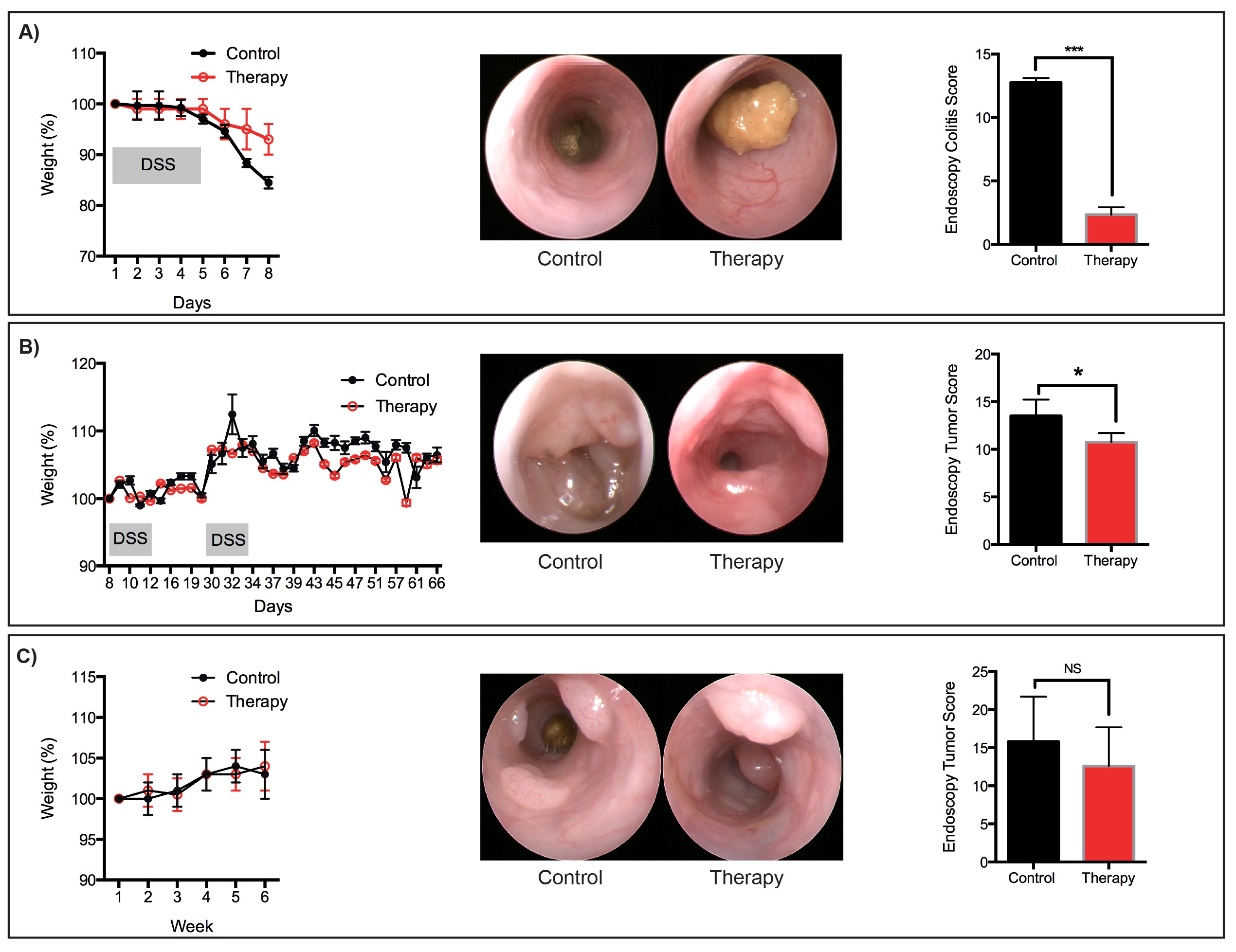
Figura 6: tratamentos terapêuticos representativos perda de peso-Representante, imagens endoscópicas e partituras para:. (A) Aguda DSS-induzida lesão da mucosa (b) tumores que se desenvolveram seguindo o protocolo / DSS AOM (c) Os tumores que se desenvolveram após o seqüencial.. protocolo OMA. N = 3 ratos por grupo. * P <0,05, *** P <0,001 (T-Student). Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Os três protocolos que são descritos os métodos de contorno de indução confiável e reprodutível da patologia da doença do cólon em camundongos. Quando combinado com as estratégias de intervenção descritas aqui acompanhamento endoscópico de rotina e, estes protocolos irá fornecer poderosa visão pré-clínicos sobre a eficácia da terapêutica. Nossos laboratórios rotineiramente usar todos esses protocolos para monitorar o sucesso de novas terapias 10,23,24.
Há um número de considerações ao escolher um modelo animal pré-clínica para testar novas terapêuticas. Estes incluem a relevância do modelo para a doença humana, e a contribuição do microambiente do tumor para a acção proposta do alvo terapêutico. Aqui nós fornecemos três protocolos de intervenção terapêutica em modelos de doenças intestinais estabelecidos. Estes modelos são reprodutíveis e a entrega de reagentes para induzir a doença é fácil de gerir. É importante ressaltar que os modelos são altamente relevantesde múltiplas facetas e fases de início colite, e de iniciação e progressão tumoral. Os investigadores devem levar em consideração o fundo genético das linhagens de camundongos utilizados na concepção experiências, como a susceptibilidade à doença induzida por DSS e / ou AOM podem variar consideravelmente 25. Além disso, diferentes comunidades microbianas podem ter diferentes capacidades metabólicas no contexto de AOM, a qual é metabolizada pelas bactérias. Advertimos contra o uso de diferentes grupos de ratos que nasceram em diferentes instalações para animais (incluindo fornecedores comerciais) em um único experimento. Da mesma forma, o diferente microflora em camundongos usados de diferentes instalações podem provocar diferentes respostas do hospedeiro para DSS-induzida danos barreira epitelial 11. Além disso, a análise de tecido apropriado (por exemplo, a purificação de ARN) também deve ser considerado, uma vez que a capacidade de DSS a inibir a transcriptase reversa terá um impacto sobre a análise molecular subsequente 26,27.
Mouse endoscopia é uma técnica de ponta para monitorar constantemente o início da doença e progressão em um mouse individual. A capacidade de gravar vídeos e extrair imagens ainda permite fácil monitoramento de vários parâmetros de doenças e tumores. Além de melhorar o bem-estar animal, a monitorização endoscópica também reduz a necessidade de vários grupos de camundongos experimentais, que tradicionalmente foram abatidos em diferentes pontos de tempo para acompanhar a evolução da doença. O sistema de pontuação MEICS não é um substituto para a análise histopatológica, mas fornece um meio alternativo para monitorar danos a saúde animal e da mucosa em camundongos vivos. Rato endoscopia é uma técnica de laboratório especializado, e todos os procedimentos devem ser realizados por pessoal treinado para garantir a manipulação e manejo adequado dos camundongos, bem como para proporcionar qualidade consistente nas imagens usadas para marcar doença. Nas mãos de pessoal qualificado, descobrimos que a endoscopia induz pouco ou nenhum dano para o tumors que poderiam causar hemorragia intra-tumoral. Para os protocolos terapêuticos esboçados, consideramos endoscopia altamente vantajoso, uma vez que fornece uma maneira de determinar a carga do tumor inicial, e nos permite coortes grupo de animais com tumor encargos semelhantes antes da administração de uma droga terapêutica. Monitoramento seqüencial da camundongos permite aos pesquisadores determinar a eficácia de novas terapias no início, com a opção de terminar de experiências sem sucesso em tempo hábil.
Como nossa compreensão da doença inflamatória intestinal e colorectal cânceres antecedência, novos alvos para a terapia será identificado. Modelos animais apropriados fará parte integrante de garantir que as novas terapias mais promissoras são movidos em direção ensaios clínicos.
Divulgações
The authors have nothing to disclose.
Agradecimentos
We would like to thank CSL Ltd. for supporting the purchase of the endoscopy equipment. The research in the laboratory of ME is supported by the Ludwig Institute for Cancer Research, and the laboratories of TP and ME are supported by the Victorian State Government Operational Infrastructure Support and the National Health and Medical Research Council of Australia. ME is an NHMRC Senior Research Fellow.
Materiais
| Name | Company | Catalog Number | Comments |
| Dextran sulfate sodium (MW 36,000-50,000) | MP Biochemicals | 160110 | Requires batch testing. |
| Azoxymethane | Sigma | A5486-100MG | Requires batch testing. |
| Vanilla protein shake | N/A | N/A | Available from hospital pharmacies. |
| Isoflurane | PPC | M60303 | This is a restricted reagent, which should be stored under lock and key. |
| 70% ethanol | N/A | N/A | Standard lab reagent. |
| Coloview miniendoscopic system | |||
| Endovision Tricam | Karl Storz | 20212001-020 | |
| Xenon 175 light source with anti-fog pump | Karl Storz | 20134001 | |
| HOPKINS straight Forward Telescope | Karl Storz | 64301AA | |
| Endoscopic sheath (total diameter 3 mm) | Kalr Stroz | 61029C | |
| Fiber optic light cable | Kalr Stroz | 69495ND | |
| Computer and media player software | Apple | iMovie | |
| Scale | Any | Any scale suitable for weighing mice. |
Referências
- Tenesa, A., Dunlop, M. G. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat Rev Genet. 10, 353-358 (2009).
- Rustgi, A. K. The genetics of hereditary colon cancer. Genes Dev. 21, 2525-2538 (2007).
- Rutter, M., et al. Severity of inflammation is a risk factor for colorectal neoplasia in ulcerative colitis. Gastroenterology. 126, 451-459 (2004).
- Eaden, J. A., Abrams, K. R., Mayberry, J. F. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 48, 526-535 (2001).
- Lakatos, P. L., Lakatos, L. Risk for colorectal cancer in ulcerative colitis: changes, causes and management strategies. World J Gastroenterol. 14, 3937-3947 (2008).
- Xiang, B., Snook, A. E., Magee, M. S., Waldman, S. A. Colorectal cancer immunotherapy. Discov Med. 15, 301-308 (2013).
- Feng, Q. Y., et al. Anti-EGFR and anti-VEGF agents: Important targeted therapies of colorectal liver metastases. World J Gastroenterol. 20, 4263-4275 (2014).
- Dinarello, C. A. Anti-inflammatory Agents: Present and Future. Cell. 140, 935-950 (2010).
- Grivennikov, S. I., et al. Adenoma-linked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth. Nature. 491, 254-258 (2012).
- Putoczki, T., Thiem, S., Loving, A., Busuttil, R. A., Wilson, N. A., Ziegler, P., Nguyen, P., Preaudet, A., Farid, R., Edwards, K., Boglev, Y., Luwor, R. B., Jarnicki, A. J., Horst, D., Boussioutas, A., Heath, J., Sieber, O., Nash, A., Greten, F., McKenzie, B. S., Ernst, M. Interleukin-11 is the dominant IL-6 family cytokine during gastrointestinal tumorigenesis and can be targeted therapeutically. Cancer Cell. 24, 257-271 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. J Biomed Biotechnol. 2012, 718617 (2012).
- Rose, W. A., Sakamoto, K., Leifer, C. A. Multifunctional role of dextran sulfate sodium for in vivo modeling of intestinal diseases. BMC Immunol. 13, 41 (2012).
- Laroui, H., et al. Dextran sodium sulfate (DSS) induces colitis in mice by forming nano-lipocomplexes with medium-chain-length fatty acids in the colon. PLoS One. 7, e32084 (2012).
- Miyazawa, F., Olijnyk, O. R., Tilley, C. J., Tamaoki, T. Interactions between dextran sulfate and Escherichia coli ribosomes. Biochim Biophys Acta. 145, 96-104 (1967).
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 14, 141-153 (2014).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nat Protoc. 2, 1998-2004 (2007).
- Schwitalla, S., et al. Loss of p53 in Enterocytes Generates an Inflammatory Microenvironment Enabling Invasion and Lymph Node Metastasis of Carcinogen-Induced Colorectal Tumors. Cancer Cell. 23, 93-106 (2013).
- Fiala, E. S. Investigations into the metabolism and mode of action of the colon carcinogens 1,2-dimethylhydrazine and azoxymethane. 40, 2436-2445 (1977).
- Chen, J., Huang, X. F. The signal pathways in azoxymethane-induced colon cancer and preventive implications. Cancer Biol Ther. 8, 1313-1317 (2009).
- Bollrath, J., et al. gp130-mediated Stat3 activation in enterocytes regulates cell survival and cell-cycle progression during colitis-associated tumorigenesis. Cancer Cell. 15, 91-102 (2009).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nat Protoc. 1, 2900-2904 (2006).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139, 485-498 (2009).
- Thiem, S., et al. mTORC1 inhibition restricts inflammation-associated gastrointestinal tumorigenesis in mice. J Clin Invest. 123, 767-781 (2013).
- Stuart, E., et al. Therapeutic inhibition of Jak activity inhibits progression of gastrointestinal tumors in mice. Mol Cancer Ther. 13, 468-474 (2014).
- De Robertis, M., et al. The AOM/DSS murine model for the study of colon carcinogenesis: From pathways to diagnosis and therapy studies. J Carcinog. 10, 9 (2011).
- Viennois, E., Chen, F., Laroui, H., Baker, M. T., Merlin, D. Dextran sodium sulfate inhibits the activities of both polymerase and reverse transcriptase: lithium chloride purification, a rapid and efficient technique to purify RNA. BMC Res Notes. 6, 350 (2013).
- Kerr, T. A., et al. Dextran sodium sulfate inhibition of real-time polymerase chain reaction amplification: a poly-A purification solution. Inflamm Bowel Dis. 18, 344-348 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados