Method Article
Medición de la fuerza isométrica máxima generada por las fibras musculares esqueléticas permeabilizadas
En este artículo
Resumen
Análisis de las propiedades contráctiles de las fibras musculares, esqueléticas químicamente piel o permeabilizadas ofrece un poderoso medio de la cual evaluar la función muscular a nivel de la célula muscular individual. En este artículo describimos una técnica válida y fiable para preparar y probar permeabilized fibras musculares esqueléticas in vitro.
Resumen
Analysis of the contractile properties of chemically skinned, or permeabilized, skeletal muscle fibers offers a powerful means by which to assess muscle function at the level of the single muscle cell. Single muscle fiber studies are useful in both basic science and clinical studies. For basic studies, single muscle fiber contractility measurements allow investigation of fundamental mechanisms of force production, and analysis of muscle function in the context of genetic manipulations. Clinically, single muscle fiber studies provide useful insight into the impact of injury and disease on muscle function, and may be used to guide the understanding of muscular pathologies. In this video article we outline the steps required to prepare and isolate an individual skeletal muscle fiber segment, attach it to force-measuring apparatus, activate it to produce maximum isometric force, and estimate its cross-sectional area for the purpose of normalizing the force produced.
Introducción
La función primaria del músculo esquelético es para generar la fuerza. La fuerza muscular se provoca in vivo a través de una compleja secuencia de eventos que incluye los potenciales de acción del nervio motor, la transmisión neuromuscular, los potenciales de acción de la fibra muscular, liberación de calcio intracelular, y la activación del sistema de proteínas reguladoras y contráctiles. Debido a la generación de fuerza es el resultado final de esta secuencia, un déficit en la fuerza podría ser causada por el fallo de uno o más de los pasos individuales. Un atributo clave de la preparación de la fibra permeabilizadas es que elimina la mayor parte de los pasos necesarios para la generación de la fuerza in vivo, con sólo las funciones de regulación y contráctiles asociados con el aparato miofibrilar restante. El investigador asume el control de la entrega de la activación de calcio y energía (ATP), y es recompensado con un sistema simplificado que permite la evaluación de las estructuras de regulación y contráctiles aislados en su co nativanfiguration. Las mediciones de la fuerza utilizando fibras musculares esqueléticas permeabilizadas son por lo tanto valioso al evaluar las alteraciones en la función muscular observada in vivo. Por ejemplo, hemos utilizado esta técnica para caracterizar la capacidad de generación de fuerza de fibras a partir de ratones deficientes en miostatina 1 y para evaluar la causa de la debilidad muscular persistente exhibido siguiente rotadores crónica del manguito de lágrimas 2,3.
Metodología de fibra permeabilizada moderna se remonta a principios de los estudios influyentes 4,5 y está actualmente en uso por un número de grupos de investigación. Aunque las técnicas se han descrito en la literatura, que aún no se han presentado en formato de vídeo. El objetivo de este artículo es ilustrar una versión actualizada, técnica válida y fiable para medir la capacidad máxima fuerza generadora de fibras individuales de las muestras de músculo esquelético permeabilizadas químicamente. Para lograr esto, un segmento de fibra individual (denominado en este documento como un ̶0; fibra ") se extrae de un paquete pre-permeabilizadas de fibras y se colocan en una cámara experimental que contiene una solución relajante, la característica que define que es una concentración de calcio que es <10 nM. La fibra se adjunta a continuación, en un extremo a un transductor de fuerza y en el otro extremo a un controlador longitud. Con la fibra celebrada en una longitud óptima del sarcómero, se transfiere a una solución de activación que tiene una concentración de calcio suficiente para provocar la activación máxima y así la máxima fuerza de contracción isométrica. Los datos de fuerza son adquiridos, almacenados y analizados utilizando una computadora personal.
Protocolo
Todos los procedimientos que involucran sujetos animales o humanos deben realizarse de conformidad con las directrices pertinentes, los reglamentos y las agencias reguladoras. La Universidad de Michigan, el Comité de Uso y Cuidado de los Animales (UCUCA) y la Universidad de Centro Junta Institucional de Revisión Médica de Michigan aprobaron todos los procedimientos humanos descritos en este artículo y animales.
1. Asegúrese de disección y Almacenamiento de la Solución
Nota: Los volúmenes finales especificados en las siguientes instrucciones se pueden escalar hacia arriba o hacia abajo si lo deseas.
- En un vaso de precipitados de 1000 ml añadir 800 ml de agua desionizada (ASTM Tipo 1). El mantenimiento de un gran revuelo suave, agregar todos los compuestos enumerados en la Tabla 1 para el agua desionizada y permita que se disuelvan.
Compuesto Deseado Conc. (M) Fórmula Peso (g / mol) Añadir a 1 L (g) K-propionato 0,250 112.17 28,040 Imidazol 0,040 68.08 2,720 EGTA 0,010 380.40 3,800 MgCl2 • 6H 2 O 0,004 203.31 0,813
Tabla 1: disección y almacenamiento solución madre componentes.
- Llevar a un volumen final de 1000 ml con agua desionizada. Tenga en cuenta que no es necesario el pH de la solución en este momento. Guarde la solución madre a 4 ° C.
2. Haga solución de almacenamiento
- Para hacer 200 ml de solución de almacenamiento, comience con 100 ml de disección y solución de almacenamiento de valores en un vaso de 250 ml. Añadir suficiente Na 2 H 2 ATP para llevar adenosina definitivatrifosfato (ATP) a concentración de 2 mM. Llevar a un volumen final de 200 ml con glicerol. Ajuste a pH 7,00 con hidróxido de potasio (KOH). Guarde la solución de almacenamiento a -20 ° C.
Nota: Debido a la naturaleza viscosa de glicerol puede ser difícil para dispensar con precisión por volumen. Debido a esto, por lo general añadimos el glicerol en peso (100 ml de glicerol pesa aproximadamente 126 g).
3. Hacer Solución de disección
- Para hacer 200 ml de solución de disección, comenzar con 100 ml de la solución madre de disección y el almacenamiento en un vaso de precipitados de 250 ml.
- Añadir suficiente Na 2 H 2 ATP para llevar la concentración de ATP final a 2 mM. Ajustar el pH a 7,00 con KOH. Llevar el volumen final a 200 ml con agua desionizada. Alícuota en volúmenes de 2,5 ml y almacenar a -80 ° C.
4. Hacer disección Solución con Brij 58
Nota: Brij 58 es un detergente no iónico que interrumpe (permeabiliza) bicapas lipídicas.
- Para hacer 200 ml de solución de disección con Brij 58, comenzar con 200 ml de la solución de disección en un vaso de precipitados de 250 ml. El mantenimiento de un gran revuelo suave, añadir 1 g de Brij 58 (0,5% w / v) a la solución de disección y deje que se disuelva. Alícuota en volúmenes de 2,5 ml y almacenar a -80 ° C.
5. Haga Soluciones de ensayo
Nota: La siguiente es una adaptación de Moisescu y Thieleczek 1978 (6). Ver Discusión para comentarios adicionales sobre la preparación de soluciones de pruebas.
- Prepare tres separadas 1,000 ml vasos etiquetados "relajante", "Pre-activación" y "Activar". Añadir 400 ml de agua desionizada a cada vaso de precipitados.
- Añadir los compuestos indicados en la Tabla 2 al vaso de precipitados adecuado y luego calentar las soluciones a entre 70 ° C y 80 ° C. Mantener una temperatura de la solución de 70-80 ° C durante 30 min mientras se agitaba continuamente.
Nota: Una temperatura de 70-80 ° C ayuda en la eliminación de ácido carbónico formado por la reacción de carbonato de calcio con EGTA en la solución de activación. Las soluciones de solución y pre-activación de relax son tratados de la misma manera que la solución de activación para mantener la consistencia.
| SOLUCIÓN RELAJANTE | SOLUCIÓN DE PRE-ACTIVACIÓN | SOLUCIÓN ACTIVACIÓN | |||||
| Compuesto | Fórmula Peso (g / mol) | Concentración deseado (mM) | Misa Obligatorio (g) | Concentración deseado (mM) | Misa Obligatorio (g) | Concentración deseado (mM) | Misa Obligatorio (g) |
| HEPES (ácido) | 238.30 | 90.0 | 10,724 | 90.0 | 10,724 | 90.00 | 10,724 |
| MgO | 40.31 | 10.3 | 0,208 | 8.5 | 0,171 | 8.12 | 0,164 |
| EGTA (ácido) | 380.40 | 52.0 | 9,890 | 52.00 | 9,890 | ||
| HDTA (ácido) | 348.36 | 50.0 | 8,709 | ||||
| CaCO 3 | 100.10 | 50.00 | 2,503 | ||||
Tabla 2: Relaxing, pre-activación y la activación de componentes de la solución.
- Enfriar la solución a temperatura ambiente y añadir suficiente NaN 3 / KOH para llevar la concentración final de NaN 3 a 1 mM.
PRECAUCIÓN: NaN 3 (azida de sodio) es venenoso. Consulte las MSDS químicos antes de manejar este producto químico.- Para hacer 100 ml de una solución de azida de sodio 100 mM, añadir 0,65 g de NaN 3 a 10 ml de 1 N de KOH. Ajustar a un volumen final de 100 ml con agua desionizada.
- Ajustar el pH a aproximadamente 7,10 utilizando KOH.
- Después de la etapa 5.4 añadir suficiente Na 2 H 2 ATP para llevar la concentración final a ATP 8 mM y suficiente Na 2 CRP a traer la phosophate creatina final (CRP) a concentración 10 mM.
- Llevar a cada solución hasta el volumen final de 500 ml utilizando agua desionizada. Chill o calentar las soluciones a la temperatura a la que se llevaron a cabo experimentos, a continuación, utilizar KOH para llevarel pH a 7,10 mientras se mantiene esa temperatura.
- Añadir la solución al vaso de precipitados que contiene la solución de pre-activación relajante de tal manera que la solución final pre-activación es 1 parte de solución en 500 solución pre-activación relajante. Alícuota en volúmenes de 2,5 ml y almacenar a -80 ° C.
6. Asegúrese de sutura Loops
- Comience con un mechón de USP 10-0 sutura de nylon monofilamento no estéril.
- Utilice las pinzas para crear un lazo con la cadena utilizando la técnica de nudo doble. Reducir el nudo en tamaño a unos 750 m de diámetro. Diámetro de bucle se puede evaluar en el microscopio utilizando marcas retícula ocular.
- Utilice microdissecting tijeras para eliminar el exceso de sutura dejando sólo el bucle y pequeñas (500 micras) colas en ambos lados. Un ejemplo de un bucle de acabado se muestra en la Figura 1.
- Repita los pasos 6.2 a 6.3 hasta 4 bucles utilizables se han hecho. Tienda bucles en un petr elastómero de silicona chapadoi plato para su uso futuro.
Nota: Se requieren cuatro bucles de sutura para cada fibra probado.
7. Paquete de muestra
Nota: Los siguientes pasos describen el procedimiento para la disección de la muestra original en "paquetes" experimentales más pequeñas de las que eventualmente serán extraídas y analizadas fibras individuales. En todo momento, la muestra debe tratarse con cuidado. Para el propósito de esta descripción, las instrucciones serán dadas como si el investigador es diestro.
- Obtener la muestra de interés y transferirlo a las instalaciones donde se llevará a cabo la disección.
Nota: Los métodos de biopsia de tejido pueden variar en función del modelo experimental y el diseño del estudio. Cuando sea posible, la perfusión del músculo debe mantenerse hasta el momento de la biopsia. - Si la muestra se va a transferir entre el sitio de la cosecha y el sitio de disección, transportarlo en un vial que contiene solución de disección refrigerada mientras mantenido en hielo.
- Preparar una placa de Petri chapado elastómero 5 cm de silicona con solución de disección fría y de dos a tres pasadores de montaje de insectos (100 micras de diámetro, de acero inoxidable).
- Transferir la muestra al plato. Asegúrese de que la muestra permanece sumergido añadiendo más solución de disección si es necesario.
- Inspeccionar la muestra bajo el microscopio y manipularlo para alinear los ejes longitudinales de las fibras hacia el hombro derecho del investigador (Figura 2). Luego anclar la muestra al plato por el fijar en las esquinas.
Nota: Hacer uso de cualquier tejido conectivo restante como puntos de anclaje en este momento ya que esto va a maximizar el uso de la muestra y conservar la integridad de la fibra. El paquete puede ser depositado en una ligera tensión para ayudar a definir los márgenes entre fibras. - Con las pinzas en la mano izquierda y la tijera microdissecting en la derecha, comienza la disección suavemente un paquete largo de los márgenes longitudinales entre fibras
Nota: En función de sulongitud total, diseccionar aún más el paquete en numerosos paquetes más pequeños. - Asegúrese de que las dimensiones del haz miden aproximadamente 0,5-1 mm de ancho y ≥3 mm de longitud. Evaluar las dimensiones utilizando un microscopio con marcas de la retícula en el ocular, o colocando una regla bajo el plato.
- Retire y deseche cualquier tejido que está dañado por las pinzas o pasadores como resultado del proceso de disección.
- Repetir el proceso hasta que un número suficiente de paquetes han sido diseccionado o hasta que la muestra se ha agotado.
Nota: El número de paquetes que se pueden obtener dependerá de numerosos factores, incluyendo el tamaño y la condición de la muestra inicial, la morfología del músculo, y la habilidad del investigador.
8. Fibras permeabilizar
- Transferencia de los paquetes de la solución de disección en un vial que contiene 2,5 ml de solución fresca, refrigerada, la disección con el detergente no iónico 'Brij 58' añadido(0,5%, w / v). Incubar en hielo durante 30 min con ocasional, agitación suave. Asegúrese de que los paquetes permanecen sumergidas en toda la incubación.
- Al final de la incubación de 30 min, la transferencia de los haces a un vial que contiene la solución de disección fresco (sin Brij 58) y agitar suavemente y brevemente para eliminar cualquier detergente restante.
9. Preparar lotes de almacenamiento
- La transferencia de los paquetes a un vial que contiene la solución de almacenamiento refrigerado y se incuba durante la noche a 4 ° C.
10. Tienda Paquetes
- Al día siguiente, preparar una caja de almacenamiento, capaz de soportar -80 ° C, con suficientes individuales 0,5 ml tubos cónicos de tornillo de tapa para dar cabida a todos los paquetes obtenidos durante el proceso de disección (un paquete por tubo). Cada tubo cónico debe estar lleno de 200-400 l de solución de almacenamiento fresco.
- La transferencia de los paquetes en los tubos cónicos etiquetados individualmente. Asegúrese de que el paquete no está pegada ael lado del tubo cónico o flotando en la superficie de la solución. Tapar los tubos cónicos y almacenar las muestras a -80 ° C hasta el día de la prueba.
11. Preparar Aparato Experimental
Nota: El aparato de encargo se compone de una etapa que alberga un transductor controlador longitud y fuerza, un sistema de cámara de movimiento y un microscopio de disección 10X. Las instalaciones de disco Micrómetro permiten la manipulación precisa de las superficies de unión de fibra. Patrones de difracción láser se utilizan para estimar la longitud del sarcómero. Los datos generados durante la experimentación se registra en un ordenador personal. Consulte la Figura 3 para imágenes con anotaciones del montaje experimental.
- Descongelar un vial cada uno de los relajantes, pre-activación y soluciones activadoras y mantener en hielo. Tenga en cuenta que la ATP y la PCR son compuestos lábiles que deben mantenerse a temperaturas frías.
- Prepare el microscopio, aparatos de ensayo y equipo asociado para su uso.
- Llene la primera cámara experimental con solución relajante. En nuestro aparato, la primera cámara contiene prismas que permiten que el investigador para fotografiar la fibra desde el lado. Llene la segunda cámara experimental con una solución de pre-activación y la tercera con la activación de solución.
- Ajuste la temperatura para que la pantalla del termómetro en la cámara lee 15 ° C. Thread dos bucles de sutura preparados sobre las superficies de fijación de acero inoxidable que se extienden desde tanto la fuerza-transductor y longitud-controlador (Figura 5A).
12. Extracto permeabilizadas sola fibra
- Descongelar un haz de fibras de interés, y transferir a una placa de Petri chapado en elastómero de silicona con solución fresca, refrigerada relajante. Asegure el paquete con los pernos en cada extremo y asegúrese de que está sumergido.
- Utilizando las pinzas, agarre una fibra en un extremo y empezar suavemente la extracción a lo largo de su eje longitudinal.
Nota: El daño a la compresión a laextremo de la fibra causada por las pinzas no es una preocupación en este momento ya que las propiedades contráctiles en esta área no se pondrá a prueba. Se debe, sin embargo, tener cuidado al extraer fibras del haz desde adherencias entre las fibras y la matriz extracelular pueden dar lugar a una tensión excesiva, conduciendo en última instancia el daño inducido por estirar a. Tenga en cuenta que existe una considerable variabilidad entre los músculos en el grado en el que las fibras se adhieren a la matriz extracelular circundante. Las fibras que se sospecha que han sido dañados por un tramo tales deben ser desechados. - Utilice una hoja de afeitar o bisturí para modificar una punta de pipeta como se muestra en la (Figura 4). Introducir la fibra en la punta junto con una pequeña cantidad de solución relajante. La transferencia de la fibra single de la placa de Petri chapado elastómero de silicona a la cámara experimental que contiene la solución relajante.
13. Monte sola fibra
Nota: Un depicti paso a pasoel se puede ver en la Figura 5.
- Guiar suavemente con los fórceps, eliminar la fibra de la punta de la pipeta y anclarlo a la longitud-controlador (izquierda) con el primer lazo de sutura.
- Utilice un solo movimiento, suave al apretar el lazo con las pinzas. Asegúrese de que una tensión igual y opuesta se aplica a cualquiera de los extremos de la sutura.
- El primer bucle debe ser atado alrededor de 1 mm a 2 mm desde el extremo de la superficie de fijación longitud-controlador.
- Manipular el otro extremo de la fibra hacia el transductor de fuerza (derecha) y asegurar la fibra usando el mismo procedimiento. Retire el exceso de sutura con las tijeras microdissecting (Figura 5C).
- Coloque la fibra a una pequeña cantidad de tensión mediante el aumento de la distancia entre la longitud y el controlador y la fuerza-transductor brazos utilizando la coordenada x unidad micrómetro (Figura 3A).
- Pase el segundo bucle sobre la primera y anclar la fibraen un punto dentro de 0,2 mm del extremo de la superficie de unión con fuerza-transductor (Figura 5D).
- Retire el exceso de sutura con las tijeras microdissecting.
- El proceso de fijación de fibra puede resultar en la pérdida de solución desde la cámara. Si es necesario, añadir solución más relajante para asegurar que la superficie de la solución es plana (ni cóncava ni convexa). Una superficie plana es importante la hora de evaluar la longitud del sarcómero usando difracción láser.
- Alinear la fibra paralela a las paredes laterales de la cámara experimental mediante el ajuste de la posición del controlador longitud en la dirección del eje y.
- Encuesta de la fibra utilizando la vista lateral prisma y ajustar la posición de la longitud-controlador en la dirección del eje z hasta que la fibra es paralela al suelo de la cámara.
Nota: Posicionamiento de la fibra paralelo al suelo de la cámara se puede lograr sin prismas de cámara, centrándose primero en un extremo de la fibra y tgallina, sin ajustar el foco del microscopio, con lo que el otro extremo de la fibra en el foco utilizando su unidad de micrómetro eje z. - Si la fibra es de ninguna manera retorcida, retorcido o dañado como resultado de el proceso de montaje, la fibra debe ser desechada y una nueva fibra adjunta.
14. Conjunto óptimo Sarcómero Longitud
- Cuando la fibra se ha alineado correctamente dentro de la cámara, inserte la pantalla de destino calibrado en la cara anterior del microscopio y alinearla sobre la primera cámara experimental.
Nota: La pantalla objetivo se calibra usando la ecuación de la red estándar, λ = SL sinθ, donde SL es la longitud del sarcómero, θ es el ángulo de difracción entre los 0 ° y 1 ° haces difractados y λ es la longitud de onda del láser. - Encienda el láser y ajustar la posición de la etapa de tal manera que el láser pasa a través del centro de la fibra.
PRECAUCIÓN: Concentrado luz láser puede ser perjudicial to la vista. Nunca intente visualizar la fibra a través del microscopio cuando el láser está encendido. - Coloque la fibra con respecto al rayo láser para difractar la luz láser y observar un golpeteo interferencias en la pantalla de destino calibrada (Figura 6). Apague las luces para visualizar este patrón con más claridad.
Nota: Si, con el correcto posicionamiento del haz de láser, no se observa patrón de interferencia, esto sugiere que los componentes miofibrilares de la fibra son anormales / dañado y que la fibra debe ser reemplazada con una nueva. - Para ajustar la longitud del sarcómero, aumentar o disminuir la tensión sobre la fibra utilizando la unidad de micrómetro eje x longitud-controlador hasta que se observa la separación deseada de la luz difractada en la pantalla de destino.
Nota: La longitud del sarcómero óptima de la fibra dependerá de la especie animal de la que se obtuvo la muestra. Una longitud del sarcómero de 2.7 micras se asume comúnmente para ser óptimo cuando asnoscantar las fibras de 7,8 tejido humano. - Después de longitud óptima del sarcómero se ha establecido, medir la distancia entre los dos puntos de sutura más íntimos. Esto se logra más fácilmente mediante la lectura digital en la unidad de micrómetro que controla el movimiento en el eje x de la cámara. Coloque la cámara de tal manera que el cabello transversal vertical del ocular está alineado en la frontera más interna de la sutura más interna y poner a cero la lectura digital en la unidad de micrómetro.
- Traducir la etapa a lo largo del eje x en relación con el microscopio hasta llegar a la otra sutura más interna. La pantalla digital indicará la longitud de la fibra. Este valor debe registrarse como longitud de la fibra, L f.
Nota: Se debe entender que la distancia entre las dos suturas más íntimos determinará la longitud funcional del tejido contráctil está evaluando. El investigador debe esforzarse para mantener la coherencia en esta dimensión (es decir, L f) dentro de unserie de experimentos.
15. Estimación transversal Área (CSA)
- Mantener la fibra en L f y utilizar la cámara microscopio montado para capturar una imagen de alta magnificación de la porción central de la fibra tanto desde la parte superior y vistas laterales. Vista lateral imágenes se pueden capturar mediante el prisma incrustado en el lado de la cámara.
Nota: Al cambiar entre vistas superior y lateral es importante para mover el microscopio sólo en la dirección y para asegurar que las dos imágenes son "en el registro" y por lo tanto muestran dos vistas diferentes de la misma sección de la fibra. - Obtener mediciones en este momento para normalizar la fuerza absoluta más tarde en el estudio. Las técnicas para la obtención de estas mediciones se describen más adelante y se ilustran en las Figuras 7A y 7B.
16. Elicit isométrica Contracción
Nota: Si bien los datos generados durante estos experimentoss puede ser recogida y interpretarse sin el uso de una computadora, un software que permite la adquisición, visualización, almacenamiento y análisis de las respuestas de la fuerza es una ventaja. El software LabVIEW personalizado creado por nuestro laboratorio permite a estas funciones, así como la capacidad para diseñar trenes 'movimiento' que rigen la acción del controlador longitud durante un experimento.
- Confirme que la temperatura de la relajación, la pre-activación y soluciones activadoras son estables a 15 ° C.
- Utilice el software de control de cámara para mover la fibra a la cámara que contiene la solución de pre-activación e incubar allí durante 3 min.
Nota: La solución de pre-activación está débilmente tamponada para Ca 2+, dando como resultado un desarrollo muy rápido de activación y la fuerza tras la introducción de la fibra a la solución de activación. - Con 10 sec restante en la solución de pre-activación y la longitud de la fibra se mantiene a L f, establecer un cero fonivel rce en el registro experimental.
Nota: El movimiento 'Encuentra Fuerza Zero' del controlador longitud revela el nivel de fuerza-transductor que corresponde a la fuerza cero (es decir, la fibra se vuelve brevemente holgura como resultado del movimiento). Fuerza pasiva es la diferencia entre ese cero y el nivel de fuerza justo antes del movimiento transductor de reducción a cero. - Al final de la 3 min, mover la fibra a la cámara que contiene la solución de activación y permitir que la fuerza isométrica máxima para desarrollar como se evidencia por una meseta en la fuerza que es precedida por un rápido aumento.
- Después de alcanzar la fuerza isométrica máxima, utilice el regulador de duración para identificar la producción de fuerza-transductor que corresponde a la fuerza cero en la cámara que contiene la solución de activación.
Nota: Esto es necesario debido a que la producción de fuerza-transductor que corresponde a la fuerza cero es, en general, diferente para cada cámara de solución lleno. - Tras el logro de una segunda fuerza plateau, devolver la fibra a la cámara que contiene la solución relajante. Prueba ahora está completa. Para probar múltiples fibras durante cualquier aspirado de una sesión de todas las soluciones y añadir nuevos, soluciones refrigeradas.
Nota: los protocolos de ciclismo de Brenner deben ser considerados cuando provocar contracciones máximas durante un período prolongado de tiempo. Este protocolo ha sido mostrado para conservar las propiedades estructurales y mecánicas en la fibra máximamente activado 9.
Resultados
Fibras individuales Saludables, permeabilizadas químicamente deben aparecer uniforme en forma y tener un espaciado entre estrías coherente cuando se observa bajo una gran ampliación. Las fibras que son inflexibles cuando se manipula con las pinzas o tienen daños estructurales evidentes deben ser desechados.
Imágenes digitales de alta magnificación tomadas durante el paso 15 se analizan para 5 mediciones de diámetro a lo largo de pares de la sección media de la fibra. Fibra CSA se estima suponiendo una sección transversal elíptica y un promedio de 5 mediciones individuales CSA como se representa en la figura 7A. La Figura 7B también sirve para ilustrar cómo dimensiones de las fibras en una sola vista puede ser significativamente diferente en comparación con las dimensiones pareadas en la otra vista (es decir, transversal secciones no son, en general, redonda).
Rastros de fuerza representativos de fibras lentas y rápidas humanos se muestran en las Figuras 8A y 8B, respectivamente. Voltagsalida e de la fuerza-transductor se adquiere durante una prueba y se convierte en la fuerza (mN) usando adquisición de datos y el software de análisis (LabVIEW). La Figura 9 ilustra el enfoque utilizado para evaluar la fuerza activa máxima (F o), que se calcula restando la fuerza requerida para mantener la fibra en longitud óptima del sarcómero mientras que en un estado relajado (fuerza pasiva, F P), de la mayor fuerza isométrica desarrollado durante la activación de fibra máxima (fuerza total, F T). Desde la salida de la fuerza-transductor que corresponde a fuerza cero es, en general, diferente para cada una de las diferentes cámaras de baño, que aflojamos brevemente la fibra, tanto en la pre-activación y la activación de soluciones para capturar el nivel de fuerza cero en el registro experimental. La normalización de la fuerza activa máxima por la fibra CSA se utiliza para generar el valor más informativo de la fuerza específica (SF o). Debido a que toma en consideración el CSA de la fibra, SF o proporciona una medida de la capacidad de generación de la fuerza intrínseca del aparato contráctil de la fibra, lo que permite comparaciones funcionales entre las fibras de tamaños dispares. Debe, sin embargo, cabe señalar que las mediciones de CSA no son capaces de distinguir la proporción de la fibra ocupada por filamentos contráctiles frente a la proporción ocupada por otras estructuras subcelulares.
Las características típicas de salud, fibras adultos de Claflin et al. 2011 10 para el consumo humano, Mendias et al. 2011 1 de ratón y Gumucio et al. 2012 2 de rata se detallan en la Tabla 3. Todos los datos que se presentan en la Tabla 3 fueron generados utilizando el técnicas descritas en este artículo.
| Humano (Vasto externo) | Ratón (EDL) | Rata (Infraespinoso) | ||||
| Masculino | Femenino | Masculino | Masculino | |||
| Tipo 1 | Tipo 2a | Tipo 1 | Tipo 2a | (No escrito) | (No escrito) | |
| CSA (m 2) | 4880 - 6900 | 5270 - 8380 | 3870 - 5470 | 4010 - 5610 | 1850 - 3080 | 5290 - 8010 |
| Fo (mN) | 0,79-1,17 | 1,02-1,54 | 0,64 a 0,97 | 0,71-1,07 | 0,14 hasta 0,25 | 0,55 hasta 0,97 |
| sF o (kPa) | 142-182 | 165-210 | 156-193 | 172-214 | 67-94 | 102-131 |
| n | 129 | 160 | 149 | 207 | 37 | 94 |
Tabla 3. Características típicas de fibras adultos sanos de vasto lateralis humana 10, extensor largo de los dedos del ratón y la rata infraespinoso 1 2 músculos. Longitudes óptimas sarcómero se fijó en 2,7 micras para las fibras humanas 7,8 y 2,5 micras, tanto para ratón (36, 37) y fibras de rata (38). Rangos Experimental L F (25 º y 75 º cuartiles) fueron 1,39 a 1,73 mm, 1,17 a 1,53 mm y 1,32 a 1,59 mm para humanos, ratones y ratas, respectivamente. Los rangos mostrados indican los 25 º y 75 º cuartiles y n es el número de fibras probadas.
Los problemas más comunes experimentados durante las pruebas incluyen una hoja de lazo de sutura, lo cual resulta en una fuerza response con una "captura" tal como el ilustrado en la Figura 10A, y una lágrima de espesor parcial o total de la fibra, lo que resulta en una respuesta de fuerza que vuelve bruscamente hacia o para (rotura) de cero mientras que la fibra está todavía inmerso en la activación de solución (Figura 10B). Si un resbalón, desgarro o ruptura se produce durante un experimento, la fibra debe ser desechada y los datos excluidos, aunque se mantiene un registro de los fallos en fibra también puede ser informativo 11. Otro resultado negativo que se puede encontrar es la activación prematura de la fibra, mientras que en la solución (Figura 10C) pre-activación. Activación parcial en la solución de pre-activación sugiere la contaminación cruzada así significativo (es decir, un aumento no intencional en la concentración de calcio en la pre-activación de bien). En este caso, todos los baños deben ser aspiradas y se enjuagan bien con agua desionizada. El secado de las superficies divisorias entre las cámaras también es recomended como la humedad o condensación en estas áreas puede conducir a la mecha de la solución entre baños. La decisión de incluir o excluir datos en última instancia, dependerá del enfoque experimental y por lo tanto deben ser considerados en el diseño del estudio.

Figura 1: bucle de sutura (10-0 sutura con monofilamento de nylon).

Figura 2:. Disección Bundle fórceps están en la mano izquierda, tijeras de microdisección están en la mano derecha. La línea roja indica la orientación favorable de la muñeca y tijeras con los ejes longitudinales de las fibras.

Figura 3: (A) un aparato de pruebas con componentes etiquetados. (A) cámaras experimentales con fondos transparentes. (B) Longitud-controlador. (C) Fuerza-transductor. (D) Fuente de luz. (E) Longitud-controlador de la unidad micrómetro xyz con pantalla digital. (F) Unidad Etapa micrómetro con pantalla digital. (G) Fuerza-transductor unidad micrómetro xyz. (H) Plataforma de calibrado pantalla de destino láser de difracción. Mesa de aislamiento (i) de la vibración. (B) Vista de primer plano de las cámaras experimentales. Superficie (j) de fijación de acero inoxidable que se extiende desde el controlador de longitud. Superficie (k) de fijación de acero inoxidable se extiende desde el transductor de fuerza. (L) Vista lateral del prisma. (M) de Vivienda para los módulos de refrigeración termoeléctricos. (N) Termopar para reportar te cámaramperatura.

Figura 4: Modificado 100 punta de la pipeta l utilizado para transferir la fibra de plato de la disección de cámara experimental.
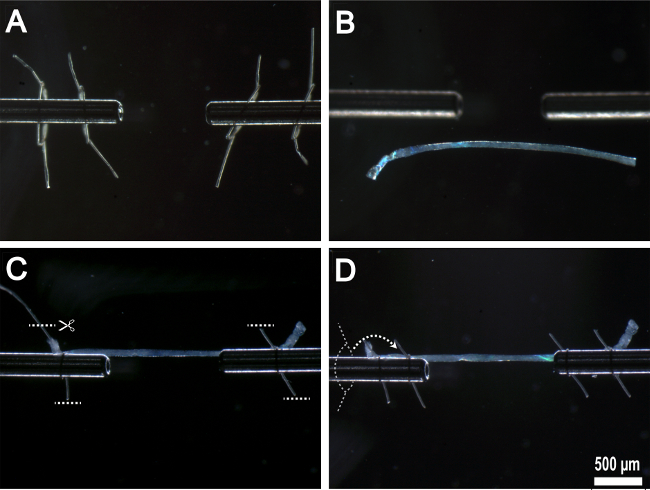
Figura 5:. Montaje sola fibra en aparato experimental (A) bucles de sutura preparados rosca sobre superficies de fijación de acero inoxidable. (B) Fibra transferido a la cámara experimental. (C) de la fibra anclado a las superficies de fijación de acero inoxidable por primera par de bucles de sutura con el exceso de sutura eliminado. (D) Segundo par de bucles de sutura roscados sobre la parte superior de la primera bucles de sutura y atados en su lugar.

Figura 6: la longitud del sarcómero se evalúa mediante la proyección de un patrón de interferencia de láser sobre una pantalla de destino calibrado (a) fuente láser.. (B) Espejo. (C) la pantalla de destino. Patrón de interferencia (d) láser.
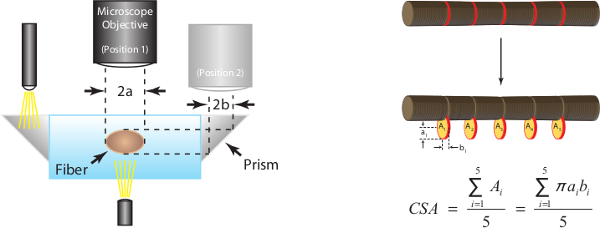
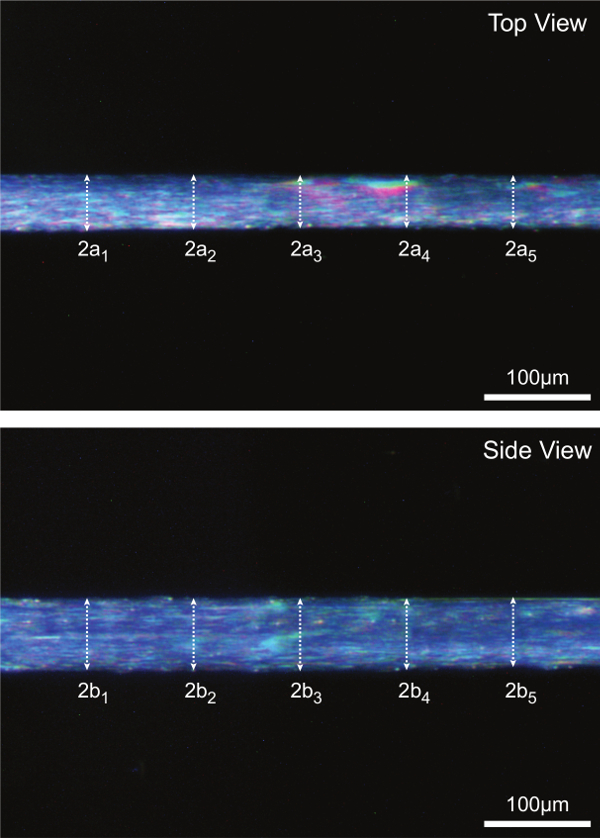
Figura 7: (A) Determinación de la zona de la fibra de la sección transversal a la longitud óptima del sarcómero (humanos = 2,7 micras). Suponiendo una sección transversal elíptica, CSA se calcula para cada uno de los cinco lugares a lo largo de la sección media de la fibra y la media de las cinco mediciones individuales se informa como fibra CSA. 2a representa la parte superior de diámetro y es vista uno de los ejes de la elipse, 2b representa la vista lateral de diámetro y es el otro eje de la elipse. (B) Las imágenes de fibra representativos que ilustran cada una de las cinco medidas del diámetro correspondientes tomadas tanto en la vista superior y lateral.
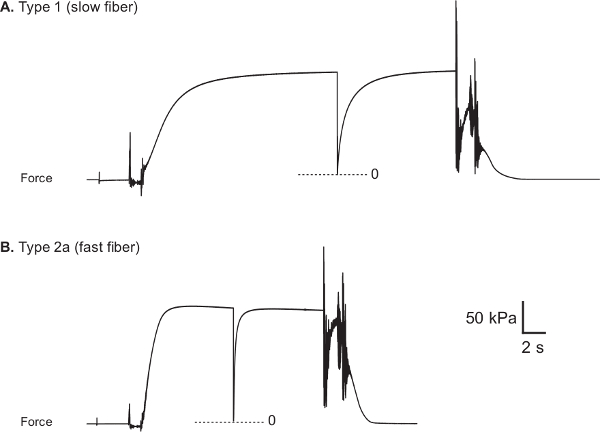
Figura 8: rastros de fuerza representativas de vasto humano sano lateralis fibras musculares (A) Tipo 1 fibra (CSA: 5.710 m 2, H o: 0,89 mN y SF o: 156 kPa).. (B) Tipo de fibra 2a (CSA: 9.510 m 2, Fo: 1,66 mN y SF o: 174 kPa). Miosina de fibra Tipo de cadena pesada se determinó mediante el uso de técnicas de separación electroforética y tinción con plata 22.
oad / 52695 / 52695fig9.jpg "/>
Figura 9: Cálculo de la fuerza activa máxima (F o) (a) Vista ampliada de la respuesta de la fuerza de la fibra durante el movimiento holgura inductores de longitud controlador iniciado en solución pre-activación.. F P es la fuerza requerida para mantener una longitud del sarcómero de 2,7 micras con la fibra en reposo. (B) Vista Ampliada de longitud-controlador de movimiento holgura inductores. Tenga en cuenta que F o = F T - F P.
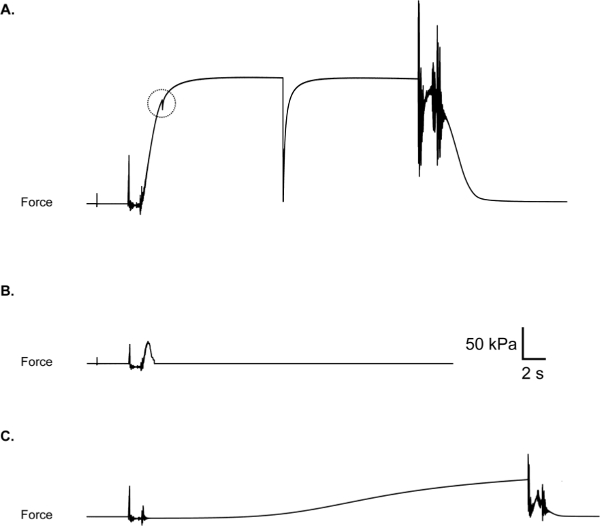
Figura 10: deslizamiento (A) de bucle de sutura, lo demuestra un "retén" en vigor rastro durante el aumento de la fuerza. Revise para asegurarse de que los bucles son seguras antes de activar la fibra. (B) ruptura de la fibra durante la activación. Puede ser debido a una mala integridad de la fibra o el tratamiento de fibra agresivo durante cabo lazo de suturación. (C) la activación de fibra parcial prematura debido a la contaminación de la cámara de pre-activación con Ca 2+.
Discusión
Las evaluaciones de las propiedades contráctiles de las fibras musculares esqueléticas individuales permeabilizadas se utilizan para investigar la función muscular en una amplia variedad de contextos. Los ejemplos incluyen los estudios que han evaluado los efectos del envejecimiento 12, ejercer 10,13,14, 15, vuelo espacial lesiones 2,3,16, tratamientos de drogas, enfermedad 17,18 19 y manipulación genética 20,21 en la estructura y función de la fibra. Debido a la capacidad de evaluar directamente el rendimiento contráctil de miofibrillas en su configuración nativa, esta técnica proporciona una plataforma atractiva desde el cual para formar una comprensión de la función miofibrilar ausente de los efectos de confusión potenciales que están presentes cuando la transmisión de la señal neuromuscular y la liberación de calcio inducida por excitación- están incluidos en el sistema bajo estudio. Además, las pruebas funcionales de las fibras individuales se puede utilizar para complementar los resultados de la identificación de proteínas contráctiles tales como lasobtenida a través de inmunohistoquímica o electroforesis en gel + western blot 22.
Una de las funciones primarias de músculo esquelético es para generar la fuerza. En consecuencia o sF, una medida de la capacidad de generación de fuerza intrínseca de un sistema contráctil, es de gran interés para los fisiólogos musculares. Estimaciones fiables de sF o requieren medidas precisas de ambos CSA fibra y Fo. Puesto que las fibras son, en general, ni circular en sección transversal, ni uniformes en CSA largo de su longitud, el gran cuidado se deben tomar cuando se estima CSA. Para este fin, las mediciones se realizan en varios lugares a lo largo de la longitud de la fibra y, en cada lugar, desde dos perspectivas separadas por 90 °. Medidas fiables de Fo requieren atención a varios detalles que incluyen contabilidad de fuerza pasiva, ajustando la longitud del sarcómero para maximizar la superposición de filamentos gruesos y delgados, empleando una solución de activación con una concentración de calcio tresultados sombrero en la activación máxima, manteniendo la temperatura experimental deseada, y el mantenimiento de las condiciones óptimas de almacenamiento (temperatura y duración) de las fibras anteriores del día del experimento.
Si bien los pasos descritos aquí describen el procedimiento para la evaluación de la fuerza isométrica máxima, con frecuencia es deseable evaluar otras cualidades funcionales importantes de las fibras musculares esqueléticas. Esto se puede lograr mediante la ampliación del protocolo experimental para incluir manipulaciones mecánicas adicionales de la fibra. Por ejemplo, la medición de la velocidad a la que la fibra se acorta en contra de una serie de diferentes cargas permite la determinación de la relación fuerza-velocidad, desde el que las relaciones de fuerza de potencia y la velocidad de potencia se pueden calcular 10,23,24. Además, la velocidad de acortamiento sin carga se puede determinar mediante el empleo de la "prueba de holgura" 25, que consisten en la aplicación de una serie de pasos de acortamiento de holgura inductor y measuring el tiempo requerido por la fibra para eliminar la holgura. Otro parámetro cinética que se reporta con frecuencia es k tr, la constante de velocidad para la fuerza de reurbanización tras una perturbación mecánica que separa temporalmente toda enlaces cruzados 26. Finalmente, la relación entre la concentración de calcio y la generación de fuerza activa (la "relación fuerza-PCA") es a menudo de interés 18 y se puede determinar mediante la exposición de la fibra a una serie de soluciones con concentraciones de calcio que van desde por debajo del umbral para la activación del contráctil sistema para aquellos suficiente para provocar la activación máxima y por lo tanto la fuerza máxima (F o).
Aunque gran parte de los equipos mencionados se necesita para evaluar la contractilidad sola fibra, otros equipos no es absolutamente necesario. El controlador longitud, por ejemplo, es esencial para cualquier protocolo experimental que requiere alargamiento o acortamiento rápida o precisa de la fibra,pero no es absolutamente necesario para la evaluación de la fuerza isométrica máxima (aunque un nivel de fuerza cero en el registro de la fuerza aún debe ser identificado por algunos medios). Los prismas que permiten la observación de la fibra desde el lado, si bien son útiles para la evaluación de área de sección transversal, no son absolutamente necesarios cuando el posicionamiento de la fibra dentro de la cámara experimental. Además, medios alternativos para la exposición de la fibra a las diversas soluciones experimentales podría ser empleado, incluyendo la elaboración de un sistema de accionamiento manual de cámaras o una cámara única que permite el llenado rápido y el vaciado de las soluciones. Finalmente, mientras que las temperaturas experimentales sub-fisiológicos tales como 15 ° C se utilizan comúnmente para mejorar la reproducibilidad de las mediciones mecánicas 1,2,3,5,8,12,17,27, es posible generar datos válidos a otras temperaturas 23 28, siempre y cuando los efectos de la temperatura sobre las propiedades de la solución (concentración de calcio, pH, etc.) se toman en consideración.
Las composiciones de las soluciones de pruebas son algunos de los aspectos más críticos de las técnicas de fibra permeabilizadas descritos aquí. Consideraciones con respecto a composición de la solución son complejos y más allá del alcance de este artículo. Las soluciones descritas en el paso 5 de la sección de protocolo están diseñados con un énfasis en la rápida activación de la fibra permeabilizada sobre su transferencia desde la pre-activación para activar soluciones mientras se mantiene una fuerza constante iónica, composición catiónica, y la osmolaridad 6,29. Otros enfoques de la composición de la solución se han empleado con éxito notable por otros grupos de investigación y por lo general hacer uso de las constantes de unión publicados y herramientas computacionales 27,30,31. Las concentraciones de iones de calcio en las diversas soluciones de activación es particularmente importante en los estudios que implican la activación submáxima tales como evaluaciones de fuerza-PCA. Para los experimentos en los que las fibras están totalmente activadas, tales como las describird aquí, la concentración de calcio en la solución de activación normalmente supera por un margen cómodo que requiere para lograr la máxima fuerza, por lo que su conocimiento preciso menos crítica. La adición de fosfato de creatina es importante para amortiguar las fluctuaciones intramyofibrillar ATP y ADP que de otro modo estarían asociados con la actividad contráctil. Se requiere creatina quinasa para catalizar la transferencia de fosfato a partir de fosfato de creatina al ADP. Bajo condiciones experimentales que dan lugar a altas tasas de rotación de ATP, incluyendo el trabajo a altas temperaturas o medir acortamiento de alta velocidad en las fibras rápidas 32, la creatina quinasa debe ser añadido a la solución para complementar la creatina quinasa endógena que permanece unido a la fibra. Para las condiciones experimentales menos exigentes, el sistema de regeneración de ATP es menos crítico 27.
Limitaciones de la técnica de una sola fibra permeabilized incluyen los siguientes. Los datos generados por estas pruebas definen elpropiedades contráctiles de la unidad miofibrilar específico que se une al aparato experimental. En consecuencia, esta captura sólo una pequeña fracción de toda la fibra multinucleadas del que se obtuvo el segmento que, a su vez, representa una pequeña fracción del número total de fibras dentro del músculo. Por tanto, los investigadores deben considerar cuidadosamente el muestreo necesario para apoyar las conclusiones extraídas de los experimentos. Además, la evaluación del impacto de una intervención práctica de ejercicio en función de la fibra presume que las fibras evaluadas fueron efectivamente reclutados durante el entrenamiento. Aunque el protocolo intenta imitar el medio intracelular natural de la fibra, el proceso de permeabilización sarcolema no es específica y necesariamente permite constituyentes intracelulares solubles para difundir libremente en las soluciones de baño. Una consecuencia adicional de la permeabilidad de la membrana es un cambio en el equilibrio osmótico se evidencia por una hinchazón en volumen de fibras 33. Loshinchazón de la fibra aumenta la distancia entre los filamentos de actina y miosina que resulta en reducción de la sensibilidad de calcio del sistema myofilament 34,35, pero puede ser revertida por la introducción de compuestos grandes, osmóticamente activos 34. Una limitación final a considerar es la consecuencia de la técnica utilizada para fijar las fibras al aparato experimental. Esto requiere invariablemente que distorsionan la relación espacial dentro del sistema de filamento en y cerca de los puntos de fijación, con la asistencia a los déficits funcionales. Específicamente, las regiones de la fibra en y adyacente a los puntos de fijación están funcionalmente comprometidas y por lo tanto contribuyen elasticidad serie de artefactos para el sistema de medición.
En resumen, hemos descrito un medio por el cual para evaluar la capacidad de generación de fuerza de las fibras musculares esqueléticas permeabilizadas químicamente in vitro. Aunque el foco de este artículo ha sido sobre la evaluación de la fuerza isométrica máxima generatincapacidad g de fibras de músculo esquelético humano, el enfoque experimental puede ser modificado y ampliado para determinar una variedad de parámetros cinéticos y las relaciones a través de una gama de especies de mamíferos, o de otra manera.
Divulgaciones
Production and free access to this article is sponsored by Aurora Scientific
Agradecimientos
This work was supported by the following funding sources: R01-AR063649, AG-020591, F31-AR035931.
Materiales
| Name | Company | Catalog Number | Comments |
| Polystyrene culture test tube with cap | Fisher Scientific | 14-956-3D | |
| 0.5 ml screw cap microcentrifuge | Fisher Scientific | 02-681-334 | |
| 0.5 ml microcentrifuge caps with o-ring | Fisher Scientific | 02-681-358 | |
| Microcentrifuge cryobox | Fisher Scientific | 5055-5005 | |
| pH meter | Mettler-Toledo | FE20 | |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Nonsterile-suture 10-0 monofilament | Ashaway Line Twine | S30002 | |
| Insect pins | Fine Science Tools | 26002-10 | |
| Forceps - Dumont #5 | Fine Science Tools | 11251-20 | |
| Microdissecting scissors | Fine Science Tools | 15000-08 | |
| Stereo microscope | Leica Microsystems | MZ8 | |
| Micrometer drives | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Aplha Omega Instruments | Series 800 | |
| LabVIEW software | National Instruments | - | |
| Computer | Varied | - | |
| Chamber system | Aurora Scientific | 802D | |
| Length-controller | Aurora Scientific | 312C | |
| Force-transducer | Aurora Scientific | 403A | |
| Reagents | |||
| K-proprionate | TCI America | P0510 | |
| Imadizole | Sigma-Aldrich | I0125 | |
| MgCl2•6H20 | Sigma-Aldrich | M2670 | |
| Brij 58 | Sigma-Aldrich | P5884 | |
| EGTA (acid) | Sigma-Aldrich | E0396 | |
| Na2H2ATP•0.56H2O | Sigma-Aldrich | A7699 | |
| Glycerol | Sigma-Aldrich | G6279 | |
| HEPES (acid) | Sigma-Aldrich | H7523 | |
| MgO | Sigma-Aldrich | 529699 | |
| HDTA (acid) | TCI America | D2019 | |
| CaCO3 | Sigma-Aldrich | C4830 | |
| NaN3 | Sigma-Aldrich | S8032 | |
| KOH (1 N) | Sigma-Aldrich | 35113 | |
| HCL (1 N) | Sigma-Aldrich | 318949 | |
| Na2CrP•4H2O | Sigma-Aldrich | P7936 | |
| pH 10 standard | Fisher Scientific | SB115 | |
| pH 7 standard | Fisher Scientific | SB107 | |
Referencias
- Mendias, C. L., Kayupov, E., Bradley, J. R., Brooks, S. V., Claflin, D. R. Decreased specific force and power production of muscle fibers from myostatin-deficient mice are associated with a suppression of protein degradation. J Appl Physiol. 111 (1), 185-191 (2011).
- Gumucio, J. P., Davis, M. E., Bradley, J. R., Stafford, P. L., Schiffman, C. J., Lynch, E. B., Claflin, D. R., Bedi, A., Mendias, C. L. Rotator cuff tear reduces muscle fiber specific force production and induces macrophage accumulation and autophagy. J Orthop Res. 30 (12), 1963-1970 (2012).
- Mendias, C. L., Roche, S. M., Harning, J. A., Davis, M. E., Lynch, E. B., Sibilsky Enselman, E. r., Jacobson, J. A., Claflin, D. R., Calve, S., Bedi, A. Reduced muscle fiber force production and disrupted myofibril architecture in patients with chronic rotator cuff tears. J Shoulder Elbow Surg. 1 (4), 111-119 (2015).
- Moss, R. L. Sarcomere length-tension relations of frog skinned muscle fibres during calcium activation at short lengths. J Physiol. 292, 177-192 (1979).
- Chase, P. B., Kushmerick, M. J. Effects of pH on contraction of rabbit fast and slow skeletal muscle fibers. Biophys J. 53, 935-946 (1988).
- Moisescu, D. G., Thieleczek, R. Calcium and strontium concentration changes within skinned muscle preparations following a change in the external bathing solution. J Physiol. 275, 241-262 (1978).
- Walker, S. M., Schrodt, G. R. I Segment lengths and thin filament periods in skeletal muscle fibers of the Rhesus monkey and the human. Anat Rec. 178, 63-81 (1974).
- Gollapudi, S. K., Lin, D. C. Experimental determination of sarcomere force-length relationship in type-1 human skeletal muscle fibers. J Biomech. 42, 2011-2016 (2009).
- Brenner, B. Technique for stabilizing the striation pattern in maximally calcium-activated skinned rabbit psoas fibers. Biophys J. 41 (1), 99-102 (1983).
- Claflin, D. R., et al. Effects of high and low-velocity resistance training on the contractile properties of skeletal muscle fibers from young and older humans. J Appl Physiol. 111, 1021-1030 (2011).
- Lynch, G. S., Faulkner, J. A., Brooks, S. V. Force deficits and breakage rates after single lengthening contractions of single fast fibers from unconditioned and conditioned muscles of young and old rats. Am J Physiol Cell Physiol. 295, C249-C256 (2008).
- Frontera, W. R., Rodriguez Zayas, A., Rodriguez, N. Aging of human muscle: understanding sarcopenia at the single muscle cell level. Phys Med Rehabil Clin N Am. 23, 201-207 (2012).
- Malisoux, L., Francaux, M., Theisen, D. What do single-fiber studies tell us about exercise training. Med Sci Sports Exerc. 39 (7), 1051-1060 (2007).
- Widrick, J. L., Stelzer, J. E., Shoepe, T. C., Garner, D. P. Functional properties of human muscle fibers after short-term resistance exercise training. Am J Physiol Regulatory Integrative Comp Physiol. 238, 408-416 (2002).
- Trappe, S. Effects of spaceflight, simulated spaceflight and countermeasures on single muscle fiber physiology. J Gravit Physiol. 9 (1), 323-326 (2002).
- Malisoux, L., Jamart, C., Delplace, K., Nielens, H., Francaux, M., Thiesen, D. Effect of long-term muscle paralysis on human single fiber mechanics. J Appl Physiol. 102, 340-449 (2006).
- Krivickas, L. S., Walsh, R., Amato, A. Single muscle fiber contractile properties in adults with muscular dystrophy treated with MYO-029. Muscle Nerve. 39, 3-9 (2009).
- Russell, A. J., et al. Activation of fast skeletal muscle troponin as a potential therapeutic approach for treating neuromuscular diseases. Nature Medicine. 18 (3), 352-356 (2012).
- Krivickas, L. S., Yang, J. I., Kim, S. K., Frontera, W. R. Skeletal muscle fiber function and rate of disease progression in amyotrophic lateral sclerosis. Muscle Nerve. 26, 636-643 (2002).
- Mendias, C. L., Marcin, J. E., Calerdon, D. R., Faulkner, J. A. Contractile properties of EDL and soleus muscles of myostatin-deficient mice. J Appl Physiol. 101, 898-905 (2006).
- Lynch, G. S., Rafael, J. A., Chamberlain, J. S., Faulkner, J. A. Contraction-induced injury to single permeabilized muscle fibers from mdx, transgenic mdx and control mice. Am J Physiol Cell Physiol. 279, 1290-1294 (2000).
- Mizunoya, Q., Wakamatsu, J., Tatsumi, R., Ikeuchi, Y. Protocol for high-resolution separation of rodent myosin heavy chain isoforms in a mini-gel electrophoresis system. Anal Biochem. 377, 111-113 (2008).
- Hill, A. V. The heat of shortening and the dynamic constants of muscle. Proc R Soc Lond B Biol Sci. 126, 136-195 (1938).
- Bottinelli, R., Canepari, M., Pellegrino, M. A., Reggiani, C. Force-velocity properties of human skeletal muscle fibres: myosin heavy chain isoform and temperature dependence. J Physiol. 495, 573-586 (1996).
- Edman, K. A. The velocity of unloaded shortening and its relation to sarcomere length and isometric force in vertebrate muscle fibres. J Physiol. 291, 143-159 (1979).
- Brenner, B., Eisenberg, E. Rate of force generation in muscle: Correlation with actomyosin ATPase activity in solution. PNAS. 83, 3542-3546 (1986).
- Moss, R. L. The effect of calcium on the maximum velocity of shortening in skinned skeletal muscle fibres of the rabbit. J. Muscle Res. Cell Motil. 3, 295-311 (1982).
- Pate, E., Wilson, G. J., Bhimani, M., Cooke, R. Temperature dependence of the inhibitory effects of orthovanadate on shortening velocity in fast skeletal muscle. Biophys J. 66, 1554-1562 (1994).
- Ashley, C. C., Moisescu, D. G. Effect of changing the composition of the bathing solutions upon the isometric tension-pCa relationship in bundles of crustacean myofibrils. J Physiol. 270, 627-652 (1977).
- Godt, R. E. Calcium-activated tension of skinned muscle fibers of the frog. Dependence on magnesium adenosine triphosphate concentration. J Gen Physiol. 63, 722-739 (1974).
- Fabiato, A., Fabiato, F. Calculator programs for computing the composition of the solutions containing multiple metals and ligands used for experiments in skinned skeletal muscle cells. Journal de Physiologie (Paris). 75, 463-505 (1979).
- Chase, P. B., Kushmerick, M. J. Effect of physiological ADP concentrations on contraction of single skinned fibers from rabbit fast and slow muscles). Am J Physiol. 268, C480-C489 (1995).
- Godt, R. E., Maughan, D. W. Swelling of skinned muscle fibers of the frog. Biophysical Journal. 19, 103-116 (1977).
- Kawai, M., Wray, J. S., Zhao, Y. The effect of lattice spacing change on cross-bridge kinetics in chemically skinned rabbit psoas muscle fibers. Biophys J. 64, 187-196 (1993).
- Millman, B. M. The filament lattice of striated muscle. Physiol Rev. 78 (2), 359-391 (1998).
- Edman, K. A. Contractile properties of mouse single muscle fibers, a comparison with amphibian muscle fibers. J Exp Biol. 208, 1905-1913 (2005).
- Phillips, S. K., Woledge, R. C. A comparison of isometric force, maximum power and isometric heat rate as a function of sarcomere length in mouse skeletal muscle. Pflügers Archiv. 420, 578-583 (1992).
- Stephenson, D. G., Williams, D. A. Effects of sarcomere length on the force-pCa relation in fast and slow-twitch skinned muscle fibres from the rat. J Physiol. 333, 637-653 (1982).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados