Method Article
Misurazione della massima isometrica forza generata dal permeabilizzate scheletrici fibre muscolari
In questo articolo
Riepilogo
Analisi delle proprietà contrattili delle fibre muscolari chimicamente dalla pelle, o permeabilizzate, scheletriche offre un potente strumento con cui valutare la funzione muscolare a livello della cellula muscolare singolo. In questo articolo descriviamo una tecnica valida e affidabile per preparare e testare permeabilizzate fibre muscolari scheletriche in vitro.
Abstract
Analysis of the contractile properties of chemically skinned, or permeabilized, skeletal muscle fibers offers a powerful means by which to assess muscle function at the level of the single muscle cell. Single muscle fiber studies are useful in both basic science and clinical studies. For basic studies, single muscle fiber contractility measurements allow investigation of fundamental mechanisms of force production, and analysis of muscle function in the context of genetic manipulations. Clinically, single muscle fiber studies provide useful insight into the impact of injury and disease on muscle function, and may be used to guide the understanding of muscular pathologies. In this video article we outline the steps required to prepare and isolate an individual skeletal muscle fiber segment, attach it to force-measuring apparatus, activate it to produce maximum isometric force, and estimate its cross-sectional area for the purpose of normalizing the force produced.
Introduzione
La funzione primaria del muscolo scheletrico è di generare forza. Forza muscolare è suscitato in vivo attraverso una complessa sequenza di eventi che comprende i potenziali nervose motorie azione, la trasmissione neuromuscolare, potenziali d'azione delle fibre muscolari, il rilascio di calcio intracellulare, e l'attivazione del sistema di proteine regolatrici e contrattili. Poiché la generazione di forza è il risultato finale di questa sequenza, un deficit in forza potrebbe essere causato da guasto di una o più delle singole fasi. Una caratteristica fondamentale della preparazione di fibre permeabilizzate è che elimina la maggior parte dei passaggi necessari per la generazione di forza in vivo, con solo le funzioni di regolamentazione e contrattili associati con l'apparato miofibrillare residuo. L'investigatore si assume il controllo della consegna di attivare calcio e di energia (ATP), e viene ricompensato con un sistema semplificato che consente la valutazione dei isolate strutture normative e contrattili nella loro co nativonfiguration. Le misurazioni della forza utilizzando fibre muscolari scheletriche permeabilizzate sono quindi preziosi nel valutare alterazioni della funzione muscolare osservata in vivo. Per esempio, abbiamo usato questa tecnica per caratterizzare la capacità di forza generatrice di fibre da miostatina topi deficienti 1 e per valutare la causa della debolezza muscolare persistente esposto seguente rotatori cronica della cuffia lacrime 2,3.
Metodologia fibra permeabilizzate moderna può essere fatta per primi studi autorevoli 4,5 ed è attualmente in uso da parte di un certo numero di gruppi di ricerca. Sebbene le tecniche sono state descritte in letteratura, che non sono ancora stati presentati in formato video. L'obiettivo di questo articolo è quello di illustrare una versione aggiornata, tecnica valida e affidabile per misurare la capacità massima forza generatrice di singole fibre da campioni muscolari scheletriche permeabilizzate chimicamente. Per realizzare ciò, un segmento singola fibra (qui indicata come ̶0; fibre ") viene estratto da un fascio pre-permeabilizzate di fibre e posto in una camera sperimentale contenente una soluzione rilassante, la caratteristica principale che è una concentrazione di calcio che è <10 nM. La fibra viene quindi collegato ad una estremità ad una forza-trasduttore e all'altra estremità ad un regolatore di lunghezza. Con la fibra presso una lunghezza ottimale sarcomere, viene trasferito a una soluzione attivante che ha una concentrazione di calcio sufficiente per provocare la massima forza di attivazione e quindi massima contrazione isometrica. Dati Force sono acquisiti, archiviati e analizzati utilizzando un personal computer.
Protocollo
Tutte le procedure che coinvolgono soggetti animali o umani dovrebbero essere effettuate in conformità alle linee guida, regolamenti, e le agenzie di regolamentazione. L'Università del Michigan Comitato per l'uso e la cura degli animali (UCUCA) e l'Università del Michigan Medical Center Institutional Review Board ha approvato tutte le procedure umane descritte in questo articolo e animali.
1. Fare dissezione e di memoria Stock Solution
Nota: I volumi finali specificate nei seguenti istruzioni possono essere scalati verso l'alto o verso il basso, se lo desideri.
- In un becher da 1000 ml aggiungere 800 ml di acqua deionizzata (ASTM Tipo 1). Il mantenimento di un scalpore dolce, aggiungere tutti i composti elencati nella tabella 1 per l'acqua deionizzata e permettere loro di sciogliere.
Composto Desiderato Conc. (M) Formula Peso (g / mol) Aggiungere a 1 L (g) K-propionato 0.250 112.17 28,040 Imidazolo 0.040 68.08 2.720 EGTA 0,010 380,40 3.800 MgCl 2 • 6H 2 O 0.004 203,31 0.813
Tabella 1: dissezione e magazzino soluzione di storage componenti.
- Portare a un volume finale di 1000 ml con acqua deionizzata. Si noti che non è necessario pH della soluzione in questo momento. Conservare la soluzione di riserva a 4 ° C.
2. Fare soluzione di storage
- Per fare 200 ml di soluzione di archiviazione, iniziare con 100 ml di dissezione e soluzione di storage magazzino in un bicchiere da 250 ml. Aggiungere sufficiente Na 2 H 2 ATP per portare adenosina finaletrifosfato (ATP) concentrazione di 2 mM. Portare a un volume finale di 200 ml con glicerolo. Regolare a pH 7,00 con idrossido di potassio (KOH). Conservare la soluzione di storage a -20 ° C.
Nota: A causa della natura viscosa di glicerolo può essere difficile per erogare con precisione in volume. A causa di questo, di solito aggiunge glicerolo in peso (100 ml di glicerolo pesa circa 126 g).
3. Fare dissezione Solution
- Per fare 200 ml di soluzione di dissezione, iniziare con 100 ml di soluzione madre dissezione e stoccaggio in un becher da 250 ml.
- Aggiungere sufficiente Na 2 H 2 ATP per portare concentrazione finale di ATP a 2 mM. Regolare il pH a 7,00 con KOH. Portare il volume finale a 200 ml con acqua deionizzata. Aliquota dei volumi di 2,5 ml e conservare a -80 ° C.
4. Fai dissezione Soluzione con Brij 58
Nota: Brij 58 è un detergente non ionico che sconvolge (permeabilizes) doppi strati lipidici.
- Per fare 200 ml di soluzione di dissezione con Brij 58, iniziare con 200 ml della soluzione di dissezione in un becher da 250 ml. Il mantenimento di un scalpore dolce, aggiungere 1 g di Brij 58 (0,5% w / v) alla soluzione dissezione e farlo sciogliere. Aliquota dei volumi di 2,5 ml e conservare a -80 ° C.
5. Fare Soluzioni per prove
Nota: La seguente è adattato da Moisescu e Thieleczek 1978 (6). Si veda la discussione per ulteriori commenti sulla preparazione di soluzioni di test.
- Preparare tre distinte 1.000 ml bicchieri etichettati "Rilassante", "Pre-attivazione" e "Attivazione". Aggiungere 400 ml di acqua deionizzata in ogni beaker.
- Aggiungere i composti indicati nella tabella 2 nel becher appropriato e quindi riscaldare la soluzione a tra 70 ° C e 80 ° C. Mantenere una temperatura della soluzione di 70-80 ° C per 30 min agitando continuamente.
Nota: una temperatura di 70-80 ° C favorisce la eliminazione dell'acido carbonico formato dalla reazione di carbonato di calcio con EGTA nella soluzione attivante. Le rilassanti soluzione soluzioni e pre-attivazione vengono trattati nello stesso modo come la soluzione attivante per mantenere la coerenza.
| SOLUZIONE RILASSANTE | PRE-ATTIVAZIONE SOLUZIONE | ATTIVAZIONE SOLUZIONE | |||||
| Composto | Formula Peso (g / mol) | Concentrazione desiderata (mm) | Richiesto Massa (g) | Concentrazione desiderata (mm) | Richiesto Massa (g) | Concentrazione desiderata (mm) | Richiesto Massa (g) |
| HEPES (acido) | 238,30 | 90.0 | 10,724 | 90.0 | 10,724 | 90.00 | 10,724 |
| MgO | 40.31 | 10.3 | 0,208 | 8.5 | 0,171 | 8.12 | 0,164 |
| EGTA (acido) | 380,40 | 52.0 | 9,890 | 52.00 | 9,890 | ||
| HDTA (acido) | 348,36 | 50.0 | 8,709 | ||||
| CaCO3 | 100.10 | 50.00 | 2.503 | ||||
Tabella 2: Relaxing, pre-attivazione e attivazione componenti della soluzione.
- Raffreddare la soluzione a temperatura ambiente e aggiungere sufficiente NaN 3 / KOH per portare la concentrazione finale NaN 3 a 1 mM.
ATTENZIONE: NaN 3 (sodio azide) è velenoso. Consultare la scheda di sicurezza chimica prima di maneggiare questa sostanza chimica.- Per fare 100 ml di 100 mM di soluzione di sodio azide, aggiungere 0,65 g di NaN 3 a 10 ml di 1 N KOH. Regolare ad un volume finale di 100 ml con acqua deionizzata.
- Regolare il pH a circa 7.10 con KOH.
- Seguendo passo 5.4 aggiungere sufficiente Na 2 H 2 ATP per portare la concentrazione finale di ATP a 8 mM e sufficiente Na 2 CrP per portare la creatina phosophate finale (CRP) concentrazione di 10 mM.
- Portare ogni soluzione al volume finale di 500 ml con acqua deionizzata. Freddo o riscaldare le soluzioni alla temperatura alla quale saranno eseguiti esperimenti, quindi utilizzare KOH per portareil pH a 7,10 mantenendo tale temperatura.
- Aggiungere la soluzione nel becher contenente la soluzione pre-attivazione relax tale che questa soluzione pre-attivazione è di 1 parte di soluzione in 500 soluzione pre-attivazione rilassante. Aliquota dei volumi di 2,5 ml e conservare a -80 ° C.
6. Fare sutura Loops
- Inizia con un filo di non sterile USP 10-0 monofilamento di nylon di sutura.
- Utilizzare le pinze per creare un ciclo con il filo con la tecnica della doppia nodo semplice. Ridurre il nodo per dimensioni, a circa 750 micron di diametro. Diametro Loop può essere valutata al microscopio con marcature oculare reticolo.
- Utilizzare microdissecting forbici per eliminare l'eccesso di sutura lasciando solo il ciclo e piccolo (500 micron) code su entrambi i lati. Un esempio di un ciclo finito è mostrato in Figura 1.
- Ripetere i passaggi sono stati fatti 6,2-6,3 fino a 4 cicli utilizzabili. Conservare loop in un silicone placcato elastomero petri piatto per uso futuro.
Nota: quattro cicli di sutura sono necessari per ogni fibra testato.
7. Bundle campione
Nota: Le seguenti operazioni descrivono la procedura per sezionare il campione originale in piccole "fasci" sperimentale da cui saranno eventualmente estratti e testati singole fibre. In ogni momento il campione deve essere trattato con cura. Ai fini della presente descrizione, le istruzioni saranno dati come se il ricercatore è di mano destra.
- Ottenere il campione di interesse e trasferirlo nella struttura dove dissezione avrà luogo.
Nota: I metodi di biopsia dei tessuti variano a seconda del modello sperimentale e disegno dello studio. Ove possibile, perfusione muscolare dovrebbe essere mantenuta fino al momento della biopsia. - Se il campione deve essere trasferita tra il sito di raccolta e il sito dissezione, trasportarlo in una fiala contenente soluzione dissezione refrigerate mentre mantenuto in ghiaccio.
- Preparare una capsula di Petri 5 centimetri elastomero siliconico placcato con soluzione di dissezione raffreddato e 2-3 perni di montaggio insetti (100 micron di diametro, in acciaio inox).
- Trasferire il campione al piatto. Assicurarsi che il campione rimanga sommersa con l'aggiunta di più soluzione di dissezione, se necessario.
- Controllare il campione al microscopio e manipolarlo per allineare gli assi longitudinali delle fibre verso la spalla destra del ricercatore (Figura 2). Poi ancorare il campione al piatto appuntando agli angoli.
Nota: Fare uso di qualsiasi tessuto connettivo rimanente come punti di ancoraggio in questo momento dato che questo ci permetterà di ottimizzare l'uso del campione e conservare l'integrità della fibra. Il bundle può essere bloccato in lieve tensione per contribuire a definire margini tra fibra. - Con la pinza nella mano sinistra e le forbici microdissecting nella destra, iniziare sezionare delicatamente un fascio lungo i margini longitudinali tra le fibre
Nota: A seconda della sualunghezza fuori tutto, sezionare ulteriormente il fascio in numerosi fasci più piccoli. - Assicurarsi che le dimensioni del pacco misurano circa 0,5-1 mm di larghezza e ≥3 mm di lunghezza. Valutare le dimensioni utilizzando un microscopio con le marcature del reticolo nell'oculare, o mettendo un righello sotto il piatto.
- Rimuovere e scartare qualsiasi tessuto che viene danneggiato dalle pinze o perni a seguito del processo di dissezione.
- Ripetere il processo fino a quando un numero sufficiente di fasci sono stati sezionati o fino a quando il campione è stato esaurito.
Nota: Il numero di fasci ottenibili dipendono da numerosi fattori tra cui la dimensione e la condizione del campione iniziale, la morfologia del muscolo, e l'abilità del ricercatore.
8. Fibre permeabilize
- Trasferire i fasci dalla soluzione dissezione in un flaconcino contenente 2,5 ml di acqua refrigerata, soluzione fresca, sezionando con il detergente non ionico 'Brij 58' aggiunto(0,5%, w / v). Incubare in ghiaccio per 30 minuti, con occasionale, agitazione. Assicurarsi che i fasci rimangano sommerse durante l'incubazione.
- Alla fine dei 30 minuti di incubazione, trasferire i fasci per una fiala contenente la soluzione dissezione fresco (senza Brij 58) e agitare delicatamente e brevemente per rimuovere eventuali residui di detersivo.
9. Preparare Bundles per l'archiviazione
- Trasferire i fasci per una fiala contenente la soluzione di stoccaggio refrigerata e incubare una notte a 4 ° C.
10. Conservare Bundles
- Il giorno seguente, preparare una scatola di immagazzinaggio, in grado di sopportare -80 ° C, con un numero sufficiente singole da 0,5 ml a vite tubi conici tappo per accogliere tutti i bundle ottenuti durante il processo di dissezione (un fascio per provetta). Ogni tubo conico deve essere riempito con 200-400 ml di soluzione di storage fresco.
- Trasferire i fasci nei tubi coniche etichettate singolarmente. Assicurarsi che il pacchetto non è bloccato ail lato del tubo conico o galleggianti sulla superficie della soluzione. Tappare le provette coniche e conservare i campioni a -80 ° C fino al giorno del test.
11. Preparare apparato sperimentale
Nota: L'apparecchio personalizzato è composto da una fase che ospita un regolatore di lunghezza e trasduttore di forza, un sistema di camera di movimento e un microscopio dissezione 10X. Impianti di trasmissione Micrometro consentono la manipolazione precisa delle superfici di fissaggio in fibra. Figure di diffrazione laser sono utilizzati per stimare la lunghezza sarcomero. I dati generati durante la sperimentazione sono registrati su un personal computer. Fare riferimento alla Figura 3 per le immagini con annotazioni del set-up sperimentale.
- Scongelare una fiala ciascuna delle soluzioni attivando rilassante, pre-attivazione e e mantenere in ghiaccio. Si noti che l'ATP e CrP sono composti labili che dovrebbero essere mantenuti a temperature fredde.
- Preparare il microscopio, apparecchiatura di prova e il computer associato all'uso.
- Riempire la prima camera sperimentale con una soluzione rilassante. Nel nostro apparato, la prima camera contiene prismi che permettono al ricercatore di fotografare la fibra dal lato. Riempire la seconda camera sperimentale con una soluzione pre-attivazione e la terza con l'attivazione di una soluzione.
- Regolare la temperatura in modo che il display termometro in-camera di lettura 15 ° C. Discussione due anelli di sutura preparate sulle superfici di fissaggio in acciaio inossidabile che si estendono sia dalla forza trasduttore e lunghezza controller (Figura 5A).
12. Estratto permeabilizzate fibra singola
- Scongelare un fascio di fibre di interesse, e il trasferimento di una capsula di Petri elastomero siliconico placcato con fresco, soluzione rilassante refrigerati. Fissare il bundle con perni alle due estremità e assicurarsi che sia sommersa.
- Utilizzando le pinze, afferrare una fibra ad una estremità e cominciare uniformemente estraendolo lungo il suo asse longitudinale.
Nota: i danni alla compressione alall'estremità della fibra causato dalle pinze non è una preoccupazione in questo momento dato che non saranno testati le proprietà contrattili in questa zona. Si deve, tuttavia, essere presa quando si estraggono fibre dal fascio dal aderenze tra le fibre e la matrice extracellulare può causare eccessiva tensione, portando in definitiva danni per allungare-indotta. Si noti che esiste una notevole variabilità tra muscoli nella misura in cui le fibre aderiscono alla matrice extracellulare circostante. Fibre che si sospetta siano stati danneggiati da tale tratto devono essere eliminati. - Utilizzare una lama di rasoio o bisturi per modificare un puntale come mostrato nella (Figura 4). Introdurre la fibra nella punta con una piccola quantità di soluzione rilassante. Trasferire la singola fibra dal Petri elastomero siliconico placcato alla camera sperimentale che contiene la soluzione rilassante.
13. Monte Fibra singola
Nota: A depicti step-by-stepsu possono essere visualizzati nella figura 5.
- Guida leggermente con le pinzette, rimuovere la fibra dalla punta della pipetta e ancorarlo al regolatore di lunghezza (a sinistra) con il primo ciclo di sutura.
- Utilizzare un unico movimento fluido quando stringendo il cappio con le pinze. Assicurarsi che una tensione uguale e contraria viene applicato alle estremità della sutura.
- Il primo ciclo deve essere legato circa 1 mm a 2 mm dall'estremità della superficie di fissaggio lunghezza controller.
- Manipolare l'altra estremità della fibra verso il trasduttore di forza (a destra) e fissare la fibra utilizzando la stessa procedura. Rimuovere l'eccesso di sutura con le forbici microdissecting (Figura 5C).
- Posizionare la fibra in una piccola quantità di tensione, aumentando la distanza tra la lunghezza-controllore e forza il trasduttore braccia con l'ascissa azionamento micrometro (Figura 3A).
- Infilare il secondo anello sopra il primo e ancorare la fibrain un punto entro 0,2 mm della fine della superficie di fissaggio forza-trasduttore (Figura 5D).
- Rimuovere l'eccesso di sutura con le forbici microdissecting.
- Il processo di attaccamento fibra può causare la perdita di soluzione dalla camera. Se necessario, aggiungere la soluzione più rilassante per garantire la superficie della soluzione è piatta (né concava nè convesso). Una superficie piana è importante nella valutazione lunghezza sarcomero utilizzando diffrazione laser.
- Allineare la fibra parallela alle pareti laterali della camera sperimentale regolando la posizione del regolatore di lunghezza in direzione y.
- Rilevare la fibra utilizzando la vista laterale del prisma e regolare la posizione della lunghezza controller in direzione dell'asse Z fino alla fibra è parallelo al pavimento della camera.
Nota: Posizionamento della fibra parallela al pavimento della camera può essere realizzato senza prismi camera concentrandosi prima su un'estremità della fibra e tgallina, senza regolare la messa a fuoco del microscopio, portando l'altra estremità della fibra a fuoco usando la sua unità micrometro asse z. - Se la fibra è in alcun modo contorto, attorcigliato o danneggiato come risultato del processo di montaggio, la fibra deve essere eliminata ed una nuova fibra collegato.
14. Imposta ottimale sarcomere Lunghezza
- Quando la fibra è stata allineata correttamente all'interno della camera, inserire la schermata di destinazione calibrato sulla faccia anteriore del microscopio e allinearlo sulla prima camera sperimentale.
Nota: La schermata di destinazione viene calibrato utilizzando l'equazione reticolo standard λ = SL sinθ, dove SL è lunghezza sarcomero, θ è l'angolo di diffrazione tra 0 ° e 1 ° fasci diffratti e λ è la lunghezza d'onda del laser. - Accendere il laser e regolare la posizione della fase tale che il laser passa attraverso il centro della fibra.
ATTENZIONE: Concentrato luce laser può essere dannoso to la vista. Non tentare di visualizzare la fibra attraverso il microscopio quando il laser è acceso. - Posizionare la fibra rispetto al fascio laser per diffrangere la luce laser ed osservare un patter interferenza sullo schermo di destinazione calibrato (Figura 6). Spegnere le luci per visualizzare questo modello in modo più chiaro.
Nota: Se, con il corretto posizionamento del fascio laser, nessun modello di interferenza è visto, questo suggerisce che i componenti miofibrillari della fibra sono alterata / danneggiata e che la fibra deve essere sostituito con uno nuovo. - Per impostare la lunghezza sarcomero, aumentare o diminuire la tensione sulla fibra utilizzando la lunghezza-controllore dell'unità micrometro ascisse fino alla spaziatura desiderata della luce diffratta è osservata sullo schermo di destinazione.
Nota: La lunghezza sarcomero ottimale della fibra dipende dalla specie di animale da cui è stato ottenuto il campione. Una lunghezza sarcomero di 2,7 micron è comunemente assunto come ottimale quando asinicantare fibre da 7,8 tessuti umani. - Dopo lunghezza ottimale sarcomero è stata impostata, misurare la distanza tra i due punti di sutura più interne. Questo è più facilmente ottenibile utilizzando il display digitale sull'unità micrometrica che controlla il movimento x-asse della camera. Posizionare la camera in modo tale che il reticolo verticale dell'oculare è allineato al confine più interna della sutura più interno e azzerare la lettura digitale sull'unità micrometro.
- Tradurre la fase lungo l'asse x rispetto al microscopio fino a raggiungere l'altra più interna suture. Il display digitale indicherà la lunghezza della fibra. Questo valore deve essere registrato come lunghezza delle fibre, L f.
Nota: Si deve comprendere che la distanza tra i due punti di sutura più interni determina la lunghezza funzionale del tessuto contrattile in corso di valutazione. L'investigatore dovrebbe sforzarsi per la coerenza in questa dimensione (cioè L f) all'interno di unserie di esperimenti.
15. Stima trasversale Area (CSA)
- Mantenere la fibra a L f e utilizzare la fotocamera montata microscopio per acquisire un'immagine alto ingrandimento della porzione centrale della fibra sia dalla parte superiore e laterale. Immagini vista laterale possono essere acquisite utilizzando il prisma incorporato nel lato della camera.
Nota: Quando si passa fra la parte superiore e laterale è importante per spostare il microscopio solo nella direzione y per garantire che le due immagini sono "a registro" e quindi mostrano due viste diverse della stessa sezione della fibra. - Ottenere misurazioni in questo momento di normalizzare forza assoluta successivamente nello studio. Le tecniche per l'ottenimento di tali misurazioni sono descritti più avanti e illustrati nelle figure 7A e 7B.
16. Elicit isometrica Contrazione
Nota: Mentre i dati generati nel corso di questi esperimentis possono essere raccolte e interpretati senza l'uso di un computer, un software che consente l'acquisizione, visualizzazione, memorizzazione e analisi delle risposte di forza è vantaggiosa. Il software LabVIEW personalizzato creato da nostro laboratorio consente queste funzioni, nonché la capacità di design 'treni Motion' che governano l'azione del regolatore di lunghezza durante un esperimento.
- Verificare che la temperatura del relax, pre-attivazione e soluzioni attivatori sono stabili a 15 ° C.
- Utilizzare il software di controllo della camera di spostare la fibra alla camera contenente la soluzione pre-attivazione e incubare per 3 min.
Nota: La soluzione pre-attivazione è debolmente spone di Ca 2+, con conseguente attivazione e forza molto rapido sviluppo sulla introduzione della fibra alla soluzione attivante. - Con 10 sec rimanente nella soluzione pre-attivazione e la lunghezza della fibra mantenuta a L f, stabilire uno zero folivello rce nel record sperimentale.
Nota: Il movimento 'Trova forza zero' del-regolatore lunghezza rivela il livello di forza-trasduttore che corrisponde alla forza zero (cioè la fibra diventa brevemente allentamento a seguito del movimento). La forza passiva è la differenza tra lo zero e il livello di forza appena prima del movimento-trasduttore azzeramento. - Alla fine del 3 min, spostare la fibra alla camera contenente la soluzione attivante e consentire massima forza isometrica per sviluppare come evidenziato da un plateau vigente che è preceduta da un rapido aumento.
- Dopo aver raggiunto la massima forza isometrica, utilizzare il controller di lunghezza per identificare la forza prodotta trasduttore che corrisponde alla forza zero nella camera contenente la soluzione attivante.
Nota: Ciò è necessario perché la forza prodotta trasduttore che corrisponde alla forza zero è, in generale, diverso per ogni camera di soluzione-riempita. - Dopo il raggiungimento di una seconda forza plateau, restituire la fibra alla camera contenente la soluzione rilassante. Il test è ora completa. Per provare più fibre durante qualsiasi aspirare una sessione tutte le soluzioni e aggiungere nuove soluzioni refrigerate.
Nota: i protocolli di ciclismo del Brennero dovrebbero essere considerati quando suscitare contrazioni massimali per un periodo di tempo prolungato. Questo protocollo è stato dimostrato per conservare le proprietà strutturali e meccaniche della fibra massimo attivato 9.
Risultati
Sano, permeabilizzate chimicamente singole fibre dovrebbero apparire uniformi in forma e avere una spaziatura striatura coerente se visto sotto alto ingrandimento. Fibre che sono inflessibile quando manipolato con le pinze o hanno evidenti danni strutturali devono essere eliminate.
Alto ingrandimento immagini digitali scattate durante la fase 15 vengono analizzati per 5 misure di diametro accoppiati lungo la parte centrale della fibra. Fibra CSA calcola assumendo una sezione trasversale ellittica e una media di 5 misurazioni individuali CSA come illustrato nella Figura 7A. Figura 7B serve anche a illustrare come dimensioni fibra in una vista può essere significativamente diverso rispetto a dimensioni associato nel altra vista (cioè, incrociata sezioni non sono, in generale, rotondo).
Rappresentativi forza tracce di fibre lente e veloci umani sono illustrati nelle figure 8A e 8B, rispettivamente. Voltage uscita della forza-trasduttore è acquisito durante un test e convertito forzare (mN) utilizzando software di acquisizione e analisi (LabVIEW). Figura 9 illustra l'approccio utilizzato per valutare la forza attiva massima (F o), che è calcolato sottraendo la forza richiesta per mantenere la fibra alla lunghezza ottimale sarcomere mentre in uno stato rilassato (forza passiva, F P), dalla massima forza isometrica sviluppato durante l'attivazione della fibra massimale (forza totale, F T). Poiché l'uscita del trasduttore di forza che corrisponde alla forza zero è, in generale, diverso per ciascuna delle diverse stanze da bagno, brevemente allentare la fibra sia nel pre-attivazione e attivare soluzioni di catturare il livello zero forza nel disco sperimentale. Normalizzazione della massima forza attiva da fibra CSA viene utilizzato per generare il valore più informativo di forza specifica (SF o). Poiché prende in considerazione la CSA della fibra, SF o fornisce una misura della capacità intrinseca forza generatrice dell'apparato contrattile della fibra, consentendo così confronti funzionali tra fibre di dimensioni diverse. Va tuttavia osservato che le misurazioni CSA non sono in grado di distinguere la proporzione della fibra occupata da filamenti contrattili contro la proporzione occupata da altre strutture subcellulari.
Caratteristiche tipiche di sano, fibre adulti di Claflin et al. 2011 10 per l'uomo, Mendias et al. 2011 1 per mouse e Gumucio et al. 2012 2 per ratto sono dettagliati in tabella 3. Tutti i dati riportati nella tabella 3 sono stati generati utilizzando il tecniche descritte in questo articolo.
| Umano (Vasto laterale) | Topo (EDL) | Ratto (Sottospinato) | ||||
| Maschio | Femminile | Maschio | Maschio | |||
| Tipo 1 | Tipo 2a | Tipo 1 | Tipo 2a | (Non digitato) | (Non digitato) | |
| CSA (micron 2) | 4880 - 6900 | 5270 - 8380 | 3870 - 5470 | 4010 - 5610 | 1850 - 3080 | 5290 - 8010 |
| F o (Mn) | 0,79-1,17 | 1,02-1,54 | 0,64-0,97 | 0,71-1,07 | 0,14-0,25 | 0,55-0,97 |
| sF o (kPa) | 142-182 | 165-210 | 156-193 | 172-214 | 67-94 | 102-131 |
| n | 129 | 160 | 149 | 207 | 37 | 94 |
Tabella 3. Caratteristiche tipiche di fibre, adulti sani dal vasto umano lateralis 10, mouse estensore lungo delle dita 1 e ratto infraspinato 2 muscoli. Lunghezze sarcomero ottimali sono stati fissati a 2,7 micron per le fibre umane 7,8 e 2,5 micron sia per mouse (36, 37) e le fibre di ratto (38). Gamme Sperimentale L F (25 ° e 75 th quartili) erano 1,39-1,73 mm, 1,17-1,53 mm e 1,32-1,59 mm rispettivamente per uomo, topo e ratto. Intervalli mostrati indicano il 25 e 75 th quartili e n è il numero di fibre testate.
I problemi più comuni emersi durante i test includono una scivolata cappio di sutura, che si traduce in una forza response con un "catturare" come quello illustrato in Figura 10A, e uno spessore rottura parziale o totale della fibra, che si traduce in una risposta forza che restituisce bruscamente verso o per (break) zero, mentre la fibra è ancora immersa in soluzione attivazione (Figura 10B). Se un lapsus, strappo o rottura si verifica nel corso di un esperimento, la fibra deve essere eliminata e esclusi i dati, pur mantenendo un record di fallimenti in fibra può anche essere informativo 11. Un altro risultato negativo che possono verificarsi è l'attivazione prematura della fibra mentre nel pre-attivazione della soluzione (Figura 10C). Attivazione parziale nella soluzione pre-attivante suggerisce un notevole contaminazione incrociata bene (cioè, un aumento non intenzionale della concentrazione di calcio nel pre-attivazione ben). In questo caso, tutte le vasche devono essere aspirati e risciacquati con acqua deionizzata. Asciugatura le superfici divisorie tra le camere è anche raccoded come umidità o condensa in queste aree può portare a traspirazione di soluzione tra bagni. La decisione di includere o escludere i dati dipende in ultima analisi l'attenzione sperimentale e devono pertanto essere considerati quando si progetta lo studio.

Figura 1: ciclo di sutura (10-0 monofilamento di nylon di sutura).

Figura 2:. Dissezione Bundle forcipe sono in mano sinistra, le forbici di microdissezione sono nella mano destra. Linea rossa indica l'orientamento favorevole del polso e forbici con gli assi longitudinali delle fibre.

Figura 3: (A) Apparecchio di prova con i componenti etichettati. (A) camere sperimentali con fondo trasparente. (B) Lunghezza-controller. (C) Forza-trasduttore. (D) sorgente luminosa. (E) di lunghezza controllore xyz auto micrometrica con display digitale. (F) unità Fase micrometrica con display digitale. (G) Forza trasduttore auto xyz micrometro. (H) Piattaforma per lo schermo l'obiettivo di laser-diffrazione calibrato. Tavolo isolamento (i) Vibrazione. (B) Close-up vista delle camere sperimentali. Di superficie (j) allegato in acciaio inox che si estende dal controller lunghezza. Di superficie (k) allegato in acciaio inox che si estende dalla forza-trasduttore. (L) Side-view prisma. (M) alloggiamento per moduli di raffreddamento termoelettrici. (N) termocoppia per la segnalazione di te da cameramperature.

Figura 4: Modificato 100 microlitri punta pipetta utilizzato per trasferire la fibra da piatto dissezione a camera sperimentale.
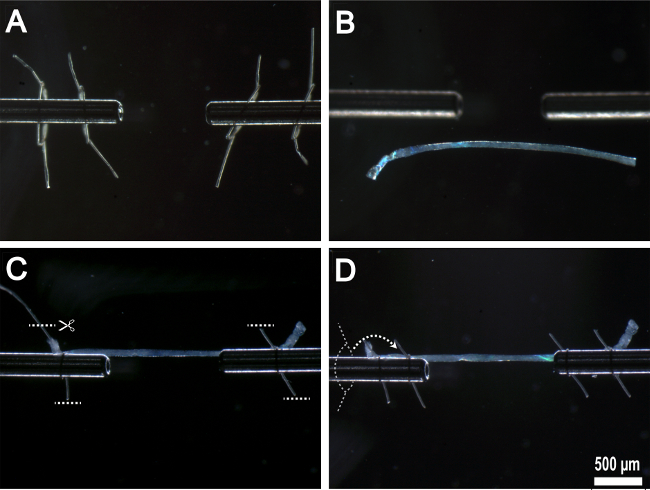
Figura 5:. Montaggio singola fibra su dispositivi sperimentali (A) loop di sutura preparati infilate su superfici di fissaggio in acciaio inox. (B) fibra trasferito alla camera sperimentale. (C) Fiber ancorata alle superfici di fissaggio di acciaio inossidabile dalla prima coppia di anelli di sutura con eccesso suture rimosso. (D) Seconda coppia di anelli di sutura filettati sulla sommità di loop prima sutura e legato in posizione.

Figura 6: lunghezza sarcomero è valutata dalla proiezione di un modello di interferenza laser su uno schermo di destinazione calibrato (a) sorgente laser.. (B) Mirror. (C) schermo di destinazione. Pattern di interferenza (d) Laser.
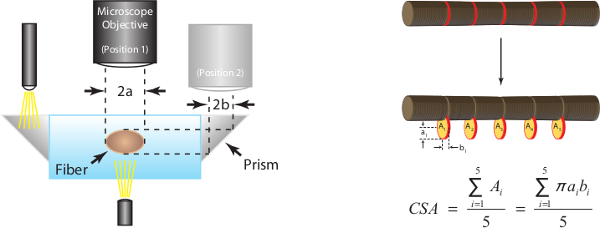
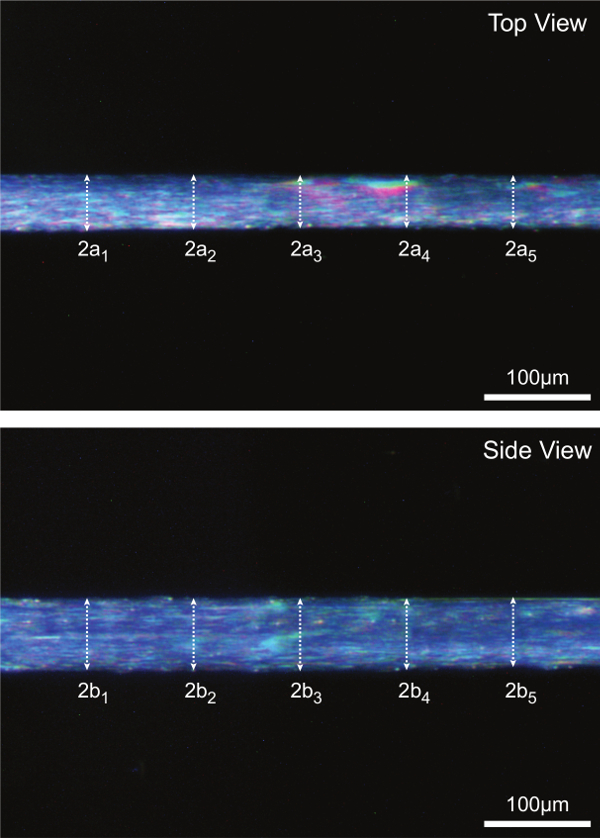
Figura 7: (A) Determinazione della zona della fibra in sezione ed in lunghezza ottimale sarcomero (umana = 2,7 um). Assumendo una sezione trasversale ellittica, CSA è calcolato per ciascuna delle cinque posizioni lungo la parte mediana fibra e la media dei cinque misurazioni individuali è segnalato come fibra CSA. 2a rappresenta top diametro vista ed è un asse dell'ellisse, 2b rappresenta vista laterale diametro ed è l'altro asse dell'ellisse. (B) immagini fibra Rappresentante illustrano ciascuna delle cinque misurazioni del diametro corrispondente, sia nella vista dall'alto e laterale.
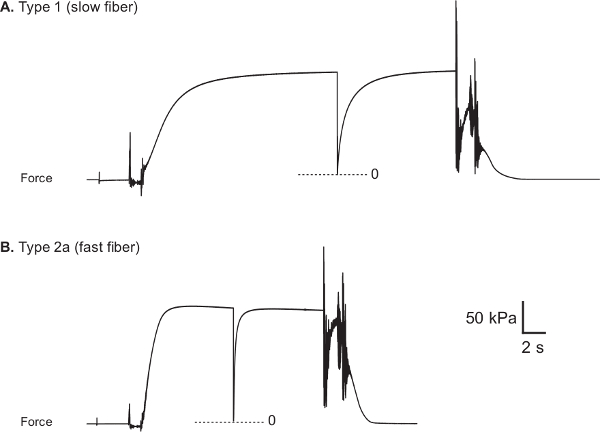
Figura 8: Rappresentante forza tracce di sano vasto umano lateralis fibre muscolari (A) Tipo 1 fibre (CSA: 5710 micron 2, F o: 0.89 milioni di euro e sF o: 156 kPa).. (B) Tipo fibra 2a (CSA: 9510 micron 2, F o: 1.66 mN e SF o: 174 kPa). Fibra miosina a catena pesante è stato determinato attraverso l'utilizzo di separazione elettroforetico e argento-colorazione tecniche 22.
OAD / 52695 / 52695fig9.jpg "/>
Figura 9: Calcolo della forza attiva massima (F o) (a), vista espansa della risposta forza fibra durante il-gioco che induce il movimento di lunghezza controller avviato in soluzione pre-attivazione.. F P è la forza richiesta per mantenere una lunghezza sarcomero di 2,7 micron con la fibra a riposo. (B) Vista estesa di lunghezza-controller di movimento-gioco che inducono. Si noti che F o F = T - F P.
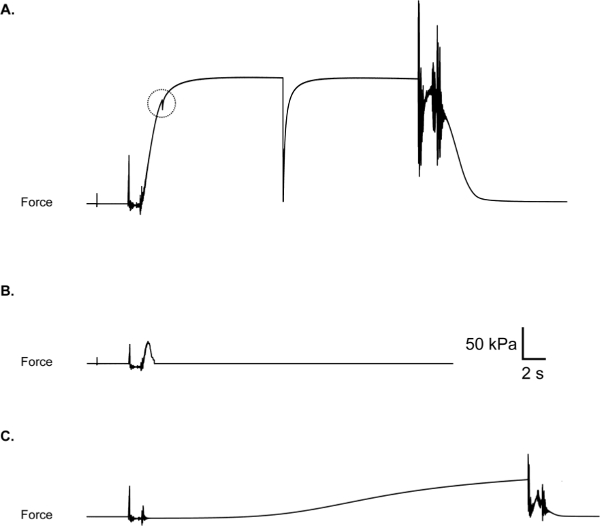
Figura 10: slittamento (A) cappio di sutura, evidenziato da un "fermo" in vigore traccia durante l'aumento di forza. Controllare per essere sicuri i cicli siano sicuri prima di attivare la fibra. (B) rottura della fibra durante l'attivazione. Può essere dovuta a integrità fibra poveri o trattamento fibra aggressivo durante sutura posto ciclomento. (C) l'attivazione della fibra parziale prematura a causa della contaminazione di camera di pre-attivazione con Ca 2+.
Discussione
Le valutazioni delle proprietà contrattili di fibre muscolari scheletriche singole permeabilizzate sono usati per studiare la funzione muscolare in un'ampia varietà di contesti. Alcuni esempi sono gli studi che hanno valutato gli effetti dell'invecchiamento 12, esercitare 10,13,14, 15 voli spaziali, lesioni 2,3,16, trattamenti farmacologici 17,18, malattie 19 e di manipolazione genetica 20,21 sulla struttura e la funzione delle fibre. A causa della capacità di valutare direttamente le prestazioni contrattile miofibrille nella loro configurazione nativa, questa tecnica fornisce una piattaforma interessante da cui formare una comprensione della funzione miofibrillare assente di effetti potenzialmente confondenti che sono presenti quando la trasmissione del segnale neuromuscolare e rilascio di calcio di eccitazione indotta sono inclusi nel sistema studiato. Inoltre, collaudo funzionale di singole fibre può essere utilizzato per integrare proteine contrattili risultati di identificazione come quelliottenuta attraverso immunoistochimica o elettroforesi su gel + Western Blot 22.
Una delle funzioni primarie del muscolo scheletrico è quello di generare forza. Conseguentemente sF o, una misura della capacità di forza generatrice intrinseca di un sistema di contrazione, è di grande interesse per fisiologi muscolari. Stime attendibili di sF o richiedono misure accurate di entrambi fibra CSA e F o. Poiché le fibre sono, in generale, non circolare in sezione trasversale, né uniformi in CSA lungo la loro lunghezza, molta cura deve essere presa nella stima CSA. A tal fine, le misurazioni vengono effettuate a diverse posizioni lungo la lunghezza della fibra e, in ogni posizione, da due prospettive separate di 90 °. Misure affidabili di F o richiedono attenzione ai diversi dettagli, tra cui la contabilità per forza passiva, regolando la lunghezza sarcomero per massimizzare sovrapposizione di filamenti spessi e sottili, impiegando una soluzione attivante con una concentrazione di calcio trisultati cappello di attivazione massima, mantenendo la temperatura desiderata sperimentale, e mantenere condizioni ottimali (temperatura e durata) delle fibre precedenti il giorno dell'esperimento.
Mentre la procedura descritta descrivono la procedura di valutazione massima forza isometrica, è spesso desiderabile per valutare altri importanti caratteristiche funzionali delle fibre muscolari scheletriche. Ciò può essere ottenuto estendendo il protocollo sperimentale per includere ulteriori manipolazioni meccaniche della fibra. Ad esempio, la misurazione della velocità con cui la fibra accorcia contro una serie di carichi diversi permette di determinare il rapporto forza-velocità, da cui i rapporti forza potenza e velocità-potenza possono essere calcolati 10,23,24. Inoltre, la velocità di accorciamento a vuoto può essere determinato utilizzando il "test slack" 25, che consistono di applicare una serie di passaggi di accorciamento-allentamento indurre e misng il tempo richiesto dalla fibra per eliminare l'allentamento. Un altro parametro cinetica che viene spesso segnalato è k tr, la costante di velocità per la forza di riqualificazione a seguito di una perturbazione meccanica che distacca temporaneamente tutti crossbridges 26. Infine, il rapporto tra la concentrazione di calcio e la generazione forza attiva (la "relazione forza-APC") è spesso di interesse 18 e può essere determinata esponendo la fibra ad una serie di soluzioni con concentrazioni di calcio che vanno da sotto la soglia di attivazione del contractile Sistema a quelli sufficienti per suscitare massima attivazione e quindi la massima forza (F o).
Anche se gran parte del materiale di cui è necessaria per valutare la contrattilità singola fibra, altre apparecchiature non è assolutamente necessario. Il regolatore di lunghezza, per esempio, è essenziale per qualsiasi protocollo sperimentale che richiede allungamento rapida e precisa o accorciamento della fibra,ma non è assolutamente necessaria per valutare la forza isometrica massima (anche se un livello zero forza nel record forza deve ancora essere identificato da alcuni mezzi). I prismi che permettono l'osservazione della fibra dal lato, mentre utile per valutare sezione trasversale, non sono assolutamente necessarie durante il posizionamento della fibra all'interno della camera sperimentale. Inoltre, mezzi alternativi per esporre la fibra alle varie soluzioni sperimentali potrebbe essere impiegato, compresi l'ideazione di un sistema di azionamento manuale di camere o un'unica camera che permette un rapido riempimento e svuotamento delle soluzioni. Infine, mentre le temperature sperimentali sub-fisiologiche come 15 ° C sono comunemente utilizzati per migliorare la riproducibilità delle misurazioni meccaniche 1,2,3,5,8,12,17,27, è possibile generare dati validi ad altre temperature 23 , 28 purché gli effetti della temperatura sulla proprietà della soluzione (concentrazione di calcio, pH, etc.) sono presi in considerazione.
Le composizioni delle soluzioni di prova sono tra gli aspetti più critici delle tecniche fibre permeabilizzate qui descritte. Considerazioni riguardanti composizione della soluzione sono complesse e al di là della portata di questo articolo. Le soluzioni descritte al punto 5 della sezione di protocollo sono stati progettati con particolare attenzione alla rapida attivazione delle fibre permeabilizzate sul suo trasferimento da pre-attivazione per attivare soluzioni, pur mantenendo una forza costante ionica, la composizione cationica, e osmolarità 6,29. Altri approcci alla composizione della soluzione sono stati impiegati con notevole successo da parte di altri gruppi di ricerca e di solito fare uso di costanti di legame pubblicati e strumenti computazionali 27,30,31. Le concentrazioni di ioni calcio nelle varie soluzioni attivanti è particolarmente importante negli studi che coinvolgono l'attivazione submassimale come valutazioni forza-PCA. Per gli esperimenti in cui le fibre sono completamente attivati, come quelli descrivered qui, la concentrazione di calcio nella soluzione attivante supera tipicamente da un margine comodo quella necessaria per ottenere la massima forza, rendendo la sua precisa conoscenza meno critica. L'aggiunta di creatina fosfato è importante per la bufferizzazione fluttuazioni ATP e ADP intramyofibrillar che altrimenti essere associati con attività contrattile. La creatina chinasi è necessaria per catalizzare il trasferimento di fosfato da creatina fosfato a ADP. In condizioni sperimentali che determinano elevati tassi di turnover ATP, compresi lavorare ad alte temperature o di misura accorciamento ad alta velocità in fibre veloci 32, creatina chinasi deve essere aggiunto alla soluzione per integrare la creatina chinasi endogena che rimane legata alla fibra. Per le condizioni sperimentali meno impegnative, il sistema di rigenerazione ATP è meno critica 27.
Limitazioni della tecnica singola fibra permeabilizzate sono i seguenti. I dati generati da queste prove definiscono laproprietà contrattili dell'unità miofibrillare specifico che è stato attaccato alla apparato sperimentale. Di conseguenza, questo cattura solo una piccola parte dell'intera fibre multinucleate da cui è stato ottenuto il segmento che, a sua volta, rappresenta una piccola frazione del numero totale di fibre all'interno del muscolo. Gli investigatori dovrebbero pertanto considerare attentamente il campionamento necessaria per supportare tutte le conclusioni tratte dagli esperimenti. Inoltre, la valutazione dell'impatto di un intervento allenamento sulla funzione fibra presume che le fibre valutati sono stati effettivamente assunti durante l'allenamento. Sebbene il protocollo cerca di imitare il naturale ambiente intracellulare della fibra, il processo permeabilizzazione sarcolemma è aspecifica e necessariamente permette costituenti intracellulari solubili a diffondersi liberamente nelle soluzioni balneari. Un'ulteriore conseguenza della permeabilità della membrana è un cambiamento nell'equilibrio osmotico evidenziato da un rigonfiamento in volume delle fibre 33. Ilfibra gonfiore aumenta la distanza tra actina e miosina conseguente ridotta sensibilità al calcio del sistema myofilament 34,35, ma può essere invertito con l'introduzione di grandi composti osmoticamente attivi 34. Una limitazione finale da considerare è la conseguenza della tecnica utilizzata per collegare fibre all'apparato sperimentale. Ciò richiede invariabilmente distorcere il rapporto spaziale all'interno del sistema filamento in e in prossimità dei punti di attacco, con frequentando deficit funzionali. In particolare, le regioni della fibra alla e adiacente ai punti di aggancio sono funzionalmente compromesse e contribuendo così serie artefatta elasticità al sistema di misura.
In sintesi, abbiamo descritto un mezzo per valutare la capacità di generare forza delle fibre muscolari scheletriche permeabilizzate chimicamente in vitro. Anche se il focus di questo articolo è stato sulla valutazione di massima forza isometrica generating capacità delle fibre muscolari scheletriche umane, l'approccio sperimentale può essere modificato ed esteso per determinare una serie di parametri e relazioni cinetici in una vasta gamma di specie di mammiferi, o in altro modo.
Divulgazioni
Production and free access to this article is sponsored by Aurora Scientific
Riconoscimenti
This work was supported by the following funding sources: R01-AR063649, AG-020591, F31-AR035931.
Materiali
| Name | Company | Catalog Number | Comments |
| Polystyrene culture test tube with cap | Fisher Scientific | 14-956-3D | |
| 0.5 ml screw cap microcentrifuge | Fisher Scientific | 02-681-334 | |
| 0.5 ml microcentrifuge caps with o-ring | Fisher Scientific | 02-681-358 | |
| Microcentrifuge cryobox | Fisher Scientific | 5055-5005 | |
| pH meter | Mettler-Toledo | FE20 | |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Nonsterile-suture 10-0 monofilament | Ashaway Line Twine | S30002 | |
| Insect pins | Fine Science Tools | 26002-10 | |
| Forceps - Dumont #5 | Fine Science Tools | 11251-20 | |
| Microdissecting scissors | Fine Science Tools | 15000-08 | |
| Stereo microscope | Leica Microsystems | MZ8 | |
| Micrometer drives | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Aplha Omega Instruments | Series 800 | |
| LabVIEW software | National Instruments | - | |
| Computer | Varied | - | |
| Chamber system | Aurora Scientific | 802D | |
| Length-controller | Aurora Scientific | 312C | |
| Force-transducer | Aurora Scientific | 403A | |
| Reagents | |||
| K-proprionate | TCI America | P0510 | |
| Imadizole | Sigma-Aldrich | I0125 | |
| MgCl2•6H20 | Sigma-Aldrich | M2670 | |
| Brij 58 | Sigma-Aldrich | P5884 | |
| EGTA (acid) | Sigma-Aldrich | E0396 | |
| Na2H2ATP•0.56H2O | Sigma-Aldrich | A7699 | |
| Glycerol | Sigma-Aldrich | G6279 | |
| HEPES (acid) | Sigma-Aldrich | H7523 | |
| MgO | Sigma-Aldrich | 529699 | |
| HDTA (acid) | TCI America | D2019 | |
| CaCO3 | Sigma-Aldrich | C4830 | |
| NaN3 | Sigma-Aldrich | S8032 | |
| KOH (1 N) | Sigma-Aldrich | 35113 | |
| HCL (1 N) | Sigma-Aldrich | 318949 | |
| Na2CrP•4H2O | Sigma-Aldrich | P7936 | |
| pH 10 standard | Fisher Scientific | SB115 | |
| pH 7 standard | Fisher Scientific | SB107 | |
Riferimenti
- Mendias, C. L., Kayupov, E., Bradley, J. R., Brooks, S. V., Claflin, D. R. Decreased specific force and power production of muscle fibers from myostatin-deficient mice are associated with a suppression of protein degradation. J Appl Physiol. 111 (1), 185-191 (2011).
- Gumucio, J. P., Davis, M. E., Bradley, J. R., Stafford, P. L., Schiffman, C. J., Lynch, E. B., Claflin, D. R., Bedi, A., Mendias, C. L. Rotator cuff tear reduces muscle fiber specific force production and induces macrophage accumulation and autophagy. J Orthop Res. 30 (12), 1963-1970 (2012).
- Mendias, C. L., Roche, S. M., Harning, J. A., Davis, M. E., Lynch, E. B., Sibilsky Enselman, E. r., Jacobson, J. A., Claflin, D. R., Calve, S., Bedi, A. Reduced muscle fiber force production and disrupted myofibril architecture in patients with chronic rotator cuff tears. J Shoulder Elbow Surg. 1 (4), 111-119 (2015).
- Moss, R. L. Sarcomere length-tension relations of frog skinned muscle fibres during calcium activation at short lengths. J Physiol. 292, 177-192 (1979).
- Chase, P. B., Kushmerick, M. J. Effects of pH on contraction of rabbit fast and slow skeletal muscle fibers. Biophys J. 53, 935-946 (1988).
- Moisescu, D. G., Thieleczek, R. Calcium and strontium concentration changes within skinned muscle preparations following a change in the external bathing solution. J Physiol. 275, 241-262 (1978).
- Walker, S. M., Schrodt, G. R. I Segment lengths and thin filament periods in skeletal muscle fibers of the Rhesus monkey and the human. Anat Rec. 178, 63-81 (1974).
- Gollapudi, S. K., Lin, D. C. Experimental determination of sarcomere force-length relationship in type-1 human skeletal muscle fibers. J Biomech. 42, 2011-2016 (2009).
- Brenner, B. Technique for stabilizing the striation pattern in maximally calcium-activated skinned rabbit psoas fibers. Biophys J. 41 (1), 99-102 (1983).
- Claflin, D. R., et al. Effects of high and low-velocity resistance training on the contractile properties of skeletal muscle fibers from young and older humans. J Appl Physiol. 111, 1021-1030 (2011).
- Lynch, G. S., Faulkner, J. A., Brooks, S. V. Force deficits and breakage rates after single lengthening contractions of single fast fibers from unconditioned and conditioned muscles of young and old rats. Am J Physiol Cell Physiol. 295, C249-C256 (2008).
- Frontera, W. R., Rodriguez Zayas, A., Rodriguez, N. Aging of human muscle: understanding sarcopenia at the single muscle cell level. Phys Med Rehabil Clin N Am. 23, 201-207 (2012).
- Malisoux, L., Francaux, M., Theisen, D. What do single-fiber studies tell us about exercise training. Med Sci Sports Exerc. 39 (7), 1051-1060 (2007).
- Widrick, J. L., Stelzer, J. E., Shoepe, T. C., Garner, D. P. Functional properties of human muscle fibers after short-term resistance exercise training. Am J Physiol Regulatory Integrative Comp Physiol. 238, 408-416 (2002).
- Trappe, S. Effects of spaceflight, simulated spaceflight and countermeasures on single muscle fiber physiology. J Gravit Physiol. 9 (1), 323-326 (2002).
- Malisoux, L., Jamart, C., Delplace, K., Nielens, H., Francaux, M., Thiesen, D. Effect of long-term muscle paralysis on human single fiber mechanics. J Appl Physiol. 102, 340-449 (2006).
- Krivickas, L. S., Walsh, R., Amato, A. Single muscle fiber contractile properties in adults with muscular dystrophy treated with MYO-029. Muscle Nerve. 39, 3-9 (2009).
- Russell, A. J., et al. Activation of fast skeletal muscle troponin as a potential therapeutic approach for treating neuromuscular diseases. Nature Medicine. 18 (3), 352-356 (2012).
- Krivickas, L. S., Yang, J. I., Kim, S. K., Frontera, W. R. Skeletal muscle fiber function and rate of disease progression in amyotrophic lateral sclerosis. Muscle Nerve. 26, 636-643 (2002).
- Mendias, C. L., Marcin, J. E., Calerdon, D. R., Faulkner, J. A. Contractile properties of EDL and soleus muscles of myostatin-deficient mice. J Appl Physiol. 101, 898-905 (2006).
- Lynch, G. S., Rafael, J. A., Chamberlain, J. S., Faulkner, J. A. Contraction-induced injury to single permeabilized muscle fibers from mdx, transgenic mdx and control mice. Am J Physiol Cell Physiol. 279, 1290-1294 (2000).
- Mizunoya, Q., Wakamatsu, J., Tatsumi, R., Ikeuchi, Y. Protocol for high-resolution separation of rodent myosin heavy chain isoforms in a mini-gel electrophoresis system. Anal Biochem. 377, 111-113 (2008).
- Hill, A. V. The heat of shortening and the dynamic constants of muscle. Proc R Soc Lond B Biol Sci. 126, 136-195 (1938).
- Bottinelli, R., Canepari, M., Pellegrino, M. A., Reggiani, C. Force-velocity properties of human skeletal muscle fibres: myosin heavy chain isoform and temperature dependence. J Physiol. 495, 573-586 (1996).
- Edman, K. A. The velocity of unloaded shortening and its relation to sarcomere length and isometric force in vertebrate muscle fibres. J Physiol. 291, 143-159 (1979).
- Brenner, B., Eisenberg, E. Rate of force generation in muscle: Correlation with actomyosin ATPase activity in solution. PNAS. 83, 3542-3546 (1986).
- Moss, R. L. The effect of calcium on the maximum velocity of shortening in skinned skeletal muscle fibres of the rabbit. J. Muscle Res. Cell Motil. 3, 295-311 (1982).
- Pate, E., Wilson, G. J., Bhimani, M., Cooke, R. Temperature dependence of the inhibitory effects of orthovanadate on shortening velocity in fast skeletal muscle. Biophys J. 66, 1554-1562 (1994).
- Ashley, C. C., Moisescu, D. G. Effect of changing the composition of the bathing solutions upon the isometric tension-pCa relationship in bundles of crustacean myofibrils. J Physiol. 270, 627-652 (1977).
- Godt, R. E. Calcium-activated tension of skinned muscle fibers of the frog. Dependence on magnesium adenosine triphosphate concentration. J Gen Physiol. 63, 722-739 (1974).
- Fabiato, A., Fabiato, F. Calculator programs for computing the composition of the solutions containing multiple metals and ligands used for experiments in skinned skeletal muscle cells. Journal de Physiologie (Paris). 75, 463-505 (1979).
- Chase, P. B., Kushmerick, M. J. Effect of physiological ADP concentrations on contraction of single skinned fibers from rabbit fast and slow muscles). Am J Physiol. 268, C480-C489 (1995).
- Godt, R. E., Maughan, D. W. Swelling of skinned muscle fibers of the frog. Biophysical Journal. 19, 103-116 (1977).
- Kawai, M., Wray, J. S., Zhao, Y. The effect of lattice spacing change on cross-bridge kinetics in chemically skinned rabbit psoas muscle fibers. Biophys J. 64, 187-196 (1993).
- Millman, B. M. The filament lattice of striated muscle. Physiol Rev. 78 (2), 359-391 (1998).
- Edman, K. A. Contractile properties of mouse single muscle fibers, a comparison with amphibian muscle fibers. J Exp Biol. 208, 1905-1913 (2005).
- Phillips, S. K., Woledge, R. C. A comparison of isometric force, maximum power and isometric heat rate as a function of sarcomere length in mouse skeletal muscle. Pflügers Archiv. 420, 578-583 (1992).
- Stephenson, D. G., Williams, D. A. Effects of sarcomere length on the force-pCa relation in fast and slow-twitch skinned muscle fibres from the rat. J Physiol. 333, 637-653 (1982).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon